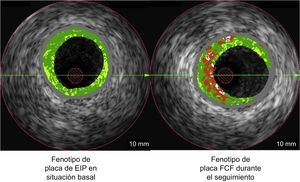
Se ha considerado que el engrosamiento intimal patológico (EIP) es un fenotipo de placa benigno. Se presentan los cambios fenotípicos de la placa en un estudio comparativo entre situación basal y seguimiento mediante un estudio de reconstrucción histológica virtual por ecografía intravascular.
MétodosSe estudió a 61 pacientes con enfermedad coronaria estable del ensayo HEAVEN (89 pacientes aleatorizados al tratamiento estándar con estatinas o atorvastatina 80 mg y ezetimiba 10 mg) por ecografía intravascular seriada de las arterias no culpables. Se compararon los cambios examinando al inicio del estudio y durante el seguimiento 693 segmentos de 5 mm de longitud mediante una nueva puntuación de riesgo, la Liverpool Active Plaque Score (LAPS), los parámetros de la placa y la composición de esta.
ResultadosEl EIP es el tipo que mostró mayor aumento de la puntuación de riesgo y, junto con las placas fibrosas, también de la LAPS. El core necrótico (CN) próximo a la luz aumentó tanto en las placas con EIP (22 ± 51,7; p = 0,0001) como en las placas fibrosas (17,9 ± 42,6; p = 0,004), pero disminuyó en el fibroateroma de capa fina (FCF) (–15,14 ± 52,2; p = 0,001). El EIP es el tipo de placa de fibroateroma de capa no fina con mayor probabilidad de transformación a FCF durante el seguimiento (el 11% del total de FCF hallados durante el seguimiento y el 35,9% de los FCF de nueva aparición), pero también el que mostró (junto con las placas fibrosas) menor estabilidad durante el tratamiento hipolipemiante (el 24,7% de los EIP y el 24,5% de las placas fibrosas se mantuvieron estables).
ConclusionesEn 1 año de seguimiento, el EIP fue el fenotipo de placa más dinámico y se asoció a un aumento de la puntuación de riesgo y de la LAPS (junto con la placa fibrosa), el porcentaje de CN (junto con la placa fibrosa) y el CN próximo a la luz, a pesar de una pequeña reducción del volumen de la placa durante el tratamiento hipolipemiante. El EIP fue el principal origen de los nuevos segmentos con FCF.
Palabras clave
Algunos trabajos recientes indican que la composición de la placa arterial coronaria puede predecir los futuros eventos clínicos1. La histología virtual por ecografía intravascular (HV-IVUS) permite evaluar la composición de la placa mediante el procesamiento de una señal de radiofrecuencia en bruto obtenida con la ecografía intravascular (IVUS). La HV-IVUS ha mostrado una correlación > 90% con la histología convencional2. Empleando los datos de imagen de HV-IVUS, se puede determinar seis clases de fenotipo de la placa. Estos tipos corresponden a las descripciones del Comité de Lesiones Vasculares de la American Heart Association3. Gran parte de los trabajos realizados en este campo se han centrado en los fibroateromas (fibroateromas de capa fina [FCF] y fibroateromas de capa gruesa [FCG]), como factores de riesgo de futuros eventos cardiacos, y se ha establecido que el FCF es la lesión que conlleva mayor riesgo de aparición de síndromes coronarios agudos4. Los demás fenotipos de la placa se han considerado lesiones estables1,5. Otros estudios indican que una clase de fenotipo de placa estable, el engrosamiento intimal patológico (EIP), puede ser un precursor de los fibroateromas6,7.
El objetivo de este estudio es investigar las propiedades dinámicas de diversos fenotipos de placa (en pacientes con enfermedad coronaria estable tratados con medicación hipolipemiante) empleando un protocolo establecido de diagnóstico por imagen con HV-IVUS y fusión con angiografía tridimensional (3D) que utiliza exámenes basales y en el seguimiento.
MÉTODOSPoblación del estudio, protocolo de angiografía y diagnóstico por imagen mediante ecografía intravascularSe utilizó una base de datos de exámenes secuenciales de HV-IVUS de 89 pacientes sometidos a angiografía coronaria electiva por enfermedad coronaria estable y analizados en el ensayo HEAVEN8 (un ensayo clínico multicéntrico, aleatorizado, de comparación de tratamiento habitual con estatinas frente a un tratamiento agresivo: atorvastatina 80 mg más ezetimiba 10 mg al día); se analizó un total de 61 conjuntos de datos iniciales y de seguimiento que cumplían los siguientes criterios: a) HV-IVUS de una arteria coronaria nativa con estenosis ≤ 50% del diámetro de la luz determinada mediante angiografía, sin que hubiera indicación para intervención coronaria percutánea o cirugía de revascularización aortocoronaria en el momento de la exploración por imagen inicial; b) exploraciones en retirada (pullback) en la HV-IVUS de buena calidad en la situación inicial y en el seguimiento (sin discontinuidades apreciables en la rapidez de la retirada); c) ausencia de calcificación intensa en las arterias examinadas, con objeto de evitar discrepancias en la determinación del tipo de placa mediante la HV-IVUS en áreas de sombra acústica, y d) retirada de al menos 30 mm de longitud en los exámenes inicial y de seguimiento, con un solapamiento de al menos 25 mm de longitud después del registro en una arteria coronaria.
Se eligió para el estudio un segmento arterial de cada paciente. Si había múltiples lesiones, se elegía para el análisis una lesión situada en una localización más proximal o (en el caso de que las localizaciones fueran similares) una lesión con mayor carga de placa.
Se utilizaron datos de 61 de los 89 pacientes incluidos en el ensayo HEAVEN. Las exploraciones realizadas en 15 pacientes tenían un solapamiento entre la situación inicial y el seguimiento < 25 mm, en 8 pacientes la angiografía no era apropiada para la reconstrucción 3D y en 5 no hubo continuidad en las exploraciones de IVUS inicial o de seguimiento.
Todos los participantes dieron su consentimiento informado. El estudio recibió la aprobación de los comités de revisión de los centros de la Charles University de Praga.
Creación de modelos 3D, corregistro y análisis de la ecografía intravascularLa HV-IVUS se realizó empleando una sonda de IVUS phased-array (Eagle Eye 20 MHz 2,9 Fr, Volcano Corporation; Rancho Cordova, California, Estados Unidos), con consola de IVUS, programa informático estándar de referencia y pullback automático a 0,5 mm/s (retirada de investigación, modelo R-100, Volcano Corporation). Tras la administración intracoronaria de 200 μg de nitroglicerina, se introdujo el catéter de IVUS en el vaso diana hasta más allá del marcador de referencia distal, y a continuación se realizó la retirada hacia la unión aortoostial. El marcador de referencia proximal fue la bifurcación principal izquierda en la arteria coronaria izquierda y la primera rama o una calcificación bien definida en la arteria coronaria derecha. Al cabo de 8-14 (media, 12 ± 2,1) meses, se repitió la angiografía con HV-IVUS de la misma arteria coronaria.
En este estudio se utilizó una reconstrucción vascular totalmente 3D geométricamente correcta para asegurar una alineación precisa de las mediciones iniciales y de seguimiento.
Los datos de imagen de retirada de la IVUS originales se transfirieron al Iowa Institute for Biomedical Imaging. De cada fotograma de todas las retiradas de IVUS, se segmentaron automáticamente la superficie luminal y de la membrana elástica externa utilizando un método gráfico LOGISMOS totalmente 3D9. Se revisaron los límites determinados automáticamente y un evaluador experto (T. Kovarnik) los perfeccionó mediante algoritmos utilizando una interfaz asistida por ordenador y guiada por el operador10. Se utilizaron las superficies/contornos del vaso y de la luz como datos para la reconstrucción histológica virtual offline mediante el programa informático de investigación de Volcano, que permite realizar los cálculos con HV-IVUS basándose en la segmentación de la luz y de la membrana elástica externa proporcionada por el usuario. Se obtuvo una representación totalmente 3D y geométricamente correcta de las superficies de la pared vascular y una caracterización tisular definida por HV-IVUS mediante la fusión de la angiografía y la HV-IVUS11. Este modelo 3D sirvió de base para los análisis morfológicos cuantitativos y para la evaluación cuantitativa de la composición de la placa en cada fotograma del vaso examinado12. Se crearon modelos de los vasos para las retiradas de imagen iniciales y de seguimiento. Tras la identificación de los correspondientes puntos de referencia vasculares en los modelos 3D de los vasos, se corregistraron pares del modelo específico del paciente mediante una técnica de optimización basada en gráficos 3D13 con objeto de emparejar correctamente las retiradas. Se calcularon los índices de la morfología de placa y la histología virtual basados en los fotogramas y se promediaron en segmentos vasculares de 5 mm registrados en la situación inicial y en el seguimiento.
Los índices morfológicos utilizados fueron el área transversal de la membrana elástica externa, el área transversal de la luz, la carga de placa (área transversal de la membrana elástica externa – área transversal de la luz / área transversal de la membrana elástica externa transversal) y la excentricidad (grosor máximo de la placa – grosor mínimo de la placa / grosor máximo de la placa)14,15.
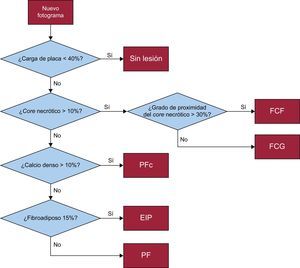
Definiciones del fenotipo de las placasLa HV-IVUS clasifica las placas en los siguientes tipos: fibrosa, fibroadiposa, calcificación densa y core necrótico (CN). Empleando HV-IVUS, cada segmento arterial de 5 mm se clasificó en una de las seis categorías siguientes1,2 (figura 1):
- 1.
Ausencia de lesión: carga de placa < 40%.
- 2.
EIP.
- 3.
Placa fibrosa.
- 4.
Placa fibrocalcificada.
- 5.
FCG.
- 6.
FCF.
Para la determinación de la categoría del FCF, se analizaron 3 fotogramas consecutivos. La asignación de una de las seis categorías de fenotipos a cada segmento de 5 mm se basó en el análisis morfológico de cada fotograma del segmento de 5 mm; la categoría específica de cada segmento se basó en el tipo de categoría del fotograma más grave observado en el segmento.
Se elaboró una puntuación de riesgo de la placa basada en el fenotipo de la placa en los fotogramas individuales de la IVUS asignando las siguientes ponderaciones: FCF (5 puntos), FCG (4 puntos), placa fibrocalcificada (3 puntos), placa fibrosa (2 puntos), EIP (1 punto) y ausencia de lesión (0 puntos). Se calculó una puntuación de riesgo para todos los fotogramas, y la puntuación más alta identificada en el segmento de 5 mm determinó la puntuación de riesgo de ese segmento. Se utilizó también la Liverpool Active Plaque Score (LAPS). Se empleó la fórmula: –2,149 + 0,68 × CN / calcificación densa + 3,39 × área luminal mínima < 4 mm2 + 5,1 (si el índice de remodelado era > 1,05) + 3,7 × FCF, basándose en un estudio llevado a cabo por Murray et al.16.
Análisis estadísticoLas variables numéricas se describen mediante media ± desviación estándar o mediana [intervalo intercuartílico] según sea apropiado. Se utilizan recuentos y porcentajes para presentar las variables discretas. Se utilizó un análisis de la varianza de efectos mixtos con el «paciente» como efecto aleatorio para corregir la agrupación de múltiples segmentos de 5 mm en los pacientes, para una comparación morfológica continua como la del cambio de área de la placa. Para las variables discretas, se utilizaron tablas de contingencia para presentar las distribuciones de frecuencias. La significación estadística se calculó con la prueba exacta de Fisher. Se utilizó el entorno R para los cálculos estadísticos. Se tomó como umbral de significación estadística un valor de p de 0,05.
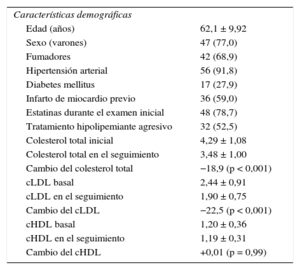
RESULTADOSCaracterísticas demográficas basalesEn la tabla 1 se presentan los datos demográficos de los 61 pacientes. Formaban la cohorte un 77% de varones, y la media de edad era 62,1 ± 9,9 años. Las concentraciones de colesterol total y colesterol unido a las lipoproteínas de baja densidad se redujeron significativamente durante el estudio, a pesar de que el 78,7% de los pacientes habían recibido previamente tratamiento con estatinas. Las arterias coronarias evaluadas fueron: 26 arterias descendentes anteriores izquierdas (42,6%), 8 arterias circunflejas izquierdas (13,1%) y 27 arterias coronarias derechas (44,3%).
Características demográficas en la situación inicial (n = 61)
| Características demográficas | |
| Edad (años) | 62,1 ± 9,92 |
| Sexo (varones) | 47 (77,0) |
| Fumadores | 42 (68,9) |
| Hipertensión arterial | 56 (91,8) |
| Diabetes mellitus | 17 (27,9) |
| Infarto de miocardio previo | 36 (59,0) |
| Estatinas durante el examen inicial | 48 (78,7) |
| Tratamiento hipolipemiante agresivo | 32 (52,5) |
| Colesterol total inicial | 4,29 ± 1,08 |
| Colesterol total en el seguimiento | 3,48 ± 1,00 |
| Cambio del colesterol total | −18,9 (p < 0,001) |
| cLDL basal | 2,44 ± 0,91 |
| cLDL en el seguimiento | 1,90 ± 0,75 |
| Cambio del cLDL | −22,5 (p < 0,001) |
| cHDL basal | 1,20 ± 0,36 |
| cHDL en el seguimiento | 1,19 ± 0,31 |
| Cambio del cHDL | +0,01 (p = 0,99) |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad.
Los lípidos se consignan en mmol/l (se multiplica por 38,67 para convertir a mg/dl).
Los valores expresan n (%) o media ± desviación estándar.
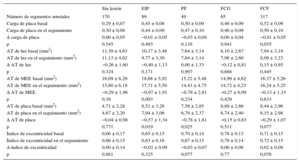
En los 61 pacientes se analizaron 693 segmentos vasculares de 5mm de longitud y el fenotipo más frecuente fue el de FCF (317 segmentos, 45,7%), seguido de la ausencia de lesión (170 segmentos, 24,5%), el EIP (89 segmentos, 12,8%), el FCG (65 segmentos, 9,4%), la placa fibrosa (49 segmentos, 7,1%) y un número muy bajo de placas fibrocalcificadas (3 segmentos, 0,4%). En la mayoría de los análisis no se incluyeron las placas fibrocalcificadas debido a su baja frecuencia. Por lo que respecta a los resultados de la IVUS en escala de grises, todos los grupos excepto el de ausencia de lesión (definida como carga de placa < 40%) presentaron una carga ateroesclerótica moderada, con una carga de placa basal de entre el 45 y el 52% (esta diferencia no fue significativa entre los cinco tipos de lesión). Los fenotipos de placa de EIP, placa fibrosa y FCF mostraron una pequeña disminución de la carga de placa en el seguimiento, que fue significativa en el grupo de FCF (tabla 2), y estos grupos, junto con los de ausencia de lesión y FCG, presentaron una pequeña disminución de la placa en el área transversal en el seguimiento, que fue significativa en los grupos de EIP y de placa fibrosa (tabla 2). Los segmentos con EIP fueron los que presentaron mayor grado de remodelado negativo, con un cambio en el área transversal de la membrana elástica externa de −0,97 ± 1,9 mm2 (p = 0,003).
Cambios morfológicos en todos los fenotipos de placa
| Sin lesión | EIP | PF | FCG | FCF | |
|---|---|---|---|---|---|
| Número de segmentos arteriales | 170 | 89 | 49 | 65 | 317 |
| Carga de placa basal | 0,29 ± 0,07 | 0,45 ± 0,08 | 0,50 ± 0,09 | 0,46 ± 0,09 | 0,52 ± 0,09 |
| Carga de placa en el seguimiento | 0,30 ± 0,08 | 0,44 ± 0,09 | 0,47 ± 0,10 | 0,46 ± 0,09 | 0,50 ± 0,10 |
| Δ carga de placa | 0,00 ± 0,05 | −0,01 ± 0,05 | −0,03 ± 0,04 | 0,00 ± 0,04 | −0,01 ± 0,05 |
| p | 0,545 | 0,493 | 0,116 | 0,941 | 0,035 |
| AT de luz basal (mm2) | 11,39 ± 4,63 | 10,17 ± 3,48 | 7,64 ± 3,14 | 8,10 ± 2,67 | 7,94 ± 3,19 |
| AT de luz en el seguimiento (mm2) | 11,13 ± 4,62 | 9,77 ± 3,30 | 7,64 ± 3,14 | 7,98 ± 2,60 | 8,09 ± 3,23 |
| Δ AT de luz | −0,26 ± 1,60 | −0,40 ± 1,13 | 0,00 ± 1,33 | −0,12 ± 0,81 | 0,15 ± 0,95 |
| p | 0,324 | 0,171 | 0,997 | 0,688 | 0,445 |
| AT de MEE basal (mm2) | 16,09 ± 6,29 | 18,68 ± 5,92 | 15,22 ± 5,48 | 14,99 ± 4,62 | 16,37 ± 5,26 |
| AT de MEE en el seguimiento (mm2) | 15,80 ± 6,18 | 17,71 ± 5,50 | 14,43 ± 4,75 | 14,72 ± 4,23 | 16,24 ± 5,25 |
| Δ AT de MEE | −0,29 ± 1,96 | −0,97 ± 1,91 | −0,78 ± 2,81 | −0,27 ± 0,99 | −0,13 ± 1,33 |
| p | 0,38 | 0,003 | 0,234 | 0,429 | 0,633 |
| AT de placa basal (mm2) | 4,71 ± 2,28 | 8,51 ± 3,26 | 7,58 ± 2,85 | 6,89 ± 2,66 | 8,44 ± 2,96 |
| AT de placa en el seguimiento (mm2) | 4,67 ± 2,20 | 7,94 ± 3,06 | 6,79 ± 2,37 | 6,74 ± 2,40 | 8,15 ± 2,98 |
| Δ AT de placa | −0,04 ± 0,98 | −0,57 ± 1,34 | −0,78 ± 1,81 | −0,15 ± 0,83 | −0,29 ± 1,07 |
| p | 0,771 | 0,019 | 0,025 | 0,511 | 0,077 |
| Índice de excentricidad basal | 0,66 ± 0,17 | 0,65 ± 0,15 | 0,70 ± 0,14 | 0,78 ± 0,13 | 0,71 ± 0,15 |
| Índice de excentricidad en el seguimiento | 0,66 ± 0,15 | 0,63 ± 0,16 | 0,67 ± 0,15 | 0,78 ± 0,14 | 0,72 ± 0,15 |
| Δ índice de excentricidad | 0,00 ± 0,14 | −0,02 ± 0,09 | −0,03 ± 0,07 | 0,00 ± 0,08 | 0,02 ± 0,08 |
| p | 0,861 | 0,325 | 0,077 | 0,77 | 0,076 |
Δ: cambio; AT: área transversal; EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; MEE: membrana elástica externa; PF: placa fibrosa.
Salvo otra indicación, los datos expresan media ± desviación estándar.
El fenotipo EIP fue el que presentó un mayor aumento de la puntuación de riesgo. Los cambios de la puntuación de riesgo fueron los siguientes: EIP, 2,2 ± 1,7 (p < 0,001); placa fibrosa, 1,7 ± 1,5 (p < 0,001); ausencia de lesión, 0,7 ± 1,5 (p < 0,001); FCG, –0,1 ± 1,4 (p = 0,58), y FCF, –0,5 ± 1,1 (p = 0,0001).
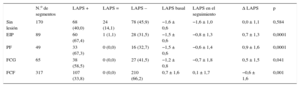
El índice LAPS y el cambio de dicho índice durante el estudio se presentan en la tabla 3. El LAPS aumentó significativamente en los fenotipos de placa fibrosa (0,9), EIP (0,7) y FCG (0,5) y se redujo significativamente en el fenotipo de placa FCF (–0,6).
Cambios en la Liverpool Active Plaque Score
| N.o de segmentos | LAPS + | LAPS = | LAPS – | LAPS basal | LAPS en el seguimiento | Δ LAPS | p | |
|---|---|---|---|---|---|---|---|---|
| Sin lesión | 170 | 68 (40,0) | 24 (14,1) | 78 (45,9) | −1,6 ± 0,6 | −1,6 ± 1,0 | 0,0 ± 1,1 | 0,584 |
| EIP | 89 | 60 (67,4) | 1 (1,1) | 28 (31,5) | −1,5 ± 0,6 | −0,8 ± 1,3 | 0,7 ± 1,3 | 0,0001 |
| PF | 49 | 33 (67,3) | 0 (0,0) | 16 (32,7) | −1,5 ± 0,6 | −0,6 ± 1,4 | 0,9 ± 1,6 | 0,0001 |
| FCG | 65 | 38 (58,5) | 0 (0,0) | 27 (41,5) | −1,2 ± 0,8 | −0,7 ± 1,8 | 0,5 ± 1,5 | 0,041 |
| FCF | 317 | 107 (33,8) | 0 (0,0) | 210 (66,2) | 0,7 ± 1,6 | 0,1 ± 1,7 | −0,6 ± 1,6 | 0,001 |
Δ: cambio; EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; LAPS: Liverpool Active Plaque Score; PF: placa fibrosa.
Aumento (+), sin cambios (=) y disminución (–) observados en el seguimiento respecto a los valores basales.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
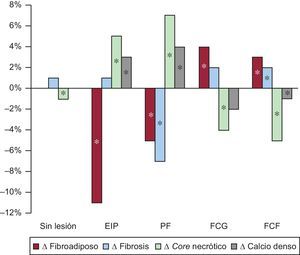
En la figura 2 se muestran los cambios de la composición relativa de la placa. Tan solo el EIP y la placa fibrosa mostraron un aumento del tejido necrótico y calcificado. Los fibroateromas (FCF y FCG) mostraron los cambios opuestos en cuanto a la composición de la placa.
Cambios de la composición relativa de la placa en diferentes fenotipos de placa. Δ: cambio; EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; PF: placa fibrosa. *Cambios significativos entre las mediciones basales y las de seguimiento.
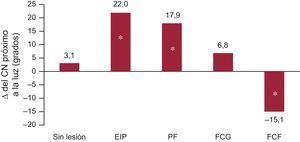
En la figura 3 se indican los cambios en el ángulo del CN próximo a la luz. El EIP fue el fenotipo de placa con mayor aumento de esta localización del CN, que es la que conlleva mayor peligro. En la figura 4 se muestra una presentación gráfica de las transiciones del fenotipo de la placa entre la situación inicial y el seguimiento. Obsérvese que la presencia de EIP en la situación inicial es el principal precursor del fenotipo FCF de nueva aparición en el seguimiento.
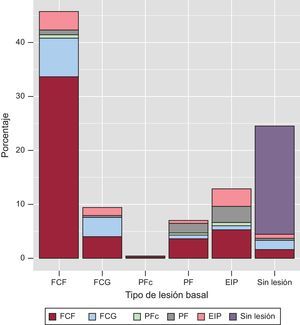
Transiciones del fenotipo de placa (eje x) entre la evaluación basal y la de seguimiento (los fenotipos de placa se indican mediante códigos de color).
EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; PF: placa fibrosa; PFc: placa fibrocalcificada.
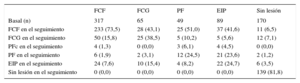
La transición de la placa durante el tratamiento hipolipemiante se resume en la figura 5 y la tabla 4. El principal origen del FCF de nueva aparición fue el fenotipo de placa de EIP. De un total de 336 segmentos con FCF identificados en el seguimiento, 233 (69,3%) procedían de un FCF existente en la situación inicial; 37 (11,0%), de un EIP inicial; 28 (8,3%), de un FCG; 25 (7,4%), de una placa fibrosa; 11 (3,3%), de ausencia de lesión en la situación inicial, y 2 (0,6%), de una placa fibrocalcificada inicial.
Transición del fenotipo de placa durante el estudio
| FCF | FCG | PF | EIP | Sin lesión | |
|---|---|---|---|---|---|
| Basal (n) | 317 | 65 | 49 | 89 | 170 |
| FCF en el seguimiento | 233 (73,5) | 28 (43,1) | 25 (51,0) | 37 (41,6) | 11 (6,5) |
| FCG en el seguimiento | 50 (15,8) | 25 (38,5) | 5 (10,2) | 5 (5,6) | 12 (7,1) |
| PFc en el seguimiento | 4 (1,3) | 0 (0,0) | 3 (6,1) | 4 (4,5) | 0 (0,0) |
| PF en el seguimiento | 6 (1,9) | 2 (3,1) | 12 (24,5) | 21 (23,6) | 2 (1,2) |
| EIP en el seguimiento | 24 (7,6) | 10 (15,4) | 4 (8,2) | 22 (24,7) | 6 (3,5) |
| Sin lesión en el seguimiento | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 139 (81,8) |
EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; PF: placa fibrosa; PFc: placa fibrocalcificada.
Salvo otra indicación, los datos expresan n (%).
En el análisis de la cantidad relativa de placa que permanecía en el mismo fenotipo durante el estudio, el fenotipo «más conservado» fue el de ausencia de lesión (81,8%), seguido de los de FCF (73,5%), FCG (38,5%), EIP (24,7%) y placa fibrosa (24,5%).
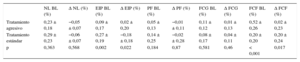
La transición de los fenotipos de placa se vio influida también por el tipo de tratamiento hipolipemiante (tabla 5). El tratamiento hipolipemiante agresivo produjo un pequeño aumento de los fenotipos de placa de EIP y FCF, mientras que el tratamiento estándar conllevó una disminución del fenotipo de placa de EIP y un mayor aumento del de FCF en comparación con el tratamiento agresivo. Estas diferencias entre las dos pautas de tratamiento fueron significativas. En la figura 5 se resume la transición de los fenotipos de la placa. En cada caso, el EIP se transformó en un fenotipo de placa con un perfil de riesgo superior (principalmente de FCF), lo cual demuestra que una disminución del EIP es un marcador de la progresión de la ateroesclerosis.
Cambios en los fenotipos de placa según el tipo de tratamiento hipolipemiante
| NL BL (%) | Δ NL (%) | EIP BL (%) | Δ EIP (%) | PF BL (%) | Δ PF (%) | FCG BL (%) | Δ FCG (%) | FCF BL (%) | Δ FCF (%) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Tratamiento agresivo | 0,23 ± 0,18 | −0,05 ± 0,07 | 0,09 ± 0,17 | 0,02 ± 0,20 | 0,05 ± 0,13 | −0,01 ± 0,11 | 0,11 ± 0,12 | 0,01 ± 0,13 | 0,52 ± 0,26 | 0,02 ± 0,23 |
| Tratamiento estándar | 0,29 ± 0,23 | −0,06 ± 0,07 | 0,27 ± 0,19 | −0,18 ± 0,18 | 0,14 ± 0,25 | −0,02 ± 0,28 | 0,08 ± 0,17 | 0,04 ± 0,11 | 0,20 ± 0,20 | 0,20 ± 0,24 |
| p | 0,363 | 0,568 | 0,002 | 0,022 | 0,184 | 0,87 | 0,581 | 0,46 | < 0,001 | 0,017 |
Δ: cambio; BL: basal; EIP: engrosamiento intimal patológico; FCF: fibroateroma de capa fina; FCG: fibroateroma de capa gruesa; NL: sin lesión; PF: placa fibrosa.
Salvo otra indicación, los datos expresan media ± desviación estándar.
El hecho de que se haya centrado la atención en el FCF como fenotipo de lesión de alto riesgo ha llevado a que haya pocos estudios sobre el destino y la evolución natural de los demás tipos de lesión distintos del fibroateroma. En este estudio se intenta establecer mejor la evolución natural de estos tipos de lesión distintos del fibroateroma. Nuestro abordaje aporta el primer estudio en que se analizan los cambios de los fenotipos de la placa empleando esta metodología de fusión avanzada, que incorpora un análisis por segmentos en vez de un análisis basado en fotogramas, como se ha hecho en estudios anteriores. Los principales resultados de este estudio son los siguientes:
- •
El fenotipo de placa de EIP fue (junto con la placa fibrosa) el que mostró mayor aumento de la puntuación de riesgo y del índice LAPS, a pesar de una disminución pequeña (pero significativa) del volumen de la placa durante el tratamiento hipolipemiante tanto en el caso del EIP como en el de la placa fibrosa.
- •
Este aumento del CN fue máximo en los fenotipos de placa fibrosa y de EIP. El aumento del CN próximo a la luz (que es la localización más peligrosa) se observó predominantemente en el EIP.
- •
La mayor parte de los fibroateromas de nueva aparición se originaron en un EIP inicial (el 11% del total de FCF observados en el seguimiento y el 35,9% de los FCF de nueva aparición).
- •
El número de segmentos arteriales de 5 mm con fenotipo de placa inalterado más bajo fue el observado en los grupos de EIP y de placa fibrosa.
Estos resultados demuestran que el EIP es el tipo de placa con mayor actividad. El aumento significativo de las puntuaciones de riesgo y del índice LAPS, y el aumento del CN (contenido relativo y ángulo en la parte próxima a la luz) en el fenotipo de placa de EIP se produjeron a pesar del tratamiento hipolipemiante. Estos aumentos se observaron a pesar de una pequeña disminución del volumen de la placa en el fenotipo EIP.
El fenotipo de placa de EIP fue el principal precursor de los FCF de nueva aparición. La transición de EIP a FCF no solo se observó con mayor frecuencia que cualquier otra transición del EIP, sino que, en el conjunto de todas las nuevas placas de FCF identificadas en el seguimiento, el tipo de placa de origen más frecuente es el EIP.
Se observaron cambios similares en el fenotipo de placa fibrosa, que sin embargo mostró un aumento inferior del CN próximo a la luz y de transición al fenotipo de placa de FCF.
Resulta alarmante la observación de que el fenotipo de placa EIP continúa progresando hacia tipos de placa más avanzados a pesar de las pequeñas reducciones del volumen de placa durante el tratamiento hipolipemiante agresivo. Se ha observado este fenómeno en pacientes que han sido tratados y han presentado una reducción satisfactoria del colesterol total y el colesterol unido a lipoproteínas de baja densidad. Estas observaciones difieren de las de un estudio de Kubo et al5., que describieron que el EIP y la placa fibrosa no mostraban transición y se mantenían en forma de EIP en más del 70% de los casos y en forma de placa fibrosa en más del 80%. Sin embargo, estos autores indicaron un aumento muy significativo del área de la placa y una disminución del área de la luz, junto con aumentos muy significativos del CN en los fenotipos de EIP. Su conclusión fue que el EIP es el fenotipo de placa más activo por lo que respecta al volumen de la placa y su composición; esta observación (al menos sobre la composición de la placa) es similar a la nuestra, aunque difiere en el sentido de los cambios que se producen en la carga de placa. Nozue et al17. han descrito una disminución relativa del EIP como resultado del tratamiento con estatinas. En su estudio, la pérdida relativa de EIP fue más frecuente en los pacientes con síndrome coronario agudo que en los pacientes estables. Fue también más frecuente en los pacientes tratados con pitavastatina que en los tratados con pravastatina. Estos autores han descrito una disminución relativa de las placas de EIP junto con un aumento relativo de los FCF y los FCF calcificados. En su estudio se observó que la placa fibrosa es un fenotipo de placa estable.
En cambio, los estudios publicados por Corban et al6. y Puri et al7. presentan observaciones similares a las nuestras. Esos autores señalan que el EIP es el fenotipo con mayor probabilidad de cambio. Tan solo un 9% de los EIP se mantuvieron en EIP durante su estudio de 6 meses. El fenotipo EIP se asoció a mayor progresión del CN y la calcificación densa, y mostró mayor probabilidad de transformación en fibroateroma que los demás fenotipos de placa. Estas observaciones son similares a las nuestras, con una excepción. Nosotros observamos el aumento máximo del CN en el fenotipo de placa fibrosa. Sin embargo, en el estudio de Puri et al7., el 56% de los EIP se mantenían sin cambios a los 24 meses de seguimiento. Los autores describieron el EIP como un fenotipo de placa de transición que contribuye de manera importante a la regresión del ateroma coronario que se produce con el tratamiento de estatinas de alta intensidad. Aunque observamos también una pequeña regresión del volumen de placa en el grupo de EIP, el perfil de riesgo de la placa en nuestros participantes continuó progresando a pesar del empleo de un tratamiento hipolipemiante.
La explicación de los aumentos del CN a pesar de una pequeña reducción de la placa puede encontrarse posiblemente en los ensayos realizados en animales. Las placas ateroescleróticas que se produjeron durante el empleo de una dieta rica en colesterol se mantuvieron en el mismo volumen durante una dieta posterior con poco colesterol, pero disminuyeron en los macrófagos y aumentaron en las células de músculo liso tras el cese de la dieta proateroesclerótica. Esto se consideró un resultado favorable18. Sin embargo, cabe plantear también la posibilidad de que los macrófagos que se transformaron en células espumosas mostraron necrosis celular y empezaron a formar un CN. El tratamiento hipolipemiante puede reducir el volumen de la placa sin afectar a la formación de un CN. El fenotipo de placa de EIP está formado principalmente por un tejido fibroso y fibroadiposo. Este tipo de placa está formado histológicamente por un tejido fibroso rodeado de células espumosas o de macrófagos sin CN19. En nuestro estudio anterior HEAVEN8, se observó que el tratamiento con estatinas no lograba detener los cambios indeseables de la composición de la placa y que el tejido fibroso y fibroadiposo se convertía en un CN con calcificación. También otros ensayos (TRUTH20, VENUS21, subestudio SATURN VH7) hicieron esta observación. Otro estudio pequeño realizado por Eshtehardi et al22. se centró en la composición de la placa y los cambios de los fenotipos de placa. En 20 pacientes tratados con 80 mg de atorvastatina, esos autores observaron una disminución de la proporción relativa de tejido fibroso y fibroadiposo y un aumento del CN y la calcificación junto con la transición de EIP a fibroateromas.
En cambio, algunos ensayos en los que se ha utilizado la HV-IVUS han descrito una disminución de la proporción relativa de CN durante el tratamiento hipolipemiante23,24 que no se observó en nuestro estudio. Una posible explicación de esta discrepancia podría ser el fenómeno de la dirección del cambio de CN específica según el fenotipo de la placa. Nosotros hemos observado que el CN aumentó en el EIP y en la placa fibrosa y disminuyó en los fibroateromas. Este comportamiento diferente del tejido necrótico se observó también en un estudio de Hwang et al.25. Esos autores estudiaron a 54 pacientes que habían sufrido un síndrome coronario agudo. Los pacientes fueron tratados con estatinas durante 6 meses, y se observó una reducción significativa del CN en la placa de tipo FCF, pero no en las placas distintas del FCF. Tan solo un pequeño número de ensayos han analizado los cambios de la composición de la placa en tipos de placa diferentes por separado. Por este motivo, no hay datos suficientemente concluyentes, aunque resulta verosímil que en un estudio con mayor número de lesiones de FCF pudiera observarse una disminución del tejido necrótico tras el inicio del tratamiento con estatinas. En cambio, en los ensayos con mayor número de estadios más tempranos de las placas ateroescleróticas se ha descrito un aumento del CN. La explicación del efecto beneficioso aportado por el tratamiento con estatinas tanto en prevención primaria como en prevención secundaria de la enfermedad coronara sigue siendo objeto de controversia. Teniendo en cuenta los conocimientos actuales, parece confirmado que las estatinas causan cierto grado de regresión de la placa. Estos fármacos pueden iniciar una disminución del CN en los fenotipos de placa más avanzados (fibroateromas), pero no detener la progresión del CN en las fases iniciales de la atereosclerosis. Cabe plantear la posibilidad de que uno de los principales efectos positivos del tratamiento con estatinas sea un aumento del grosor de la cubierta fibrosa, tal como se ha observado en un estudio que empleó tomografía de coherencia óptica26.
LimitacionesLa principal limitación de nuestro estudio es el bajo número de pacientes plenamente apropiados para el estudio de entre el total de 89 pacientes de nuestra cohorte, puesto que solo 61 cumplían los criterios necesarios para la realización del análisis 3D secuencial. Intentamos superar esta limitación empleando una metodología de fusión avanzada que incorpora un análisis de segmentos en vez del análisis basado en fotogramas que se ha utilizado en estudios previos. Esta metodología permitió analizar por separado el comportamiento de 693 segmentos vasculares de 5 mm de longitud. Otra limitación es la inclusión de pacientes tratados con terapias hipolipemiantes estándar y agresiva en un mismo grupo. Se optó por no perder potencia estadística para las comparaciones entre cinco tipos de fenotipos de placa utilizando dos grupos de participantes. Además, esta cohorte de pacientes refleja la situación real que se da en la práctica clínica, en la que se trata a parte de los pacientes de manera «conservadora» y otros reciben un tipo de tratamiento hipolipemiante más agresivo. Otra limitación son los tiempos de seguimiento ligeramente distintos dentro de la cohorte (8-14 meses), aunque son similares a los de otros estudios de comparación entre situación inicial y seguimiento.
También es una limitación la exclusión del análisis de las placas intensamente calcificadas. El calcio causa una sombra acústica, con lo que el análisis de la HV-IVUS pierde su exactitud y no se puede usar para la evaluación de la composición de la placa.
CONCLUSIONESEn un estudio en el que se analizaron múltiples segmentos vasculares adyacentes de 5 mm de longitud mediante el corregistro de los datos basales y de seguimiento de imágenes de fusión de angiografía/HV-IVUS y la reconstrucción 3D de la arteria, se pudo analizar con unas características únicas segmentos vasculares más largos que los que se puede evaluar con una técnica basada en fotogramas, con lo que se pudo realizar un examen de segmentos vasculares más representativos y un análisis cuantitativo más completo. Con este enfoque, se ha observado que el EIP es el fenotipo de placa más activo en la progresión de la inestabilidad de la placa. Se observó que estos cambios se producen a pesar de un tratamiento hipolipemiante que produjo valores bajos de colesterol unido a lipoproteínas de baja densidad y una disminución pequeña, pero significativa, del volumen de la placa. La cantidad relativa de CN aumentó en los fenotipos de placa menos avanzados (EIP y placa fibrosa) y se redujo en los más avanzados (fibroateromas).
FINANCIACIÓNEste estudio fue financiado en parte por una subvención interna de la Agencia de Subvenciones Internas del Ministerio de Salud, República Checa, IGA NT13224-4/2012, subvenciones de los NIH (National Institutes of Health) R01 EB004640 y R01 HL063373, y la National Natural Science Foundation of China 81501545.
CONFLICTO DE INTERESESNinguno.
- –
En el ensayo PROSPECT se ha demostrado que el EIP es un «fenotipo de placa protector», con una relación negativa con los eventos cardiacos. Esta observación se confirmó en un estudio de Kubo et al5., que describieron que el EIP es un fenotipo de placa estable que se mantiene básicamente inalterado en el 70% de los casos identificados en el examen inicial.
- –
En cambio, otros estudios han indicado que el EIP es un fenotipo de placa muy activo.
- –
El objetivo del estudio es aportar más datos para describir el comportamiento del EIP durante el tratamiento hipolipemiante.
- –
Se identificó el fenotipo de placa EIP como un tipo de placa muy activo, que presenta el incremento máximo de nuestra nueva puntuación de riesgo y de la puntuación de riesgo de Liverpool (con un resultado similar por lo que respecta a la placa fibrosa), un aumento del volumen de la placa e incrementos en la composición de la placa que conlleva mayor peligro: CN próximo a la luz.
- –
Además, el EIP es un importante origen de fibroateromas de nueva aparición y el que presentó el menor número de segmentos vasculares de 5 mm con fenotipo de placa inalterado en los grupos de EIP y placa fibrosa.
- –
Estos cambios se produjeron a pesar de una disminución significativa del volumen de la placa y una reducción significativa del colesterol unido a lipoproteínas de baja densidad durante el tratamiento hipolipemiante agresivo.