La puntuación PARIS permite una estratificación combinada de los riesgos isquémico y hemorrágico de los pacientes con cardiopatía isquémica tratados con stent coronario y tratamiento antiagregante plaquetario doble (TAPD). Se desconoce su utilidad en pacientes con síndrome coronario agudo (SCA) tratados con ticagrelor o prasugrel. Se investiga este aspecto en un registro internacional.
MétodosEstudio retrospectivo multicéntrico con participación voluntaria de 11 centros de 6 países europeos. Se estudió a 4.310 pacientes con SCA dados de alta en TAPD con ticagrelor o prasugrel. Se definió evento isquémico como trombosis de stent o infarto de miocardio espontáneo, y evento hemorrágico según BARC (Bleeding Academic Research Consortium) tipo 3 o 5. Se calculó la discriminación y la calibración para ambas vertientes de la puntuación PARIS (PARISisquémico y PARIShemorrágico). El beneficio neto isquémico-hemorrágico se obtuvo mediante la diferencia entre las probabilidades predichas de eventos isquémicos y hemorrágicos.
ResultadosDurante 17,2 ± 8,3 meses, hubo 80 eventos isquémicos (el 1,9% anual) y 66 eventos hemorrágicos (el 1,6% anual). PARISisquémico y PARIShemorrágico se asociaron con el riesgo de eventos isquémicos (sHR = 1,27; IC95%, 1,16-1,39) y hemorrágicos (sHR = 1,14; IC95%, 1,01-1,30) respectivamente. La discriminación de eventos isquémicos fue discreta (índice C = 0,64) y la de eventos hemorrágicos, pobre (índice C = 0,56), con buena calibración para ambos. El beneficio neto isquémico-hemorrágico resultó negativo (más eventos hemorrágicos) en pacientes con alto riesgo hemorrágico y positivo (más eventos isquémicos) en pacientes con alto riesgo isquémico.
ConclusionesEn pacientes con SCA tratados con TAPD con ticagrelor o prasugrel, la escala PARIS ayuda a establecer un equilibrio apropiado del riesgo isquémico-hemorrágico.
Palabras clave
Una de las piedras angulares del tratamiento del síndrome coronario agudo (SCA) es el tratamiento antiagregante plaquetario doble (TAPD)1. El TAPD con ácido acetilsalicílico (AAS) y un inhibidor del receptor plaquetario P2Y12 ha permitido reducir la recurrencia de eventos isquémicos tras un SCA2–4. Sin embargo, su uso conlleva un aumento del riesgo hemorrágico que a su vez empeora el pronóstico5. Lograr una terapia antitrombótica equilibrada que maximice el beneficio de su uso (reducción del riesgo isquémico sin incrementar el riesgo hemorrágico) es uno de los objetivos de la cardiología clínica actual en pacientes con SCA6,7.
Actualmente se dispone de diversas puntuaciones que permiten estratificar el riesgo de eventos isquémicos8. Ante un paciente con elevado riesgo isquémico, las actuales directrices de tratamiento en el SCA recomiendan el uso de antiplaquetarios más potentes (ticagrelor o prasugrel) y durante más tiempo (< 12 frente a ≥ 12 meses)9–11. Sin embargo, dicha recomendación se debe basar también en el riesgo hemorrágico individual7. Hasta hace poco, no se disponía de herramientas cuantitativas que ayudaran a los clínicos en la estratificación del riesgo hemorrágico tras el alta en el SCA. En cambio, ahora hay varias, como las escalas PARIS12 y PRECISE-DAPT13, entre otras14. El hecho de que los riesgos isquémico y hemorrágico a menudo compartan predictores dificulta la aplicabilidad clínica de las herramientas previas en la toma de decisiones clínicas.
Los investigadores del registro PARIS (Patterns of non-adherence to Antiplatelet Regimens In Stented patients)12 han intentado recientemente resolver los vacíos mencionados. La nueva puntuación PARIS, al integrar ambos riesgos en la misma herramienta, pretende ayudar a los clínicos a predecir el riesgo isquémico y hemorrágico después del alta por un SCA12.
Con este estudio, se pretende analizar la utilidad de la escala isquémico-hemorrágica PARIS en una población de pacientes con SCA revascularizados percutáneamente con implante de stent coronario (metálico y/o farmacoactivo) y que recibían TAPD con AAS más prasugrel o AAS más ticagrelor en el momento del alta hospitalaria.
MÉTODOSPoblación de estudioEl RENAMI (REgistry of New Antiplatelet therapy in patients with acute Myocardial Infarction) es un registro retrospectivo, observacional, multicéntrico e internacional, en el que participaron voluntariamente 11 centros de 6 países europeos (España, Italia, Suiza, Grecia, Serbia y Reino Unido). El RENAMI es un registro no financiado, dependiente del investigador, que surge de la necesidad de profundizar en el conocimiento sobre el beneficio clínico (riesgo isquémico-hemorrágico) del TAPD con ticagrelor frente a prasugrel en el SCA. Durante la celebración del congreso Europeo de cardiología de 2016, en una reunión de jóvenes investigadores, se propuso la realización del mencionado registro y se establecieron los siguientes criterios de inclusión: a) pacientes consecutivos dados de alta con el diagnóstico de SCA, en cualquier franja temporal del periodo comprendido entre enero de 2012 y enero de 2016; b) con estenosis coronarias ≥ 50% en tronco de coronaria izquierda o ≥ 70% en el resto del árbol coronario; c) tratados con stent coronario durante el ingreso índice, y d) tratados al alta hospitalaria con TAPD: AAS (100 mg cada 24 h) más prasugrel (10 mg cada 24 h) o AAS más ticagrelor (90 mg cada 12 h).
Se diseñó una base de datos para la recogida retrospectiva de información sobre variables clínicas, analíticas, angiográficas y del seguimiento (mortalidad, eventos isquémicos y hemorrágicos) (tabla 1 del material suplementario). Las bases de datos cubiertas procedentes de cada uno de los 11 centros participantes (tabla 2 del material suplementario), se enviaron encriptadas al centro de coordinación (Hospital Universitario Álvaro Cunqueiro de Vigo, Pontevedra), donde se fusionaron en un único registro. Dos investigadores del centro de coordinación (E. Abu-Assi y S. Raposeiras-Roubín) se encargaron de construir el registro unificado. Todo ello se realizó según lo establecido en la Declaración de Helsinki y la aprobación de los comités de ética locales.
Los SCA se clasificaron en infarto agudo de miocardio (IAM) con elevación del segmento ST, IAM sin elevación del segmento ST y angina inestable10,11.
En este estudio, de los 4.424 pacientes del RENAMI, se excluyó (con base en el diseño original de la puntuación PARIS, centrado en los eventos tras el alta) a aquellos con: a) hemorragia mayor hospitalaria de tipos 3 o 5 (n = 52 [1,2%]) de la clasificación BARC (Bleeding Academic Research Consortium)15, y b) IAM espontáneo16 durante la hospitalización o trombosis de stent (probable o confirmada)17 (n = 62 [1,4%]).
Así, la cohorte final de este estudio fue de 4.310 pacientes. Los procedimientos diagnósticos y terapéuticos se realizaron según las prácticas locales.
Objetivo, definición y seguimientoEl objetivo del estudio es valorar la utilidad clínica de la puntuación PARIS en la evaluación del beneficio neto isquémico-hemorrágico en pacientes que reciben TAPD con ticagrelor o prasugrel, así como la capacidad predictiva de cada vertiente (PARISisquémico y PARIShemorrágico) en la valoración del riesgo de reinfarto/trombosis de stent y hemorragia mayor.
Los eventos en este estudio se definieron siguiendo las definiciones adoptadas en el estudio PARIS12. Así, se consideró hemorragias mayores como una hemorragia BARC 3 o 5 y como eventos isquémicos, el IAM espontáneo (definido como elevación de marcadores de daño miocárdico por encima del límite superior de la normalidad en combinación con clínica anginosa o alteraciones electrocardiográficas compatibles con isquemia miocárdica16) y la trombosis de stent confirmada o probable según el Academic Research Consortium17.
La información sobre los eventos durante el seguimiento se obtuvo de los registros de datos clínicos hospitalarios y administrativos. En este estudio solo se consideró el primer evento isquémico y hemorrágico. El tiempo de seguimiento se dio por finalizado en caso de que se presentara un evento isquémico (n = 80 [1,8%]) o hemorrágico (n = 66 [1,5%]), muerte (n = 97 [2,3%]), suspensión/retirada de TAPD (n = 2.609 [60,5%]) o fin de seguimiento en el registro clínico local.
Cálculo de las escalas de riesgo de la escala PARIS y categorizaciónLas puntuaciones PARISisquémico y PARIShemorrágico se calcularon según las definiciones empleadas en la cohorte de desarrollo12 (tabla 3 del material suplementario).
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar. Las variables discretas se expresan en porcentajes. Las variables continuas se compararon con la prueba de la t de Student. Las variables discretas se compararon con la prueba de la χ2 de Pearson. Para el análisis de incidencia de eventos (isquémicos y hemorrágicos), se trazaron las curvas de incidencia acumulada.
Se determinaron los componentes individuales de la puntuación PARIS que resultaron predictores independientes en esta serie. Para ello se introdujeron dichos componentes en un modelo de regresión de Fine y Gray para riesgos competitivos18, siendo la muerte el evento competitivo, y se examinó su asociación con los eventos estudiados (tanto isquémicos como hemorrágicos). La magnitud de dicha asociación se expresó mediante subhazard ratio (sHR), con su intervalo de confianza del 95% (IC95%). La capacidad predictiva de las 2 vertientes de la escala PARIS (PARISisquémico y PARIShemorrágico) se evaluó también mediante un modelo de regresión de Fine y Gray para riesgos competitivos, de modo similar a lo anteriormente descrito. Para comparaciones entre grupos, se utilizó la categoría de bajo riesgo como referencia. Mediante la opción clúster en Stata, se realizó un análisis de clúster no jerárquico para tener en cuenta la agrupación de pacientes dentro de cada hospital.
La capacidad predictiva del modelo final se calculó mediante el índice c, usando la función c-index de la extensión «pec» para R. La calibración se evaluó comparando la probabilidad observada con la predicha en los 3 grupos de riesgo originalmente establecidos en la cohorte de derivación de la puntuación PARIS12, y se indicaron los valores de p obtenidos aplicando el método de Hosmer-Lemeshow.
El beneficio neto isquémico-hemorrágico se calculó mediante la diferencia absoluta entre la probabilidad predicha de eventos isquémicos y la probabilidad predicha de eventos hemorrágicos, de modo análogo a lo realizado en la cohorte de derivación de la puntuación PARIS13. El riesgo esperado de eventos isquémicos y hemorrágicos para ambas puntuaciones de la escala PARIS se modelizó mediante polinomiales fraccionados. Las diferencias positivas indican un exceso de riesgo isquémico, mientras que las diferencias negativas indican un exceso de riesgo hemorrágico.
De manera complementaria, se realizó un análisis de la capacidad predictiva de las 2 puntuaciones para mortalidad, mediante un modelo de regresión de Cox (figura 1 del material suplementario, figura 2 del material suplementario, figura 3 del material suplementario y figura 4 del material suplementario). El requisito de linealidad de las 2 puntuaciones PARIS se confirmó mediante el comando nlcheck de Stata.
En RENAMI, se disponía de datos completos de todas las variables salvo de la hemoglobina basal y la creatinina sérica (el 3,3% de valores perdidos, n = 141) y peso y talla (el 16,6% de valores perdidos, n = 717). Para los valores perdidos, se realizó una imputación simple con reemplazo por las medianas de cada variable según el sexo. Para valorar el impacto de los datos perdidos en la capacidad predictiva de la puntuación, se realizó un análisis de sensibilidad tras excluir a los pacientes con valores perdidos (tabla 4 del material suplementario y tabla 5 de material suplementario).
Los análisis estadísticos se realizaron usando los paquetes Stata/MP 13.1 y R 3.3.1. Se consideró un resultado estadísticamente significativo si p < 0,05.
RESULTADOSPoblación de estudio y eventosLa media de edad de los 4.310 pacientes estudiados era 60,9 ± 11,5, y el 20,8% eran mujeres. Del total, el 58,0% tenía IAM con elevación del segmento ST; el 32,9%, IAM sin elevación del segmento ST, y el 9,0%, angina inestable; estaba en clase Killip ≥ II el 11,1%.
Se trató con TAPD con ticagrelor al 61,4% (n = 2.647). Se dispone de datos sobre la puntuación GRACE a 6 meses de 1.528 pacientes (35,4%), con valor de 120,7 ± 32,1 puntos. En pacientes con SCA sin elevación del segmento ST, el valor medio de la puntuación GRACE fue de 118,3 ± 32,1 puntos, y de 122,7 ± 31,9 la de los pacientes con IAM con elevación del segmento ST.
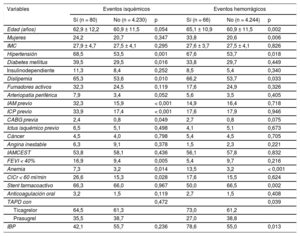
Durante 17,2 ± 8,3 meses, murieron 97 pacientes (2,3%); 80 experimentaron eventos isquémicos (incidencia acumulada anual, 1,9%; IC95%, 1,5-2,3%), de los cuales 41 fueron trombosis de stent; 66 pacientes presentaron hemorragias BARC 3 o 5 (incidencia acumulada anual, 1,6%; IC95%, 1,2-2,0%). En la tabla 1 se comparan las características basales de los pacientes con y sin eventos isquémicos y hemorrágicos.
Características basales de la población de estudio, por grupos de pacientes con y sin eventos (tanto hemorrágicos como isquémicos)
| Variables | Eventos isquémicos | Eventos hemorrágicos | ||||
|---|---|---|---|---|---|---|
| Sí (n = 80) | No (n = 4.230) | p | Sí (n = 66) | No (n = 4.244) | p | |
| Edad (años) | 62,9 ± 12,2 | 60,9 ± 11,5 | 0,054 | 65,1 ± 10,9 | 60,9 ± 11,5 | 0,002 |
| Mujeres | 24,2 | 20,7 | 0,347 | 33,8 | 20,6 | 0,006 |
| IMC | 27,9 ± 4,7 | 27,5 ± 4,1 | 0,295 | 27,6 ± 3,7 | 27,5 ± 4,1 | 0,826 |
| Hipertensión | 68,5 | 53,5 | 0,001 | 67,6 | 53,7 | 0,018 |
| Diabetes mellitus | 39,5 | 29,5 | 0,016 | 33,8 | 29,7 | 0,449 |
| Insulinodependiente | 11,3 | 8,4 | 0,252 | 8,5 | 5,4 | 0,340 |
| Dislipemia | 65,3 | 53,6 | 0,010 | 66,2 | 53,7 | 0,033 |
| Fumadores activos | 32,3 | 24,5 | 0,119 | 17,6 | 24,9 | 0,326 |
| Arteriopatía periférica | 7,9 | 3,4 | 0,052 | 5,6 | 3,5 | 0,405 |
| IAM previo | 32,3 | 15,9 | < 0,001 | 14,9 | 16,4 | 0,718 |
| ICP previo | 33,9 | 17,4 | < 0,001 | 17,6 | 17,9 | 0,946 |
| CABG previa | 2,4 | 0,8 | 0,049 | 2,7 | 0,8 | 0,075 |
| Ictus isquémico previo | 6,5 | 5,1 | 0,498 | 4,1 | 5,1 | 0,673 |
| Cáncer | 4,5 | 4,0 | 0,798 | 5,4 | 4,5 | 0,705 |
| Angina inestable | 6,3 | 9,1 | 0,378 | 1,5 | 2,3 | 0,221 |
| IAMCEST | 53,8 | 58,1 | 0,436 | 56,1 | 57,8 | 0,832 |
| FEVI < 40% | 16,9 | 9,4 | 0,005 | 5,4 | 9,7 | 0,216 |
| Anemia | 7,3 | 3,2 | 0,014 | 13,5 | 3,2 | < 0,001 |
| ClCr < 60 ml/min | 26,6 | 15,3 | 0,028 | 17,6 | 15,5 | 0,624 |
| Stent farmacoactivo | 66,3 | 66,0 | 0,967 | 50,0 | 66,5 | 0,002 |
| Anticoagulación oral | 3,2 | 1,5 | 0,119 | 2,7 | 1,5 | 0,408 |
| TAPD con | 0,472 | 0,039 | ||||
| Ticagrelor | 64,5 | 61,3 | 73,0 | 61,2 | ||
| Prasugrel | 35,5 | 38,7 | 27,0 | 38,8 | ||
| IBP | 42,1 | 55,7 | 0,236 | 78,6 | 55,0 | 0,013 |
CABG: cirugía de revascularización aortocoronaria; ClCr: aclaramiento de creatinina; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IBP: inhibidor de la bomba de protones; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; TAPD: tratamiento antiagregante plaquetario doble.
Salvo otra indicación, los valores expresan porcentaje.
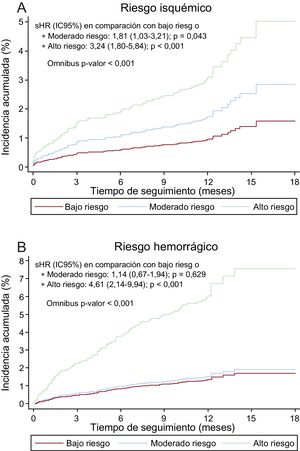
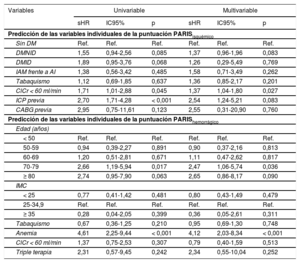
La puntuación PARISisquémico se asoció significativamente con el riesgo isquémico, tanto de forma continua (sHR = 1,27; IC95%, 1,16-1,39; p < 0,001), como categórica (figura 1A). La puntuación PARIShemorrágico también se asoció significativamente con el riesgo hemorrágico, sobre todo de forma continua (sHR = 1,14; IC95%, 1,01-1,30; p = 0,038). Como variable categórica, el grupo de riesgo moderado no mostró diferencias en la incidencia de hemorragia respecto al grupo de bajo riesgo (figura 1B).
En la tabla 2 se muestra la asociación de las variables que forman las puntuaciones de riesgo PARIS con los eventos isquémicos y hemorrágicos.
Análisis univariable y multivariable de las variables de la puntuación PARIS
| Variables | Univariable | Multivariable | ||||
|---|---|---|---|---|---|---|
| sHR | IC95% | p | sHR | IC95% | p | |
| Predicción de las variables individuales de la puntuación PARISisquémico | ||||||
| Sin DM | Ref. | Ref. | Ref. | Ref. | Ref. | Ref. |
| DMNID | 1,55 | 0,94-2,56 | 0,085 | 1,37 | 0,96-1,96 | 0,083 |
| DMID | 1,89 | 0,95-3,76 | 0,068 | 1,26 | 0,29-5,49 | 0,769 |
| IAM frente a AI | 1,38 | 0,56-3,42 | 0,485 | 1,58 | 0,71-3,49 | 0,262 |
| Tabaquismo | 1,12 | 0,69-1,85 | 0,637 | 1,36 | 0,85-2,17 | 0,201 |
| ClCr < 60 ml/min | 1,71 | 1,01-2,88 | 0,045 | 1,37 | 1,04-1,80 | 0,027 |
| ICP previa | 2,70 | 1,71-4,28 | < 0,001 | 2,54 | 1,24-5,21 | 0,083 |
| CABG previa | 2,95 | 0,75-11,61 | 0,123 | 2,55 | 0,31-20,90 | 0,760 |
| Predicción de las variables individuales de la puntuación PARIShemorrágico | ||||||
| Edad (años) | ||||||
| < 50 | Ref. | Ref. | Ref. | Ref. | Ref. | Ref. |
| 50-59 | 0,94 | 0,39-2,27 | 0,891 | 0,90 | 0,37-2,16 | 0,813 |
| 60-69 | 1,20 | 0,51-2,81 | 0,671 | 1,11 | 0,47-2,62 | 0,817 |
| 70-79 | 2,66 | 1,19-5,94 | 0,017 | 2,47 | 1,06-5,74 | 0,036 |
| ≥ 80 | 2,74 | 0,95-7,90 | 0,063 | 2,65 | 0,86-8,17 | 0,090 |
| IMC | ||||||
| < 25 | 0,77 | 0,41-1,42 | 0,481 | 0,80 | 0,43-1,49 | 0,479 |
| 25-34,9 | Ref. | Ref. | Ref. | Ref. | Ref. | Ref. |
| ≥ 35 | 0,28 | 0,04-2,05 | 0,399 | 0,36 | 0,05-2,61 | 0,311 |
| Tabaquismo | 0,67 | 0,36-1,25 | 0,210 | 0,95 | 0,69-1,30 | 0,748 |
| Anemia | 4,61 | 2,25-9,44 | < 0,001 | 4,12 | 2,03-8,34 | < 0,001 |
| ClCr < 60 ml/min | 1,37 | 0,75-2,53 | 0,307 | 0,79 | 0,40-1,59 | 0,513 |
| Triple terapia | 2,31 | 0,57-9,45 | 0,242 | 2,34 | 0,55-10,04 | 0,252 |
AI: angina inestable; CABG: cirugía de revascularización aortocoronaria; ClCr: aclaramiento de creatinina; DM: diabetes mellitus; DMID: DM insulinodependiente; DMNID: DM no insulinodependiente; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; sHR: subhazard ratio.
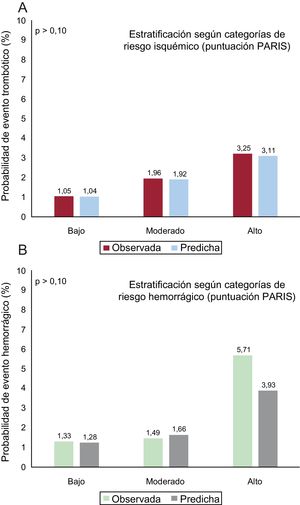
La capacidad discriminativa de la puntuación PARIS para eventos isquémicos fue discreta (índice C = 0,64; IC95%, 0,62-0,66), con una calibración buena (figura 2A), mientras que para eventos hemorrágicos fue pobre (índice C = 0,56; IC95%, 0,53-0,59), con una calibración aceptable, sobre todo para los grupos de riesgo bajo y moderado (figura 2B).
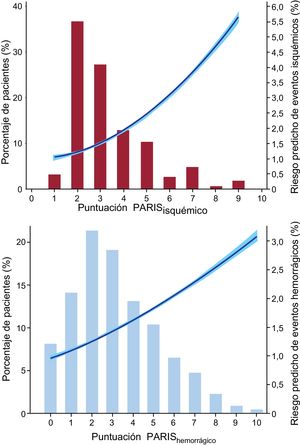
La figura 3 muestra la distribución de ambas puntuaciones PARIS, con la probabilidad predicha de los correspondientes eventos. La mayoría de los pacientes se clasificaron en riesgo isquémico bajo-moderado (≤ 4 puntos) y riesgo hemorrágico bajo (≤ 3 puntos). Muy pocos pacientes se clasificaron en riesgo hemorrágico elevado (n = 280 [6,5%]).
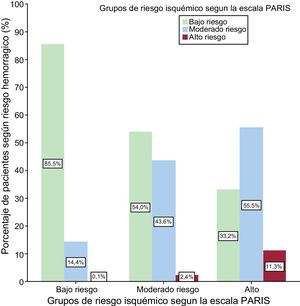
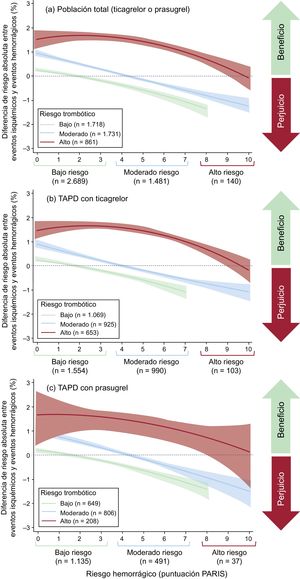
Equilibrio isquémico-hemorrágicoLa mayor parte (85,5%) de los pacientes con bajo riesgo isquémico también tenían bajo riesgo hemorrágico según la escala PARIS. Sin embargo, para alto riesgo isquémico, solo el 11,3% de los pacientes estaban en alto riesgo hemorrágico (figura 4).
La figura 5 refleja gráficamente el beneficio neto isquémico-hemorrágico en función del grupo de riesgo isquémico y hemorrágico en el que se encuentre el paciente. El beneficio neto isquémico-hemorrágico resulta negativo (más riesgo de eventos hemorrágicos que isquémicos) para la mayoría de los pacientes con bajo riesgo isquémico (aumentado a medida que aumenta el riesgo hemorrágico), así como en aquellos con riesgo isquémico moderado y riesgo hemorrágico moderado-alto.
En los pacientes de alto riesgo isquémico, el beneficio neto isquémico-hemorrágico tendió a ser positivo, especialmente para aquellos con riesgo hemorrágico bajo-moderado. Estos resultados son similares tanto para ticagrelor como para prasugrel (figura 5).
DISCUSIÓNEl presente estudio muestra la utilidad de la escala PARIS para optimizar el beneficio neto isquémico-hemorrágico en una población de pacientes con SCA tratados con intervención coronaria percutánea que recibieron TAPD con ticagrelor o prasugrel. Los datos de este registro internacional, con más de 4.000 pacientes de la vida real, validan las 2 puntuaciones de riesgo (isquémico y hemorrágico) de la escala PARIS. La capacidad discriminativa de eventos isquémicos fue discreta y la de episodios hemorrágicos, pobre, pero con una buena calibración.
A pesar de que el riesgo isquémico y hemorrágico se correlacionan estrechamente19, los resultados del presente estudio indican que, con base en la escala PARIS, se puede identificar a los pacientes con riesgos discordantes. Así, la combinación de ambas puntuaciones (PARISisquémico y PARIShemorrágico) permitió predecir el beneficio neto isquémico-hemorrágico. Tras estratificar a los pacientes en bajo, moderado y alto riesgo, se observó que los pacientes con bajo riesgo isquémico y aquellos con alto riesgo hemorrágico generalmente tienen un beneficio neto isquémico-hemorrágico negativo (más eventos hemorrágicos que isquémicos) con el TAPD con prasugrel y ticagrelor, mientras que los pacientes con alto riesgo isquémico y aquellos con bajo riesgo hemorrágico tienen un beneficio neto isquémico-hemorrágico positivo (más eventos isquémicos que hemorrágicos). En pacientes de moderado riesgo isquémico, el equilibrio isquémico-hemorrágico está condicionado por el riesgo hemorrágico: en pacientes de moderado-alto riesgo hemorrágico, el equilibrio tiende a ser negativo, mientras que en los pacientes con bajo riesgo hemorrágico, el equilibrio tiende a ser positivo.
Estos resultados deben interpretarse en el contexto clínico donde se realizó el estudio: pacientes que recibieron intervención coronaria percutánea tratados al alta con TAPD con ticagrelor o prasugrel, que durante la hospitalización no presentaron eventos isquémicos ni hemorrágicos y cuyo riesgo de muerte a 6 meses, estimado por la escala GRACE, era moderado.
La escala predictiva PARIS12 tuvo una buena acogida a la hora de evaluar el riesgo-beneficio del TAPD. Así, en la revisión anexa a las recomendaciones americanas de la duración del TAPD20, se aconsejaba evaluar el riesgo hemorrágico y superponerlo al riesgo isquémico de modo similar que la escala PARIS. Así, en los pacientes en los que se preveía un beneficio neto isquémico-hemorrágico negativo por predominio de eventos hemorrágicos, se aconsejaban pautas más cortas de TAPD, y con preferencia usando clopidogrel en detrimento de ticagrelor o prasugrel11.
En la escala PARIS original12, los pacientes con bajo riesgo hemorrágico presentaban tasas de hemorragia a 2 años < 2%; los de riesgo moderado, de un 2-4%, y los de alto riesgo, > 4%. En este estudio, en una población de pacientes a los que se prescribió TAPD con ticagrelor o prasugrel, la incidencia acumulada anual de hemorragia resultó muy similar entre los pacientes con moderado y bajo riesgo de hemorragia (ambas por debajo del 2%) y los de alto riesgo de hemorragia (> 4%), aunque la capacidad discriminativa de la puntuación PARIShemorrágico es más bien pobre. Una posible explicación para ese discreto resultado en la predicción solo de eventos hemorrágicos radica en que la población de nuestro estudio (RENAMI) es una población a priori seleccionada. Eran pacientes a los que se pautó TAPD con ticagrelor o prasugrel en lugar de clopidogrel en función del juicio clínico del médico responsable de cada paciente. Y esta prescripción suele estar condicionada por la estimación subjetiva de un riesgo hemorrágico bajo o moderado. De hecho, no se recomienda prasugrel para pacientes mayores de 75 años, con antecedentes de ictus o peso < 60 kg, ya que en ellos el TAPD con prasugrel se ha asociado con mayor riesgo de hemorragia y un beneficio neto isquémico-hemorrágico no favorable en comparación con el TAPD con clopidogrel2.
Una vez integradas ambas vertientes de la escala PARIS y estratificando por grupos de riesgo, la estimación del beneficio neto isquémico-hemorrágico en esta población fue buena. Según los resultados obtenidos, se podría considerar el uso de la escala PARIS (diseñada en una población que mayoritariamente recibió TAPD con clopidogrel, apenas el 7% de los pacientes recibieron prasugrel [n < 400] y ninguno ticagrelor) para determinar el beneficio neto isquémico-hemorrágico en los pacientes tratados con TAPD con ticagrelor y prasugrel. Teniendo en cuenta que el perfil isquémico-hemorrágico del clopidogrel difiere bastante del de ticagrelor o prasugrel2,3, el beneficio neto isquémico-hemorrágico es útil a la hora de determinar la mejor estrategia antitrombótica al alta, en cuanto a duración y tipo del TAPD21,22. De esta forma, para los pacientes con alto riesgo hemorrágico según la puntuación PARIS, sobre todo si el riesgo isquémico es bajo o moderado, no solo se debería aconsejar pautas de TAPD más cortas23–26, sino también TAPD con clopidogrel en lugar de ticagrelor o prasugrel2,3,27. Aunque la escala PARIS se derivó de una población de pacientes con cardiopatía isquémica (tanto angina estable como SCA, que son el 37,8% de la población del PARIS) tratados con stents farmacoactivos12, los resultados se centran únicamente en pacientes con SCA, todos ellos tratados con stents farmacoactivos o metálicos.
Hay que tener en cuenta que en los últimos 2 años han surgido diferentes puntuaciones de riesgo que tratan de ayudar a los médicos en la toma de decisiones sobre el tipo y la duración del TAPD. Recientemente, y posterior a la puntuación PARIS, surgió la puntuación PRECISE-DAPT13, que trata de estratificar el riesgo de los pacientes y el beneficio que tendría acortar o prolongar la duración del TAPD según el riesgo hemorrágico. La ventaja de la puntuación PARIS12, recomendada por las guías americanas, frente a la puntuación PRECISE-DAPT13, recomendada por las europeas, radica en que se combinan ambos riesgos, el isquémico y el hemorrágico, lo cual permite calcular el beneficio neto isquémico-hemorrágico previsto.
También está la puntuación DAPT27, que una vez cumplido 1 año de TAPD ayuda al clínico en la selección de pacientes que se benefician de prolongar el TAPD más allá del primer año. Frente a la puntuación TAPD, la puntuación PARIS12 tiene la ventaja de que permite estimar un equilibrio isquémico-hemorrágico ya en el momento del alta, sin tener que esperar al primer año, lo que a su vez permite no solo prolongar el TAPD, sino también decidir en qué pacientes se debe acorta su duración23,24.
LimitacionesLa principal limitación del presente estudio radica en su naturaleza retrospectiva, con las limitaciones inherentes a este tipo de registros. Tal y como se comentó en la discusión, hay un importante sesgo de selección terapéutica en la población, pues son todos pacientes a los que se prescribió TAPD con prasugrel o ticagrelor en lugar de clopidogrel en función de las normas y las preferencias de cada centro y del criterio subjetivo del médico responsable, limitado fundamentalmente por la estimación subjetiva de un riesgo hemorrágico bajo o moderado. Además, debe tenerse en cuenta que se excluyó a pacientes con eventos isquémicos y hemorrágicos durante la fase hospitalaria. Por otro lado, los resultados del presente estudio han de interpretarse en el contexto de pacientes de riesgo moderado según la puntuación GRACE de predicción de mortalidad a 6 meses. Otra limitación de este estudio es la ausencia de datos sobre el acceso vascular empleado para la coronariografía durante el ingreso. Asimismo, la generalización de los hallazgos obtenidos está limitada a los pacientes con SCA tratados con intervención coronaria percutánea durante el ingreso y al alta con TAPD con prasugrel o ticagrelor además de AAS. A pesar de dichas limitaciones, el estudio sirve para asentar la hipótesis de que la escala isquémico-hemorrágica PARIS podría tener utilidad a la hora de decidir el tipo y la duración del TAPD tras un SCA. Sería necesario un estudio prospectivo que demostrase si la personalización del TAPD para cada paciente con base en la escala PARIS es útil o no para prevenir eventos tanto isquémicos como hemorrágicos.
CONCLUSIONESEn pacientes con SCA tratados con intervención coronaria percutánea durante la hospitalización y TAPD con ticagrelor o prasugrel al alta, la escala PARIS podría ayudar a la estimación del beneficio neto isquémico-hemorrágico, con vistas a determinar la estrategia antitrombótica más adecuada para cada paciente en cuanto a tipo y duración del TAPD.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología.
- –
La puntuación PARIS se ha desarrollado en una población de pacientes con cardiopatía isquémica (< 50% SCA) tratados con revascularización percutánea con stent farmacoactivo y doble antiagregación (> 90% con clopidogrel). Además de demostrarse una adecuada capacidad predictiva tanto de eventos isquémicos como de eventos hemorrágicos, su gran atractivo radica en que permite integrar ambos riesgos en un mismo paciente, lo que facilita una valoración precisa del beneficio neto isquémico-hemorrágico que podría ser de utilidad para decidir la mejor estrategia antitrombótica en cuanto a tipo y duración del TAPD.
- –
El presente estudio analiza por primera vez la capacidad de la puntuación PARIS para la predicción de eventos isquémicos y hemorrágicos en una población de pacientes con SCA tratados con revascularización percutánea (stents farmacoactivos y stents metálicos) y doble antiagregación con ticagrelor o prasugrel. Se demuestra la utilidad de la puntuación PARIS para integrar ambos riesgos (isquémico y hemorrágico) en esta población, determinando los grupos de pacientes con un beneficio neto isquémico-hemorrágico más favorable y que podrían beneficiarse de la doble antiagregación con ticagrelor y prasugrel.