Las enfermedades cardiovasculares, incluida la miocardiopatía, son las principales complicaciones de la diabetes mellitus. Un conocimiento más profundo de los mecanismos moleculares que conducen a la miocardiopatía es crucial para el desarrollo de nuevos tratamientos. Se propuso la fosfoinosítido 3-cinasa gamma (PI3Kγ) como objetivo molecular contra la miocardiopatía diabética, dado el papel que desempeña la PI3Kγ en el remodelado cardiaco frente a la sobrecarga de presión. Dada la disponibilidad de un inhibidor farmacológico de este objetivo molecular, el GE21, se ha investigado la validez de nuestra hipótesis induciendo la diabetes a ratones con ablación genética de la PI3Kγ, o knock-in, para una PI3Kγ catalíticamente inactiva.
MétodosSe provocó la diabetes a los ratones empleando estreptozotocina. Se evaluó la función cardiaca mediante exámenes ecocardiográficos secuenciales, mientras que la fibrosis y la inflamación se evaluaron mediante examen histológico.
ResultadosLa diabetes mellitus indujo disfunción cardiaca en los ratones genéticamente intactos (wild-type). La disfunción sistólica se previno completamente y la diastólica parcialmente, tanto en ratones con PI3Kγ inactivada como ratones sin actividad de cinasa. La disfunción cardiaca se recuperó en la misma medida administrando el inhibidor de la PI3Kγ GE21, de manera dependiente de la dosis. Estas acciones de inhibición genética o farmacológica de la PI3Kγ se asociaron con una reducción de la fibrosis y la inflamación en el corazón diabético.
ConclusionesNuestro estudio demuestra un papel fundamental de la PI3Kγ en la miocardiopatía diabética en ratones y el efecto beneficioso de la inhibición farmacológica de la PI3Kγ; destaca su potencial como estrategia prometedora para el tratamiento clínico de las complicaciones cardiacas de los pacientes diabéticos.
Palabras clave
La diabetes mellitus (DM) es un importante problema de salud pública que afecta a casi 400 millones de personas y causa 5 millones de muertes al año en todo el mundo1. Las complicaciones cardiovasculares, como la aterosclerosis y la miocardiopatía, son las principales causas de muerte en la DM.
En la DM se observan varias anomalías cardiacas, como apoptosis, hipertrofia, fibrosis y alteraciones de la contractilidad de los miocitos, que dan lugar a disfunción ventricular izquierda. Estas anomalías llevan al trastorno clínico denominado miocardiopatía diabética (MCD), que se diagnostica cuando se produce una disfunción ventricular sin que haya aterosclerosis coronaria ni hipertensión. Se ha demostrado que la DM aumenta el riesgo de insuficiencia cardiaca entre 2 y 5 veces2.
La miocardiopatía diabética puede tener varias causas, ya que hay distintas alteraciones anatomopatológicas inducidas por el estado hiperglucémico, como el estrés oxidativo, la disfunción endotelial y la alteración del perfil inflamatorio, que pueden afectar a la función y la estructura del corazón3.
Un conocimiento más profundo de los mecanismos moleculares que conducen a las anomalías cardiacas anatomopatológicas es crucial para el desarrollo de nuevos tratamientos destinados a mejorar la evolución cardiovascular de los pacientes diabéticos.
Hemos estudiado ampliamente, tanto en células cardiacas como en leucocitos, la señalización de la isoforma gamma de la fosfoinosítido 3-cinasa gamma (PI3Kγ), una cinasa de lípidos y proteínas que genera el segundo mensajero fosfatidilinositol (3,4,5)-trifosfato, y da lugar a la activación de las cascadas de señalización de pasos posteriores. Al estudiar la función que esta proteína cumple en el remodelado cardiaco en respuesta a la sobrecarga de presión, se observó que, en los miocitos, la PI3Kγ ejerce un control negativo de la concentración de adenosina monofosfato cíclico (cAMP) como proteína de armazón4,5 y desempeña un papel clave durante la internalización de los receptores adrenérgicos β activados, a través de su actividad cinasa6. Además, dado que se sabe que la PI3Kγ regula la migración de los leucocitos al desencadenar la acumulación de fosfatidil(3,4,5)-trifosfato en el borde de avance7, se exploró con mayor detalle la repercusión de esta vía de señalización en el proceso inflamatorio que interviene en el remodelado cardiaco en respuesta a la sobrecarga de presión. Se observó que la PI3Kγ leucocitaria afecta de manera crucial al reclutamiento de células inflamatorias y el proceso fibroso que es característico observar en la sobrecarga de presión, ya que su inhibición permite un remodelado cardiaco favorable8. En el aspecto vascular, se ha descrito que los ratones que carecen de PI3Kγ están protegidos contra la hipertensión inducida por la administración crónica de angiotensina II9 a través de un mecanismo en el que intervienen tanto el estrés oxidativo como el manejo del calcio, lo cual indica un papel adicional de la PI3Kγ en la regulación del tono vascular. Recientemente, se ha sintetizado un nuevo inhibidor farmacológico de la PI3Kγ de molécula pequeña, que parece prometedor en la lucha contra las enfermedades cardiovasculares asociadas a la inflamación10.
La hipótesis del presente estudio es que la vía de señalización de la PI3Kγ puede ser importante en la regulación de la migración leucocitaria y el remodelado cardiaco, incluso en otros contextos de fisiopatología cardiovascular, como las alteraciones cardiacas inducidas por la DM. Así pues, se investigó si la PI3Kγ tiene un papel en el desarrollo de la disfunción cardiaca inducida por la DM y si la inhibición farmacológica de la PI3Kγ por medios farmacológicos puede tener efecto terapéutico ante esa complicación de la DM.
MÉTODOSModelo animalSe utilizaron ratones C57Bl/6J machos de 8 semanas de edad, knock-out (KO) para la p110γ, que es la subunidad catalítica de la PI3Kγ, o ratones knock-in con una p110γ catalíticamente inactiva (kinase-dead [KD]), así como otros ratones de las respectivas camadas, genéticamente intactos (wild-type [WT]). Se generaron ratones transgénicos con un método descrito con anterioridad5. Se mantuvo en un ciclo de luz/oscuridad de 12 h a los animales, que dispusieron de alimento y agua ad libitum. Los experimentos se realizaron según lo establecido en las guías europea (Directiva del Consejo de la CE 2010/6) e italiana (D.Lgs. 116/92) sobre el cuidado de los animales, y fueron autorizados por un comité del centro.
Se indujo DM mediante inyecciones consecutivas de estreptozotocina. Se disolvió estreptozotocina (Sigma-Aldrich; Estados Unidos) en tampón de citrato de Na al 2,94% con pH 4,5 y concentración de 7,5 mg/ml. Se inyectó a los ratones por vía intraperitoneal estreptozotocina 50 mg/kg/día durante 5 días.
La aparición de la DM se determinó mediante análisis de la glucosa en suero tras un periodo de 12 h en ayunas y utilizando un kit de análisis colorimétrico de la glucosa (Cayman Chemical; Estados Unidos), según las instrucciones del fabricante.
Se disolvió GE21 en agua y se administró mediante sonda a dosis de 5 mg/kg/día o 50 mg/kg/día, según estuviera indicado. La administración de GE21 se inició 7 semanas después de la primera inyección de estreptozotocina.
Análisis ecocardiográficoSe realizaron análisis ecocardiográficos seriados hasta 15 semanas después de las inyecciones de estreptozotocina.
El análisis ecocardiográfico se realizó después de aplicar a los ratones anestesia con isoflurano (al 5% en oxígeno a 1 l/min para la inducción y al 1% para el mantenimiento de la anestesia), utilizando un dispositivo Vevo 2100 equipado con un transductor de haz lineal de 15–40 MHz (Visualsonics; Canadá). La adquisición de todas las imágenes ecocardiográficas se realizó cuando la frecuencia cardiaca de los ratones era de entre 540 y 590 lpm. Se obtuvo un registro ventricular izquierdo en modo M, utilizando imágenes de eje corto paraesternal bidimensionales como guía. Se midió el grosor del septo interventricular y de la pared posterior en la fase telediastólica, así como el diámetro interno del ventrículo izquierdo. Se calcularon el grosor relativo de la pared, la fracción de eyección y la fracción de acortamiento utilizando fórmulas estándares.
A continuación, en proyección apical de 4 cámaras, se realizó un análisis de Doppler pulsado a nivel de la válvula mitral para determinar el llenado ventricular rápido (onda E) y se utilizó Doppler tisular para determinar la velocidad de relajación precoz a través de la onda E’ en el anillo mitral lateral. Puede argumentarse que el cociente E/E’ no es un indicador perfecto de la función diastólica, que se podría estimar mejor con métodos invasivos como las curvas de presión-volumen. Sin embargo, se ha demostrado que el cociente E/E’ es el parámetro no invasivo más útil como estimador de la función diastólica11, y se optó por este método porque permite evaluar la función diastólica continuamente en el mismo animal.
Por último, se realizó un análisis de la deformación según un método ya descrito12. De manera resumida, se utiliza un análisis de strain basado en el método de speckle-tracking de imágenes de ecocardiografía bidimensionales y en escala de grises adquiridas en las proyecciones de eje corto y eje largo paraesternal, para cuantificar la strain y la strain rate (tasa de deformación) en los ejes longitudinal y radial. Todas las imágenes se adquirieron a una velocidad alta (unos 200 fotogramas/s).
HistologíaSe anestesió a los ratones, se realizó una toracotomía y se provocó una parada cardiaca en diástole (inyección intracardiaca de 100 μl de KCl 1M). Se extrajeron los corazones y se aplicó posfijación durante una noche en paraformaldehído al 4% en solución salina tamponada con fosfato, tras lo cual se incluyeron en parafina. En los cortes cardiacos (4 μm), se determinó la PI3Kγ mediante tinción con un anticuerpo específico (1:100) producido con métodos ya descritos6,8, seguida de un anticuerpo secundario antirratón (1:200, Jackson Immunoresearch; Estados Unidos). Los cortes se tiñeron también con anti-CD68 (1:200, AbD Serotec; Reino Unido), seguido de un anticuerpo secundario antirrata (1:200, Jackson Immunoresearch) con objeto de evaluar la infiltración macrofágica. Además, se evaluó la fibrosis en cortes teñidos con rojo Sirius y se cubrieron con cubreobjetos utilizando medios de montaje de preparaciones con xileno.
Todas las imágenes se captaron con un microscopio de fluorescencia/óptico DMI3000B Leica (Leica Microsystems; Alemania) y se procesaron para los análisis cuantitativos con el programa Leica Application Suite (LAS V3.3) Image Analysis.
Análisis estadísticoLos datos se expresan en forma de media ± error estándar de la media. Se analizaron con un ANOVA (análisis de la varianza) de una vía o con ANOVA de medidas repetidas, según fuera apropiado, seguido de la prueba de Bonferroni post hoc, utilizando un programa informático de estadística (SPSS 21.0, IBM). Se consideró significativo un valor de p bilateral < 0,05.
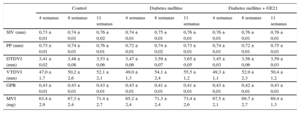
RESULTADOSEfectos de la diabetes mellitus en los parámetros fisiológicos y la estructura y la función cardiacasLa DM inducida por la infusión de estreptozotocina en 4 semanas elevó la glucemia en ayunas de 180 ± 9 a 303 ± 30 mg/dl (p < 0,05) e inhibió el aumento del peso corporal inducido por el avance de la edad en los ratones de control (24,4 ± 0,5 frente a 26,1 ± 0,4g al final del periodo de observación). La DM no afectó a los índices macroscópicos de la estructura cardiaca. De igual modo, la inhibición de la PI3Kγ no tuvo efecto alguno en la estructura del corazón. De hecho, ni las mediciones del grosor del septo interventricular y de la pared posterior ni las del diámetro y el volumen del ventrículo izquierdo mostraron diferencias entre los grupos experimentales (tabla). De igual modo, los parámetros calculados, como la masa ventricular izquierda y el grosor relativo de la pared, fueron similares en los ratones diabéticos y los de control (tabla).
Parámetros ecocardiográficos de la estructura cardiaca
| Control | Diabetes mellitus | Diabetes mellitus + GE21 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 4 semanas | 8 semanas | 11 semanas | 4 semanas | 8 semanas | 11 semanas | 4 semanas | 8 semanas | 11 semanas | |
| SIV (mm) | 0,73 ± 0,01 | 0,74 ± 0,01 | 0,76 ± 0,02 | 0,74 ± 0,01 | 0,75 ± 0,01 | 0,76 ± 0,01 | 0,76 ± 0,01 | 0,76 ± 0,01 | 0,76 ± 0,01 |
| PP (mm) | 0,73 ± 0,01 | 0,74 ± 0,01 | 0,76 ± 0,01 | 0,72 ± 0,01 | 0,74 ± 0,02 | 0,73 ± 0,01 | 0,74 ± 0,01 | 0,72 ± 0,01 | 0,75 ± 0,01 |
| DTDVI (mm) | 3,41 ± 0,02 | 3,48 ± 0,08 | 3,53 ± 0,06 | 3,47 ± 0,06 | 3,59 ± 0,07 | 3,65 ± 0,05 | 3,45 ± 0,03 | 3,56 ± 0,06 | 3,59 ± 0,03 |
| VTDVI (mm) | 47,0 ± 1,7 | 50,2 ± 2,6 | 52,1 ± 2,1 | 49,0 ± 1,3 | 54,1 ± 2,4 | 55,5 ± 1,2 | 49,3 ± 1,1 | 52,9 ± 2,3 | 50,4 ± 1,2 |
| GPR | 0,43 ± 0,01 | 0,43 ± 0,01 | 0,43 ± 0,01 | 0,43 ± 0,01 | 0,41 ± 0,01 | 0,41 ± 0,01 | 0,43 ± 0,01 | 0,42 ± 0,01 | 0,43 ± 0,01 |
| MVI (mg) | 63,4 ± 2,9 | 67,3 ± 2,4 | 71,4 ± 2,7 | 65,2 ± 2,4 | 71,3 ± 2,4 | 73,4 ± 2,6 | 67,5 ± 2,1 | 69,7 ± 2,7 | 69,4 ± 1,3 |
DTDVI: diámetro telediastólico ventricular izquierdo; GPR: grosor relativo de la pared; MVI: masa ventricular izquierda; PP: grosor de la pared posterior ventricular izquierda en diástole; SIV: grosor del septo interventricular en diástole; VTDVI: volumen telediastólico ventricular izquierdo.
Parámetros ecocardiográficos de la estructura cardiaca de los ratones de control, los tratados con estreptozotocina (50 mg/kg/día durante 5 días) y los tratados con estreptozotocina más la dosis superior de GE21 (50 mg/kg/día, iniciada 5 semanas después de la estreptozotocina).
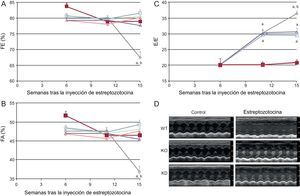
Tal como se esperaba, la DM indujo miocardiopatía. Concretamente, se observó un deterioro de la función sistólica (evaluada mediante la fracción de acortamiento y la fracción de eyección) (figura 1) 15 semanas después de la inducción de DM. La función sistólica empeoró hasta el final del periodo de observación. La DM inducida por estreptozotocina provocó también una disfunción diastólica, evaluada mediante el cociente E/E’. La disfunción diastólica se inició en la semana 11 tras la infusión de estreptozotocina y empeoró luego hasta el final del estudio.
La manipulación genética de la PI3Kγ afecta a la disfunción sistólica y diastólica en los ratones diabéticos, según lo indicado por la ecocardiografía convencional. A: fracción de eyección. B: fracción de acortamiento. C: cociente E/E’ en los ratones WT, KD y KO en condiciones de control y de diabetes. D: imágenes ecocardiográficas representativas. FA: fracción de acortamiento; FE: fracción de eyección; KD: sin actividad cinasa (kinase-dead); KO: knock-out; PI3Kγ: fosfoinosítido 3-cinasa gamma; WT: wild-type. Ratones WT, n = 11 por grupo; ratones KD, n = 7 por grupo; ratones KO, n = 4 por grupo. Símbolos negros: ratones de control; símbolos claros: ratones diabéticos; ◊: ratones WT; □ ratones KD, Δ: ratones KD.
ap < 0,01 frente a las condiciones de control.
bp < 0,01 frente a KD y frente a KO.
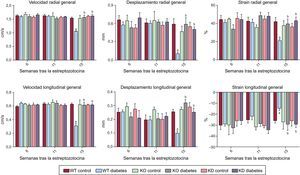
Para evaluar con mayor detalle la función cardiaca, se realizó un análisis de la strain, y se observó que los ratones diabéticos presentaban una alteración de la función miocárdica tanto en el movimiento radial como en el longitudinal (figura 2). De hecho, la DM determinó una disminución de la velocidad radial y longitudinal, el desplazamiento y la strain. De igual modo, la DM redujo la strain radial y longitudinal.
La manipulación genética de la PI3Kγ afecta a la disfunción cardiaca de los ratones diabéticos, según lo indicado por el análisis de la strain. Velocidad radial y longitudinal, desplazamiento y strain en ratones WT, KD y KO en condiciones de control y de diabetes mellitus. KD: sin actividad cinasa; KO: knock-out; WT: wild-type; PI3Kγ: fosfoinosítido 3-cinasa gamma. Ratones WT, n = 11 por grupo; ratones KD, n = 7 por grupo; ratones KO, n = 4 por grupo.
ap < 0,01 frente a las condiciones de control.
bp < 0,01 frente a KD y frente a KO.
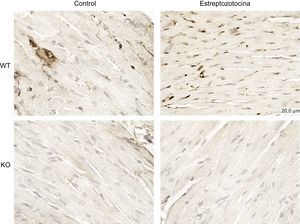
La DM se asoció a activación de la PI3Kγ en el corazón, según lo indicado por la evaluación inmunohistoquímica (figura 3). Así pues, se investigó si la PI3Kγ intervenía en la MCD mediante el examen de ratones con ablación genética de la PI3Kγ (KO). Además, se investigó si estos efectos se debían a la actividad cinasa de la enzima mediante el estudio de ratones que expresaban una forma KD de la enzima.
La expresión de PI3Kγ aumenta en los ratones diabéticos. Imágenes microscópicas representativas de preparaciones histológicas de ventrículos izquierdos de ratones de control y ratones diabéticos. Se utilizaron ratones KO para la PI3Kγ como controles negativos. Aumentos: ×200; barra de la escala: 100 μm; n = 4 por grupo. KO: knock-out; PI3Kγ: fosfoinosítido 3-cinasa gamma; WT: wild-type.
Ni la ablación genética ni la expresión de una forma KD de la PI3Kγ afectaron a la glucemia en ayunas (KO, 288 ± 51 mg/dl; KD, 295 ± 46mg/dl) o el peso corporal, lo cual permitió examinar el efecto en la MCD de manera independiente de la hiperglucemia. Además, según los datos obtenidos en ratones WT, la DM no afectó a los índices macroscópicos de la estructura cardiaca en ninguno de los genotipos (datos no presentados).
La función cardiaca basal fue similar en todos los genotipos. Como se ha indicado antes, la DM indujo disfunción sistólica en los animales WT. La disminución de la fracción de acortamiento y de la fracción de eyección, que son índices de la disfunción sistólica, no se observó en los ratones KO ni en los KD (figura 1). De igual modo, el análisis más detallado de la strain mostró que la disfunción cardiaca observada en los ratones WT 15 semanas después del tratamiento con estreptozotocina no se observaba en los ratones KO ni en los KD. De hecho, la velocidad longitudinal y radial, el desplazamiento y la strain no se vieron afectados por la DM cuando se causó una ablación o una mutación de la PI3Kγ (figura 2).
El papel de la PI3Kγ en la disfunción diastólica inducida por la DM tuvo un perfil temporal diferente. En las fases iniciales (hasta 11 semanas después de la inyección de estreptozotocina), tanto los ratones KO como los KD mostraron la misma disminución del cociente E/E’ que los ratones WT. Sin embargo, mientras que la disfunción diastólica siguió empeorando en los ratones WT en las semanas posteriores, la función diastólica se mantuvo estable en los ratones mutantes (figura 1).
Así pues, tanto la presencia como la actividad cinasa de la PI3Kγ son importantes para facilitar la instauración de una disfunción cardiaca en respuesta a la DM.
La inhibición farmacológica de la PI3Kγ contrarresta la disfunción sistólica y diastólica observada en los ratones diabéticosEstos resultados llevaron a explorar la posibilidad de que un inhibidor farmacológico de la actividad cinasa de la PI3Kγ pudiera revertir la MCD. Para ello, se trató a ratones con GE21 7 semanas después de la inyección de estreptozotocina, es decir, después de que la MCD fuera ya evidente. De hecho, la disfunción cardiaca apareció más precozmente en esta serie experimental, lo cual era de prever por la alta variabilidad que se asocia generalmente al tratamiento con estreptozotocina13.
Además, la inhibición de la PI3Kγ no afectó a la glucemia en ayunas (337 ± 27 mg/dl a la dosis máxima) o el peso corporal (datos no presentados). De manera análoga, la administración de GE21 no afectó a los índices macroscópicos de la función cardiaca (tabla).
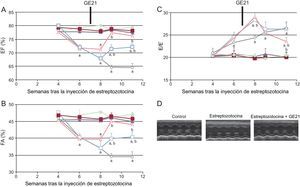
La administración de GE21 pudo contrarrestar la disminución de la fracción de acortamiento y la fracción de eyección solo 2 semanas después del inicio del tratamiento. La dosis superior de este inhibidor de la PI3Kγ permitió restablecer incluso la función cardiaca por completo, hasta hacerla similar a la observada en los ratones de control. La administración de GE21 no tuvo efecto alguno en la función sistólica en los ratones de control (figura 4).
El GE21 revierte la disfunción sistólica y diastólica en los ratones diabéticos, según lo indicado por la ecocardiografía convencional. A: fracción de eyección. B: fracción de acortamiento. C: cociente E/E’ de los ratones de control y los ratones diabéticos, tratados con diferentes concentraciones de GE21. D: imágenes ecocardiográficas representativas (n = 10 por grupo). FA: fracción de acortamiento; FE: fracción de eyección.
Símbolos negros: ratones de control; símbolos vacíos: ratones diabéticos; ◊: tratados con el vehículo; □: tratados con GE21 5 mg/kg/día, Δ: tratados con GE21 50 mg/kg/día.
ap < 0,01 frente a los ratones de control.
bp < 0,01 frente a los ratones tratados con el vehículo.
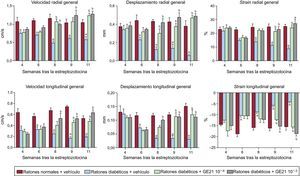
Al realizar el análisis de la strain, la administración de GE21 permitió contrarrestar la disfunción de la velocidad radial y longitudinal, el desplazamiento y la strain, con lo que los ratones diabéticos presentaron una recuperación completa de la función miocárdica (figura 5). El efecto producido por el GE21 en la velocidad radial y el desplazamiento mostró una acción temprana del fármaco que podía observarse ya tras la primera semana de tratamiento. Además, la dosis superior del fármaco mostró efecto en la velocidad longitudinal y el desplazamiento antes que la dosis inferior. La administración de GE21 no tuvo efecto alguno en los ratones de control (datos no presentados).
El GE21 revierte la disfunción sistólica de los ratones diabéticos, según lo indicado por el análisis de la strain. Velocidad radial y longitudinal, desplazamiento y strain en ratones de control y ratones diabéticos tratados con el vehículo o con GE21 (n = 5 por grupo).
ap < 0,05 frente a los ratones de control.
bp < 0,05 frente a los ratones tratados con el vehículo.
Según lo observado con la manipulación genética de la enzima, la acción del GE21 en la función diastólica mostró un perfil temporal de eficacia diferente del observado en la función sistólica (figura 4). De hecho, el GE21 mostró un efecto bifásico: en las primeras semanas de tratamiento, el GE21 causó mayor deterioro de la función diastólica en comparación con los ratones no tratados. Este efecto nocivo en la función diastólica fue breve, puesto que fue observable a partir de la segunda semana de tratamiento. En cambio, después de 4 semanas, el tratamiento con GE21 a la dosis superior de 50 mg/kg/día empezó a contrarrestar la disfunción diastólica inducida por la DM.
Tanto la acción nociva temprana como el efecto beneficioso tardío del GE21 en la función diastólica dependían de la interacción farmacológica con mecanismos que estaban alterados por la DM, puesto que el GE21 no tuvo efecto alguno en los ratones de control.
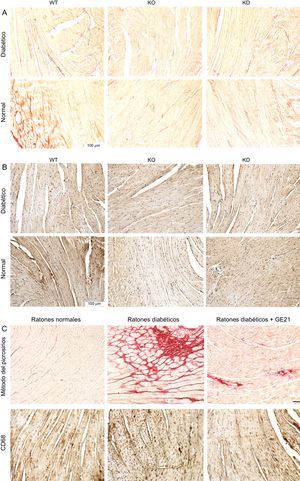
La PI3Kγ modula la fibrosis y la inflamación cardiacas observadas en los ratones diabéticosEl análisis histológico realizado al final del periodo experimental mostró que el corazón de los ratones diabéticos presentaba un intenso depósito de material fibroso y de infiltración macrofágica (figura 6).
La inhibición genética o farmacológica de la PI3Kγ reduce la fibrosis y la inflamación cardiacas de los ratones diabéticos, sin afectar a los miocardiocitos o los vasos sanguíneos. A y B: imágenes microscópicas representativas de preparaciones histológicas de ventrículos izquierdos de ratones WT, KD y KO en condiciones de control y de diabetes mellitus (tinción utilizada en A, método del picrosirio; en B, anti-CD68; n = 4 por grupo). C: imágenes microscópicas representativas de preparaciones histológicas de ventrículos izquierdos de ratones control y diabéticos tratados con el vehículo o con GE21 50 mg/kg/día (n = 10 por grupo; aumentos, ×200; barra de la escala, 100 μm). KD: sin actividad cinasa; KO: knock-out; WT: wild-type.
Tanto la inactivación genética de la actividad de PI3Kγ como la inhibición farmacológica de la PI3Kγ, que permitían contrarrestar la disfunción cardiaca inducida por la DM, se asociaron también a menos fibrosis e infiltración macrofágica.
DISCUSIÓNLa miocardiopatía diabética es una entidad clínicamente diferenciada en los pacientes diabéticos, que se caracteriza por disfunción cardiaca sin factores de riesgo concomitantes como obesidad, hipertensión o tabaquismo14. Se supone que un 40-75% de los pacientes diabéticos sufren MCD3, lo cual aumenta la incidencia de insuficiencia cardiaca15. A pesar de la elevada prevalencia de esta enfermedad, actualmente no hay ningún tratamiento específico para los pacientes con MCD. En este estudio, se observó que la PI3Kγ desempeña un papel fundamental en la respuesta a la DM a través de la actividad cinasa, como se observa en los ratones tratados con una dosis baja de estreptozotocina, que constituyen un modelo bien caracterizado de DM de inicio temprano que conduce a una elevación gradual de la glucemia16. En consecuencia, la inhibición farmacológica de la PI3Kγ puede revertir la disfunción cardiaca inducida por la DM. Por último, se observó que este efecto de la PI3Kγ se asocia a 2 importantes determinantes anatomopatológicos de la MCD, la fibrosis y la inflamación.
Nuestros resultados indican que el principal efecto de la inhibición de la PI3Kγ en los diabéticos es una mejoría de la función cardiaca. De hecho, la DM causó anomalías cardiacas evidentes tanto en la función sistólica como en la diastólica. En cambio, no se observó alteración alguna de la estructura macroscópica del corazón durante todo el periodo de observación. Estos datos concuerdan con los de estudios previos17, en los que se ha observado que la DM inducida por estreptozotocina causa un deterioro de la función cardiaca sin modificar la estructura del corazón. La ausencia de PI3Kγ previno por completo la función sistólica incluso en presencia de DM. Se observó el mismo efecto con la inhibición genética de la actividad catalítica de la PI3Kγ. Por lo que respecta a estas acciones, la PI3Kγ tiene efectos en el corazón dependientes e independientes de cinasa5. El hecho de que la simple inhibición genética de la actividad catalítica sea suficiente para obtener los mismos efectos que produce la ausencia total de PI3Kγ indica que esta causa sus efectos cardiacos nocivos en la DM solo a través de su acción dependiente de cinasa. La mejoría de la disfunción sistólica se demostró con mayor sensibilidad en el análisis de la strain, que es un examen más detallado de la función cardiaca.
Hay varios mecanismos que pueden explicar los efectos cardiacos de la PI3Kγ en nuestro estudio. La PI3Kγ desempeña funciones fundamentales en los leucocitos, los miocitos y las células vasculares18, y todas estas células intervienen en la respuesta cardiaca a la DM4. En concreto, se ha demostrado que la PI3Kγ controla directamente la contractilidad de los miocitos a través de una regulación de la producción de cAMP que es independiente de cinasa5. El hecho de que los animales KD, que tienen concentraciones de cAMP comparables a las de los WT5, no sufrieran disfunción contráctil en respuesta a la DM descarta esta posible explicación, si bien no se puede descartar otros posibles efectos directos en los miocitos. Por otra parte, nuestro estudio puso de manifiesto que la inhibición genética o farmacológica de la PI3Kγ tuvo un efecto beneficioso en 2 parámetros que afectan a la función cardiaca en la respuesta a la DM: la inflamación y la fibrosis. El sistema inmunitario participa en el desarrollo de la MCD. De hecho, los modelos murinos de DM muestran sobreexpresión cardiaca de citocinas como la interleucina 1β y el factor de crecimiento transformador beta19 y activación de los macrófagos20. La PI3Kγ es un mediador fundamental de la activación del sistema inmunitario y la ausencia de su actividad cinasa inhibe la acumulación de leucocitos en el corazón8. Otra característica anatomopatológica de la MCD es la inducción de fibrosis. El aumento de la fibrosis perivascular e intermiofibrilar se ha observado tanto en pacientes humanos21 como en ratones con DM inducida por estreptozotocina19. Además, estas 2 acciones probablemente estén relacionadas, puesto que la activación de las vías de la inflamación conduce a un aumento de la fibrosis en los ratones con MCD19. En consecuencia, se ha demostrado también que la PI3Kγ induce fibrosis cardiaca5 y se ha puesto de relieve que esta característica depende de la PI3Kγ en los leucocitos8, lo cual confirma la importancia de la relación entre la inflamación cardiaca y la fibrosis en la acción cardiaca de la PI3Kγ.
Este estudio tuvo también un objetivo traslacional al estudiar el tratamiento con un inhibidor farmacológico como estrategia novedosa contra la MCD. Un inhibidor farmacológico diferente de la PI3Kγ previno la aparición de DM autoinmunitaria y revirtió la hiperglucemia en ratones no obesos diabéticos22. Esto ha elevado las expectativas respecto a un tratamiento anti-PI3Kγ para abordar las alteraciones metabólicas observadas en la DM. Sin embargo, debe señalarse que la aparición de DM en los ratones no obesos diabéticos se ha atribuido a un trastorno autoinmunitario23. En la DM autoinmunitaria, cabe esperar que los tratamientos farmacológicos que actúan sobre la vía inmunitaria de la PI3Kγ contrarresten de manera efectiva la etiología de la DM, más que sus consecuencias. Por otra parte, no se observó reversión de la hiperglucemia en nuestro estudio, en el que la DM se produjo a través de un efecto tóxico directo en las células de los islotes del páncreas. Nuestro estudio amplía estas observaciones previas respecto al efecto de los inhibidores farmacológicos de la PI3Kγ en la DM, al mostrar que, incluso en ausencia de los efectos metabólicos que se podrá obtener en la DM autoinmunitaria —que es bastante infrecuente—, la inhibición de la PI3Kγ continúa teniendo una acción potente contra la MCD.
En nuestro estudio, la inhibición genética o farmacológica de la PI3Kγ contrarrestó la disfunción cardiaca inducida por la DM. Tal como se ha observado en los modelos genéticos, el efecto principal que se produjo después del tratamiento con GE21 fue una notable mejoría de la función sistólica, que se restableció por completo. El análisis más detallado de la strain mostró un efecto más temprano del GE21 y permitió también una definición más exacta de la acción regional del fármaco. De hecho, la mejoría en la velocidad y en el desplazamiento del eje radial del ventrículo izquierdo, que refleja predominantemente la actividad del mesocardio (parte media del miocardio)24, se observó también con una dosis inferior del fármaco de manera más temprana que las correcciones del eje longitudinal, que en cambio reflejan principalmente la actividad del endocardio. Sin embargo, la acción sobre la función diastólica fue menos clara. De hecho, el desarrollo inicial de la disfunción diastólica no se corregió con la ablación de la PI3Kγ ni con la inhibición de la actividad cinasa, y solo se bloqueó la progresión posterior de la disfunción diastólica. De igual modo, con la inhibición farmacológica, la función diastólica se mantuvo incluso sin deterioro alguno en los ratones diabéticos, y solo un tratamiento prolongado con GE21 llevó a una recuperación de la disfunción diastólica inducida por la DM. Nuestros datos indican que hay 2 mecanismos diferentes para el desarrollo inicial de la disfunción diastólica y su progresión final en respuesta a la DM, y que la PI3Kγ interviene solo en el estadio final. En consecuencia, parece que la inhibición crónica de la PI3Kγ requeriría un inicio más prolongado para alcanzar una mejora de las características diastólicas del ventrículo izquierdo. Dado que la mayoría de los pacientes con MCD se caracterizan por una disfunción diastólica prominente3,14, esto podría limitar el beneficio aportado por la inhibición de la PI3Kγ en la práctica clínica. Sin embargo, la importancia general de nuestros resultados, que muestran mejoras a largo plazo tanto de la función sistólica como de la diastólica, indica que los inhibidores de la PI3Kγ podrían considerarse posibles tratamientos de interés para las complicaciones cardiacas de los pacientes diabéticos. Es posible que futuros estudios permitan establecer si esta línea de investigación puede conducir a mejoras en el tratamiento clínico de estos pacientes.
CONCLUSIONESNuestro estudio demuestra un efecto beneficioso de la inhibición genética o farmacológica de la PI3Kγ en los ratones con MCD. El estudio confirma la acción de la inhibición de la PI3Kγ sobre la función cardiaca, y amplía por primera vez la validez de este abordaje de la DM. Los resultados de este estudio constituyen una prueba de concepto que resalta el potencial de una aproximación farmacológica basada en la inhibición de la PI3Kγ como estrategia prometedora para el tratamiento clínico de los pacientes que sufren MCD.
FINANCIACIÓNEste trabajo fue financiado por Regione Campania (PON Distretto Campania Bioscience y POR-HOCKEY) y por el Ministerio de Salud de Italia (Ricerca Corrente) en ayudas a G. Lembo.
- –
La MCD es un problema médico frecuente. El conocimiento de los mecanismos moleculares que conducen a la MCD es crucial para el desarrollo de nuevos tratamientos para esta enfermedad.
- –
Se demuestra el papel esencial de la PI3Kγ en el desarrollo de la MCD empleando modelos genéticos. Se demuestra que el tratamiento farmacológico basado en la inhibición de la PI3Kγ es eficaz en un modelo murino de MCD. Tanto la inhibición genética como la inhibición farmacológica de la PI3Kγ mostraron una actividad contra la reducción inducida por la DM en la función sistólica más potente que en la función diastólica.
Ninguno.
Damos las gracias a V. Berardi (IRCCS Neuromed) por su ayuda en la preparación y corrección del manuscrito.