Se examina si los polimorfismos rs180070 y rs2070011 del gen del fibrinógeno podrían afectar al riesgo de enfermedad coronaria de los pacientes hipertensos al modificar el proceso inflamatorio y la coagulación.
MétodosSe practicó una angiografía coronaria a causa de síntomas de angina estable a 744 participantes, de los que 332 tenían hipertensión.
ResultadosLa presencia del alelo A (rs180070) se asoció a cifras de fibrinógeno significativamente elevadas en los pacientes hipertensos (p = 0,05). En el análisis multivariable, la homocigosis para A (rs180070) (β = 0,257 ± 18,6; p < 0,001), pero no la presencia de hipertensión (β = 0,05 ± 11,9; p = 0,29), fue un factor independiente predictivo de la concentración de fibrinógeno. En los pacientes hipertensos, la concentración de fibrinógeno > 443 mg/dl (odds ratio = 3,50; intervalo de confianza del 95%, 1,14-10,90; p = 0,029), pero no la homocigosis para A (odds ratio = 3,00; intervalo de confianza del 95%, 0,78-11,90; p = 0,110), fueron un factor independiente predictivo de enfermedad coronaria. Además, los valores de interleucina 6 fueron más altos en los individuos homocigotos para el polimorfismo rs180070 que en todos los demás genotipos (p = 0,046). De hecho, este genotipo fue el único factor independiente predictivo de la concentración de interleucina 6 en el análisis ajustado (β = 0,151 ± 0,642; p = 0,032). También se asoció a cifras de dímero D superiores en la hipertensión en comparación con los portadores del alelo G (p = 0,048).
ConclusionesLa presencia de homocigosis para A (rs180070) se asocia a un aumento de las concentraciones de mediadores inflamatorios y mayor incidencia de enfermedad coronaria angiográfica. Tiene importancia que el fibrinógeno es un factor independiente predictivo de la presencia angiográfica de enfermedad coronaria en los pacientes hipertensos.
Palabras clave
Actualmente se reconoce claramente el papel que desempeñan las vías inflamatorias y trombóticas en la progresión de la ateroesclerosis1,2. Además, la hipertensión (HT) es un importante factor de riesgo de enfermedad cardiovascular, mientras que la inflamación vascular tiene un papel crucial en todas las fases de la ateroesclerosis. En concreto, en presencia de factores de riesgo como la HT, la inflamación vascular se acentúa y se asocia a las manifestaciones clínicas de la enfermedad coronaria (EC)3,4.
De entre los demás biomarcadores, el fibrinógeno tiene un perfil de marcador doble. Interviene en la respuesta inflamatoria, con lo que constituye un biomarcador inflamatorio, y también en las vías de la coagulación dando lugar a disfunción endotelial y ateroesclerosis2,5. Además, en estudios previos se ha descrito una asociación independiente de la concentración plasmática de fibrinógeno con el riesgo de EC2,5. Los pacientes con síndromes coronarios agudos presentan generalmente cifras de fibrinógeno más altas que los pacientes con EC estable o los controles sanos6, mientras que en algunas ocasiones el fibrinógeno parece tener más efecto en el riesgo de EC que los factores de riesgo clásicos, como la HT7.
La evidencia reciente resalta el posible papel de la variabilidad genética del fibrinógeno en el riesgo de EC, pero los datos existentes son controvertidos. Así pues, los estudios previos señalaban un posible efecto regulador de los polimorfismos genéticos, como el rs180070 y el rs2070011, en los valores de fibrinógeno y el riesgo de EC, mientras que otros estudios no respaldan esta posibilidad8–10. Además, la interacción farmacológica entre los factores de riesgo cardiovascular y los polimorfismos del fibrinógeno no se ha esclarecido todavía por completo.
El objetivo del presente estudio es examinar la asociación de los polimorfismos de nucleótido único del fibrinógeno con la presencia de una EC obstructiva en los pacientes hipertensos. Además, se investigó si esta interacción puede dar lugar a un aumento de la incidencia de EC angiográfica a través de sus efectos en el proceso inflamatorio y la coagulación.
MÉTODOSPoblación del estudioFormaron la población en estudio 744 participantes caucásicos ingresados en un periodo de 3 años en nuestro hospital para una angiografía coronaria a causa de síntomas de angina de pecho estable. El diagnóstico de EC se estableció angiográficamente en presencia de una estenosis > 50% en al menos 1 de las 3 arterias coronarias principales o sus ramas mayores. Según la guía de la Sociedad Europea de Cardiología, se consideró que los participantes eran hipertensos si tenían la presión arterial sistólica ≥ 140 mmHg o la diastólica ≥ 90 mmHg en 2 ocasiones diferentes o estaban en tratamiento en ese momento con fármacos antihipertensivos11. Se consideró que los participantes tenían hiperlipemia si se detectaba una concentración de colesterol total ≥ 220 mg/dl en los análisis de bioquímica o estaban en tratamiento con medicación hipolipemiante12. Asimismo se consideró que los participantes tenían diabetes mellitus si la glucosa plasmática en ayunas era ≥ 126mg/dl, la glucosa plasmática sin ayuno era ≥ 200mg/dl, la glucohemoglobina A1c era > 7% o estaban en tratamiento con fármacos hipoglucemiantes13. Se definió como fumadores actuales a los participantes que habían fumado entre 1 y 10 cigarrillos/día durante al menos el último año14. Los criterios de exclusión fueron la existencia de cualquier enfermedad inflamatoria o infecciosa, enfermedad hepática o renal, cáncer, insuficiencia cardiaca definida como fracción de eyección < 45% o antecedentes de trombosis venosa profunda o embolia pulmonar. Para evitar posibles influencias de las técnicas de intervención, se obtuvieron muestras de sangre antes de la angiografía coronaria o de la intervención coronaria percutánea. Se obtuvo el consentimiento informado de todos los pacientes y el protocolo del estudio se atuvo a lo establecido en las directrices éticas de la Declaración de Helsinki de 1975 que se reflejaban en la autorización obtenida a priori por el comité de investigación humana del centro.
Extracción del ADN y determinación del genotipoSe extrajeron aproximadamente 5 ml de sangre en tubos con contenido de ácido etilenodiaminotetraacético. Se extrajo el ADN genómico a partir de entre 2 y 5 ml de sangre total, utilizando métodos estándar (QIAamp DNA blood kit; Qiagen, West Sussex, Reino Unido). Para la detección del rs180070 (cadena beta) y el rs2070011 (cadena alfa), se utilizó un análisis de polimorfismo de restricción de longitud mediante reacción en cadena de la polimerasa. Con objeto de amplificar una parte del gen (mediante reacción en cadena de la polimerasa), se utilizaron los cebadores intrónicos de flanqueo anterógrado (5′-GAACATTTTACCTTATGTGAATTAAGG-3′) e inverso (5′-GAAGCTCCAAGAAACCATCC-3′) para el primer polimorfismo. Además, para el segundo polimorfismo se utilizaron los cebadores anterógrado (5′-TGCAACAGCTTATCGGAAGC-3′) e inverso (5′-GTGGAATAAACACCAGAGAG-3′). Los productos resultantes se digirieron con las enzimas de restricción HaeIII y AciI respectivamente (resolución mediante electroforesis en gel de agarosa al 2%). Los fragmentos digeridos se visualizaron tras la tinción con bromuro de etidio bajo luz ultravioleta. Para el control de calidad de la reacción en cadena de la polimerasa, se seleccionó aleatoriamente el 5% de las muestras y se determinó 2 veces su genotipo para la garantía de calidad; la concordancia obtenida fue del 100%.
Análisis bioquímicoSe indicó a todos los participantes que se abstuvieran de fumar y consumir bebidas que contuvieran alcohol o cafeína durante la noche anterior (durante 12 h) a la obtención de las muestras de sangre. Las muestras de sangre venosa se centrifugaron a 3.500 rpm a 4°C durante 15 min y se obtuvo el plasma o el suero, que se conservó a –80°C hasta el momento del análisis. Se determinaron las concentraciones séricas de fibrinógeno con el método de Clauss (Multifibren U, Siemens; Alemania) y dímero D con un método inmunonefelométrico (Innovance D-Dimer, Siemens; Alemania), y se determinó también la proteína C reactiva ultrasensible (PCRus). Asimismo, se determinó la actividad de factor V en plasma con un análisis de una sola etapa basado en el tiempo de protrombina (déficit de factor V, Dade Behring; Alemania) y del factor X con un método de una sola etapa empleando e plasma con déficit de factor X de un solo donante con un analizador Dade Behring C BCS Coagulation Analyzer (Deerfield; Illinois, Estados Unidos). Se determinaron las concentraciones de interleucina (IL) 6 y ligando soluble de CD40 mediante un ELISA (R&D Systems Inc.; Estados Unidos).
Análisis estadísticoLas variables cualitativas se presentan en forma de frecuencias relativas. Se evaluó si las variables continuas tenían una distribución normal con la prueba de Kolmogorov-Smirnov. Los datos de distribución normal se expresan en forma de media ± error estándar de la media. Los datos de distribución no normal se presentan en forma de mediana [intervalo intercuartílico]. Para las variables discretas se utilizó la prueba de la χ2 o la exacta de Fisher para comparar las distribuciones de 2 o más grupos. Se aplicaron pruebas de la t de Student para datos no apareados en las comparaciones de las variables continuas de distintos tratamientos. Analizamos si las frecuencias de los alelos se atenían a las proporciones de equilibrio de Hardy-Weinberg con la prueba de la χ2. El desequilibrio de ligamiento entre los 2 polimorfismos de nucleótido único se evaluó con el programa informático online de Rodríguez et al.15. Se utilizó un análisis de regresión logística múltiple para estimar las odds ratio (OR) y los intervalos de confianza del 95% (IC95%) para la EC como función de los polimorfismos rs180070 y rs2070011, y los valores de fibrinógeno con un ajuste respecto a los factores de riesgo tradicionales, como edad, sexo, HT, diabetes mellitus, hipercolesterolemia y tabaquismo. Se realizó un análisis multivariable escalonado tomando los parámetros bioquímicos determinados como variables dependientes y los factores de riesgo y los polimorfismos como variables independientes. Se utilizó también un análisis de la varianza para comparar las medias de 3 o más variables en el análisis multivariable, con objeto de determinar los factores independientes predictivos de EC angiográfica e infarto agudo de miocardio. Todas las pruebas de significación fueron bilaterales y se realizaron con un nivel de significación del 5%. Todos los análisis estadísticos se realizaron con el programa SPSS (IBM SPSS Statistics, versión 22.0).
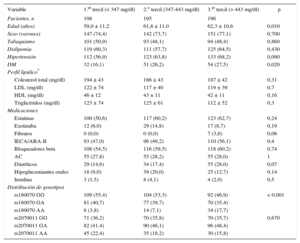
RESULTADOSEn la tabla 1 se presentan las características demográficas de los 744 pacientes consecutivos examinados en nuestro centro durante un periodo de 3 años, así como la distribución de genotipos según los terciles de fibrinógeno. De estos pacientes, 332 tenían HT. Tenían una EC 448 pacientes, mientras que en 296 no se observó. Es de destacar que no se observaron diferencias en el perfil lipídico o la medicación entre los 3 grupos (tabla 1). En nuestra cohorte de estudio, las prevalencias de los alelos A de rs180070 y rs2070011 fueron similares en los pacientes con y sin EC (p = 0,339 y p = 0,988 respectivamente).
Características basales según los terciles de concentración de fibrinógeno
| Variable | 1.er tercil (< 347 mg/dl) | 2.o tercil (347-443 mg/dl) | 3.er tercil (> 443 mg/dl) | p |
|---|---|---|---|---|
| Pacientes, n | 198 | 195 | 196 | |
| Edad (años) | 59,0 ± 11,2 | 61,8 ± 11,0 | 62,3 ± 10,6 | 0,010 |
| Sexo (varones) | 147 (74,4) | 142 (73,7) | 151 (77,1) | 0,700 |
| Tabaquismo | 101 (50,9) | 93 (48,1) | 94 (48,4) | 0,860 |
| Dislipemia | 119 (60,3) | 111 (57,7) | 125 (64,5) | 0,430 |
| Hipertensión | 112 (56,9) | 123 (63,8) | 133 (68,2) | 0,090 |
| DM | 32 (16,1) | 51 (26,2) | 54 (27,5) | 0,020 |
| Perfil lipídico* | ||||
| Colesterol total (mg/dl) | 194 ± 43 | 186 ± 43 | 187 ± 42 | 0,31 |
| LDL (mg/dl) | 122 ± 74 | 117 ± 40 | 119 ± 39 | 0,7 |
| HDL (mg/dl) | 46 ± 12 | 43 ± 11 | 42 ± 11 | 0,16 |
| Triglicéridos (mg/dl) | 123 ± 74 | 125 ± 61 | 112 ± 52 | 0,3 |
| Medicaciones | ||||
| Estatinas | 100 (50,6) | 117 (60,2) | 123 (62,7) | 0,24 |
| Ezetimiba | 12 (6,0) | 29 (14,8) | 17 (8,7) | 0,19 |
| Fibratos | 0 (0,0) | 0 (0,0) | 7 (3,6) | 0,06 |
| IECA/ARA-II | 93 (47,0) | 96 (49,2) | 110 (56,1) | 0,4 |
| Bloqueadores beta | 108 (54,5) | 116 (59,5) | 118 (60,2) | 0,74 |
| AC | 55 (27,8) | 55 (28,2) | 55 (28,0) | 1 |
| Diuréticos | 29 (14,6) | 34 (17,4) | 55 (28,0) | 0,07 |
| Hipoglucemiantes orales | 18 (9,0) | 39 (20,0) | 25 (12,7) | 0,14 |
| Insulina | 3 (1,5) | 8 (4,1) | 4 (2,0) | 0,5 |
| Distribución de genotipos | ||||
| rs180070 GG | 109 (55,4) | 104 (53,3) | 92 (46,9) | < 0,001 |
| rs180070 GA | 81 (40,7) | 77 (39,7) | 70 (35,4) | |
| rs180070 AA | 8 (3,8) | 14 (7,1) | 34 (17,7) | |
| rs2070011 GG | 71 (36,2) | 70 (35,8) | 70 (35,7) | 0,670 |
| rs2070011 GA | 82 (41,4) | 90 (46,1) | 96 (48,4) | |
| rs2070011 AA | 45 (22,4) | 35 (18,2) | 30 (15,8) | |
AC: antagonistas del calcio; ARA-II: antagonistas del receptor de la angiotensina II; DM: diabetes mellitus; HDL: lipoproteínas de alta densidad; IECA: inhibidores de la enzima de conversión de la angiotensina; LDL: lipoproteínas de baja densidad.
Salvo otra indicación, los datos expresan n (%) o media ± error estándar.
Los valores de p se basan en un análisis de la varianza para las variables continuas que tienen una distribución normal y en la prueba de la χ2 para las variables discretas.
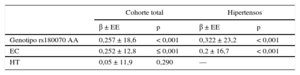
En la cohorte total, hubo un efecto significativo de la presencia del alelo A de rs180070 (genotipos AA y AG) en la concentración sérica de fibrinógeno (AA o AG frente a GG, 424,26 ± 7,74 frente a 401,20 ± 6,64mg/dl; p = 0,025). Es importante señalar que los homocigotos AA tenían unas concentraciones de fibrinógeno significativamente mayores que los portadores del alelo G (503,4 ± 18,8 frente a 402,6 ± 5,14 mg/dl; p < 0,001). En cambio, la presencia del alelo A de rs2070011 no se asoció a un aumento del fibrinógeno (AA frente a AG o GG, 417,1 ± 6,9 frente a 404,4 ± 8,8mg/dl; p = 0,26) en los pacientes con HT.
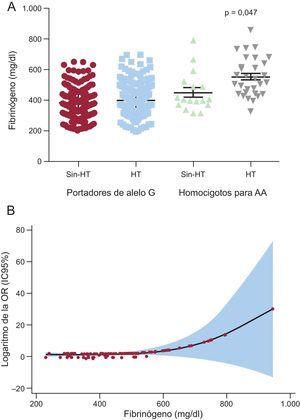
Concentración de fibrinógenoTambién se clasificó a los pacientes en tres subcategorías según los valores de fibrinógeno (< 347, 347–443 y > 443 mg/dl) (tabla 1). Se examinaron también los efectos de estos polimorfismos en las concentraciones séricas de fibrinógeno de los pacientes con HT. Se observó un aumento progresivo de estas: la presencia del alelo A de rs180070 (genotipos AA y AG) se asoció con valores significativamente superiores en los participantes con HT (433,36 ± 10,90 frente a 405,70 ± 8,80mg/dl; p = 0,047), mientras que la homocigosis de AA de rs180070 se asoció también a cifras superiores (541,03 ± 25,20 frente a 405,20 ± 6,80mg/dl; p < 0,001) (figura 1A). La presencia del alelo A de rs2070011 no tuvo efectos significativos en la concentración de fibrinógeno de los pacientes con HT. En el análisis multivariable, la homocigosis de AA de rs180070 (β = 0,257 ± 18,6; p < 0,001) y la EC (β = 0,252 ± 12,8; p ≤ 0,001), pero no la HT (β = 0,05 ± 11,9; p = 0,290), fueron factores independientes predictivos de la concentración de fibrinógeno. En los pacientes con HT, el genotipo AA de rs180070 (β = 0,322 ± 23,2; p < 0,001) y la EC (β = 0,2 ± 16,7; p < 0,001) continuaban siendo factores independientes predictivos del fibrinógeno (tabla 2).
A: concentración de fibrinógeno en los pacientes hipertensos según el polimorfismo rs180070, presentados como media ± desviación estándar. B: logaritmo de la OR de la enfermedad coronaria según la concentración de fibrinógeno en los pacientes hipertensos. HT: hipertensión; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Análisis multivariable de los factores predictivos de la concentración de fibrinógeno
| Cohorte total | Hipertensos | |||
|---|---|---|---|---|
| β ± EE | p | β ± EE | p | |
| Genotipo rs180070 AA | 0,257 ± 18,6 | < 0,001 | 0,322 ± 23,2 | < 0,001 |
| EC | 0,252 ± 12,8 | ≤ 0,001 | 0,2 ± 16,7 | < 0,001 |
| HT | 0,05 ± 11,9 | 0,290 | — | |
EC: enfermedad coronaria; EE: error estándar; HT; hipertensión.
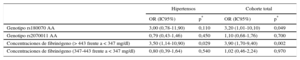
El análisis de regresión logística multivariable tras un ajuste respecto a edad, sexo, tabaquismo, hipercolesterolemia, HT, diabetes mellitus y log (PCRus) como factores predictivos independientes puso de manifiesto que las cifras de fibrinógeno > 443 mg/dl se asociaban a mayor riesgo de EC (OR = 3,90; IC95%, 1,70-9,40; p = 0,002) en comparación con las < 347 mg/dl en la población general. En cambio, la subcategoría de concentración de fibrinógeno intermedia no tuvo efecto significativo en el riesgo de EC (OR = 1,02; IC95%, 0,46-2,24; p = 0,970), mientras que la presencia de AA (rs180070) se asoció también significativamente al aumento del riesgo de EC (OR = 3,20; IC95%, 1,01-10,10; p = 0,049) (tabla 3).
Efectos de la concentración y los polimorfismos del fibrinógeno en el riesgo de enfermedad coronaria
| Hipertensos | Cohorte total | |||
|---|---|---|---|---|
| OR (IC95%) | p* | OR (IC95%) | p* | |
| Genotipo rs180070 AA | 3,00 (0,78-11,90) | 0,110 | 3,20 (1,01-10,10) | 0,049 |
| Genotipo rs2070011 AA | 0,79 (0,43-1,46) | 0,450 | 1,10 (0,68-1,76) | 0,700 |
| Concentraciones de fibrinógeno (> 443 frente a < 347 mg/dl) | 3,50 (1,14-10,90) | 0,029 | 3,90 (1,70-9,40) | 0,002 |
| Concentraciones de fibrinógeno (347-443 frente a < 347 mg/dl) | 0,80 (0,39-1,64) | 0,540 | 1,02 (0,46-2,24) | 0,970 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
En los pacientes hipertensos, los valores de fibrinógeno máximos > 443mg/dl (OR = 3,50; IC95%, 1,14-10,90; p = 0,029) (figura 1B), pero no el genotipo AA de rs180070 (OR = 3,00; IC95%, 0,78-11,90; p = 0,110) fueron factor independiente predictivo de EC. En nuestra cohorte total, se observó que la presencia de los alelos A de rs180070 (OR = 1,36; IC95%, 0,63-2,95; p = 0,434) y rs2070011 (OR = 0,99; IC95%, 0,56-1,78; p = 0,995) no se asociaba con la gravedad angiográfica de la EC. Por último, la homocigosis de AA de rs180070 (OR = 1,87; IC95%, 0,37-8,90; p = 0,46) y de AA de rs2070011 (OR = 0,75; IC95%, 0,39-1,43; p = 0,378) no se asociaron con la aparición de infarto agudo de miocardio en la cohorte total. Tampoco se detectó asociación entre los homocigotos para AA (rs180070) y el infarto agudo de miocardio en los participantes con HT. El riesgo de EC sin ajustar para los portadores del alelo A (rs2070011, AA o AG) no fue significativo (OR = 1,003; IC95%, 0,72-1,40; p = 0,988). En los subgrupos de pacientes con HT, el riesgo de EC sin ajustar no fue significativo en los portadores del alelo A de rs2070011. El carácter homocigoto (AA, rs2070011) no se asoció a un aumento del riesgo de EC en la cohorte total (OR = 1,10; IC95%, 0,68-1,76; p = 0,700) (tabla 3).
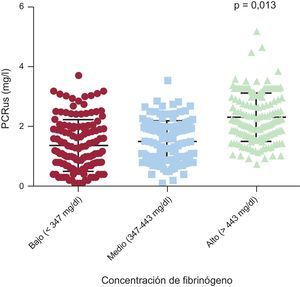
Efectos de los polimorfismos rs180070 y rs2070011 en los mediadores inflamatoriosEn la cohorte total, se observó que los valores de PCRus eran más altos en el grupo de pacientes con cifras de fibrinógeno superiores que en los de cifras inferiores o intermedias (0,23 [0,11-0,39] frente a 0,15 [0,03-0,36] frente a 0,13 [0,01-0,35] mg/l; p = 0,013) (figura 2). Sin embargo, los homocigotos AA para el polimorfismo rs180070 no tenían cifras de PCRus más altas (AA: 0,21 [0,12-0,36] frente a AG o GG 0,19 [0,05-0,37] mg/l; p = 0,6). Además, en los pacientes con HT, los valores de PCRus fueron más altos en el grupo de pacientes con concentraciones de fibrinógeno más altas que en aquellos con valores más bajos o intermedios (0,28 [0,12-0,42] frente a 0,17 [0,04-0,38] frente a 0,18 [0,09-0,39] mg/l; p = 0,032).
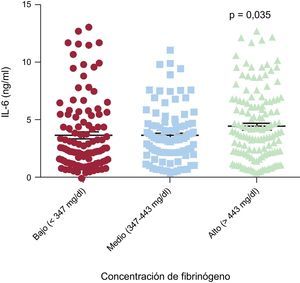
Las concentraciones de IL-6 fueron mayores en la subcategoría de fibrinógeno elevado (altos frente a intermedios frente a bajos, 4,52 ± 0,26 frente a 3,67 ± 0,24 frente a 3,70 ± 0,30 ng/ml) que en la de valores de fibrinógeno intermedios (p = 0,027) o bajos (p = 0,035) (figura 3). Además, se observó un efecto significativo del polimorfismo rs180070 en las cifras de IL-6 en la HT. Concretamente, fueron superiores en los homocigotos AA para el polimorfismo rs180070 que en todos los demás genotipos (AG o GG) (4,96 ± 0,69 frente a 3,70 ± 0,20 ng/ml; p = 0,046). En los pacientes hipertensos, el análisis multivariable reveló que la homocigosis para AA (rs180070) era el único factor ajustado independiente predictivo de las cifras de IL-6 (β = 0,151 ± 0,642; p = 0,032). En la regresión logística multivariable sobre la cohorte total, la concentración de IL-6 no se asoció con el riesgo de EC, infarto agudo de miocardio o enfermedad multivaso.
La PCRus no se observó afectada por la homocigosis para el polimorfismo rs2070011 en la cohorte total (p = 0,486) ni en los pacientes hipertensos (p = 0,677). En la cohorte total, la homocigosis para AA de rs180070 daba lugar a valores de CD40L significativamente más altos (2,55 ± 0,35 frente a 2,13 ± 0,19 ng/ml; p = 0,019). Sin embargo, el análisis de subgrupos de los pacientes con HT no mostró diferencia alguna en CD40L en presencia del genotipo AA (rs180070) (p = 0,144). No se observó cambio significativo de las cifras de IL-6 o CD40L con la presencia del genotipo AA de rs2070011 entre los subgrupos estudiados.
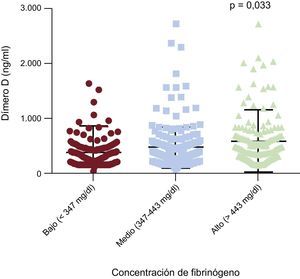
Efectos de los polimorfismos rs180070 y rs2070011 en los factores de la coagulaciónEn la cohorte total, la concentración de dímero D fue más alta en la subcategoría de valores de fibrinógeno máximos (altos frente a intermedios frente a bajos, 586,00 ± 40,90 frente a 479,40 ± 28,00 frente a 383,90 ± 34,60mg/dl) en comparación con los intermedios (p = 0,03) y los bajos (p = 0,001) (figura 4 y tabla 4). La homocigosis para AA de rs180070 comportó valores de dímero D significativamente más altos que la de GG + GA (555,3 ± 43,0 frente a 469,1 ± 19,6 ng/ml; p = 0,033). Se observaron resultados similares con la homocigosis AA (rs180070) en los valores de dímero D en la HT en comparación con los portadores del alelo G (623,3 ± 79,6 frente a 388,6 ± 23,5 ng/ml; p = 0,048). Tras introducir un ajuste respecto a edad, sexo, tabaquismo, hipercolesterolemia, HT, diabetes mellitus y la presencia del genotipo AA (rs180070) como factores predictivos independientes, el análisis de regresión logística multivariable reveló que el dímero D se asocia a la EC (OR = 1,001; IC95%, 1,000-1,002; p = 0,009). Al incluir en el modelo el fibrinógeno, la asociación entre el dímero D y la EC continuaba siendo significativa (OR = 1,001; IC95%, 1,000-1,001; p = 0,04). En los subgrupos de pacientes con HT, la regresión logística no mostró asociación entre el dímero D y la EC. La presencia de los polimorfismos rs180070 o rs2070011 no tuvo relación con ningún cambio en los factores V y X, el plasminógeno o la trombina en los pacientes con HT.
Asociación de los biomarcadores inflamatorios con las concentraciones de fibrinógeno en la cohorte total
| Fibrinógeno (mg/dl) | PCRus (mg/dl) | IL-6 (ng/ml) | Dímero D (mg/dl) |
|---|---|---|---|
| Concentraciones superiores (> 443) | 0,23 [0,11-0,39] | 4,52 ± 0,26 | 586,00 ± 40,90 |
| Concentraciones intermedias (347-443) | 0,15 [0,03-0,36] | 3,67 ± 0,24 | 479,40 ± 28,00 |
| Cuartil inferior (< 347) | 0,13 [0,01-0,35] | 3,70 ± 0,30 | 383,90 ± 34,60 |
IL-6: interleucina 6; PCRus: proteína C reactiva ultrasensible.
Los datos se presentan en forma de media ± error estándar o mediana [intervalo intercuartílico].
Que nosotros sepamos, el presente estudio es el primero en que se examinan los efectos de los polimorfismos genéticos rs180070 y rs2070011 en la inflamación, la coagulación y el riesgo de EC detectado en la angiografía coronaria en pacientes con HT. Se observó que la homocigosis en cuanto a AA del polimorfismo rs180070 se asociaba a concentraciones de fibrinógeno superiores y a la presencia de EC en la cohorte total, mientras que el fibrinógeno > 443 mg/dl se asociaba de manera independiente a la presencia de EC en la HT. El genotipo AA (rs180070) se asociaba también a cifras de IL-6 y dímero D más altas en la HT. Asimismo los valores de esos parámetros fueron más altos en los pacientes con fibrinógeno > 443mg/dl. En la cohorte total y los pacientes hipertensos, se observó que la PCRus estaba elevada en el subgrupo de fibrinógeno alto. Estos resultados indican que la presencia del genotipo AA (rs180070) se asocia con un aumento de los mediadores inflamatorios y mayor riesgo de EC. Sin embargo, el factor predictivo de la presencia de EC más significativo fueron la concentración de fibrinógeno alta > 443mg/dl. En cambio, el polimorfismo rs2070011 no se asoció al riesgo de EC o la concentración de mediadores inflamatorios y de la coagulación.
Hipertensión y polimorfismos del fibrinógeno: riesgo de enfermedad coronariaEl papel de la HT en la ateroesclerosis es bien conocido, y los estudios realizados han puesto de manifiesto que estos pacientes presentan un aumento del riesgo de EC. Además, se han realizado investigaciones sobre el papel de los polimorfismos del fibrinógeno en el riesgo de EC, con resultados contradictorios. Así, se ha descrito que la concentración de fibrinógeno gamma en plasma influye en el riesgo de infarto de miocardio, posiblemente por el efecto positivo en la concentración de fibrinógeno16. En cambio, el polimorfismo de –148C/T del gen de la cadena beta del fibrinógeno no mostró asociación alguna con el riesgo de EC9. La evidencia más reciente indica que hubo una asociación significativa entre la HT y el polimorfismo rs2070008 del fibrinógeno solo en las mujeres, mientras que los haplotipos del fibrinógeno no mostraron asociación con la HT tras la corrección aplicada para las comparaciones múltiples en los varones o las mujeres17. Por último, el polimorfismo rs4220 del gen de la cadena beta del fibrinógeno mostró una asociación independiente con la conentración plasmática de fibrinógeno y con la HT en participantes chinos, lo cual indica un posible papel causal del fibrinógeno en la aparición de la HT, sobre todo en los varones18.
Sin embargo, no hay datos claros sobre el papel de los polimorfismos estudiados respecto al riesgo de EC en los pacientes con HT. Nuestros resultados indican que el fibrinógeno elevado es un factor independiente predictivo del riesgo de EC en los participantes con HT. En cambio, el polimorfismo rs2070011 no afectó al fibrinógeno ni al riesgo de EC en nuestra cohorte. Aunque la homocigosis para AA (rs180070) implicó cifras de fibrinógeno más altas y riesgo de EC en la cohorte total, no se observó un efecto significativo (en el riesgo de EC) en el subgrupo de HT. Esta observación puede apuntar a que el genotipo AA no eleva el riesgo de EC de manera independiente de la concentración de fibrinógeno y los factores de riesgo principales, como la HT.
Hipertensión y polimorfismos del fibrinógeno: efectos en la inflamaciónVarios estudios han mostrado que la HT se asocia a un aumento de los biomarcadores inflamatorios circulantes3,4. Aunque se ha examinado ampliamente este factor de riesgo, el papel de la genética no se ha esclarecido por completo en esta población. Anteriormente, el polimorfismo C148T de la cadena beta del fibrinógeno se asoció con un aumento del fibrinógeno, la PCR y la IL-6 en pacientes sometidos a un injerto de bypass arterial coronario19,20. Wong et al21. señalaron que había una influencia genética clara del polimorfismo IL6-572C > G en el fibrinógeno plasmático y la PCR, en especial en los pacientes con HT. Además, el polimorfismo genético A1675G en el gen AT2R afecta al riesgo cardiovascular y a la gravedad de la enfermedad al fomentar la inflamación vascular, en especial en los varones hipertensos22, mientras que el polimorfismo M235T del gen del angiotensinógeno no parece que tenga efecto alguno23.
En el presente estudio, se confirma que los pacientes de riesgo elevado tienen concentraciones más altas de los biomarcadores inflamatorios. Además, los pacientes con valores de fibrinógeno altos mostraron mayores concentraciones de PCRus, IL-6 y CD40L. Esta observación indica que, entre los individuos de alto riesgo, la determinación simultánea de fibrinógeno y PCRus puede identificar a los pacientes con mayor riesgo cardiovascular. Es importante señalar que se pone de relieve, por primera vez, un efecto significativo del polimorfismo rs180070 en la IL-6 de los pacientes hipertensos. Así, los valores de IL-6 fueron más altos en los homocigotos AA para el rs180070 que en todos los demás genotipos (AG o GG) y la homocigosis en AA fue el único factor ajustado independiente predictivo de la concentración de IL-6. En la cohorte total y los pacientes con HT, el proceso inflamatorio no se afectaba por la homocigosis (AA) para el polimorfismo rs2070011.
Hipertensión y polimorfismos del fibrinógeno: efectos en la coagulaciónLa evidencia existente indica que el aumento de fibrinógeno, dímero D y fragmento 1 + 2 de la protrombina plasmáticos se da en los pacientes hipertensos con una disminución leve del aclaramiento de creatinina, lo cual indica que el sistema de la coagulación está activado en estos pacientes24. Sin embargo, los datos existentes sobre los efectos de la variabilidad genética del fibrinógeno en la cascada de la coagulación en los pacientes con HT son escasos. La presencia del polimorfismo Ala379Val de la fosfolipasa A2 unida a lipoproteínas afectó a los valores de fibrinógeno de una población hipertensa caucásica25, mientras que el polimorfismo Thr312Ala del fibrinógeno alfa se asoció a la HT pulmonar tromboembólica crónica26. Además, se ha descrito que los polimorfismos rs2227401 y rs2070016 de los genes del fibrinógeno se asocian a cifras de fibrinógeno significativamente superiores17, mientras que el polimorfismo rs1049636 se asocia a unas concentraciones de fibrinógeno más bajas en las mujeres, pero no en los varones17. Tan solo en una cohorte pequeña se ha observado que el estado de portador de A455 se asocia a un aumento del fibrinógeno en los pacientes con HT, pero ese estudio no examinó el riesgo de EC en esa población27.
En nuestra cohorte, se observó que la presencia del alelo A de rs180070 se asociaba a cifras de fibrinógeno significativamente superiores en los participantes hipertensos. Sin embargo, la presencia del alelo A de rs2070011 no tuvo efectos significativos en el fibrinógeno de esos pacientes. En el análisis multivariable, el genotipo AA del rs180070 y la EC continuaron siendo factores independientes predictivos de la concentración de fibrinógeno. Es importante señalar que se ha podido demostrar por primera vez que la homocigosis para AA del polimorfismo rs180070 conlleva cifras de dímero D significativamente superiores que con GG + GA y que esta diferencia sigue siendo significativa en los pacientes con HT. Es de destacar que no se observaron diferencias en el perfil lipídico o el tratamiento médico entre los grupos, lo cual indica que el riesgo cardiovascular inicial era similar en los diversos terciles del fibrinógeno28. Sin embargo, la presencia de los polimorfismos rs180070 o rs2070011 no estaba relacionada con ningún cambio en las concentraciones de los factores V y X, el plasminógeno o la trombina de los pacientes hipertensos.
LimitacionesLa interpretación del análisis de nuestros datos tiene algunas limitaciones. En primer lugar, se trata de un estudio transversal y no se presentan datos de seguimiento clínico. Por otra parte, la gravedad de la EC no se cuantificó de manera detallada con el empleo de la puntuación SYNTAX. Por último, los posibles factores de confusión no medidos podrían afectar a la asociación entre las variantes genéticas y el riesgo de EC.
CONCLUSIONESNuestro estudio muestra que el fibrinógeno es un factor independiente predictivo de EC y que esto se relaciona estrechamente con las concentraciones de aquel en la HT. Además, la homocigosis para AA de rs180070 se asocia a mayores concentraciones de fibrinógeno, IL-6 y dímero D y riesgo de EC en la cohorte total.
CONFLICTO DE INTERESESNinguno.
AGRADECIMIENTOSUn especial agradecimiento a la señora Magdalini Sgouridi por el apoyo técnico.
- –
El fibrinógeno es un biomarcador que interviene tanto en la respuesta inflamatoria como en las vías de la coagulación, y conduce a disfunción endotelial y ateroesclerosis.
- –
Anteriormente se ha documentado una asociación independiente entre valores plasmáticos de fibrinógeno y riesgo de EC.
- –
La evidencia reciente apunta a un posible papel de la variabilidad genética del fibrinógeno en el riesgo de EC, pero los datos existentes al respecto son controvertidos.
- –
Los estudios previos han sido contradictorios por lo que respecta a los posibles efectos reguladores de los polimorfismos genéticos, como rs180070 y rs2070011, en cuanto a la concentración de fibrinógeno y el riesgo de EC.
- –
Este estudio demostró que la presencia del alelo A de rs180070 se asocia a cifras de fibrinógeno significativamente mayores, mientras que la presencia del alelo A de rs2070011 no tiene efecto significativo en el fibrinógeno de los participantes hipertensos.
- –
En el análisis multivariable, el genotipo AA del polimorfismo rs180070 y la EC continuaron siendo factores independientes predictivos de la concentración de fibrinógeno.
- –
La homocigosis para AA del rs180070 conlleva cifras de dímero D significativamente mayores que GG + GA, y esta diferencia sigue siendo significativa en los pacientes con HT.