Aunque las guías de práctica clínica recomiendan una estrategia invasiva para el infarto agudo de miocardio sin elevación del segmento ST (IAMSEST), en la práctica clínica esta estrategia se infrautiliza en ancianos frágiles. Además estos enfermos habitualmente quedan excluidos de los ensayos clínicos, por lo que la evidencia es escasa. Nuestra hipótesis es que una estrategia invasiva para el anciano con fragilidad y IAMSEST mejorará el pronóstico.
MétodosSe trata de un estudio prospectivo, multicéntrico y aleatorizado que compara una estrategia invasiva frente a una conservadora en ancianos frágiles con IAMSEST. Los criterios de inclusión son: IAMSEST, edad ≥ 70 años y fragilidad definida por al menos 4 criterios de la escala Clinical Frailty Scale. Se aleatorizará a los participantes a una estrategia invasiva (coronariografía y revascularización si se considera anatómicamente indicada) o conservadora (tratamiento médico y coronariografía solo en caso de inestabilidad clínica persistente). El objetivo principal será el número de días vivo fuera del hospital durante el primer año. El objetivo coprincipal será el tiempo hasta la presentación de muerte cardiovascular, reinfarto agudo de miocardio o revascularización tras el alta. El tamaño de la muestra estimado es de 178 pacientes (89 por grupo), asumiendo un incremento del 20% en la proporción de días vivo fuera del hospital con la estrategia invasiva.
ResultadosLos resultados del estudio aportarán información novedosa para el tratamiento del anciano frágil con IAMSEST.
ConclusionesNuestra hipótesis es que una estrategia invasiva mejorará el pronóstico de los pacientes ancianos frágiles con IAMSEST. Si esta hipótesis se confirmara, la situación de fragilidad no debería disuadir al cardiólogo de indicar un tratamiento invasivo. Ensayo registrado en ClinicalTrials.gov (Identificador: NCT03208153).
Palabras clave
Palabras clave
Vídeo del artículo

La fragilidad se define como un estado fisiológico de disminución de la resistencia ante situaciones de estrés, que se debe a una reducción de las reservas fisiológicas de múltiples sistemas y da lugar a una vulnerabilidad a sufrir resultados adversos1. Los síndromes coronarios agudos constituyen un factor de estrés importante para los pacientes frágiles. De hecho, la fragilidad predice la mortalidad a corto y largo plazo tras un síndrome coronario agudo2–7. Además, de entre los trastornos geriátricos (es decir, discapacidad física, discapacidad instrumental, deterioro cognitivo y comorbilidades), la fragilidad junto con las comorbilidades permite captar la mayor parte de la información pronóstica4,6.
No hay evidencias que permitan establecer el óptimo tratamiento de los pacientes frágiles que sufren un infarto agudo de miocardio sin elevación del segmento ST (IAMSEST). Aunque las guías de práctica clínica recomiendan un tratamiento invasivo precoz basándose en los resultados de los ensayos clínicos, los pacientes frágiles están infrarrepresentados en esos ensayos. En consecuencia, actualmente no está claro el papel de la estrategia invasiva en los pacientes frágiles. Nuestra hipótesis es que una estrategia invasiva sistemática mejorará los resultados en dichos pacientes. El objetivo del presente ensayo es evaluar la eficacia y la seguridad de una estrategia invasiva sistemática para aumentar el número de días vivo fuera del hospital y mejorar los resultados cardiovasculares durante el primer año tras un IAMSEST.
MÉTODOSDiseño del estudioSe trata de un ensayo clínico prospectivo, multicéntrico, aleatorizado, iniciado por los investigadores, en el que se compara una estrategia invasiva con una estrategia no invasiva en pacientes de edad ≥ 70 años, con IAMSEST y fragilidad. Los pacientes serán aptos para la inclusión si cumplen los 3 criterios de inclusión siguientes: a) IAMSEST, definido como un dolor torácico agudo, ausencia de elevación persistente del segmento ST en presencia de repolarización interpretable en el ECG y elevación de la troponina (según el método de análisis del laboratorio local); b) edad ≥ 70 años; c) criterios de fragilidad definidos por una puntuación en la Clinical Frailty Scale ≥ 4 (figura del material suplementario)8. Los criterios de exclusión serán los siguientes: a) enfermedad coronaria no revascularizable conocida con anterioridad; b) cardiopatía no isquémica concomitante significativa (es decir, valvulopatía grave, miocardiopatía); c) incapacidad de comprender/firmar un documento de consentimiento informado (pacientes o familiares), y d) esperanza de vida < 12 meses.
Además de los criterios de inclusión y exclusión definidos, el cardiólogo que atiende al paciente debe considerar que la participación de este en el estudio sea razonable. Podrían ser motivo para considerar inapropiada la participación tanto que el cardiólogo encargado considere necesaria una estrategia de tratamiento invasivo como ante cualquier factor clínico que haga inaplicable el tratamiento invasivo.
Este estudio se registró en ClinicalTrials.gov (Identificador: NCT03208153).
TratamientoLos pacientes serán aleatorizados en un plazo de 48 h tras su ingreso para asignarlos a una estrategia de coronariografía y revascularización coronaria, si se considera apropiada, durante la hospitalización índice, o a un tratamiento médico sin coronariografía planeada. La asignación a los 2 grupos de tratamiento se llevará a cabo con un esquema de aleatorización generado por ordenador, en relación 1:1. La aleatorización se realizará a través de una página web en la que el proceso se ocultará a los investigadores hasta que se hayan asignado las intervenciones. El tratamiento médico al ingreso y al alta se optimizará según lo establecido en las guías para los 2 grupos de estudio.
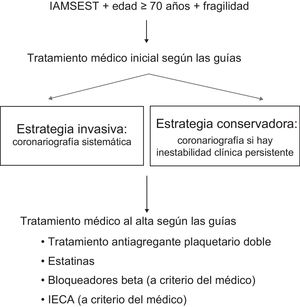
En la figura se presenta el algoritmo del estudio. En el grupo de tratamiento invasivo se realizará una coronariografía en las primeras 72 h tras el ingreso. Cuando se lleve a cabo una intervención coronaria percutánea, el tipo de stent que implantar se dejará al criterio del cardiólogo que realice el tratamiento, si bien se recomienda el empleo de stents con una seguridad demostrada para el uso de un tratamiento antiagregante plaquetario doble de corta duración si fuera necesario, con el fin de reducir el posible riesgo de hemorragia en esta población. En cambio, los pacientes asignados al grupo de estrategia no invasiva recibirán tan solo tratamiento médico, si bien se permitirá el cateterismo cardiaco en el caso de que haya una mala evolución en el hospital debido a una isquemia recurrente documentada (dolor torácico más alteraciones electrocardiográficas o nueva elevación de la troponina) o una inestabilidad hemodinámica durante el ingreso índice. Según lo indicado por un ensayo clínico anterior, el porcentaje estimado de cambio a la estrategia de tratamiento alternativa es del 24%9. Se determinará mediante ecocardiografía la fracción de eyección del ventrículo izquierdo previa al alta de todos los pacientes. El periodo estándar de tratamiento antiagregante plaquetario combinado doble será de 1 año en los 2 grupos de estudio, si bien a los pacientes con un riesgo hemorrágico elevado (a criterio del médico encargado) o que necesiten tratamiento anticoagulante oral, podrá retirarse 1 de los fármacos antiagregantes plaquetarios después del primer mes. Se obtendrán datos clínicos y de tratamiento detallados al ingreso y durante la hospitalización (tabla 1 y tabla 2).
Variables evaluadas al ingreso
| Hospitalización: unidad coronaria, sala de cardiología, sala de medicina interna, sala de geriatría, otras |
| Criterios de inclusión (todos): infarto agudo de miocardio sin elevación del segmento ST, edad (≥ 70 años), criterios de fragilidad (Clinical Frailty Scale ≥ 4) |
| Criterios de exclusión (todos): enfermedad coronaria no revascularizable previa y conocida, cardiopatía no isquémica concomitante significativa, incapacidad de comprender/firmar el consentimiento informado (pacientes o familiares), esperanza de vida < 12 meses |
| Datos demográficos: sexo, peso, estatura |
| Factores de riesgo: diabetes (insulina, metformina, sulfonilureas, otros), hipertensión (número de fármacos), dislipemia (estatinas, fibratos, ezetimiba, otros), tabaquismo, enfermedad arterial periférica documentada, ictus previo, insuficiencia renal previa (tasa de filtrado glomerular < 60 ml/min, diálisis) |
| Antecedentes de cardiopatía: infarto agudo de miocardio, cardiopatía isquémica documentada con coronariografía, intervención coronaria percutánea, bypass arterial coronario, ingreso por insuficiencia cardiaca, fibrilación auricular, marcapasos o desfibrilador, antecedentes farmacológicos detallados |
| Comorbilidades: hospitalización previa por hemorragia, neoplasia, hepatopatía, tratamiento a largo plazo con fármacos antiinflamatorios no esteroideos, demencia, depresión (fármacos), consumo de alcohol, número total de fármacos |
| Datos de ingreso relacionados con el infarto agudo de miocardio sin elevación del segmento ST: hora de inicio del dolor, hora de ingreso, ≥ 2 episodios de dolor en las 24 h previas, signos electrocardiográficos, presión arterial, frecuencia cardiaca, clase de Killip |
Variables evaluadas durante la hospitalización
| Coronariografía (si se realiza): vía de acceso (radial/femoral), volumen de contraste, dominancia, arteria culpable, flujo TIMI inicial, número de vasos con una estenosis significativa, afección de la principal izquierda, puntuación SYNTAX, intervención de revascularización, EuroSCORE II |
| Intervención coronaria percutánea: número de vasos tratados, implante directo de stent, revascularización completa, número de stents, tipo de stent, flujo TIMI final |
| Ecocardiografía: fracción de eyección del ventrículo izquierdo, insuficiencia mitral, derrame pericárdico |
| Análisis de sangre: hemoglobina (al ingreso y valor mínimo), recuento leucocitario (al ingreso), creatinina (al ingreso y valor máximo), glucosa (al ingreso y valor máximo), cLDL, cHDL, triglicéridos |
| Tratamientos farmacológicos durante la hospitalización |
| Complicaciones clínicas: muerte, reinfarto, angina recurrente, BAV, taquicardia ventricular, fibrilación ventricular, fibrilación auricular, complicación mecánica, hemorragia (criterios de hemorragia del Academic Research Consortium), delirio confusional, ictus |
| Tratamientos farmacológicos al alta |
BAV: bloqueo auriculoventricular; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; TIMI: Thrombolysis In Myocardial Infarction.
Se realizará una evaluación geriátrica sistemática y completa antes del alta, mediante una entrevista con el paciente y la familia o cuidadores, referida al estado del paciente antes del ingreso, respecto a lo siguiente: a) la capacidad funcional para las actividades básicas de la vida diaria se evaluará con el índice de Barthel10; se trata de una escala ordinal con una puntuación total de 0 a 100, cuyos valores intermedios son útiles para evaluar los diferentes grados de dependencia: total (0-20), grave (21-40), moderada (41-60), leve (61-90) e independiente (> 90); b) las actividades instrumentales se evaluarán con el índice de Lawton-Brody11; c) el estado cognitivo se evaluará con la prueba de Pfeiffer12; d) la fragilidad previa se evaluará, además de con la escala de Rockwood, con la escala FRAIL, que incluye una evaluación de la fatiga, la resistencia, la capacidad de deambulación, las enfermedades concomitantes y la pérdida de peso13; e) después de la fase clínica aguda (una vez estabilizado el paciente), se aplicará la Short Physical Performance Battery14, examen que incluye: i) equilibrio en 3 posiciones (pies juntos, semitándem y tándem), ii) velocidad de la marcha (a lo largo de 4 m), y iii) levantarse y sentarse en una silla 5 veces; la puntuación total de la SPPB es la suma de los 3 subapartados, y va de 0 (el peor resultado) a 12, y una puntuación < 10 indica fragilidad y aumento del riesgo de discapacidad y caídas; f) para evaluar las comorbilidades, se aplicará el índice de Charlson, con un máximo de 37 puntos15; se registrará también el número de medicaciones de prescripción que tomaba el paciente de manera crónica antes del ingreso; g) la evaluación del riesgo nutricional se llevará a cabo con la Mini Nutritional Assessment-Short Form16, que toma valores entre 0 y 14 puntos; las puntuaciones < 11 identifican a los pacientes con riesgo de desnutrición, y h) la calidad de vida se analizará con el cuestionario EQ 5D 5L17.
ObjetivosEl objetivo principal será el número de días vivo fuera del hospital durante el primer año. El objetivo coprincipal será el tiempo transcurrido hasta la primera aparición de 1 de los eventos incluidos en el objetivo combinado (muerte de causa cardiovascular, infarto de miocardio o revascularización tras el alta). Los objetivos secundarios serán el tiempo hasta la muerte por cualquier causa, el infarto de miocardio, la rehospitalización por causas cardiacas o no cardiacas, los episodios hemorrágicos y el ictus. Tan solo se tendrán en cuenta los episodios hemorrágicos de tipo ≥ 2 según la definición del Academic Research Consortium18. La aparición de un infarto de miocardio relacionado con la intervención se evaluará con la determinación de las troponinas 12 h después de la revascularización. El infarto relacionado con la intervención se definirá por una elevación de la troponina > 5 veces el percentil 99 después de la intervención coronaria percutánea y > 10 veces el percentil 99 después la cirugía coronaria, junto con datos que indiquen isquemia aguda según los síntomas clínicos, el electrocardiograma, la angiografía o las técnicas de imagen. La capacidad funcional (índice de Barthel), las actividades instrumentales (índice de Lawson-Brody), la capacidad cognitiva (Pfeiffer) y la calidad de vida (EQ 5D5L) se volverán a evaluar a los 6 meses, también como objetivos secundarios. El seguimiento incluirá una visita clínica o un contacto telefónico a los 3 meses, 1 año y luego 1 vez al año hasta los 3 años.
Comités del estudioSe trata de una iniciativa impulsada por los investigadores, bajo los auspicios de la Sociedad Española de Cardiología y los grupos de trabajo de Cardiología Intervencionista y de Cardiología Geriátrica. Un comité directivo se encargará de supervisar los aspectos científicos y operativos del estudio. No se aplicará enmascaramiento de los pacientes y los investigadores respecto a la asignación del tratamiento, pero un comité de eventos clínicos evaluará los eventos clínicos con enmascaramiento para evitar el sesgo. De igual modo, habrá un comité de vigilancia de datos y seguridad que no conocerá la asignación del tratamiento de los pacientes y se encargará de hacer recomendaciones al comité directivo respecto a los objetivos y cualquier posible observación importante relacionada con la seguridad de los pacientes.
Tamaño de la muestraNo hay datos sobre el tratamiento óptimo de los pacientes frágiles con IAMSEST. En un estudio previo en pacientes ancianos con IAMSEST y comorbilidades, los pacientes a los que se aplicó una estrategia conservadora continuaron vivos fuera del hospital durante una media de 273 ± 123 días durante el primer año tras el alta9. Partiendo del supuesto de que los pacientes frágiles podrían tener un perfil bastante similar y considerando un aumento del 20% en la proporción de días vivo fuera del hospital (55 días) con una estrategia invasiva, estimamos un tamaño muestral de 178 pacientes (89 por grupo de tratamiento) con una potencia estadística estimada del 80%, un nivel de alfa bilateral de 0,05 y un 10% de pérdidas del seguimiento. La obtención de este tamaño muestral requerirá un enfoque multicéntrico. Estimamos que será necesaria la participación de un mínimo de 10 hospitales.
Análisis estadísticoTodas las comparaciones estadísticas se realizarán según el principio de intención de tratar. Los resultados se presentarán en forma de frecuencias o media ± desviación estándar según sea apropiado. Las comparaciones de los grupos se realizarán con la prueba de la t de Student o la prueba exacta de Fisher.
El seguimiento de los pacientes se censurará para el análisis en el momento de la muerte o al final del estudio. El objetivo principal, como variable continua, se comparará en un grupo frente al otro mediante ANOVA. Por lo que respecta al objetivo coprincipal y los objetivos secundarios, el efecto de la estrategia invasiva en los eventos clínicos se describirá con el método de Kaplan-Meier y se evaluará con un modelo de regresión de Cox. Se calculará la hazard ratio y su intervalo de confianza del 95%. Se llevará a cabo un análisis de subgrupos preespecificados según las comorbilidades (índice de Charlson).
Se considerará estadísticamente significativo un valor de p bilateral < 0,05.
DISCUSIÓNLa prevalencia de la fragilidad en los pacientes ancianos ingresados por un síndrome coronario agudo oscila entre el 27 y el 34%4,19. Su presencia se asocia con riesgo de mortalidad tanto durante el ingreso como después del alta2–7. Esto podría deberse en parte a una infrautilización de los tratamientos recomendados en las guías. Las guías clínicas recomiendan una estrategia invasiva sistemática en el IAMSEST20. No obstante, el tratamiento invasivo está infrautilizado en los pacientes frágiles y con comorbilidades2,21–23. Esta política podría deberse a la percepción de ciertos riesgos asociados con las intervenciones invasivas en esta población especialmente vulnerable, como los de hemorragia, nefropatía por medios de contraste o intervenciones de revascularización difíciles (p. ej., en lesiones muy calcificadas). Sin embargo, con empleando la vía de acceso radial, las medidas profilácticas para la nefropatía por medios de contraste y los nuevos dispositivos de revascularización, la preocupación generada por el abordaje invasivo no parece justificada. No obstante, la percepción de ausencia de beneficio debido a un mal pronóstico derivado del estado de fragilidad en sí, que no es modificable, podría continuar siendo un argumento.
Hay unos pocos estudios que han abordado el papel de las estrategias invasivas en los pacientes ancianos. En un estudio de Savonitto et al.24, una estrategia invasiva sistemática no fue estadísticamente superior a una estrategia invasiva selectiva en pacientes ancianos con IAMSEST, pero el estudio tuvo una potencia estadística insuficiente debido al pequeño tamaño muestral. El ensayo clínico aleatorizado After Eighty fue un estudio de un tamaño adecuado que incluyó a pacientes de más de 80 años con IAMSEST, y se demostró el beneficio de una estrategia invasiva para reducir los eventos del objetivo combinado formado por muerte y eventos cardiovasculares a los 1,5 años25. Conviene señalar que en ninguna circunstancia se realizó cateterismo cardiaco a ninguno de los pacientes del grupo de tratamiento conservador del estudio. Además, solo un 23% de los posibles candidatos a la inclusión fueron incluidos finalmente en la asignación aleatoria, lo cual indica un sesgo hacia los pacientes de menor riesgo. Recientemente, en el ensayo clínico aleatorizado MOSCA se evaluó la eficacia de una estrategia invasiva en pacientes ancianos con IAMSEST y comorbilidades9. Aunque es un ensayo pequeño, no hubo diferencias entre las estrategias invasiva y conservadora. Según un análisis exploratorio que no había sido preespecificado, la estrategia invasiva redujo la probabilidad de muerte o eventos isquémicos a los 3 meses. No obstante, este beneficio dejó de observarse en el seguimiento de 2,5 años. No hay información sólida respecto a la fragilidad. De hecho, generalmente se excluye de los ensayos clínicos aleatorizados a los pacientes frágiles. Por ejemplo, el ensayo TRILOGY ACS (TaRgeted platelet Inhibition to cLarify the Optimal strateGy to medicallY manage Acute Coronary Syndromes) incluyó un porcentaje notablemente bajo (4,7%) de pacientes frágiles5. Un estudio de observación indica que el tratamiento invasivo podría aportar un beneficio para los pacientes frágiles con IAMSEST26. Esta hipótesis deberá validarse en un ensayo clínico aleatorizado específico para este fin.
Se ha observado cierta relación entre la edad y el riesgo hemorrágico de los pacientes en tratamiento antiagregante plaquetario combinado doble27. Esta relación no se observó con la fragilidad5. En términos generales, los médicos tienden a evitar los nuevos fármacos antiagregantes plaquetarios potentes a los pacientes ancianos o frágiles, debido al mayor riesgo de hemorragia. En relación con este hecho, los cardiólogos intervencionistas han sido reacios a utilizar los stents farmacoactivos debido a la preocupación generada por la necesidad de una mayor duración del tratamiento antiagregante plaquetario doble. Además, algunos pacientes frágiles necesitan anticoagulación oral por fibrilación auricular crónica. Sin embargo, los nuevos diseños de los stents permiten el tratamiento antiagregante plaquetario doble de corta duración y podrían ser una herramienta excelente28.
Por último, aunque la mayoría de los estudios se centran principalmente en la muerte, el infarto de miocardio, el ictus, la necesidad de revascularización o la rehospitalización, los pacientes también desean recuperar una vida independiente y volver a su lugar habitual de residencia. La presencia de síndromes geriátricos (como fragilidad, deterioro cognitivo, dependencia grave y depresión) no solo se asocia con un peor resultado clínico, sino también con mayor riesgo de deterioro funcional y necesidad de una nueva ayuda social, lo cual implica un aumento del grado de dependencia. Esto tiene una importante repercusión en la calidad de vida y el bienestar psicológico, pero con frecuencia pasa a ser también una carga social y económica importante para los pacientes y las familias. En consecuencia, uno de los verdaderos retos del tratamiento del síndrome coronario agudo de pacientes muy ancianos es evitar la dependencia. A este respecto, el uso de nuevos parámetros de valoración especialmente destinados a medir el grado de independencia y la calidad de vida resulta especialmente importante29.
LimitacionesLa estimación del tamaño muestral es parcialmente especulativa, puesto que no hay datos previos sobre las repercusiones pronósticas de la estrategia de tratamiento en los pacientes frágiles con un IAMSEST. En consecuencia, se tuvo que utilizar la información procedente de nuestro estudio previo en pacientes ancianos con comorbilidades e IAMSEST para estimar el tamaño muestral a pesar de que en ese estudio no se evaluó la fragilidad9.
CONCLUSIONESSe desconoce cuál es el tratamiento óptimo para los pacientes frágiles con IAMSEST. Hasta el momento no se ha realizado ningún ensayo diseñado para esta población específica. Nuestra hipótesis es que la estrategia invasiva mejorará los resultados en los pacientes ancianos frágiles con IAMSEST. En el caso de que se confirme, la fragilidad no deberá disuadir a los médicos de aplicar un tratamiento invasivo.
FINANCIACIÓNEste trabajo fue financiando por subvenciones del Ministerio de Economía y Competitividad de España a través del Instituto de Salud Carlos III: FIS 17/01736, FIS 17/00899 y FIS 15/00837, FEDER; CIBER-CV 16/11/00420, Madrid, España. Cuenta también con el apoyo de la SCReN-Spanish Clinical Research Network (PT13/0002/0031; PT17/0017/0003) del Plan Nacional de I+D+D del Instituto de Salud Carlos III (Ministerio de Economía y Competitividad: Cofinanciado por el Fondo Europeo de Desarrollo Regional «A way to make Europa») para la monitorización del estudio.
CONFLICTO DE INTERESESE. Abu-Assi es Editor Asociado de Revista Española de Cardiología. H. Bueno declara subvenciones y pagos personales de Astra-Zeneca; pagos personales de Daichii-Sankyo, Eli-Lilly, Bayer y Sanofi durante la realización del estudio, y pagos personales de Novartis, BMS-Pfizer y Servier sin relación con el trabajo presentado. J. Núñez declara pagos personales de Novartis, Vifor, Abbott, Rovi, Boehringer Ingelheim y Novo Nordisk, sin relación con el trabajo presentado. M. Sanmartín declara pagos personales de Bayer, Boehringer Ingelheim y Astra sin relación con el trabajo presentado.
- –
Las guías de práctica clínica recomiendan una estrategia invasiva en el IAMSEST, basándose en los resultados de los ensayos clínicos aleatorizados.
- –
Los pacientes frágiles ancianos están infrarrepresentados en los ensayos clínicos aleatorizados.
- –
En consecuencia, continúa sin conocerse cuál es el tratamiento óptimo de los pacientes frágiles con IAMSEST.
- –
Hasta donde sabemos, este es el primer ensayo clínico aleatorizado en el que se comparan las estrategias invasiva y conservadora en pacientes frágiles ancianos con IAMSEST.
- –
Los ensayos aleatorizados previos han estudiado a los pacientes ancianos sin tener en cuenta su grado de fragilidad.
- –
Los resultados de este ensayo aportarán información relevante respecto al tratamiento de esta población, que representa un verdadero reto.
Los autores agradecen a Marta Peiró, M. Dolores Iglesias y Mireia Hernández la monitorización del estudio.