Palabras clave
INTRODUCCIÓN
La endocarditis derecha es una entidad clínica bien definida en pacientes con antecedentes de adicción a drogas por vía parenteral (ADVP) o portadores de marcapasos u otros dispositivos intracardiacos1-4. Su
forma de presentación clínica y su tratamiento difieren de los de la endocarditis izquierda1-4, y su pronóstico es más favorable, puesto que muchos pacientes pueden alcanzar una curación con tan sólo tratamiento médico1,4 o con la extracción quirúrgica del dispositivo en la endocarditis por marcapasos2-3. La fiebre asociada a antecedentes de ADVP o de uso de marcapasos debe hacer sospechar una endocarditis, que puede confirmarse mediante hemocultivos y ecocardiografía.
La endocarditis derecha aislada, en ausencia de antecedentes de ADVP o en pacientes no portadores de marcapasos, es una entidad poco conocida. La mayor parte de los estudios publicados sobre esta enfermedad corresponden a descripciones antiguas de casos aislados5-7. La serie más amplia, descrita por Nandakumar et al8, resumió las características de 29 casos de endocarditis tricuspídea en pacientes sin ADVP publicados por diversos autores las últimas décadas del siglo pasado. El estudio de Naidoo9 analizó 15 casos de endocarditis derecha en pacientes sin ADVP; sin embargo, se trata de un análisis retrospectivo en el que se incluyeron también casos de endocarditis izquierda.
Así pues, carecemos de información sobre el perfil clínico y el pronóstico de la endocarditis derecha en pacientes no portadores de marcapasos y sin antecedentes de ADVP. El objetivo de este estudio fue investigar la frecuencia actual de esta entidad y describir su perfil clínico, microbiológico, ecocardiográfico y pronóstico.
MÉTODOS
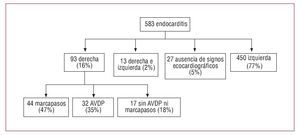
Analizamos 583 episodios de endocarditis diagnosticados de manera consecutiva entre 1996 y 2006 en las unidades de cardiología y cirugía cardiaca de cuatro centros terciarios, siguiendo los criterios de Duke (hasta 2002) o los criterios de Duke modificados10 (de 2003 a 2006). De los 93 (16%) episodios localizados en el lado derecho del corazón, 44 (47%) afectaron a un dispositivo intracardiaco, 32 (35%) a pacientes con ADVP y 17 (18%) a pacientes sin antecedentes de ADVP que no eran portadores de marcapasos. Estos 17 pacientes (el 2,9% de la cohorte total de nuestra serie) constituyen el grupo de estudio para este trabajo. En la figura 1 se muestra la distribución de nuestra población de pacientes.
Fig. 1. Distribución de nuestra población. ADVP: adictos a drogas por vía parenteral.
Para cada paciente utilizamos el mismo protocolo para registrar la información de manera prospectiva, empezando el día del ingreso en el hospital. El protocolo incluía 90 variables11: 19 epidemiológicas, 8 clínicas, 10 analíticas, 4 radiográficas, 6 electrocardiográficas, 13 microbiológicas, 16 ecocardiográficas y 14 características de seguimiento. De todos los pacientes, registramos los resultados de al menos una exploración física, un electrocardiograma, una radiografía de tórax, un análisis de orina, tres hemocultivos al ingreso, tres hemocultivos 48 h después de iniciado el tratamiento antibiótico y una ecocardiografía transtorácica y transesofágica. Se inició tratamiento antibiótico empírico tras la obtención de los hemocultivos si el estado clínico del paciente así lo requería, y se modificó el tratamiento en caso necesario en función de los resultados de los hemocultivos y el antibiograma. Si los hemocultivos obtenidos a las 72 h eran negativos, se realizaban pruebas serológicas para Chlamydia, Brucella, fiebre Q, Legionella y Mycoplasma.
Definición de los términos
La endocarditis infecciosa asociada a la asistencia sanitaria incluye la infección nosocomial y la infección asociada a la asistencia sanitaria no nosocomial. La endocarditis se consideró nocosomial cuando se producía en un paciente hospitalizado durante más de 72 h antes de la aparición de signos o síntomas indicativos de endocarditis. La endocarditis infecciosa asociada a la asistencia sanitaria no nosocomial se definió como la aparecida en pacientes ambulatorios con un contacto amplio con la asistencia sanitaria (dispositivos permanentes para tratamiento intravenoso, catéteres de hemodiálisis, etc.). Los episodios diagnosticados en el momento del ingreso (o en las primeras 72 h siguientes al ingreso) en pacientes que no cumplían los criterios de infección asociada a la asistencia sanitaria se consideraron contraídos en la comunidad.
Consideramos endocarditis protésica precoz como la producida en el plazo de 1 año tras la intervención quirúrgica12. La enfermedad se consideró de inicio agudo cuando el tiempo transcurrido entre la aparición de los síntomas y el ingreso no era superior a 15 días. La insuficiencia renal se definió como una concentración sérica de creatinina > 2 mg/dl. La anemia crónica se definió como una concentración de hemoglobina < 9 g/dl documentada durante al menos 1 año antes de la hospitalización. Consideramos que cualquier tratamiento que pudiera reducir la inmunidad celular o humoral constituía un tratamiento inmunosupresor. Los criterios ecocardiográficos para vegetaciones, abscesos, seudoaneurismas y fístulas han sido descritos previamente13.
Las indicaciones de cirugía fueron la insuficiencia cardiaca resistente al tratamiento médico, la endocarditis fúngica, la embolia recurrente con vegetaciones persistentes en la ecocardiografía y la infección no controlada, definida como bacteriemia persistente o fiebre de más de 7 días de duración a pesar del tratamiento antibiótico apropiado, una vez descartados otros focos de infección.
Análisis estadístico
Presentamos un análisis descriptivo de las variables epidemiológicas, analíticas, radiográficas, electrocardiográficas, microbiológicas, ecocardiográficas y de seguimiento en 17 pacientes con ADVP y no portadores de marcapasos que presentaban una endocarditis derecha aislada. Las variables continuas se expresan en forma de media ± desviación estándar o mediana [rango intercuartílico], y las variables discretas se presentan con el valor absoluto y el porcentaje. Todos los datos se analizaron con el programa SPSS, v. 12.0 (SPSS Inc., Chicago, Illinois, Estados Unidos).
RESULTADOS
Hallazgos epidemiológicos y clínicos
La media de edad fue 38 ± 15 (20-61) años; 11 pacientes eran varones. La infección fue nosocomial en 7 pacientes, contraída en la comunidad en 7 y asociada a la asistencia sanitaria no nosocomial en 3. La puerta de entrada pudo determinarse en 11 pacientes y fue la siguiente: catéter intravascular en 6 casos, intervenciones genitourinarias (legrado por aborto séptico) en 3, cirugía cardiaca previa (sustitución de válvula aórtica) en 1 y derrame articular séptico en el hombro en 1. Se documentaron antecedentes de enfermedades cardiacas en 4 pacientes: 2 de ellos eran portadores de prótesis valvulares (1 prótesis mecánica aórtica y 1 prótesis biológica de válvula tricúspide) y 2 presentaban cardiopatías congénitas (comunicación interventricular en 1 caso y tétrada de Fallot en el otro); 3 pacientes tenían antecedentes de un episodio previo de endocarditis (1 endocarditis aórtica y 2 endocarditis tricuspídeas). Se identificaron enfermedades o trastornos predisponentes en 8 (47%) pacientes: inmunodepresión en 4, anemia crónica en 3, diabetes mellitus en 3, tratamiento inmunosupresor en 3, insuficiencia renal crónica en 3 y cáncer en 3. En 5 pacientes había más de una enfermedad predisponente. En la mayor parte de los pacientes, el inicio de la enfermedad fue agudo, y tan sólo 2 pacientes presentaban síntomas de más de 2 meses de evolución. En 13 (76%) episodios, el paciente había recibido tratamiento antibiótico antes del diagnóstico de endocarditis para tratar un síndrome febril que generalmente se atribuyó a una infección respiratoria.
Los síntomas y signos más comunes al ingreso fueron fiebre (n = 15) y disnea (n = 5). Tres pacientes fueron ingresados en shock séptico, y otros 3 presentaban signos clínicos de insuficiencia cardiaca derecha. Las radiografías de tórax mostraron cardiomegalia en 9 pacientes, embolia pulmonar séptica en 7, derrame pleural en 6 e insuficiencia cardiaca izquierda en 2.
Hallazgos microbiológicos
Los hemocultivos fueron positivos al ingreso en 14 pacientes, y se positivizaron en las primeras 48 h en 1 paciente. En 2 pacientes no pudo identificarse el microorganismo causal; ambos estaban recibiendo tratamiento antibiótico cuando se obtuvieron los hemocultivos. Tras 48 h de tratamiento antibiótico, los hemocultivos se negativizaron en 13 pacientes. El microorganismo aislado con más frecuencia fue Staphylococcus aureus (n = 7; 41%), sensible a meticilina en 4 pacientes y resistente a meticilina en 3. En la tabla 1 se muestra el perfil microbiológico de nuestros 17 pacientes.
Hallazgos ecocardiográficos
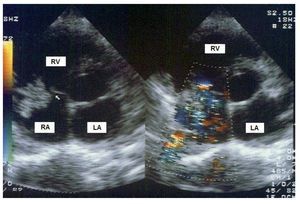
La endocarditis asentó en la válvula tricúspide en 14 (82%) pacientes. En los demás casos, afectó a la vena cava superior, a un defecto del tabique ventricular y una endocarditis precoz de una prótesis valvular biológica tricuspídea. Ninguno de los episodios afectó a más de una válvula. Todos los pacientes presentaban vegetaciones en la ecocardiografía transesofágica, y la mayoría de ellas eran grandes —(13 ± 7) ´ (8 ± 6) mm; área, 87 ± 65 mm2— y muy móviles (fig. 2). Sin embargo, la aparición de complicaciones perivalvulares fue muy poco frecuente (3 fístulas). Se produjo una rotura valvular en 1 caso y una insuficiencia tricuspídea grave en 12 pacientes.
Fig. 2. Ecocardiografía transtorácica en un paciente con endocarditis tricuspídea. Vegetación de gran tamaño (flecha) que causa una severa insuficiencia valvular. AD: aurícula derecha; AI: aurícula izquierda; VD: ventrículo derecho.
Curso clínico
Durante la hospitalización, en 1 paciente se desarrolló insuficiencia cardiaca izquierda (por sobrecarga hídrica en un paciente en hemodiálisis y con una función ventricular izquierda reducida), 2 pacientes presentaron insuficiencia renal de nueva aparición y 1 paciente presentó bloqueo auriculoventricular completo.
La anemia fue frecuente en nuestros pacientes, y solamente 3 de ellos presentaban al ingreso una concentración de hemoglobina > 12 g/dl. En 10 pacientes, la concentración era < 10 g/dl, y en 7 el valor era < 9 g/dl. La hematuria microscópica fue también frecuente y se objetivó en 8 (44%) pacientes.
La cirugía cardiaca fue necesaria en 5 (29%) pacientes: 3 a causa de embolia pulmonar recurrente a pesar del tratamiento apropiado, con persistencia de vegetaciones móviles grandes en la ecocardiografía, y 2 por una infección persistente (1 de ellos presentaba también insuficiencia cardiaca derecha resistente al tratamiento). La cirugía consistió en desbridamiento y reparación de la válvula tricúspide en 3 casos y en sustitución valvular en 2 (1 prótesis valvular mecánica y 1 biológica). En un paciente fue necesaria la implantación de un marcapasos epicárdico permanente a causa de un bloqueo auriculoventricular completo.
La mediana de duración de la hospitalización fue de 37 [30-63] días. Durante la hospitalización, fallecieron 2 pacientes, ambos por shock séptico. Un paciente falleció 24 h después del diagnóstico, tras una clínica de 1 mes de síndrome febril que se trató sin éxito extra-hospitalariamente. El otro paciente tenía un cáncer metastásico y una insuficiencia renal terminal, y refería un síndrome febril de 2 meses de evolución tratado sin éxito con antibióticos antes del diagnóstico. Así pues, la mortalidad intrahospitalaria fue del 12%. Por lo que respecta al pronóstico, la mortalidad en pacientes sin ADVP y no portadores de marcapasos que presentaron una endocarditis derecha aislada fue inferior a la del grupo de endocarditis izquierda (el 11 frente al 33%; p = 0,06).
El seguimiento posterior al alta en 11 pacientes tuvo una mediana de duración de 344 [180-1.227] días. Un paciente falleció 1 mes después del alta por causas desconocidas, y otro paciente con endocarditis tricuspídea por Propionibacterium acnes presentó una recaída al cabo de 3 meses; todos los demás pacientes se mantuvieron asintomáticos. En la tabla 1 se resumen las características clínicas de nuestros 17 pacientes.
DISCUSIÓN
La endocarditis derecha se asocia a menudo a los dispositivos intracardiacos o a antecedentes de ADVP, y en muchos estudios publicados se han descrito estas dos formas de presentación de la enfermedad1-4. Sin embargo, la aparición de una endocarditis derecha en un paciente que no presenta ninguno de estos dos antecedentes se ha descrito con muy poca frecuencia, probablemente por la baja incidencia de la enfermedad. De hecho, nuestra búsqueda bibliográfica identificó solamente descripciones antiguas de casos aislados5-9.
En este estudio se presentan los resultados de la primera serie prospectiva publicada hasta la fecha de pacientes con endocarditis derecha sin ADVP y no portadores de marcapasos.
Aunque la frecuencia de la endocarditis derecha en el tipo de pacientes que se describe aquí fue baja en relación con el conjunto del grupo de pacientes con endocarditis (el 18% del total de pacientes con endocarditis derecha, el 3% del total de pacientes con endocarditis de nuestra serie), la frecuencia fue superior a la inicialmente esperada, sobre todo teniendo en cuenta que más de la mitad de los casos se dieron en pacientes aparentemente sanos, sin enfermedades predisponentes. Es probable que la frecuencia real sea superior a la que nosotros observamos, por dos razones. Los síntomas iniciales de una endocarditis derecha son similares a los de una infección respiratoria (fiebre, disnea e infiltrado pulmonar), y ello hace probable la confusión diagnóstica. Además, dado que el estado clínico del paciente mejora con el tratamiento antibiótico, muchos casos de endocarditis derecha quedan sin diagnosticar. Esto explica que la mayor parte de los pacientes de nuestra serie recibieran tratamiento antibiótico antes de que se estableciera el diagnóstico correcto. Por otra parte, la incidencia real de la enfermedad puede haberse infravalorado, ya que la mayor parte de los estudios han incluido a pacientes con endocarditis complejas o pacientes en los que la enfermedad tiene una mala evolución clínica y por ello son remitidos a centros de referencia1,8. Esto puede comportar un sesgo de selección, de manera que nuestras conclusiones sólo serían aplicables a poblaciones similares a la nuestra.
En general, la endocarditis derecha aislada en pacientes sin ADVP y no portadores de marcapasos afecta a individuos jóvenes9,14. La presencia de uno o varios factores predisponentes (inmunodeficiencia, insuficiencia renal o cáncer) no es infrecuente. En estos pacientes, la fiebre no suele indicar un diagnóstico de endocarditis, sino que apunta más bien hacia otros tipos de infección (p. ej., respiratoria o abdominal) y ello puede retrasar aún más el diagnóstico. Así pues, la endocarditis derecha debe incluirse en el diagnóstico diferencial de los pacientes jóvenes con fiebre y una enfermedad predisponente.
En la mayor parte de los casos pudo identificarse la puerta de entrada de la infección. La más frecuente fue un catéter intravascular, y de hecho la posibilidad de aparición de una endocarditis a causa de un catéter venoso central se había señalado ya con anterioridad15.
Los catéteres vasculares son el principal origen de bacteriemias, en especial de las infecciones causadas por estafilococos16, que fueron los microorganismos hallados con mayor frecuencia en nuestra serie.
El retraso en el diagnóstico se debe, en parte, al hecho de que los criterios de Duke no son apropiados para los pacientes con endocarditis derecha (es decir, la sensibilidad de estos criterios para detectar la enfermedad es baja), y según muchos autores es preciso modificarlos17,18. Se ha propuesto una serie de criterios mayores y menores para el diagnóstico de la endocarditis derecha17. Ésta no se manifiesta clínicamente con los signos clásicos de la endocarditis izquierda5, sino con síntomas respiratorios. Es frecuente que la radiografía de tórax muestre embolia séptica y derrame pleural. Dado que predominan los signos y síntomas respiratorios, es frecuente que se diagnostique a los pacientes una neumonía5,8. La combinación de infiltrados pulmonares y enfermedad renal puede motivar una sospecha de vasculitis8. La embolia pulmonar es frecuente en los pacientes con endocarditis derecha y podría retrasar el diagnóstico de la enfermedad si se interpreta como una causa de la endocarditis en vez de una manifestación de ella. La fiebre también es un signo frecuente en los primeros días siguientes a una embolia pulmonar, pero rara vez es muy alta o prolongada. Así pues, en los pacientes con embolia pulmonar y fiebre alta, mantenida o recurrente o con elevados valores de marcadores inflamatorios, deben descartarse otras etiologías del síndrome febril, como la endocarditis derecha, sobre todo si tienen factores de riesgo (catéteres venosos centrales, alcoholismo, cáncer, cardiopatía previa, etc.)19.
Se ha señalado que debe sospecharse una endocarditis derecha en presencia del denominado «síndrome tricuspídeo»: episodios respiratorios recurrentes, anemia y hematuria microscópica8. El presente estudio corrobora esta asociación, puesto que el 24% de nuestros pacientes presentaba el síndrome tricuspídeo y el 65% tenía al menos dos de los tres componentes. La aparición de alteraciones renales en pacientes con endocarditis infecciosa es frecuente, y estas alteraciones pueden manifestarse en forma de diversas complicaciones con una distinta trascendencia clínica. La manifestación renal más frecuente es la hematuria o la proteinuria (o ambas), y la observación anatomopatológica más frecuente es la glomerulonefritis, que suele ser proliferativa y difusa o vasculítica20,21.
Los hemocultivos fueron positivos en la mayor parte de los pacientes. En nuestra serie, el microorganismo causal más frecuente fue S. aureus, igual que se había descrito en series anteriores8,9. La bacteriemia estafilocócica se asocia con mayor frecuencia a endocarditis que a neumonía5, por lo que la identificación de este germen aumenta la necesidad de descartar la endocarditis, en especial en pacientes con enfermedades predisponentes o portadores de un catéter intravascular. Es interesante señalar que rara vez se identificaron hongos como agentes causales, a pesar de que la mayor parte de nuestros pacientes habían recibido tratamiento antibiótico previo, estaban inmunodeficientes o eran portadores de catéteres intravasculares. Es de destacar la ausencia de Streptococcus viridans, al igual que en un estudio anterior8. Es probable que los casos de endocarditis derecha que no habían sido diagnosticados por haberlos confundido con infecciones respiratorias (y haber mejorado con el tratamiento antibiótico) fueran causados por gérmenes poco agresivos, como los estreptococos. Esto explicaría que Staphylococcus aureus sea el microorganismo más común en nuestra serie, puesto que las infecciones causadas por los gérmenes más agresivos sólo se diagnostican cuando el paciente no mejora al recibir tratamiento para una neumonía.
Las vegetaciones fueron una observación constante en nuestros pacientes. Además, éstas eran grandes como consecuencia de la menor presión ejercida por las cámaras cardiacas derechas, que permite que las vegetaciones crezcan más que en el lado izquierdo22.
Muchos estudios han relacionado las vegetaciones grandes y móviles con una incidencia elevada de embolias23,24, y ello puede explicar la presencia frecuente de embolias pulmonares en nuestra serie.
En la mayor parte de nuestros pacientes, el curso clínico fue satisfactorio con el tratamiento médico solo. La cirugía cardiaca fue necesaria en el 29% de los pacientes, porcentaje inferior al descrito en series anteriores8, probablemente a causa de las mejoras en el tratamiento antibiótico en las últimas décadas. Las causas de la cirugía fueron similares a las de la endocarditis derecha en general1,5,8,9. Todos los pacientes quirúrgicos tuvieron un curso clínico satisfactorio. A diferencia de lo que ocurre en los pacientes con ADVP, la reinfección de la prótesis valvular no es un problema frecuente en los pacientes sin ADVP2. Solamente 1 de nuestros pacientes presentó una recaída al cabo de 3 meses. La mortalidad causada por la enfermedad fue baja e inferior a la asociada a la endocarditis izquierda, si bien la comparación no alcanzó significación estadística, probablemente por la diferencia de tamaño muestral entre los dos grupos.
CONCLUSIONES
En resumen, nuestros resultados indican que la endocarditis derecha aislada debe incluirse en el diagnóstico diferencial de los pacientes con síndrome febril, síntomas respiratorios y una enfermedad predisponente (cáncer, inmunodeficiencia o insuficiencia renal crónica), incluso cuando no sean portadores de marcapasos y no tengan antecedentes de ADVP. La presencia de un catéter intravascular, los antecedentes recientes de una intervención quirúrgica y la bacteriemia por estafilococos deben reforzar la sospecha de endocarditis derecha. El pronóstico parece ser más favorable que el de la endocarditis izquierda.
ABREVIATURAS
ADVP: adicto a drogas por vía parenteral.
Full English text available from: www.revespcardiol.org
Este estudio fue financiado en parte por la Red Cooperativa de Investigación Cardiovascular (RECAVA) del Instituto de Salud Carlos III y por una beca de la Sociedad Castellano-Leonesa de Cardiología (SOCALEC).
Correspondencia: Dra. A. Revilla Orodea.
Departamento de Cardiología y Cirugía Cardíaca. Instituto de Ciencias del Corazón (ICICOR). Hospital Clínico Universitario.
Ramón y Cajal, 3-5. Valladolid. España.
Correo electrónico: arevillaorodea@gmail.com
Recibido el 15 de abril de 2008.
Aceptado para su publicación el 16 de septiembre de 2008.