Palabras clave
INTRODUCCIÓN
La terapia de resincronización cardiaca (TRC) es uno de los principales avances en el tratamiento de la insuficiencia cardiaca en los últimos años. Los beneficios obtenidos, tanto en la mejoría del estado funcional y calidad de vida del paciente como en la disminución del número de hospitalizaciones, han sido probados de modo consistente en ensayos clínicos1-4. Más recientemente, se ha demostrado en dos grandes ensayos multicéntricos5,6 su papel en la disminución de la mortalidad total a largo plazo.
Sin embargo, en todos los estudios hay un 20-30% de pacientes que no mejoran con la estimulación biventricular1,2. El problema de la falta de respuesta a la TRC es complejo y multifactorial7. La identificación de predictores clínicos8-10 de respuesta se hace más importante después de la gran variabilidad mostrada por los índices ecocardiográficos de asincronía ventricular11-13.
Otro de los aspectos fundamentales en el análisis de la respuesta a la TRC es el adecuado emplazamiento del electrodo ventricular izquierdo (VI). Habitualmente se utiliza la región lateral del ventrículo, que es la zona de mayor retraso en la activación eléctrica en un alto porcentaje de pacientes con bloqueo de rama izquierda del haz de His (BRIHH)14. Sin embargo, mientras en la miocardiopatía dilatada idiopática el patrón de activación eléctrica es más predecible, en la disfunción ventricular de etiología isquémica la presencia de áreas de necrosis determina patrones de activación más variables15-18. Los pacientes con trastorno en la conducción intraventricular y eje QRS normal pueden tener un patrón de activación ventricular diferente respecto a aquellos con eje QRS desviado a la izquierda en presencia de una miocardiopatía con severa depresión de la función sistólica VI.
El objetivo de este estudio es analizar la relación entre el eje eléctrico QRS y la respuesta a la TRC según las diferentes localizaciones del electrodo VI.
MÉTODOS
Criterios de inclusión
Se trata de un estudio prospectivo observacional en el que se ha incluido a 80 pacientes consecutivos remitidos al laboratorio de electrofisiología de nuestro centro para TRC entre agosto de 2001 y junio de 2006. Todos los pacientes se hallaban en clase funcional III/IV de la New York Heart Association (NYHA) bajo tratamiento médico óptimo para insuficiencia cardiaca, presentaban función sistólica VI deprimida (fracción de eyección [FE], < 35%) y duración del complejo QRS > 120 ms.
Implantación y programación
El implante del electrodo VI se realizó previo angiograma del seno coronario, buscando como objetivo la vena lateral o posterolateral, siempre que se consiguiesen umbrales de estimulación aceptables y ausencia de estimulación frénica. En caso de que dichas regiones fuesen inaccesibles, se procedió al implante del electrodo en la vena interventricular anterior. El dispositivo se programó en modo de estimulación DDDR en los pacientes en ritmo sinusal y VVIR en los que estaban en fibrilación auricular, intentando en estos últimos garantizar la mayor estimulación biventricular posible, ya fuera con fármacos o con ablación de nodo auriculoventricular. Tras el implante, los intervalos auriculoventricular y ventriculoventricular se optimizaron de modo individualizado guiados por parámetros ecocardiográficos de asincronía intraventricular izquierda.
Seguimiento y definiciones
Tras el implante del dispositivo, se realizó una evaluación completa de los pacientes a los 6 y a los 12 meses de seguimiento. La clase funcional fue determinada por un cardiólogo clínico independiente del cardiólogo implantador. Se consideró respondedores a los pacientes que cumplieron todos los criterios siguientes: mejorar al menos un grado en su clase funcional, incrementar al menos un 5% la FE del VI, no requerir hospitalización por insuficiencia cardiaca y seguir vivos a los 12 meses de seguimiento. No cumplir alguno de estos requisitos clasificó al paciente como no respondedor.
Las características electrocardiográficas, la duración del QRS y el eje eléctrico fueron determinados en el electrocardiograma (ECG) de 12 derivaciones (50 mm/s) inmediatamente antes y tras el implante del dispositivo de resincronización. Según el eje eléctrico QRS en el ECG preimplante, los pacientes se clasificaron en dos grupos: eje normal (entre -30° y +120°) y eje izquierdo (entre -30° y -90°). La medición del eje se realizó de forma automática y después un cardiólogo lo comprobó manualmente. Según la localización del electrodo ventricular izquierdo, se clasificó a los pacientes en tres grupos: anterior (vena interventricular anterior o colaterales), lateral (vena marginal o lateral) y posterior (vena posterolateral o vena cardiaca media). Para precisar mejor la ubicación anatómica de los electrodos, se describió su localización en la posición radiológica oblicua anterior izquierda, donde las venas tributarias del seno coronario radian como las agujas del reloj. Así se definieron según su posición en la esfera horaria entre la una y las cinco19.
Los datos ecocardiográficos fueron determinados con un equipo convencional (Sequoia C 256 Siemens AG, Múnich, Alemania). La FE se determinó siguiendo el método de Simpson en el plano apical de cuatro cámaras. La severidad de la insuficiencia mitral se determinó por el cociente entre el área máxima del chorro regurgitante por Doppler color y el área de la aurícula izquierda. Se clasificó a los pacientes en ligera (relación < 20%), moderada (20-40%) y severa (> 40%). Los coeficientes de variación intraobservador y entre observadores para la FE en nuestro laboratorio son del 3,5 y el 4,4%, respectivamente.
Análisis estadístico
Las variables cualitativas se expresan como número y porcentaje y las cuantitativas, como media ± desviación estándar. Para verificar si había diferencias significativas entre los grupos, se ha utilizado la prueba de la c2 de Fisher en caso de variables cualitativas y la prueba de la t de Student y la no paramétrica de Mann-Whitney en el caso de variables continuas. Para estimar los factores que predicen buena respuesta a la TRC, se ha utilizado un modelo de regresión logística. Las variables introducidas en el modelo son: edad, etiología, eje QRS preimplante, FE preimplante, insuficiencia mitral, localización del electrodo en la vena del seno coronario y la interacción entre el eje y la localización. A partir de los coeficientes de regresión se han calculado las odds ratio (OR) con su intervalo de confianza del 95%. Se consideran estadísticamente significativos los valores de p < 0,05.
RESULTADOS
De los 80 pacientes consecutivos referidos para TRC, en 2 (2,5%) fracasó el abordaje percutáneo, y hubo 4 (5,1%) muertes durante el año de seguimiento. Respondieron a la TRC 52 (66,7%) pacientes. Las características basales de los 78 pacientes restantes se indican en la tabla 1. La media de edad fue 70 ± 7 años, y 57 (73%) pacientes eran varones. Estaban en clase funcional III de la NYHA 67 (86%) y en clase IV, 11 (14%). La duración media del QRS preimplante fue de 172 ± 23 ms y la FE del VI, 27% ± 7%. La isquemia fue la causa de la miocardiopatía en 31 (40%) pacientes. El ritmo cardiaco era fibrilación auricular en 23 (29%) casos. Se realizó ablación del nodo auriculoventricular para garantizar la estimulación biventricular en 9 (39%) pacientes del grupo de fibrilación auricular. No se observaron diferencias significativas en las características clínicas basales con relación al eje eléctrico (tabla 2).
Respecto a la localización del electrodo ventricular izquierdo, en 27 (35%) pacientes se implantó en la vena lateral; en 18 (23%), en una vena posterior, y en 33 (42%), en la vena interventricular anterior. No se encontraron diferencias significativas en la localización del electrodo ventricular izquierdo con relación al eje (tabla 2). Todos los electrodos en el ventrículo derecho se localizaron en el ápex.
La relación entre las características clínicas basales y la respuesta a la TRC se muestra en la tabla 3. La respuesta a la TRC fue algo mejor en el grupo con eje izquierdo (72,7%) que en el grupo con eje normal (62,2%), aunque en el análisis univariable esta diferencia no alcanzó significación estadística (p = 0,331). La FE previa era más baja en los pacientes respondedores (25,7% ± 5,3%) que en los no respondedores (28,7% ± 5,5%) (p = 0,023). La respuesta fue mejor en pacientes con insuficiencia mitral previa (73,1%) que en aquellos sin insuficiencia mitral (46,2%) (p = 0,019). No se observaron diferencias significativas en la respuesta en relación con la clase funcional NYHA, la etiología isquémica o idiopática, el ritmo cardiaco, la reducción en la anchura del QRS, los trastornos de la conducción o la localización de la vena para el implante.
La posición anatómica en la proyección radiológica oblicua anterior izquierda de los electrodos implantados en la vena interventricular anterior fue: 23 (70%) estaban a la una; 8 (24%), a las dos, y 2 (6%), a las tres. Por lo tanto, un 30% de los electrodos estaban en una posición superior y lateral. En la vena lateral, 22 (81%) estaban a las tres; 4 (15%), a las cuatro, y 1 (4%) a las dos. En la vena posterior, 15 (83%) estaban a las cuatro; 2 (11%), a las tres, y 1 (6%), a las cinco.
Por lo tanto, la mayoría de los electrodos posteriores estaban en una posición inferior.
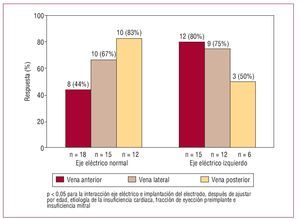
En los electrodos implantados en la vena interventricular anterior, se encontró un mayor número de respondedores cuando los pacientes presentaban un eje izquierdo; 12 (80%) pacientes con eje izquierdo respondieron a la TRC, frente a 8 (44,4%) de los pacientes con eje normal (p = 0,037). En los electrodos implantados en la vena lateral, no se encontraron diferencias significativas en la respuesta de los pacientes con eje izquierdo (75%) respecto a los que tenían un eje normal (66,7%). Tampoco se hallaron diferencias significativas en la respuesta en los electrodos implantados en la vena posterior según el eje fuera izquierdo (50%) o normal (83,3%) (fig. 1).
Fig. 1. Respuesta a la terapia de resincronización en relación con el eje eléctrico del QRS y la localización del electrodo ventricular izquierdo.
Siguiendo un modelo de regresión logística en el que se ajustó también por la edad, la respuesta a la TRC se asocia a un eje izquierdo (OR = 5,04 [IC del 95%, 1-29,2]; p = 0,050), FE baja (OR = 0,91 [IC del 95%, 0,84-0,99]; p = 0,033), insuficiencia mitral previa (OR = 3,45 [IC del 95%, 1,13-10,6]; p = 0,030) y etiología idiopática (OR = 1,86 [IC del 95%, 0,61-5,72]; p = 0,278) (tabla 4). Hay interacción entre las variables eje eléctrico y localización de electrodo (p = 0,026).
DISCUSIÓN
El hallazgo más relevante de nuestro estudio es la descripción del eje eléctrico del QRS, un parámetro electrocardiográfico sencillo, fácil de medir y reproducible, como predictor de la respuesta a la TRC. Además, y de especial importancia, hay que reseñar que se produce una interacción significativa en la respuesta a la TRC entre el eje eléctrico QRS y la localización del electrodo, de tal forma que los pacientes a los que se implanta un electrodo en la vena interventricular anterior tienen una mayor respuesta cuando el eje de QRS preimplante es izquierdo. Creemos que nuestros datos pueden tener implicaciones de relevancia clínica, en particular en la selección de pacientes con insuficiencia cardiaca para someterlos a TRC y en la optimización de la localización del electrodo VI.
Hemos encontrado que los pacientes con eje eléctrico izquierdo presentan una respuesta más favorable que aquellos con eje eléctrico normal. Este mejor pronóstico se observa después de ajustar por la edad del paciente y otros parámetros que influyen en la respuesta a esta terapia. Sin embargo, estos resultados pueden deberse, en parte, a que el porcentaje de electrodos implantados en la vena anterior es elevado (42%), y es con esta localización que los pacientes con eje izquierdo presentan mayor respuesta respecto a los pacientes con eje normal.
La identificación de predictores de respuesta a la TRC es una tarea no resuelta. Se han estudiado predictores ecocardiográficos y clínicos7-9,20-26. Probablemente, la comunicación de los resultados del estudio PROSPECT, en que se pone de manifiesto una gran variabilidad entre observadores de los parámetros ecocardiográficos que evalúan la asincronía mecánica intraventricular izquierda, hace que se vuelva a concentrar el interés en los parámetros clínicos como marcadores de respuesta a la TRC13. Entre éstos, existen referencias sobre la etiología de la insuficiencia cardiaca5-6,27, la duración del complejo QRS previo8,20-26, la reducción del QRS8,20-26 y el péptido natriurético cerebral preimplante28, entre otros. Sin embargo, no encontramos ninguna referencia en relación con el eje eléctrico QRS preimplante. Solamente se ha descrito la evidencia de un remodelado eléctrico en el sistema de conducción nativo inducido por la resincronización caracterizado por una reducción de la duración del QRS y una desviación del eje QRS a la izquierda29.
Estas variaciones reflejan probablemente cambios en el sistema de conducción y en la transmisión intramiocárdica del impulso cardiaco y son consecuencia de la acción crónica de la estimulación biventricular.
Se ha descrito la etiología isquémica como un factor independiente de ausencia de respuesta clínica a la TRC. Esta peor respuesta parece deberse a la presencia de áreas de cicatriz o de baja perfusión que no responden a la estimulación8. Sin embargo, en los dos grandes estudios clínicos CARE HF6 y COMPANION5, el beneficio de la TRC fue independiente de la etiología de la cardiopatía, y más recientemente, Vidal et al27 no hallaron diferencias en la respuesta clínica ni en el grado de remodelado ventricular inverso entre los pacientes de etiología isquémica y los de etiología dilatada idiopática. En nuestro estudio el porcentaje de no respondedores fue mayor entre los pacientes isquémicos, aunque sin alcanzar significación estadística. Tampoco se encontró asociación entre el eje eléctrico y la etiología. Más aún, el porcentaje de pacientes isquémicos fue mayor en el grupo con eje desviado a la izquierda (42%) que en el grupo con eje normal (38%), lo que descarta la etiología como una potencial variable de confusión en la relación entre respuesta a la TRC y eje eléctrico del corazón.
Diversas publicaciones describen con resultados variables la utilidad de la duración del QRS basal preimplante y de la reducción de la duración del QRS con estimulación biventricular, para predecir la respuesta a la TRC8,9,20-26,30. Incluso se ha descrito beneficio clínico y en la función VI, en pacientes con insuficiencia cardiaca, duración del QRS normal y evidencia ecocardiográfica de asincronía interventricular e intraventricular izquierda31. En nuestro estudio no encontramos diferencias significativas en la respuesta clínica con relación a la duración del QRS basal. Respecto a la reducción de la duración del QRS con la estimulación biventricular, se ha publicado una mayor reducción entre los respondedores, pero no se ha podido establecer un punto de corte que discrimine qué pacientes van a responder, y probablemente haya que ajustar su valor al QRS basal, ya que reducciones de la misma magnitud pueden tener respuestas diferentes según la anchura del QRS preimplante. En nuestro estudio no hemos encontrado diferencias significativas en la respuesta clínica con relación a la reducción del QRS, si bien la reducción fue mayor en los pacientes respondedores. Aunque sin alcanzar significación estadística, la reducción del QRS también fue mayor en el grupo con eje izquierdo, lo que indicaría que tal vez éste sea uno de los posibles mecanismos por el que los pacientes con eje izquierdo tengan una mejor respuesta.
La localización de la estimulación en VI asociada a un mayor beneficio de respuesta clínica genera controversia8,24. Actualmente se acepta que el electrodo VI debe posicionarse en la pared libre, ya que la vena lateral y la posterolateral drenan este territorio17,18. En el análisis univariable no encontramos asociación entre el lugar de estimulación en la vena del seno coronario y la respuesta clínica. Sin embargo, cuando estratificamos por eje eléctrico de QRS, observamos una mejor respuesta en la vena anterior y lateral en pacientes con eje de QRS desviado a la izquierda y una mejor respuesta en la vena posterior en pacientes con eje de QRS normal (p = 0,026). Esta observación puede deberse al patrón de activación ventricular diferente según el eje eléctrico de QRS en pacientes con trastorno de conducción intraventricular y disfunción sistólica del VI severa. A pesar de no hallar diferencias significativas en la anchura del QRS preimplante entre ambos grupos, planteamos la posibilidad de un mayor retraso en la activación de la región superior y lateral del ventrículo izquierdo en los pacientes con eje de QRS desviado a la izquierda y, por lo tanto, una mejor respuesta a la TRC cuando el electrodo se implanta en la vena interventricular anterior, cuya posición es también superior y sobre todo si el electrodo se emplaza en una colateral de la vena interventricular anterior, que permite una ubicación más lateral. En nuestro estudio un 30% de los electrodos implantados en la vena interventricular anterior estaban en posición superior y lateral, lo que probablemente permita una mejor resincronización entre los segmentos basales y los apicales. Este mecanismo es el que sustenta la estimulación biventricular en tres localizaciones, en la que dos electrodos se implantan en el VI32.
Creemos que estos hallazgos son interesantes, particularmente el de la interacción. Se abre una nueva vía con implicaciones clínicas que otros investigadores pueden corroborar o refutar en futuros estudios que incluyan un mayor número de procedimientos y en diferentes entornos.
Limitaciones
La definición de respuesta clínica a la TRC se estableció en la mejoría de un grado en la clase funcional en ausencia de hospitalizaciones por insuficiencia cardiaca durante el período de seguimiento del estudio (12 meses), y no se realizaron otras mediciones tales como el test de los 6 min caminando o la determinación del consumo máximo de oxígeno.
Se incluyó a los pacientes con fibrilación auricular, y se realizó ablación del nodo auriculoventricular a aquellos con frecuencias ventriculares altas (39%), por lo que estos pacientes podrían haber mejorado por el efecto combinado de ambas terapias.
Al tratarse de un estudio observacional, en el que la implantación de los electrodos no se aleatorizó, puede haber otras variables que pueden influir en el efecto de la localización del electrodo en la respuesta a la TRC.
CONCLUSIONES
Se objetiva una interacción entre la localización del electrodo y el eje eléctrico de QRS preimplante, de tal forma que se observa una mayor respuesta a la TRC en pacientes a quienes se implanta el electrodo en la vena interventricular anterior y el eje está desviado a la izquierda. Con la estrategia habitual de implantación, los pacientes en quienes no es posible implantar el electrodo en la vena lateral o posterolateral pueden verse especialmente beneficiados del implante en la vena anterior si el eje eléctrico preimplante es izquierdo.
ABREVIATURAS
ECG: electrocardiograma.
FE: fracción de eyección.
TRC: terapia de resincronización cardiaca. VI: ventrículo izquierdo.
VÉASE EDITORIAL EN PÁGS. 1236-8
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. F.J. García Seara.
Mónaco, 21, 2.o A. 15703 Santiago de Compostela. A Coruña. España.
Correo electrónico: javiergarciaseara@yahoo.es
Recibido el 26 de febrero de 2008.
Aceptado para su publicación el 2 de julio de 2008.