Palabras clave
INTRODUCCION
Los síndromes coronarios agudos (SCA) son una complicación infrecuente1 en los pacientes con endocarditis, tanto en el momento agudo como en períodos posteriores. Por esta razón, el tratamiento más adecuado es desconocido.
El objetivo de este estudio es describir las características epidemiológicas, clínicas, microbiológicas, ecocardiográficas y evolutivas de los pacientes que tuvieron un SCA en el seno de una endocarditis y proponer un esquema terapéutico para estos pacientes.
MÉTODOS
Grupo de pacientes
Se han incluido, de forma prospectiva y consecutiva, los episodios de pacientes ingresados en 5 hospitales con el diagnóstico de endocarditis definitiva según los criterios de la Universidad de Duke, desde junio de 1995 hasta diciembre de 2005. Todos los hospitales disponían de servicio de cirugía cardiaca. Los episodios se recogieron en una hoja de recogida de datos común y se incorporaron a una base de datos general. Para el presente estudio se han analizado 586 episodios de endocarditis, de los cuales 481 eran episodios de endocarditis izquierdas pertenecientes a 460 pacientes. En esta serie, 14 pacientes presentaron un SCA y son el objeto de nuestro estudio.
En todos los casos se ha recogido información acerca de las características demográficas (edad, sexo, procedencia), la presencia de cardiopatía previa predisponente, las enfermedades subyacentes, el factor desencadenante, las manifestaciones clínicas de presentación y las alteraciones analíticas. También se han registrado los datos microbiológicos, el número de hemocultivos, el tipo de microorganismo, los estudios de sensibilidad, la sinergia y la serología. Los hallazgos de la ecocardiografía, tanto transtorácica como transesofágica, se han consignado junto con la lesión valvular. Asimismo, se recogió el tipo de tratamiento antibiótico aplicado, su duración y los datos referidos a la evolución clínica. En los casos en los que se realizó cirugía cardiaca se registraron la indicación y el tipo de intervención. Finalmente, se consignó la fecha de alta o de muerte y su causa.
Definiciones
Hemos considerado como SCA a la presencia de dolor torácico típico acompañado de al menos uno de los siguientes signos: alteraciones del electrocardiograma (ECG) y/o alteración de los marcadores enzimáticos, siguiendo una curva típica2,3.
Las definiciones ecocardiográficas de vegetación, absceso, seudoaneurisma y fístula ya han sido expuestas en trabajos previos4.
Análisis estadístico
Los datos se expresan como frecuencias absolutas o porcentajes en el caso de las variables cualitativas. Las variables cuantitativas se describen con la media ± desviación estándar (DE) o la mediana y el rango intercuartílico (RIQ) según sigan una distribución normal o no. En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos y se contrastó la hipótesis de homogeneidad de varianzas.
Se evaluó la asociación de variables cualitativas con el test de la χ² o la prueba exacta de Fisher, según esté indicado. La asociación entre variables cuantitativas se evaluó mediante el test no paramétrico de la U de Mann-Whitney.
En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo 1 o un error α < 5% (p < 0,05).
El paquete informático utilizado para el análisis fue el SPSS versión 12.0
RESULTADOS
Características clínicas
De los 586 episodios de endocarditis infecciosa diagnosticados en nuestros hospitales, 481 correspondían a endocarditis sobre válvulas izquierdas. De ellos, 14 (2,9%) se complicaron con un SCA. La edad media de estos pacientes fue de 50 ± 17 años, había 10 pacientes < 70 años (71%) y 12 varones (85%). Se conocía la existencia de cardiopatía previa en 10 casos (71%): 7 válvulas protésicas, un prolapso mitral y 2 válvulas degenerativas. Además, 3 de los pacientes habían tenido una endocarditis previa. La distribución de cardiopatías previas en el grupo sin SCA fue la siguiente: 51 válvulas reumáticas (11%), 182 válvulas protésicas (39,3%), 47 enfermedades degenerativas (10,2%), 24 cardiopatías congénitas (5,2%) y 17 prolapsos mitrales (3,7%), sin diferencias significativas. De los 14 episodios con SCA, 9 eran de origen comunitario (64%), 4 pacientes eran usuarios de drogas por vía parenteral (UDVP) y 3 de ellos estaban infectados por el virus de la inmunodeficiencia humana (VIH). En la serie general había 21 pacientes UDVP (4,5%) y 14 (3%) eran portadores del VIH. La mayoría de los pacientes con SCA no tenía factores desencadenantes (71%), en 2 había antecedentes de manipulación dental, en uno de cirugía previa y otro era portador de un catéter intravascular. Presentaban distintas comorbilidades: 4 estaban inmunodeprimidos (28%), uno tenía antecedentes de alcoholismo (7%), uno era diabético (7%), uno tenía criterios de enfermedad pulmonar obstructiva crónica (7%), 2 tenían anemia crónica (14%) y 2 insuficiencia renal (14%); uno de estos últimos estaba en un programa de diálisis.
La manifestación clínica más frecuente en el momento del ingreso fue la fiebre, que ocurrió en todos los pacientes, acompañada de tiritona en la mitad de los casos. El dolor torácico fue el motivo de consulta en 5 pacientes. Otros síntomas frecuentes fueron la aparición de un nuevo soplo en 8 pacientes y la presencia de disnea en 7. Sólo un paciente se presentó con insuficiencia cardiaca y estaba en clase funcional II, y otro lo hizo con shock séptico. Las características clínicas de ambos grupos están reflejadas en la tabla 1.
La endocarditis se presentó de forma aguda en la mayor parte de los pacientes: en los primeros 15 días en 10 (71%), entre el primer y el segundo mes en 2 (14%), y en 2 pacientes la presentación fue más tardía, alrededor de los 3 meses.
Microbiología
Se pudo aislar el germen causal en 11 de los episodios (78,6%). La identificación del microorganismo causal se consiguió mediante hemocultivo en todos los pacientes excepto en uno, en el cual se aisló el germen en el cultivo de la válvula. La distribución de los gérmenes causales fue la siguiente: Staphylococcus aureus en 5 casos, Staphylococcus epidermidis en 1, Streptococcus viridans en 2, Propionibacterium acnes en uno, Candida spp. en uno y polimicrobiana (S. aureus y Candida spp.) en uno. La distribución etiológica de ambos grupos se expone en la tabla 2.
Lesión valvular y hallazgos ecocardiográficos
Las vegetaciones se objetivaron mediante ecocardiografía transesofágica (ETE) en todos los pacientes excepto en 2, uno cuyas vegetaciones se documentaron en la necropsia y otro que no presentó vegetaciones sino tan sólo complicaciones perianulares. En 7 pacientes las vegetaciones se habían detectado previamente por ecocardiografía transtorácica. En nuestra serie, la localización más frecuente de la infección fue la válvula aórtica en 12 casos (85,7%), según muestra la siguiente distribución: 4 válvulas aórticas nativas, 6 válvulas aórticas protésicas (2 mecánicas y 4 biológicas), una válvula mitral nativa y 3 afecciones multivalvulares (prótesis mitral y válvula tricúspide nativa; válvula aórtica y tricúspide nativas, y válvula aórtica y mitral nativas). Hubo 5 episodios de endocarditis protésica precoz y 2 de endocarditis protésica tardía. De nuestra serie, 10 pacientes presentaron complicaciones perianulares (4 abscesos, 6 seudoaneurismas y una fístula desde la aorta al tracto de salida del ventrículo izquierdo). El paciente que presentó la fístula había tenido previamente un absceso de gran tamaño. Respecto a la disfunción valvular, 13 casos tuvieron insuficiencia valvular al menos moderada (9 severa y 4 moderada) y se objetivó estenosis de grado moderado en un paciente portador de una prótesis biológica.
Se halló la mediana de los tamaños máximos de las complicaciones perianulares en los pacientes con SCA, que fue de 32,5 mm (30,0-45,75 mm), mientras que en los pacientes que no presentaron SCA la mediana fue de 12,0 mm (10,0-20,0 mm) (p = 0,001). También se halló la mediana de los tamaños máximos por separado de abscesos y seudoaneurismas. La mediana de los abscesos en los pacientes que presentaron SCA fue de 30 mm (23,25-33,75 mm), mientras que en los pacientes sin SCA fue de 11,5 mm (10,0-19,25 mm) (p = 0,005). La mediana de los seudoaneurismas en los pacientes con SCA fue de 39 mm (30,0-48,0 mm), y en los pacientes sin SCA de 10,5 mm (10,0-20,0 mm) (p = 0,001). Respecto al tamaño de las vegetaciones, en los pacientes con SCA la mediana fue 11,5 mm (7,75-18,25 mm), mientras que en los pacientes sin SCA la mediana fue de 14,5 mm (9,0-20,0 mm) (p = 0,486).
Mediante ETE se pudo documentar que la localización de la complicación perianular, bien absceso o seudoaneurisma, se disponía entre las 12 y las 3 del anillo aórtico en 6 de los casos, mientras que en otro la localización del absceso fue circunferencial. En 4 de los casos se pudo observar que dichas complicaciones perianulares, además de comprimir el tronco de la arteria coronaria izquierda, también producían un aumento de la velocidad del flujo diastólico coronario mediante la técnica Doppler.
Curso clínico
En la evolución clínica, 6 pacientes (42,85%) presentaron insuficiencia cardiaca y 5 tuvieron embolias sépticas (35%), 4 antes del tratamiento y uno, después. La localización de las embolias fue la siguiente: 3 en el sistema nervioso central (SNC), una en el bazo, una en los miembros inferiores y tres en las arterias coronarias. Los 3 pacientes con embolia coronaria habían tenido una embolia previa, uno en el SNC, otro en el bazo y el último en los miembros inferiores. Además, 2 pacientes desarrollaron bloqueo auriculoventricular (BAV) completo, 5 pacientes presentaron shock cardiogénico en algún momento de la evolución y 4 tuvieron signos de infección persistente. Un paciente que ya había presentado derrame pericárdico en el momento del ingreso evolucionó a taponamiento cardiaco y requirió una pericardiocentesis. El curso clínico de ambos grupos se muestra en la tabla 3.
Nueve pacientes precisaron cirugía cardiaca (64%), 7 de forma urgente y 2 electiva. La indicación de cirugía cardiaca fue multifactorial en la mayoría de los casos y las causas fundamentales fueron la disfunción valvular severa en 6 pacientes (42%) y la presencia de complicaciones perivalvulares en 8 (57%). Otras razones para remitir el paciente a cirugía fueron la presencia de insuficiencia cardiaca en 2 pacientes, embolias múltiples en 2 y a causa del propio germen en otros 2 pacientes. Los pacientes que no fueron intervenidos no lo fueron por distintas razones: un paciente falleció antes de la cirugía, un paciente portador de VIH se negó a ser intervenido y otro paciente tenía retraso mental y la familia desestimó la cirugía, falleciendo ambos. Otros dos pacientes no tenían indicación de cirugía y no murieron durante el seguimiento realizado.
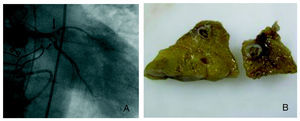
Nueve pacientes fallecieron (64%), de los cuales disponemos de necropsia en 4 (fig. 1). Cinco de los pacientes que murieron habían precisado cirugía urgente. La causa de la muerte fue en 8 de ellos el propio SCA (por shock cardiogénico o insuficiencia cardiaca) y en uno de ellos, fracaso multiorgánico.
Fig. 1. A: Imagen de la oclusión distal del tronco coronario izquierdo por la vegetación aórtica. B: cortes anatómicos de la arteria descendente anterior del mismo paciente, donde se objetiva la vegetación en su interior.
Como se expone en la tabla 3, en los pacientes con SCA fue más frecuente la presencia de complicaciones perianulares y de BAV. Durante la evolución clínica estos pacientes tuvieron insuficiencia cardiaca y shock cardiogénico con más frecuencia que los que no tenían SCA. La mortalidad fue también mayor en los pacientes con SCA.
Síndrome coronario agudo
Respecto al momento de aparición del SCA, en la mayoría de ellos ocurrió en la primera semana del diagnóstico. De hecho, el SCA fue el motivo de ingreso en 5 pacientes y apareció en la primera semana en otros 5. En 2 pacientes se produjo en la segunda semana y otros 2 tuvieron una presentación más tardía, uno a las 3 semanas del ingreso y el último paciente a los 3 meses de finalizado el tratamiento antibiótico, mientras esperaba la cirugía de forma electiva por disfunción valvular y complicaciones perivalvulares.
Las causas del SCA fueron embolias coronarias sépticas en 3 de los casos, mientras que en la mayoría de las ocasiones la causa fue la compresión externa de las coronarias secundaria a complicaciones perianulares (abscesos y seudoaneurismas en 8 pacientes), un paciente presentaba enfermedad severa multivaso previa a la endocarditis y ya había tenido más episodios de SCA, y en los 2 restantes no se pudo especificar la causa, que quizá fuera multifactorial: insuficiencia aórtica severa, fiebre, anemia y/o sepsis. Uno de los pacientes que tuvo un SCA de origen embólico también presentaba un absceso periaórtico de gran tamaño.
Respecto a los factores de riesgo cardiovascular, disponemos de datos de los últimos 10 pacientes, de los cuales sólo uno era diabético, 4 tenían hipertensión, 4 dislipidemia y 3 eran fumadores o exfumadores.
Los hallazgos electrocardiográficos están representados en la tabla 4. Se objetivó infradesnivelación del segmento ST en 4 pacientes (2 de localización anterolateral, uno inferolateral y uno anterior), supradesnivelación del segmento ST en 4 de los episodios (2 de localización anterolateral y 2 inferolateral). En un paciente sólo se documentó inversión de las ondas T. Un paciente presentó un bloqueo de rama izquierda del haz de His no conocido y BAV de primer grado que evolucionó rápidamente a BAV completo. Además, 2 pacientes presentaron taquicardia ventricular en el contexto del SCA. Al menos 7 de ellos tuvieron marcadores enzimáticos de necrosis miocárdica elevados, con gran variabilidad en sus valores. La troponina osciló desde 0,23 hasta 10 ng/ml, y la creatincin asa de 295 a 2.895 U/l. En los primeros pacientes de esta serie no disponemos de los valores de la troponina.
En 8 pacientes se documentó la presencia de coronarias sin lesiones arterioescleróticas significativas, bien mediante cateterismo en el momento del SCA (3 pacientes) o en una coronariografía previa (menos de un año, un paciente) o bien en la necropsia (4 pacientes). En un paciente se llevó a cabo una angioplastia para intentar dilatar la arteria ocluida por el émbolo séptico; no se realizó fibrinólisis en ningún caso. Un paciente con enfermedad severa multivaso fue revascularizado mediante cirugía a la vez que se llevó a cabo la sustitución valvular.
DISCUSION
Distintos autores han descrito una elevada incidencia (hasta un 90%) de infartos miliares y microembolias en los pacientes con endocarditis5-8. Por otro lado, la obstrucción de las arterias coronarias epicárdicas o de sus ramas principales con repercusión clínica (SCA) es una complicación muy poco frecuente de la endocarditis izquierda que ha sido reseñada ocasionalmente en la bibliografía1,9-13.
Infartos miliares
En 1950, Saphir et al14 revisaron los datos histológicos y electrocardiográficos de 76 pacientes con endocarditis y encontraron alteraciones intramiocárdicas en todos ellos, áreas de infiltrado inflamatorio, degeneración miocítica, fibrosis perivascular, pequeñas cicatrices en varios estadios de reparación, infartos miliares, abscesos y microembolias sépticas y asépticas. La correlación electrocardiográfica fue más bien escasa y se hizo evidente que estas lesiones ocurren con mucha más frecuencia de la que se detecta clínicamente. Este dato ha sido ratificado por otros autores5-8. En uno de estos estudios5, los autores encontraron focos de necrosis en los músculos papilares en el 58% de los 38 casos en que se efectuaron secciones histológicas múltiples. Doce pacientes tuvieron una embolia coronaria y en 9 de ellos solamente las pequeñas ramas coronarias intramurales estaban afectadas. En algunos enfermos con infartos miliares y microembolias, las células endoteliales de los capilares y las arteriolas coronarias están edematosas, hay infiltrados celulares perivasculares, arteriolitis e incluso necrosis de la media o la adventicia arteriolar. Otro estudio más reciente15 demuestra de nuevo que los infartos miliares son un hallazgo de la necropsia con poca o ninguna traducción clínica. Debido a la discrepancia entre la baja incidencia de embolia coronaria y la alta frecuencia de estas lesiones miocárdicas, se han involucrado otros factores en la etiología de estas lesiones, como las toxinas bacterianas o la invasión tisular directa por microorganismos o depósitos de inmunocomplejos circulantes.
Síndrome coronario agudo
La incidencia de SCA en la endocarditis infecciosa es difícil de estimar. En una serie rusa con 104 pacientes, 11 (10,6%) tuvieron un infarto como resultado de una embolia séptica16. En nuestra serie de 586 episodios de endocarditis, la incidencia de SCA fue de un 2,9%. Se trata de una complicación grave de la endocarditis; en nuestra serie falleció el 64% de los pacientes. Algún caso incluso ha requerido trasplante cardiaco por disfunción ventricular e insuficiencia cardiaca17. En un estudio muy reciente, el incremento de los valores de troponina T en el seno de una endocarditis fue predictor de un aumento de mortalidad y de accidente cerebrovascular18. Habitualmente, el SCA ocurre de manera precoz en el curso de la enfermedad; de hecho, el paciente puede presentar un SCA como manifestación inicial o éste puede aparecer durante los primeros días del ingreso. No obstante, también puede ocurrir después de haber finalizado el tratamiento, tal y como sucedió en uno de nuestros pacientes. Es más frecuente en los enfermos con infección valvular aórtica y no es específico de ningún microorganismo en particular1,10,11,19 aunque en nuestra serie se asoció más con microorganismos virulentos.
La presentación y la evolución clínica del SCA de los pacientes con endocarditis son similares a las observadas en los individuos con arteriopatía coronaria arterioesclerótica1. En la mayoría de los casos el infarto es anterior o anterolateral, y tan sólo hemos encontrado un caso en la bibliografía con un infarto inferior puro20. Muchos de estos pacientes tienen embolias en otras localizaciones (riñón, bazo, etc.)21,22. En esta serie, el mecanismo más frecuente de isquemia miocárdica fue la compresión coronaria por complicaciones perianulares aórticas (abscesos y seudoaneurismas) de gran tamaño, sobre todo cuando están situadas entre las 12 y las 3 del anillo aórtico. Otros autores también han documentado este tipo de complicación23-26. Algunos grupos han encontrado que el mecanismo patogénico más común del SCA en la endocarditis es la embolia coronaria16,27. Otros mecanismos menos frecuentes de isquemia miocárdica en el seno de una endocarditis son: obstrucción del ostium coronario por una gran vegetación16, como en casos de endocarditis fúngica con grandes vegetaciones; coexistencia de lesiones arterioescleróticas coronarias que se ponen de manifiesto durante la infección activa de la enfermedad y en la que intervienen la anemia, la fiebre y la activación del sistema de la coagulación en un paciente séptico, y la existencia de una regurgitación aórtica aguda grave que por sí misma puede causar isquemia miocárdica por disminución de la presión de perfusión coronaria y reducción de la reserva coronaria28 (tabla 5).
El tratamiento del SCA en estos casos se complica por el mayor riesgo que conlleva la terapia con anticoagulantes y trombolíticos en los pacientes con endocarditis. En algún caso, estos fármacos han tenido éxito29, pero en la mayoría de los pacientes se han acompañado de hemorragias cerebrales con un desenlace fatal1,9-12. Por esta razón, para algunos autores12 y también para nosotros mismos la endocarditis es una contraindicación para el uso de trombolíticos.
Aunque según la experiencia de algunos investigadores30 la realización de una coronariografía en la endocarditis es un procedimiento seguro, nosotros creemos que en el seno de una endocarditis aórtica activa existe riesgo de que se puedan desprender fragmentos de la vegetación si el catéter contacta con la superficie valvular o al efectuar la inyección de contraste. Por esta razón, y tras los resultados de estos estudios, ante un paciente con un SCA y endocarditis nuestro procedimiento diagnóstico inicial de elección es la ETE; si hay complicaciones perianulares, sobre todo sin elevación del segmento ST en el ECG, el paciente es remitido a cirugía sin coronariografía previa, pues lo más probable es que la isquemia sea secundaria a la compresión extrínseca del tronco coronario izquierdo o del segmento proximal de la arteria descendente anterior. Si, por el contrario, no se detectan abscesos ni seudoaneurismas aórticos o en el ECG se observa un ascenso del segmento ST, se practica una coronariografía diagnóstica. En caso de que se demuestre una oclusión coronaria, nosotros optamos por la reperfusión mecánica por medio de angioplastia con balón y colocación de un stent si es necesario (fig. 2). Diferentes autores han descrito la aparición posterior de un aneurisma micótico en el lugar de la angioplastia1,31,32. Por tanto, aconsejamos que se realice un seguimiento angiográfico tras la realización de la angioplastia. En caso de que se documentara un aneurisma micótico coronario, sería una indicación de cirugía por su tendencia a la rotura31,33.
Fig. 2. Tratamiento del síndrome coronario agudo en los pacientes con endocarditis infecciosa. ACTP: angioplastia coronaria transluminal percutánea; ETE: ecocardiografía transesofágica; SCA: síndrome coronario agudo.
CONCLUSIONES
En la actualidad, el SCA es una complicación poco frecuente de los pacientes con endocarditis. Habitualmente, tiene lugar en la fase aguda de la enfermedad (primeros 15 días) y se asocia más con microorganismos virulentos, infección valvular aórtica, insuficiencia valvular grave y complicaciones perianulares de gran tamaño. El mecanismo de isquemia miocárdica es variable, pero la compresión coronaria extrínseca por dichas complicaciones perianulares es frecuente. Este síndrome, en el seno de la endocarditis, conlleva una elevada mortalidad.
Correspondencia: Dr. I. Vilacosta.
Instituto Cardiovascular. Hospital Universitario San Carlos.
Martín Lagos, s/n. 28040 Madrid. España.
Correo electrónico: mcmanzano@lycos.es
Recibido el 24 de marzo de 2006.
Aceptado para su publicación el 14 de septiembre de 2006.