El significado pronóstico a largo plazo del patrón de dominancia coronaria en pacientes con infarto de miocardio con elevación del segmento ST está mal caracterizado. Se investigó el pronóstico de esos pacientes según tuvieran dominancia derecha, izquierda o codominancia.
MétodosEstudio retrospectivo de 767 pacientes, ingresados entre 2007 y 2012 por infarto de miocardio con elevación del segmento ST y tratados con intervencionismo coronario percutáneo primario. Se determinó el impacto del patrón de dominancia coronaria, en la mortalidad por cualquier causa y los reingresos por infarto ajustando por mortalidad como evento competitivo.
ResultadosLa dominancia coronaria fue derecha en el 80,9% e izquierda en el 8,6%. Durante 40,8 [intervalo intercuartílico, 21,9-58,3] meses de seguimiento, se registraron 118 (15,4%) muertes, 39 (5,1%) de ellas, intrahospitalarias. La mortalidad fue del 7,1, el 36,4 y el 13,8% (p < 0,001) en dominancia derecha, izquierda y codominancia, respectivamente. La causa de muerte fue cardiovascular en el 7,1, el 21,2 y el 2,4%. En el análisis multivariable de Cox, la dominancia izquierda se asoció significativamente con la mortalidad (hazard ratio = 1,76; p = 0,02). Considerar «dominancia coronaria» en la predicción de riesgo de muerte mejoró la capacidad de discriminación y calibración de la puntuación GRACE (Global Registry of Acute Coronary Events). El 9,3% (71 pacientes) presentó reinfarto durante el seguimiento. En el análisis multivariable, la dominancia izquierda fue predictora independiente de reinfarto (sub-hazard ratio = 2,06; p = 0,01).
ConclusionesEn el infarto con elevación del segmento ST tratado con intervencionismo coronario percutáneo primario, la dominancia izquierda confiere mayor riesgo de muerte y reinfarto que la dominancia derecha, y debería tenerse en cuenta en la estratificación pronóstica.
Palabras clave
La dominancia coronaria (DC) izquierda y la codominancia se describen generalmente como una variante de la anatomía normal, con una prevalencia de la DC izquierda de alrededor de un 7-10% de la población general1,2. Los pacientes con DC izquierda tienen una arteria coronaria derecha no dominante que suministra sangre tan solo al ventrículo y la aurícula derechos, mientras que el ventrículo izquierdo se abastece completamente del árbol coronario izquierdo. De este modo, en pacientes con DC izquierda, ante una oclusión coronaria, habría mayor área de miocardio en riesgo que en pacientes con DC derecha, lo cual podría condicionar negativamente su pronóstico.
Existen pocos estudios clínicos sobre la relevancia pronóstica del patrón de DC en pacientes con un síndrome coronario agudo (SCA). Además, en el contexto del infarto agudo de miocardio (IAM) con elevación del segmento ST (IAMCEST), la importancia pronóstica a largo plazo del patrón de DC sigue estando mal caracterizada, con datos discordantes sobre su significado pronóstico3,4.
El objetivo de este trabajo es valorar la relación entre el patrón de DC y la mortalidad y el reingreso por un nuevo IAM (reIAM) ajustando por mortalidad como episodio competitivo.
MÉTODOSPoblación de estudioEstudio de cohortes retrospectivo basado en el registro CardioCHUS, que incluye a todos los pacientes ingresados por SCA consecutivamente en el Servicio de Cardiología del Complejo Hospitalario Universitario de Santiago de Compostela desde diciembre de 2003 a septiembre de 2012 (n = 5.532). En el presente subestudio del registro CardioCHUS, se incluye entre julio de 2007 y septiembre de 2012 —periodo que se considera que representa el manejo contemporáneo del IAMCEST— a los pacientes consecutivos con diagnóstico principal de IAMCEST y datos disponibles sobre el patrón de DC tratados con intervencionismo coronario percutáneo (ICP) primario. La población inicial del presente subestudio se componía de 1.084 pacientes con el diagnóstico principal de IAMCEST; de ellos, el tratamiento inicial fue ICP primario para 769. No se pudo determinar el patrón de DC de 2 pacientes, por lo cual se los excluyó. Así, la población final del presente estudio es de 767 pacientes.
Definición de variables en el estudioSe definió IAMCEST en presencia de síntomas que lo indicaran y elevación del segmento ST ≥ 1mm en al menos dos derivaciones contiguas, bloqueo de rama izquierda nuevo o presumiblemente nuevo y elevación de troponina I cardiaca (salvo casos de muerte precoz antes de realizarse determinaciones de laboratorio).
Las lesiones coronarias detectadas en la coronariografía invasiva se consideraron significativas en presencia de estenosis ≥ 70% valoradas visualmente a criterio del hemodinamista responsable. Este porcentaje equivale a una estenosis del 50% mediante el método de análisis cuantitativo5. Las lesiones del tronco común izquierdo se consideraron significativas si eran ≥ 50%.
La DC se definió según la arteria coronaria de la que nacen la arteria descendente posterior y las ramas posterolaterales. La DC se clasificó en derecha, izquierda y en codominancia. La información sobre la DC se obtuvo revisando los informes de coronariografía.
Se definió ICP fallido en presencia de flujo TIMI (Thrombolysis In Myocardial Infarction) final < III o estenosis residual > 30%. La cuantificación de la fracción de eyección del ventrículo izquierdo se realizó durante la hospitalización por ecocardiografía según el método de Simpson. El estudio se realizó de acuerdo con los principios de la Declaración de Helsinki.
Objetivo y seguimientoEl objetivo del estudio es estudiar el efecto pronóstico del tipo de DC en la mortalidad total y la causa de la muerte a largo plazo, así como en el reIAM (no mortal) ajustando por mortalidad como evento competitivo, en pacientes con IAMCEST tratados con ICP primario.
Tras el alta, se siguió a los pacientes en una consulta monográfica de cardiopatía isquémica y por atención primaria. El seguimiento estructurado se realizó a través de la historia electrónica (única en la comunidad autónoma de Galicia, programa IANUS), revisándose todas las asistencias médicas y los registros hospitalarios y recurriendo en determinados casos al contacto telefónico.
Para la clasificación de la causa de muerte, se ha empleado la misma clasificación de las causas de muerte que el grupo ha usado previamente6. Se definió muerte de origen cardiovascular (cardiaca y vascular no cardiaca) como la debida a muerte súbita, insuficiencia cardiaca refractaria, SCA, síndrome aórtico agudo, tromboembolia pulmonar, sistémica o cerebral o enfermedad vasculorrenal (fallo renal en ausencia de glomerulopatías u otras alteraciones parenquimatosas). Las demás causas de muerte disponibles se consideraron de origen no cardiovascular.
Dos cardiólogos (M. Castiñeira-Busto y E. Abu-Assi) asignaron la causa de la muerte. En caso de discrepancia entre esos dos cardiólogos, se recurría a un tercer cardiólogo (J.M. García-Acuña). Cuando no se disponía de información o no había consenso sobre la causa de muerte, esta se incluyó en el grupo de «causa de muerte desconocida o inclasificable».
Análisis estadísticoLas variables cuantitativas, dada la ausencia de distribución gaussiana, se expresaron como mediana [intervalo intercuartílico] y las discretas, como frecuencias y porcentajes. Las características basales de la población se estratificaron por subgrupos de DC derecha, DC izquierda o codominancia. Para la comparación de variables continuas se utilizó el test de Kruskal-Wallis. Para variables discretas, se utilizó la prueba de la χ2 o la prueba exacta Fisher.
La proporción de muertes ocurridas en cada categoría de DC se estimó mediante curvas de Kaplan-Meier, y sus diferencias se cuantificaron por el log rank test. La proporción ajustada de reIAM se estimó mediante la técnica de incidencia acumulada, y las diferencias entre los tres subgrupos de DC se cuantificaron mediante el test de Gray7. El modelo de regresión de Cox se utilizó para el análisis de la asociación entre DC y la mortalidad. Para evaluar el efecto intrínseco de DC en la tasa de reIAM, se utilizó el modelo de riesgos competitivos de Fine y Gray8. En el modelo de Cox, se incluyeron las variables que en el análisis univariable de mortalidad total presentaron p ≤ 0,20 y otras que se consideraron de relevancia clínica (IAM de localización anterior, revascularización completa y sexo). El supuesto de proporcionalidad del riesgo se evaluó mediante el análisis de los residuos de Schoenfeld y la forma funcional de las variables cuantitativas (relación log-lineal) se determinó mediante polinomiales fraccionados9. Se consideraron las siguientes variables en la construcción del modelo multivariable de Cox: año de ingreso, edad ≥ 65 años, sexo, diabetes mellitus, enfermedad vascular (arteriopatía periférica o ictus/accidente isquémico transitorio), antecedentes de neoplasia, IAM de localización anterior, clase Killip ≥ II o fracción de eyección del ventrículo izquierdo ≤ 40%, hemoglobina al ingreso, creatinina sérica al ingreso ≥ 1,3mg/dl, revascularización coronaria completa y DC («DC derecha» como categoría de referencia).
Una vez establecido el modelo de Cox inicial, se procedió posteriormente a su simplificación reteniendo en el modelo las covariables que presentaron p < 0,1 y cuya exclusión secuencial no produjese cambios > 15% en el coeficiente de la variable «DC izquierda». Así, el modelo multivariable simplificado de Cox incluyó ocho parámetros: edad ≥ 65 años, diabetes mellitus, clase Killip ≥ II o fracción de eyección del ventrículo izquierdo ≤ 40%, enfermedad vascular, hemoglobina al ingreso, creatinina sérica al ingreso ≥ 1,3mg/dl, antecedentes de neoplasia y DC.
La capacidad discriminatoria, determinada mediante el estadístico C para datos censurados, del modelo multivariable simplificado fue de 0,854, lo que representa el 97,6% del poder predictivo del modelo completo compuesto por 12 variables: año de ingreso, edad ≥ 65 años, sexo, diabetes mellitus, enfermedad vascular, antecedentes de enfermedad neoplásica, IAM de localización anterior, clase Killip ≥ II o fracción de eyección del ventrículo izquierdo ≤40%, hemoglobina al ingreso, creatinina sérica al ingreso ≥ 1,3mg/dl, revascularización coronaria completa y DC.
Los índices AIC y BIC (criterio de información de Akaike y criterio de información bayesiano respectivamente) fueron de 832 y 883, respectivamente, para el modelo simplificado (frente a 1.286 y 1.352, respectivamente, para el modelo completo), lo que indica mejor ajuste usando el modelo parsimonioso.
El modelo multivariable final de riesgos competitivos de Fine y Gray8 incluyó las variables que mostraron asociación con p ≤ 0,20 con el evento «reIAM»: edad ≥ 65 años, hipertensión arterial, diabetes mellitus, ICP previo y clase Killip ≥ II o fracción de eyección del ventrículo izquierdo < 35%, además de la variable «sexo». De 85 pacientes no se disponía de los valores de colesterol unido a lipoproteínas de baja densidad, por lo que dicha covariable no se introdujo en el modelo previo de riesgos competitivos, pero se repitió el análisis considerando dicha variable para determinar un posible efecto en la incidencia de reIAM.
Para estudiar el efecto ajustado de DC en la mortalidad tras el alta hospitalaria, se repitió el análisis de mortalidad excluyendo a los pacientes que no habían sobrevivido a la fase hospitalaria (n = 39). Se determinó también si tener en cuenta la DC en la estratificación del riego de muerte aporta algún valor pronóstico incremental con respecto a la puntuación GRACE (Global Registry of Acute Coronary Events) de predicción del riesgo de muerte tras el alta hospitalaria. Esta puntuación se compone de nueve variables pronósticas (edad, historia de insuficiencia cardiaca, historia de IAM, frecuencia cardiaca y presión arterial sistólica al ingreso, depresión del segmento ST, creatinina sérica al ingreso, elevación de marcadores de necrosis miocárdica e ICP durante el ingreso índice), y aunque se diseñó para predecir la mortalidad a 6 meses, varios estudios han corroborado su excelente capacidad en la predicción del riesgo de muerte más a largo plazo10,11.
Se ha calculado y reportado los valores de p de significación estadística y de hazard ratio (HR), así como de sub-HR con sus respectivos intervalos de confianza del 95% (IC95%). Para el análisis estadístico se utilizaron los paquetes estadísticos STATA 13 y SPSS 22.
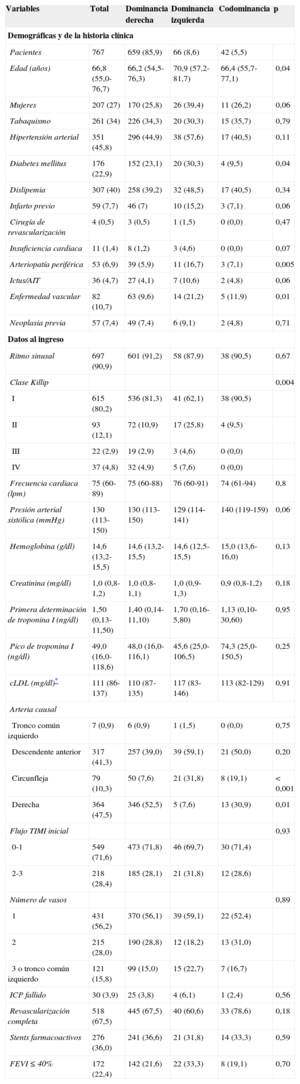
RESULTADOSCaracterísticas de la muestra estratificadas por patrón de dominancia coronariaLa mediana de edad fue 66,8 [55,0-76,7] años y el 27% eran mujeres. Los pacientes con dominancia izquierda eran significativamente de mayor edad que los pacientes con dominancia no izquierda y presentaban en general peor perfil de riesgo cardiovascular con mayor prevalencia de hipertensión arterial, diabetes mellitus, historia de IAM, enfermedad vascular e insuficiencia cardiaca (tabla 1).
Características basales
| Variables | Total | Dominancia derecha | Dominancia izquierda | Codominancia | p |
|---|---|---|---|---|---|
| Demográficas y de la historia clínica | |||||
| Pacientes | 767 | 659 (85,9) | 66 (8,6) | 42 (5,5) | |
| Edad (años) | 66,8 (55,0-76,7) | 66,2 (54,5-76,3) | 70,9 (57,2-81,7) | 66,4 (55,7-77,1) | 0,04 |
| Mujeres | 207 (27) | 170 (25,8) | 26 (39,4) | 11 (26,2) | 0,06 |
| Tabaquismo | 261 (34) | 226 (34,3) | 20 (30,3) | 15 (35,7) | 0,79 |
| Hipertensión arterial | 351 (45,8) | 296 (44,9) | 38 (57,6) | 17 (40,5) | 0,11 |
| Diabetes mellitus | 176 (22,9) | 152 (23,1) | 20 (30,3) | 4 (9,5) | 0,04 |
| Dislipemia | 307 (40) | 258 (39,2) | 32 (48,5) | 17 (40,5) | 0,34 |
| Infarto previo | 59 (7,7) | 46 (7) | 10 (15,2) | 3 (7,1) | 0,06 |
| Cirugía de revascularización | 4 (0,5) | 3 (0,5) | 1 (1,5) | 0 (0,0) | 0,47 |
| Insuficiencia cardiaca | 11 (1,4) | 8 (1,2) | 3 (4,6) | 0 (0,0) | 0,07 |
| Arteriopatía periférica | 53 (6,9) | 39 (5,9) | 11 (16,7) | 3 (7,1) | 0,005 |
| Ictus/AIT | 36 (4,7) | 27 (4,1) | 7 (10,6) | 2 (4,8) | 0,06 |
| Enfermedad vascular | 82 (10,7) | 63 (9,6) | 14 (21,2) | 5 (11,9) | 0,01 |
| Neoplasia previa | 57 (7,4) | 49 (7,4) | 6 (9,1) | 2 (4,8) | 0,71 |
| Datos al ingreso | |||||
| Ritmo sinusal | 697 (90,9) | 601 (91,2) | 58 (87,9) | 38 (90,5) | 0,67 |
| Clase Killip | 0,004 | ||||
| I | 615 (80,2) | 536 (81,3) | 41 (62,1) | 38 (90,5) | |
| II | 93 (12,1) | 72 (10,9) | 17 (25,8) | 4 (9,5) | |
| III | 22 (2,9) | 19 (2,9) | 3 (4,6) | 0 (0,0) | |
| IV | 37 (4,8) | 32 (4,9) | 5 (7,6) | 0 (0,0) | |
| Frecuencia cardiaca (lpm) | 75 (60-89) | 75 (60-88) | 76 (60-91) | 74 (61-94) | 0,8 |
| Presión arterial sistólica (mmHg) | 130 (113-150) | 130 (113-150) | 129 (114-141) | 140 (119-159) | 0,06 |
| Hemoglobina (g/dl) | 14,6 (13,2-15,5) | 14,6 (13,2-15,5) | 14,6 (12,5-15,5) | 15,0 (13,6-16,0) | 0,13 |
| Creatinina (mg/dl) | 1,0 (0,8-1,2) | 1,0 (0,8-1,1) | 1,0 (0,9-1,3) | 0,9 (0,8-1,2) | 0,18 |
| Primera determinación de troponina I (ng/dl) | 1,50 (0,13-11,50) | 1,40 (0,14-11,10) | 1,70 (0,16-5,80) | 1,13 (0,10-30,60) | 0,95 |
| Pico de troponina I (ng/dl) | 49,0 (16,0-118,6) | 48,0 (16,0-116,1) | 45,6 (25,0-106,5) | 74,3 (25,0-150,5) | 0,25 |
| cLDL (mg/dl)* | 111 (86-137) | 110 (87-135) | 117 (83-146) | 113 (82-129) | 0,91 |
| Arteria causal | |||||
| Tronco común izquierdo | 7 (0,9) | 6 (0,9) | 1 (1,5) | 0 (0,0) | 0,75 |
| Descendente anterior | 317 (41,3) | 257 (39,0) | 39 (59,1) | 21 (50,0) | 0,20 |
| Circunfleja | 79 (10,3) | 50 (7,6) | 21 (31,8) | 8 (19,1) | < 0,001 |
| Derecha | 364 (47,5) | 346 (52,5) | 5 (7,6) | 13 (30,9) | 0,01 |
| Flujo TIMI inicial | 0,93 | ||||
| 0-1 | 549 (71,6) | 473 (71,8) | 46 (69,7) | 30 (71,4) | |
| 2-3 | 218 (28,4) | 185 (28,1) | 21 (31,8) | 12 (28,6) | |
| Número de vasos | 0,89 | ||||
| 1 | 431 (56,2) | 370 (56,1) | 39 (59,1) | 22 (52,4) | |
| 2 | 215 (28,0) | 190 (28,8) | 12 (18,2) | 13 (31,0) | |
| 3 o tronco común izquierdo | 121 (15,8) | 99 (15,0) | 15 (22,7) | 7 (16,7) | |
| ICP fallido | 30 (3,9) | 25 (3,8) | 4 (6,1) | 1 (2,4) | 0,56 |
| Revascularización completa | 518 (67,5) | 445 (67,5) | 40 (60,6) | 33 (78,6) | 0,18 |
| Stents farmacoactivos | 276 (36,0) | 241 (36,6) | 21 (31,8) | 14 (33,3) | 0,59 |
| FEVI ≤ 40% | 172 (22,4) | 142 (21,6) | 22 (33,3) | 8 (19,1) | 0,70 |
AIT: accidente isquémico transitorio; cLDL: colesterol unido a lipoproteínas de baja densidad; ICP: intervencionismo coronario percutáneo; FEVI: fracción de eyección del ventrículo izquierdo; TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan n (%) o mediana (intervalo intercuartílico).
Además, esos pacientes se presentaban en el hospital más frecuentemente con insuficiencia cardiaca. La localización del IAM era más frecuentemente anterior entre los pacientes con dominancia izquierda. Desde el punto de vista angiográfico, hubo mayor proporción de enfermedad coronaria significativa de tres vasos/tronco común izquierdo entre los pacientes con dominancia izquierda, además de mayor porcentaje de ICP fallido y menor proporción de revascularización coronaria completa, comparados con los pacientes con DC derecha o codominancia.
En la ecocardiografía, se detectó más frecuentemente disfunción sistólica ventricular izquierda cuando la DC era izquierda.
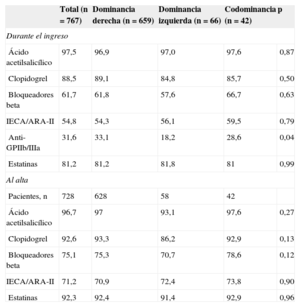
El tratamiento farmacológico durante el ingreso y el prescrito al alta no difirieron significativamente entre los tres subgrupos de DC (tabla 2).
Tratamiento farmacológico intrahospitalario y al alta
| Total (n = 767) | Dominancia derecha (n = 659) | Dominancia izquierda (n = 66) | Codominancia (n = 42) | p | |
|---|---|---|---|---|---|
| Durante el ingreso | |||||
| Ácido acetilsalicílico | 97,5 | 96,9 | 97,0 | 97,6 | 0,87 |
| Clopidogrel | 88,5 | 89,1 | 84,8 | 85,7 | 0,50 |
| Bloqueadores beta | 61,7 | 61,8 | 57,6 | 66,7 | 0,63 |
| IECA/ARA-II | 54,8 | 54,3 | 56,1 | 59,5 | 0,79 |
| Anti-GPIIb/IIIa | 31,6 | 33,1 | 18,2 | 28,6 | 0,04 |
| Estatinas | 81,2 | 81,2 | 81,8 | 81 | 0,99 |
| Al alta | |||||
| Pacientes, n | 728 | 628 | 58 | 42 | |
| Ácido acetilsalicílico | 96,7 | 97 | 93,1 | 97,6 | 0,27 |
| Clopidogrel | 92,6 | 93,3 | 86,2 | 92,9 | 0,13 |
| Bloqueadores beta | 75,1 | 75,3 | 70,7 | 78,6 | 0,12 |
| IECA/ARA-II | 71,2 | 70,9 | 72,4 | 73,8 | 0,90 |
| Estatinas | 92,3 | 92,4 | 91,4 | 92,9 | 0,96 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los valores expresan porcentajes.
Durante una mediana de seguimiento de 40,8 [21,9-58,3] meses, se registraron 118 (15,4%) muertes: 39 (5,1%) ocurrieron durante la fase de hospitalización.
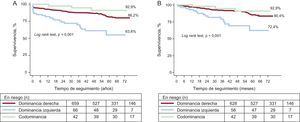
La distribución de la mortalidad estratificada por el tipo de DC mostró un incremento monotónico de esta desde la codominancia hasta la dominancia izquierda (el 7,1, el 13,8 y el 36,4%; p < 0,001) (figura 1A).
En las curvas de Kaplan-Meier se puede identificar también que las curvas de supervivencia para los tres tipos de DC divergen desde los primeros momentos, especialmente en los pacientes con dominancia izquierda (figura 1), y que dicha divergencia persiste e incluso se incrementa durante la evolución. Excluyendo las muertes intrahospitalarias (n = 39), las diferencias según el tipo de DC persistieron prácticamente sin variar (figura 1B).
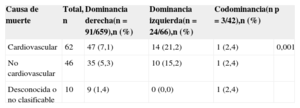
Entre los pacientes con dominancia izquierda hubo mayor proporción de muertes de origen cardiovascular que entre los de dominancia no izquierda (el 21,2 frente al 7,1% en dominancia derecha y el 2,4% en codominancia; p = 0,001) (tabla 3).
Causa de muerte por subgrupos según el patrón de dominancia coronaria
| Causa de muerte | Total, n | Dominancia derecha(n = 91/659),n (%) | Dominancia izquierda(n = 24/66),n (%) | Codominancia(n = 3/42),n (%) | p |
|---|---|---|---|---|---|
| Cardiovascular | 62 | 47 (7,1) | 14 (21,2) | 1 (2,4) | 0,001 |
| No cardiovascular | 46 | 35 (5,3) | 10 (15,2) | 1 (2,4) | |
| Desconocida o no clasificable | 10 | 9 (1,4) | 0 (0,0) | 1 (2,4) |
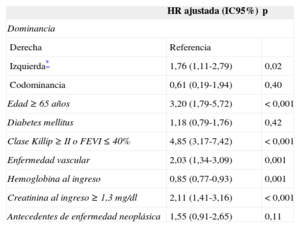
En el análisis multivariable, la DC izquierda se asoció positivamente con la mortalidad (HR = 1,76; IC95%, 1,11-2,79; p = 0,02) (tabla 4); tras excluir las muertes intrahospitalarias se obtuvo HR = 1,96 (IC95%, 1,09-3,52; p = 0,025).
Efecto ajustado del patrón de dominancia coronaria en la mortalidad total*
| HR ajustada (IC95%) | p | |
|---|---|---|
| Dominancia | ||
| Derecha | Referencia | |
| Izquierda* | 1,76 (1,11-2,79) | 0,02 |
| Codominancia | 0,61 (0,19-1,94) | 0,40 |
| Edad ≥ 65 años | 3,20 (1,79-5,72) | < 0,001 |
| Diabetes mellitus | 1,18 (0,79-1,76) | 0,42 |
| Clase Killip ≥ II o FEVI ≤ 40% | 4,85 (3,17-7,42) | < 0,001 |
| Enfermedad vascular | 2,03 (1,34-3,09) | 0,001 |
| Hemoglobina al ingreso | 0,85 (0,77-0,93) | 0,001 |
| Creatinina al ingreso ≥ 1,3 mg/dl | 2,11 (1,41-3,16) | < 0,001 |
| Antecedentes de enfermedad neoplásica | 1,55 (0,91-2,65) | 0,11 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La prueba ómnibus para la variable «dominancia coronaria» resultó en p = 0,1 para el modelo completo de Cox compuesto por 12 variables. Tras la exclusión de la variable «año de ingreso», el test ómnibus arrojó p = 0,08, que prácticamente no se modificó posteriormente tras la exclusión de «sexo». Después de excluir las variables «infarto agudo de miocardio de localización anterior» y «revascularización coronaria completa», la prueba ómnibus obtuvo p = 0,06 y p = 0,046 respectivamente.
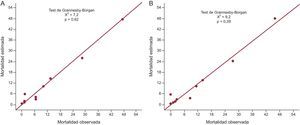
En los pacientes que sobrevivieron al ingreso, la puntuación GRACE de predicción de riesgo de muerte después del alta mostró una asociación, como variable continua, con la mortalidad (HR = 1,05; IC95%, 1,04-1,06; p < 0,001). Tras añadir «DC» a la puntuación GRACE, la DC izquierda persistía como predictor independiente de muerte (HR = 2,12; IC95%, 1,15-3,90; p = 0,015). El estadístico C fue superior en el modelo que incluyó DC más la puntuación GRACE frente a la puntuación GRACE sola (test de Hanley-McNeil, 0,837 frente a 0,821; p = 0,51). La calibración del riesgo de muerte posterior al alta también mejoró (reducción del valor de χ2 e incremento del valor de p del test de Grønnesby-Borgan, que indican mayor poder de calibración, y por inspección visual) al considerar en la estimación de tal riesgo la DC (figura 2).
Los pacientes de riesgo intermedio y alto según la clasificación GRACE mostraron mayor riesgo de muerte (frente a categoría de riesgo bajo, HR = 3,72; IC95%, 1,17-13,92; p = 0,03; y HR = 23,61; IC95%, 7,43-75,06; p < 0,001). Añadir «DC» a la puntuación GRACE como variable categórica resultó en mejora del estadístico C de 0,781 a 0,801 (p = 0,47).
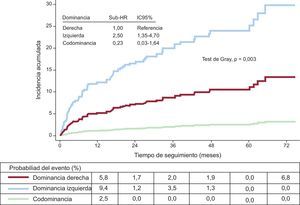
Relación de la dominancia coronaria con el reinfarto agudo de miocardioDurante el seguimiento se registraron 71 (9,3%) reIAM. Las tasas de reIAM según el tipo de DC fueron el 8,6, el 19,7 y el 2,4% para dominancia derecha, dominancia izquierda y codominancia respectivamente (figura 3).
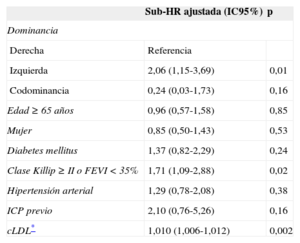
En el análisis multivariable, la DC izquierda fue un predictor independiente de presentar reIAM en el seguimiento (sub-HR = 2,06; IC95%, 1,15-3,69; p = 0,01) (tabla 5).
Efecto ajustado del tipo de dominancia coronaria en la incidencia de reinfarto ajustando por mortalidad como evento competitivo
| Sub-HR ajustada (IC95%) | p | |
|---|---|---|
| Dominancia | ||
| Derecha | Referencia | |
| Izquierda | 2,06 (1,15-3,69) | 0,01 |
| Codominancia | 0,24 (0,03-1,73) | 0,16 |
| Edad ≥ 65 años | 0,96 (0,57-1,58) | 0,85 |
| Mujer | 0,85 (0,50-1,43) | 0,53 |
| Diabetes mellitus | 1,37 (0,82-2,29) | 0,24 |
| Clase Killip ≥ II o FEVI < 35% | 1,71 (1,09-2,88) | 0,02 |
| Hipertensión arterial | 1,29 (0,78-2,08) | 0,38 |
| ICP previo | 2,10 (0,76-5,26) | 0,16 |
| cLDL* | 1,010 (1,006-1,012) | 0,002 |
cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervencionismo coronario percutáneo.
El test ómnibus resultó en p = 0,01, y al incluir el colesterol unido a lipoproteínas de baja densidad en el modelo, p = 0,026.
El hallazgo principal de este estudio consiste en que la DC izquierda es un predictor independiente de muerte y reIAM en pacientes con un IAMCEST tratado con ICP primario. Un patrón de DC izquierda en esos pacientes también confiere mayor riesgo de muerte por causa cardiovascular. Los datos señalan asimismo que la influencia pronóstica negativa que ejerce un patrón de DC izquierda en el contexto de un IAMCEST es de inicio precoz y persiste, e incluso aumenta a lo largo del seguimiento. Otro hallazgo de este estudio es la mejora en la capacidad predictiva (mejora de los índices de discriminación y calibración) de la puntuación GRACE en la predicción de la mortalidad después del alta al tener en cuenta el patrón de DC. Este es el primer estudio en demostrar que el patrón de DC mejora la capacidad predictiva de riesgo de muerte de la puntuación GRACE.
Es poca la información disponible sobre el valor pronóstico de la DC en pacientes con SCA en general y en el IAMCEST en particular. Goldberg et al3 observaron en 27.289 pacientes sometidos a cateterismo cardiaco en el contexto de un SCA que la presencia de DC izquierda era un predictor de muerte en un seguimiento medio de 3,5 años (HR = 1,18; IC95%, 1,05-1,34). En ese estudio, el efecto pronóstico de la DC izquierda fue más pronunciado en pacientes con IAMCEST.
En contraste con los hallazgos de Goldberg et al3, un estudio reciente de Veltman et al4 en 1.131 pacientes con IAMCEST tratados con ICP primario reveló que la importancia pronóstica de la DC izquierda se confina exclusivamente a los primeros 30 días del evento agudo (muerte, odds ratio = 2,51; IC95%, 1,11-5,67; combinado de reIAM o muerte cardiaca, odds ratio = 2,25; IC95%, 1,09-4,61), y posteriormente (mediana de seguimiento de 48 meses) la DC izquierda presenta un efecto pronóstico neutro.
En el registro CathPCI-4, que incluyó a 207.926 pacientes con SCA tratados con ICP, la DC izquierda, comparada con la DC derecha, fue un predictor independiente de mortalidad hospitalaria (odds ratio = 1,19; IC95%, 1,06-1,34) en el conjunto de los pacientes12; sin embargo, no se asoció a mayor mortalidad hospitalaria en el subgrupo de pacientes con IAMCEST (odds ratio = 1,2; IC95%, 0,96-1,30). Desafortunadamente, el registro CathPCI-4 no aportó información sobre las implicaciones pronósticas a largo plazo del patrón de DC.
Así, los resultados del presente estudio refuerzan los hallazgos de Goldberg et al3 con respecto a la importancia pronóstica del patrón de DC en pacientes con IAMCEST, y plantean la necesidad de estudios futuros, ya que estos resultados refutan las observaciones recientes de Veltman et al4 respecto a la ausencia de esta pronóstica del patrón de DC izquierda a largo plazo. Destaca que esta población, en comparación con la estudiada por Veltman et al4, es de más edad (66 ± 14 frente a 61 ± 12 años; p < 0,001) y mayor carga de comorbilidades, lo cual, junto con las diferencias en el diseño (se incluyó a pacientes con su primer IAMCEST, y además se exclyó a los pacientes con ICP o cirugía de revascularización coronaria previa), pudo contribuir a las diferencias observadas entre ambos trabajos.
El peor pronóstico que confiere la DC izquierda en este estudio puede explicarse por el hecho de que la DC derecha consigue una mayor partición de la vasculatura coronaria que irriga el ventrículo izquierdo (en tres «partes»), mientras que la DC izquierda hace que la mayor parte del miocardio dependa de dos arterias fundamentalmente. De hecho, en este estudio hubo mayor alteración de la función ventricular izquierda en los pacientes con DC izquierda, lo que pudo condicionar el peor pronóstico observado en esos pacientes, comparados con los de DC derecha. Sin embargo, la DC izquierda se mantuvo como predictor de peor pronóstico tras corregir por la alteración de la función sistólica ventricular izquierda.
En este trabajo hubo mayor tasa de revascularización coronaria completa entre los pacientes con DC derecha (67,5%) que en el grupo de DC izquierda (60,6%), que no fue significativa (p = 0,32) y se cree que puede deberse a que esos pacientes presentaban lesiones en la coronaria derecha que se decidió no tratar por ser un vaso no dominante.
Por lo tanto, puede que existan otros mecanismos que expliquen el peor pronóstico asociado a DC izquierda en estos pacientes. En el estudio clásico de Dodge et al13, que evaluó 83 coronariografías invasivas, se demostró que la arteria circunfleja tiene mayor calibre en pacientes con DC izquierda. Esto significa que en los pacientes con DC izquierda la arteria circunfleja es más importante desde el punto de vista de la circulación coronaria, no solo por proporcionar más ramas coronarias, sino por su mayor diámetro. De hecho, Ilia et al14 observaron que las tasas de shock cardiogénico y mortalidad hospitalaria tras la oclusión aguda de arteria circunfleja en su porción proximal fueron mayores que las observadas tras la oclusión aguda de la arteria descendente anterior, lo que subraya la importancia de la arteria circunfleja dominante que podía estar encargada de suministrar flujo al 60% del ventrículo izquierdo. Por otro lado, Ilia et al14 encontraron que había una arteria descendente anterior larga en el 87% de los pacientes con DC izquierda, en comparación con el 47% de los pacientes con DC derecha15. Esto implica que la afección de arteria descendente anterior en pacientes con DC izquierda produciría mayor daño miocárdico. En esta serie, el 59% de los pacientes con DC izquierda (frente al 39% en DC derecha) tenía la arteria descendente anterior como la arteria causante del IAM, lo cual según los hallazgos de Ilia et al15, habría causado mayor extensión del IAM y disfunción ventricular, lo cual empeora el pronóstico. En el presente estudio no se dispuso de datos sobre la longitud de la arteria descendente anterior ni sobre el calibre de las distintas arterias del árbol coronario, pero se disponía de información sobre la fracción de eyección del ventrículo izquierdo y la gravedad y extensión del evento coronario; a pesar de ello, la DC izquierda mantuvo su asociación con mortalidad y reinfarto. De este modo, este estudio alerta sobre la necesidad de llevar a cabo más estudios para investigar las causas que subyacen a la mayor letalidad del patrón de DC.
En cuanto a los mecanismos causantes de reIAM en los pacientes con DC izquierda, el colesterol unido a lipoproteínas de baja densidad, cuyas cifras eran más altas en el subgrupo con DC izquierda, fue un predictor independiente de reinfarto, y puede explicar, al menos parcialmente, la mayor incidencia de reIAM en presencia de DC izquierda. Sin embargo, otros factores angiográficos también podrían haber contribuido a la asociación de DC izquierda con el reIAM, como las lesiones bifurcadas y muy calcificadas, que se dan más frecuentemente en pacientes con DC izquierda16.
Dado el significativo exceso de eventos adversos que condiciona la DC izquierda en pacientes con IAMCEST, la indicación de un tratamiento farmacológico intensivo y un programa de cuidados específicos17, así como un seguimiento cuidadosamente planificado, debería plantearse preferentemente para los pacientes con IAMCEST y DC izquierda. Probablemente, la búsqueda de isquemia inducible en pacientes con DC izquierda en relación con lesiones intermedias debería de ser más activa. Por ejemplo, aunque una estenosis < 50% del tronco común izquierdo no se asoció a peor pronóstico en una población no seleccionada de más de 11.000 pacientes sometidos a ICP18, la importancia de ese tipo de lesiones podría ser mayor si la DC es izquierda, especialmente si el tronco es corto19.
El presente estudio proporciona información valiosa para la estratificación del riesgo a largo plazo de los pacientes con IAMCEST. Aunque los riesgos, a corto y medio plazo, de muerte y reIAM después de tener un SCA están bien caracterizados, las consecuencias tardías siguen estando mal definidas10 y los clínicos apreciarían la identificación de factores20,21 que condicionan peor pronóstico en el seguimiento a largo plazo para tratarlos, modificarlos o, al menos, contrarrestar su impacto pronóstico negativo. Considerar el patrón de DC junto con la puntuación GRACE proporcionó mejora de las estimaciones del riesgo de muerte en esta serie. A pesar de que la magnitud de dicha mejora fue pequeña y se desconoce actualmente el verdadero impacto que tendría en el manejo del paciente con IAMCEST, los autores de este estudio creen que se debería tener en cuenta el patrón de DC en el proceso integral de estratificación del riesgo de los pacientes con IAMCEST tratados con ICP primario, pues en este estudio se ha mostrado predictor independiente de la ocurrencia de reIAM y muerte, además de haber contribuido a refinar las estimaciones de la puntuación GRACE.
LimitacionesEn primer lugar, se trata de un estudio retrospectivo con las limitaciones inherentes a este tipo de trabajos. Se incluyó solo a pacientes con IAMCEST tratados con ICP primario, lo cual pudo influir en la prevalencia del patrón de DC. Sin embargo, el objetivo no era determinar la prevalencia del tipo de DC, sino sus implicaciones pronósticas. Por otro lado, estos hallazgos deben interpretarse en el contexto del IAMCEST tratado con ICP primario, y no necesariamente se aplican al conjunto de pacientes con IAMCEST.
Los modelos de regresión se encontraban en el límite del sobreajuste, debido a un número relativamente bajo de eventos clínicos en el presente estudio22. En la evaluación de la utilidad pronóstica incremental del patrón de DC con respecto a la puntuación GRACE, no se han usado métodos más sensibles como las curvas de decisión22, que posiblemente habrían aportado mayor información sobre la utilidad pronóstica o al menos otra perspectiva del beneficio neto que se habría obtenido de considerar el patrón de DC y la puntuación GRACE conjuntamente.
Por último, debido a que no se dispone de datos de los tratamientos durante el seguimiento, no es posible descartar que las diferencias observadas entre los dos grupos de este estudio puedan deberse, al menos en parte, a las diferencias en el tratamiento entre los tres grupos estudiados.
CONCLUSIONESEn este registro contemporáneo de pacientes con IAMCEST tratados con ICP primario, la DC izquierda, en comparación con la derecha, conlleva un exceso de mortalidad y de reIAM que se produce precozmente tras el evento agudo y persiste e incluso se acentúa durante el seguimiento. La mortalidad de origen cardiovascular es hasta 3 veces mayor entre los pacientes con IAMCEST tratados con ICP primario y DC izquierda, en comparación con los pacientes con IAMCEST y DC derecha.
Se debería tener en cuenta el patrón de DC además de la puntuación GRACE para la predicción del riesgo de muerte a largo plazo.
CONFLICTO DE INTERESESNinguno.