Existe escasa información sobre la incidencia y los predictores de infarto, ictus o muerte cardiovascular tras presentar un síndrome coronario agudo. Se investigaron los aspectos previos y se desarrollaron herramientas de predicción de dichos eventos según la temporalidad de su ocurrencia.
MétodosEstudio retrospectivo de 4.858 pacientes supervivientes a un evento coronario agudo. Se analizó la incidencia y los predictores de infarto agudo de miocardio, ictus o muerte cardiovascular durante el primer año (n=4.858) frente a años sucesivos (n=4.345 pacientes libres del evento combinado durante el primer año).
ResultadosEn el primer año hubo 329 eventos (función de incidencia acumulada, 7,3% personas-año) y 616 posteriormente (21,5% personas-año; seguimiento de 4,9±2,4 años). El riesgo de eventos durante el primer año en los terciles de riesgo establecidos fue del 2,5% personas-año en el grupo de riesgo bajo (< 3 puntos), el 4,8% personas-año en el grupo de riesgo intermedio (3-6 puntos) y el 15,5% personas-año en el grupo de riesgo alto (> 6 puntos) (p<0,001). En la cohorte que presentó el evento combinado después del primer año, el riesgo de eventos aumentó de 10,7% personas-año en el tercil de riesgo bajo (< 3 puntos) a 40,3% personas-año en el tercil de riesgo alto (> 6 puntos) (p<0,001). Ambas escalas mostraron los siguientes índices predictivos: estadístico C, 0,74 y 0,69 respectivamente; p (test de Hosmer-Lemeshow)≥0,44.
ConclusionesPersiste un riesgo elevado de recidiva de eventos cardiovasculares después de un síndrome coronario agudo. Es posible cuantificar dicho riesgo de manera sencilla y con aceptable capacidad predictiva.
Palabras clave
A pesar de que la incidencia y el pronóstico de la enfermedad coronaria a corto-medio plazo tras presentar un síndrome coronario agudo (SCA) se encuentran entre las áreas más estudiadas en cardiología1–8, se dispone de escasa información sobre la incidencia y los determinantes de presentar nuevos eventos cardiovasculares adversos durante el curso evolutivo a más largo plazo9–11. Es más, la escasa información disponible procede de poblaciones de pacientes con SCA en los que escaseaba el empleo de revascularización coronaria9–11, incluso en las series más contemporáneas9.
Por otro lado, el efecto de muchos de los factores asociados a la aparición de eventos cardiovasculares tras un SCA a menudo no se considera en función de si se trata de un seguimiento a corto-medio plazo o a más largo plazo. Caracterizar el curso evolutivo después de presentar un SCA en relación con la ocurrencia de los principales eventos cardiovasculares adversos e identificar los precursores de dichos eventos podría ayudar a individualizar el seguimiento clínico y evaluar la efectividad de los tratamientos, además de optimizar la asignación de recursos. Lo previo cobra todavía mayor relevancia si se tienen en cuenta las previsiones para los próximos años en cuanto a la considerable carga de morbilidad y costes que causará la cardiopatía isquémica12–14 y la importancia de la estratificación individual de riesgos en los modelos de gestión de la cronicidad.
En la presente cohorte de pacientes con SCA tratados con alta tasa de revascularización coronaria, se propuso estudiar el riesgo de infarto agudo de miocardio (IAM), ictus o muerte cardiovascular durante el primer año de seguimiento (ajustando por mortalidad no cardiovascular como episodio competitivo) y compararlo con el riesgo de presentarlos después del primer año. Se propuso asimismo hacer más accesible para los clínicos la estimación del riesgo de los eventos previos elaborando dos herramientas clínicas intuitivas.
MÉTODOSPoblación del estudioEstudio retrospectivo basado en el registro CardioCHUS, que incluye a todos los pacientes ingresados consecutivamente en el Servicio de Cardiología del Hospital Clínico Universitario de Santiago de Compostela, desde diciembre de 2003 a septiembre de 2012, con el diagnóstico primario y definitivo de SCA (n=5.203). Se excluyó a los pacientes que murieron en el hospital (n=291) y a los perdidos durante el seguimiento (n=54). Así, la cohorte final del presente estudio fue de 4.858 pacientes.
El estudio se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki.
Objetivos y seguimientoEl objetivo primario del estudio era determinar el porcentaje y los predictores del combinado de IAM, ictus o muerte cardiovascular durante el primer año y después del primer año de seguimiento del subgrupo de pacientes que se mantuvieron libres de eventos durante el primer año.
Se definió IAM (no fatal) en el seguimiento como la primera hospitalización por IAM (según síntomas compatibles, elevación de troponina I por encima del límite de la normalidad del laboratorio, con/sin alteraciones electrocardiográficas). Se definió ictus isquémico (no fatal; el primero en suceder) en presencia de diagnóstico definitivo realizado por el neurólogo encargado por la presencia de un defecto neurológico persistente de nueva aparición y, al menos, una prueba de imagen.
Para la clasificación de la causa de muerte, se empleó la misma clasificación de las causas de muerte utilizada previamente por el grupo15. Se definió muerte cardiovascular (cardiaca y vascular no cardiaca) como la debida a muerte súbita, insuficiencia cardiaca refractaria, SCA, síndrome aórtico agudo, tromboembolia pulmonar, sistémica o cerebral o enfermedad vasculorrenal (insuficiencia renal en ausencia de glomerulopatías u otras alteraciones parenquimatosas). Las demás causas de muerte se consideraron de origen no cardiovascular. Dos cardiólogos (N. Bouzas-Cruz y E. Abu-Assi) asignaron la causa de muerte. En caso de discrepancia entre los dos cardiólogos, se recurría a un tercero (J.M. García-Acuña). Cuando no se disponía de información o no había consenso sobre la causa de muerte, se la incluyó en el grupo de «causa de muerte desconocida o inclasificable».
La determinación de los eventos durante el seguimiento se realizó a través de la historia clínica electrónica (única en la comunidad autónoma de Galicia, programa IANUS), y entre enero y marzo de 2014 se revisaron todas las asistencias médicas y registros hospitalarios, recurriendo en determinados casos al contacto telefónico.
Análisis estadísticoLas variables cuantitativas se expresaron como media±desviación estándar y las cualitativas, como porcentajes. Las variables cualitativas se compararon mediante el test de la χ2 o el test exacto de Fisher; las cuantitativas se compararon usando el test de la t de Student.
La proporción ajustada del evento combinado se estimó mediante la función de incidencia acumulada (CIF) a lo largo de los dos periodos del estudio: a) durante el primer año, y b) después del primer año hasta el final del seguimiento de los que se mantuvieron libres del evento combinado durante el primer año.
Como la muerte no cardiovascular compite con el riesgo de IAM, ictus o muerte cardiovascular, se utilizó el método de riesgos competitivos de Fine y Gray16 para estimar la incidencia y la identificación de predictores de dichos eventos.
En el modelo multivariable para la predicción del riesgo del evento combinado durante el primer año, se incluyeron las variables que en el análisis bivariable mostraron asociación con el evento de interés con p<0,10 forzando la entrada de sexo, año de ingreso y desfibrilador automático implantable. Así, el modelo previo se construyó a partir de edad, sexo, tabaquismo, hipertensión arterial, diabetes mellitus, arteriopatía periférica, ictus/accidente isquémico transitorio previos, cardiopatía isquémica previa (IAM previo o revascularización coronaria previa), enfermedad pulmonar obstructiva crónica, historia de fibrilación auricular (previa al ingreso o durante este), historia de insuficiencia cardiaca (previa al ingreso o durante este), frecuencia cardiaca al ingreso, IAM sin elevación del segmento ST, creatinina sérica y hemoglobina al ingreso, enfermedad coronaria multivaso (al menos dos arterias coronarias principales con estenosis ≥ 70% o ≥ 50% si afectaba al tronco común izquierdo), ausencia de revascularización coronaria durante el evento índice, intervencionismo coronario percutáneo fallido (flujo TIMI [Thrombolysis In Myocardial Infarction] final<3 o estenosis residual >30%), hemorragia intrahospitalaria moderada o grave la escala la escala TIMI17, desfibrilador automático implantable, estancia hospitalaria (loge) y año de ingreso.
En la construcción del modelo multivariable para predecir el evento combinado después del primer año, se consideraron las variables que mostraron en el análisis bivariable asociación con p<0,1 —edad, tabaquismo, hipertensión arterial, diabetes mellitus, arteriopatía periférica, ictus/accidente isquémico transitorio previos, cardiopatía isquémica previa, enfermedad pulmonar obstructiva crónica, historia de fibrilación auricular, historia de insuficiencia cardiaca, frecuencia cardiaca al ingreso, IAM sin elevación del segmento ST, creatinina sérica y hemoglobina al ingreso, enfermedad coronaria multivaso significativa, ausencia de revascularización coronaria durante el evento índice, hemorragia intrahospitalaria moderada o grave según la escala TIMI17, desfibrilador automático implantable, estancia hospitalaria (loge) y cáncer previo—, forzando además la entrada de sexo y año de ingreso.
La forma funcional de las variables cuantitativas (relación log-lineal) se determinó mediante polinomiales fraccionados18. No hubo evidencia de incumplimiento del supuesto de riesgos proporcionales, comprobado mediante el estudio de la interacción de las covariables en los modelos con el tiempo: en ausencia de significación estadística (p >0,05), se deduce que no se vulnera la hipótesis de riesgos proporcionales.
Los valores de significación estadística y de sub-hazard ratio con sus respectivos intervalos de confianza del 95% (IC95%) se calcularon y se estimaron mediante mil replicaciones bootstrap.
Con el fin de que la predicción del riesgo obtenido de los modelos multivariables sea más accesible para los clínicos, se ha elaborado una puntuación de riesgo de acuerdo con Sullivan et al19. La puntuación de riesgo se asignó de manera proporcional a los coeficientes de las variables con p<0,05 en los modelos multivariables finales. Las puntuaciones se redondearon al número 0,5 o al número entero más cercano. Posteriormente se establecieron las escalas de riesgo a partir de las puntuaciones de riesgo obtenidas y se calculó la probabilidad de riesgo correspondiente a las puntuaciones previas.
La calibración de la escala de riesgo y su capacidad de separar a los pacientes en grupos de riesgo se evaluó inspeccionando los eventos esperados frente a los observados y usando el test de Hosmer-Lemeshow. La capacidad discriminativa de la puntuación de riesgo se evaluó por el estadístico C.
Debido a que la fracción de eyección del ventrículo izquierdo (FEVI) (no cuantificada en 467 pacientes) no se consideró en la derivación de las escalas predictivas, se comprobó la discriminación por subgrupos según tuviesen FEVI<35%, 35-45%, >45% o FEVI no disponible.
Para el análisis estadístico se utilizaron los paquetes estadísticos R y STATA 13.
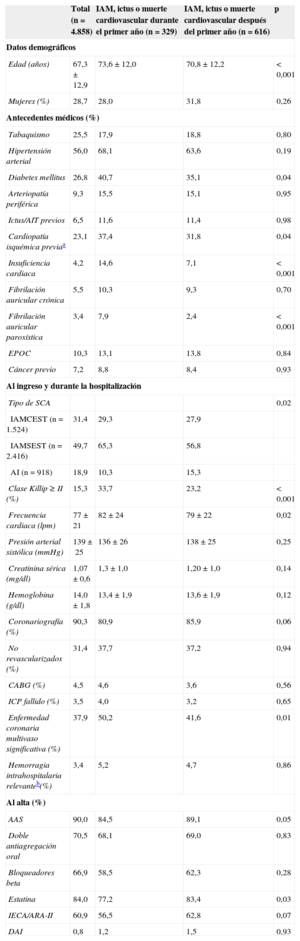
RESULTADOSLas características basales del conjunto de los 4.858 pacientes se listan en la tabla 1. La media de edad era 67,3 años y el 28,7% eran mujeres. Se realizó coronariografía al 90,3% del total de pacientes y se revascularizó al 68,6%.
Características basales de la población del estudio en su conjunto y estratificada por subgrupos según la temporalidad de ocurrencia de infarto, ictus o muerte cardiovascular
| Total (n=4.858) | IAM, ictus o muerte cardiovascular durante el primer año (n=329) | IAM, ictus o muerte cardiovascular después del primer año (n=616) | p | |
|---|---|---|---|---|
| Datos demográficos | ||||
| Edad (años) | 67,3±12,9 | 73,6±12,0 | 70,8±12,2 | <0,001 |
| Mujeres (%) | 28,7 | 28,0 | 31,8 | 0,26 |
| Antecedentes médicos (%) | ||||
| Tabaquismo | 25,5 | 17,9 | 18,8 | 0,80 |
| Hipertensión arterial | 56,0 | 68,1 | 63,6 | 0,19 |
| Diabetes mellitus | 26,8 | 40,7 | 35,1 | 0,04 |
| Arteriopatía periférica | 9,3 | 15,5 | 15,1 | 0,95 |
| Ictus/AIT previos | 6,5 | 11,6 | 11,4 | 0,98 |
| Cardiopatía isquémica previaa | 23,1 | 37,4 | 31,8 | 0,04 |
| Insuficiencia cardiaca | 4,2 | 14,6 | 7,1 | <0,001 |
| Fibrilación auricular crónica | 5,5 | 10,3 | 9,3 | 0,70 |
| Fibrilación auricular paroxística | 3,4 | 7,9 | 2,4 | <0,001 |
| EPOC | 10,3 | 13,1 | 13,8 | 0,84 |
| Cáncer previo | 7,2 | 8,8 | 8,4 | 0,93 |
| Al ingreso y durante la hospitalización | ||||
| Tipo de SCA | 0,02 | |||
| IAMCEST (n=1.524) | 31,4 | 29,3 | 27,9 | |
| IAMSEST (n=2.416) | 49,7 | 65,3 | 56,8 | |
| AI (n=918) | 18,9 | 10,3 | 15,3 | |
| Clase Killip ≥ II (%) | 15,3 | 33,7 | 23,2 | <0,001 |
| Frecuencia cardiaca (lpm) | 77±21 | 82±24 | 79±22 | 0,02 |
| Presión arterial sistólica (mmHg) | 139±25 | 136±26 | 138±25 | 0,25 |
| Creatinina sérica (mg/dl) | 1,07±0,6 | 1,3±1,0 | 1,20±1,0 | 0,14 |
| Hemoglobina (g/dl) | 14,0±1,8 | 13,4±1,9 | 13,6±1,9 | 0,12 |
| Coronariografía (%) | 90,3 | 80,9 | 85,9 | 0,06 |
| No revascularizados (%) | 31,4 | 37,7 | 37,2 | 0,94 |
| CABG (%) | 4,5 | 4,6 | 3,6 | 0,56 |
| ICP fallido (%) | 3,5 | 4,0 | 3,2 | 0,65 |
| Enfermedad coronaria multivaso significativa (%) | 37,9 | 50,2 | 41,6 | 0,01 |
| Hemorragia intrahospitalaria relevanteb(%) | 3,4 | 5,2 | 4,7 | 0,86 |
| Al alta (%) | ||||
| AAS | 90,0 | 84,5 | 89,1 | 0,05 |
| Doble antiagregación oral | 70,5 | 68,1 | 69,0 | 0,83 |
| Bloqueadores beta | 66,9 | 58,5 | 62,3 | 0,28 |
| Estatina | 84,0 | 77,2 | 83,4 | 0,03 |
| IECA/ARA-II | 60,9 | 56,5 | 62,8 | 0,07 |
| DAI | 0,8 | 1,2 | 1,5 | 0,93 |
AAS: ácido acetilsalicílico; AI: angina inestable; AIT: accidente isquémico transitorio; ARA-II: antagonistas de los receptores de la angiotensina II;CABG: cirugía de revascularización aortocoronaria; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervencionismo coronario percutáneo; IECA: inhibidores de la enzima de conversión de la angiotensina; SCA: síndrome coronario agudo.
Antecedentes de infarto agudo de miocardio o revascularización coronaria previa, ya sea percutánea o quirúrgica.
Hemorragia intrahospitalaria moderada o grave según la escala Thrombolysis In Myocardial Infarction17.
Durante un total de 4,8±2,6 años de seguimiento, hubo 945 IAM, ictus o muertes cardiovasculares.
Durante el primer año, 329 pacientes presentaron el evento combinado (CIF = 7,3 [IC95%, 6,5-8,1]/100 personas-año). Los 329 eventos previos se contabilizaron a partir de 185 IAM, 40 ictus y 104 muertes de origen cardiovascular.
Fallecieron por causa no cardiovascular durante el primer año 184 pacientes. Así, la cohorte del segundo periodo de seguimiento se compone de 4.345 pacientes que sobrevivieron al primer año y se mantuvieron libres de eventos.
El seguimiento de los 4.345 pacientes previos fue de 4,9±2,4 años. De los 4.345 pacientes mencionados, 616 presentaron el evento combinado (21,5 [IC95%, 18,3-24,7]/100 personas-año). En la cohorte anterior, las CIF a 1, 2, 3, 4 y 5 años de seguimiento fueron 3,5, 6,0, 8,6, 10,1 y 13,2 eventos/100 personas-año, respectivamente.
Entre los 616 eventos registrados durante el segundo periodo de seguimiento, hubo 274 IAM, 133 ictus y 209 muertes por causa cardiovascular.
Algunas características eran más frecuentes entre los pacientes que presentaron el evento combinado durante el primer año: eran casi 3 años mayores (73,6 frente a 70,8 años; p<0,001) y presentaban significativamente mayor prevalencia de cardiopatía isquémica previa, diabetes mellitus, insuficiencia cardiaca y fibrilación auricular (tabla 1). Esos pacientes presentaban más frecuentemente al ingreso IAM sin elevación del segmento ST y peor función renal. Además, se les prescribía menos frecuentemente ácido acetilsalicílico, estatinas o inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II.
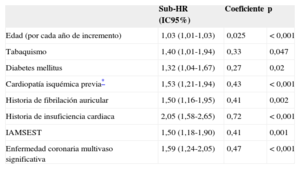
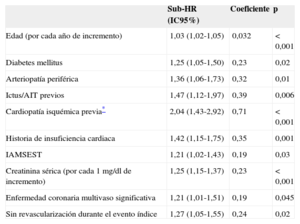
Se identificaron ocho predictores independientes del evento combinado durante el primer año y 10 predictores independientes de aparición del evento combinado después del primer año (tablas 2 y 3) (en las tablas 1 y 2 del material suplementario se muestra el efecto de todos los factores pronósticos que compusieron los modelos multivariables finales).
Efecto de los predictores independientes en el modelo multivariable final para la predicción de infarto, ictus o muerte cardiovascular durante el primer año de seguimiento
| Sub-HR (IC95%) | Coeficiente | p | |
|---|---|---|---|
| Edad (por cada año de incremento) | 1,03 (1,01-1,03) | 0,025 | <0,001 |
| Tabaquismo | 1,40 (1,01-1,94) | 0,33 | 0,047 |
| Diabetes mellitus | 1,32 (1,04-1,67) | 0,27 | 0,02 |
| Cardiopatía isquémica previa* | 1,53 (1,21-1,94) | 0,43 | <0,001 |
| Historia de fibrilación auricular | 1,50 (1,16-1,95) | 0,41 | 0,002 |
| Historia de insuficiencia cardiaca | 2,05 (1,58-2,65) | 0,72 | <0,001 |
| IAMSEST | 1,50 (1,18-1,90) | 0,41 | 0,001 |
| Enfermedad coronaria multivaso significativa | 1,59 (1,24-2,05) | 0,47 | <0,001 |
IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Efecto de los predictores independientes en el modelo multivariable final para la predicción de infarto, ictus o muerte cardiovascular después del primer año
| Sub-HR (IC95%) | Coeficiente | p | |
|---|---|---|---|
| Edad (por cada año de incremento) | 1,03 (1,02-1,05) | 0,032 | <0,001 |
| Diabetes mellitus | 1,25 (1,05-1,50) | 0,23 | 0,02 |
| Arteriopatía periférica | 1,36 (1,06-1,73) | 0,32 | 0,01 |
| Ictus/AIT previos | 1,47 (1,12-1,97) | 0,39 | 0,006 |
| Cardiopatía isquémica previa* | 2,04 (1,43-2,92) | 0,71 | <0,001 |
| Historia de insuficiencia cardiaca | 1,42 (1,15-1,75) | 0,35 | 0,001 |
| IAMSEST | 1,21 (1,02-1,43) | 0,19 | 0,03 |
| Creatinina sérica (por cada 1 mg/dl de incremento) | 1,25 (1,15-1,37) | 0,23 | <0,001 |
| Enfermedad coronaria multivaso significativa | 1,21 (1,01-1,51) | 0,19 | 0,045 |
| Sin revascularización durante el evento índice | 1,27 (1,05-1,55) | 0,24 | 0,02 |
AIT: accidente isquémico transitorio; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
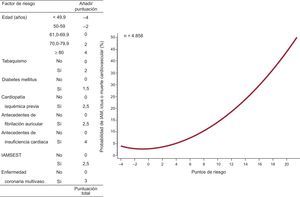
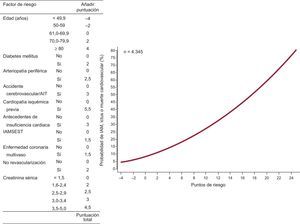
Los predictores previos sirvieron para diseñar dos herramientas cuantitativas más intuitivas para estimar el riesgo del evento combinado durante el primer año (figura 1) y a partir del primer año (figura 2).
Sistema de puntuación y la correspondiente probabilidad estimada de presentar infarto agudo de miocardio, ictus o muerte cardiovascular después del primer año de seguimiento. AIT: accidente isquémico transitorio; IAM: infarto agudo de miocardio; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST.
La distribución de las puntuaciones de riesgo de IAM, ictus o muerte cardiovascular durante o después del primer año se muestra en la figura 1 del material suplementario. La banda de valores de la puntuación de riesgo durante del primer año fue de –4 a 22. En cambio, la puntuación de riesgo después el primer año estuvo en la franja de –4 a 29,5.
A partir de las puntuaciones de riesgo, se estratificó el riesgo de eventos en tres grupos (terciles) y se calculó la CIF.
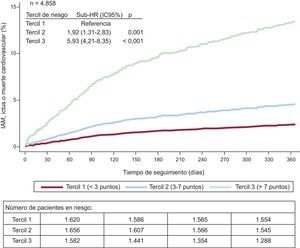
De los 329 eventos registrados durante el primer año, 39 ocurrieron en el primer tercil o grupo de riesgo bajo (< 3 puntos; CIF=2,5 [IC95%, 1,8-3,4]/100 personas-año), 76 en el segundo tercil o riesgo intermedio (3-6 puntos; CIF=4,8 [IC95%, 3,8-6,0]/100 personas-año) y 214 en el tercer tercil o riesgo alto (> 6 puntos; CIF=15,5 [IC95%, 13,6-17,7]/100 personas-año; p <0,001) (figura 3).
\ Función de incidencia acumulada de infarto agudo de miocardio, ictus o muerte cardiovascular durante el primer año de seguimiento estratificada por terciles de riesgo. Se ajusta por mortalidad como episodio competitivo. IAM: infarto agudo de miocardio; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
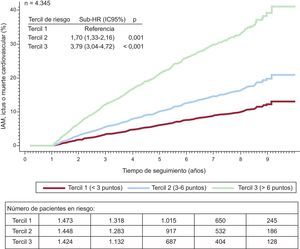
En la cohorte que presentó el evento combinado después del primer año, las CIF en el primer (riesgo bajo, <3 puntos), el segundo (riesgo intermedio, 3-6 puntos) y el tercer tercil (riesgo alto, >6 puntos) fueron 10,7 (IC95%, 8,4-13,0)/100 personas-año (eventos, n=104), 19,0 (IC95%, 16,0-22,0)/100 personas-año (eventos, n=167) y 40,3 (IC95%, 36,0-44,5)/100 personas-año (eventos, n=345) respectivamente (p <0,001) (figura 4).
Función de incidencia acumulada de infarto agudo de miocardio, ictus o muerte cardiovascular después del primer año de seguimiento estratificada por terciles de riesgo. Se ajusta por mortalidad como episodio competitivo. IAM: infarto agudo de miocardio; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La capacidad discriminativa de los modelos multivariables fue similar a la mostrada por las puntuaciones de riesgo, tanto a 1 año (0,74 [IC95%, 0,71-0,76] frente a 0,73 [IC95%, 0,71-0,76]) como después del primer año (0,69 [IC95%, 0,67-0,72] frente a 0,68 [IC95%, 0,65-0,70]).
La discriminación de la puntuación del riesgo de IAM, ictus o muerte cardiovascular después del primer año prácticamente no varió cuando se limitó el seguimiento correspondiente al segundo periodo del estudio a 1, 3 o ≥ 5 años de seguimiento, con estadístico C entre 0,67 y 0,69.
El estadístico C por los subgrupos de FEVI <35% y 35-45% fue 0,67 y para FEVI >45% o FEVI no disponible, 0,68 —similar al encontrado en el conjunto de pacientes—.
La calibración fue buena para ambas puntuaciones de riesgo (Hosmer-Lemeshow, p≥0,44) (figuras 2 y 3 del material suplementario).
DISCUSIÓNEl presente estudio muestra que aproximadamente 1 de cada 4 pacientes que abandonan el hospital tras sobrevivir a un SCA presentará un IAM, ictus o muerte cardiovascular en los 5 años siguientes. El riesgo de presentar uno de esos eventos es especialmente alto en el primer año, pues representan el 34,8% (n=329) del total de eventos registrados (n=945) durante los 5±2 años de seguimiento.
Estos resultados indican también que el riesgo de IAM, ictus o muerte cardiovascular se reduce después del primer año, pero persiste un riesgo residual considerable, de modo que 1 de cada 5 pacientes libres del evento combinado durante el primer año lo presentará durante los siguientes 5 años.
En un reciente estudio sueco, que incluyó entre 2006 y 2011 a más de 90.000 pacientes con IAM en los que el empleo de revascularización fue de alrededor del 50%, el porcentaje de IAM, ictus o muerte cardiovascular 1 año tras el alta fue del 18,3% y a los 3 años alcanzó al 20% de los que se mantuvieron libres de eventos durante el primer año9. En cambio, en el registro REACH20, que incluyó (entre 2003 y 2004 con cierre del seguimiento en 2009) a 21.890 pacientes con antecedentes de SCA, la incidencia acumulada de IAM, ictus o muerte cardiovascular fue de alrededor del 6% a 1 año y de alrededor del 16% a los 4 años. De manera similar, Rapsomaniki et al21, que estudiaron en Reino Unido a más de 15.000 pacientes con SCA entre 2005 y 2010, las incidencias acumuladas de IAM, ictus o muerte cardiovascular fueron del 7,3, el 12,3 y el 17,7% a 1, 2, 3 años respectivamente. Así, la incidencia de IAM, ictus o muerte cardiovascular concuerda con lo descrito recientemente en diferentes entornos y, en conjunto, apuntan a un elevado riesgo de recurrencia de las principales complicaciones cardiovasculares tras sobrevivir a la fase hospitalaria de un SCA.
Aunque recientemente se ha observado un descenso de la mortalidad por cardiopatía isquémica2,12–14, los ingresos por SCA aumentarán en España en los próximos años12. La causa más importante de este aumento será la expansión de la población anciana, que supondrá hasta un 60% del total de casos de SCA en el año 204912. Además de acarrear mayor carga de morbilidad, habrá mayor carga de costes económicos22, pues la asistencia del SCA consume una gran cantidad de recursos. A comienzos de la década pasada, solo los costes directos de la asistencia sanitaria durante el primer año tras un SCA fueron más de mil millones de euros22. Por todo ello, la gestión de las enfermedades crónicas en cardiología es un reto de todos los servicios sanitarios.
Enfrentarse a esa situación requiere asignar adecuadamente los recursos de prevención secundaria con el fin de reducir el exceso de riesgo de futuras complicaciones cardiovasculares. Para ello, es esencial disponer de datos sobre el curso evolutivo de la enfermedad en sus distintas fases y sobre los precursores de futuros eventos adversos, ya que la correcta identificación de los determinantes pronósticos permitiría destinar e intensificar las terapias preventivas hacia los que están en el extremo superior del espectro de riesgo, que suelen ser los que más probabilidades de beneficiarse tienen23–28.
En la presente serie serie, los predictores de IAM, ictus o muerte cardiovascular consistieron en una interacción de factores de riesgo clásicos (edad, tabaquismo y diabetes mellitus), marcadores de la carga aterosclerótica (cardiopatía isquémica previa, ictus/accidente isquémico transitorio previos, arteriopatía periférica y deterioro renal), además de indicadores de extensión de la enfermedad coronaria (IAM sin elevación del segmento ST e insuficiencia cardiaca). Seis de los 10 determinantes del pronóstico después del primer año fueron también condicionantes del pronóstico a lo largo del primer año, aunque la magnitud del efecto individual de esos condicionantes variaba según el periodo estudiado. Además, el presente estudio demuestra que es posible cuantificar el riesgo individual de IAM, ictus o muerte cardiovascular a la cabecera del paciente o en la consulta usando los sistemas de puntuación propuestos.
Todos los predictores de eventos identificados en este registro ya se han descrito previamente9,11,20,29. El hecho de que el tabaquismo se haya asociado a la ocurrencia de eventos durante el primer año pero no posteriormente puede deberse a que el abandono del tabaquismo causase reducción o cese del efecto desestabilizador de las placas ateroscleróticas por el tabaquismo. No se dispone de datos sobre el hábito tabáquico después del alta, por lo que ese mecanismo es meramente una especulación. En cuanto a la historia de fibrilación auricular como predictor de eventos exclusivamente durante el primer año, puede deberse a que la estrategia de tratamiento antitrombótico para esos pacientes todavía no está bien definida, y las consecuencias de ello se hacen notables durante los primeros meses después del alta.
El sistema de puntuación para predecir los eventos a 1 año de seguimiento mostró aceptable capacidad discriminativa y buena calibración. En cambio, el sistema de puntuación para predecir los eventos después del primer año mostró discriminación moderada (0,68). Con independencia de ello, en este trabajo se ha intentado identificar de manera sencilla los determinantes pronósticos, de modo que los clínicos puedan familiarizarse con ellos para su integración en el juicio clínico, tratando de realizar una estratificación del riesgo que permita orientar las estrategias de demostrada eficacia pronóstica23–28 y optimizar las estrategias de seguimiento dentro de programas de rehabilitación cardiaca27.
Por otro lado, debido a las limitaciones económicas actuales, sería deseable mejorar la asignación de recursos sanitarios, para lo cual sería preceptivo atacar los factores vulnerables de las diferentes enfermedades. En busca de sistemas eficientes de gestión de pacientes con enfermedades crónicas, es necesario realizar una estratificación individual del pronóstico a largo plazo. El presente estudio aporta información sobre la magnitud del impacto de la enfermedad coronaria y sus predictores en una cohorte contemporánea de pacientes con SCA. El uso de los sistemas de puntuación propuestos en este estudio no pretende reemplazar el juicio clínico, sino ayudar y facilitar al clínico la elaboración de un juicio clínico razonado y ponderado que permita optimizar el manejo de los pacientes y la utilización de recursos.
LimitacionesEn primer lugar, se trata de un estudio retrospectivo con las limitaciones inherentes a este tipo de trabajos. Por ejemplo, en este estudio, no es posible confirmar que no se haya subestimado las causas de muerte cardiovascular. Una fortaleza destacable de este estudio es la recogida de datos y su elaboración por cardiólogos clínicos, lo cual permite disponer de datos cualitativamente fiables para extraer conclusiones. Una limitación importante es la ausencia de análisis de validación externa de las estimaciones del riesgo de los sistemas de puntuación diseñados en este estudio. Así, antes de su uso en otras poblaciones de pacientes con SCA, es deseable validar, preferiblemente de manera prospectiva, los sistemas de estimación del riesgo propuestos por el grupo.
Es de destacar que, debido al tamaño muestral, algunos subgrupos de riesgo, especialmente aquellos en los extremos de las puntuaciones de riesgo, no están representados adecuadamente y la estimación de su riesgo debe realizarse con cautela.
Por último, debido a que no se dispone de datos del tratamiento durante el seguimiento, no se puede descartar que las diferencias observadas entre grupos en este estudio puedan deberse, al menos parcialmente, a las diferencias en el tratamiento.
CONCLUSIONESEn esta cohorte contemporánea de pacientes tratados en elevada tasa con revascularización coronaria, persiste un riesgo elevado de recidiva de eventos cardiovasculares. A partir de unos predictores de fácil disponibilidad, es posible cuantificar ese riesgo de manera sencilla y con aceptable habilidad predictiva. La estratificación individual en pacientes de bajo o alto riesgo de eventos a largo plazo permitiría una utilización eficiente de los recursos y el diseño de programas de gestión de crónicos basados en la evidencia científica.
CONFLICTO DE INTERESESNinguno.