Con frecuencia se producen alteraciones en la conducción tras el implante de una prótesis CoreValve. Se pretende analizar qué cambios se producen en la conducción cardiaca de pacientes con estenosis aórtica tratados con este tipo de prótesis.
MétodosDesde abril de 2008 hasta diciembre de 2013, se seleccionó a 181 pacientes con estenosis aórtica grave tratados con esta prótesis y estudiados mediante electrocardiograma. Se estudió a un subgrupo de 137 pacientes consecutivos (75,7%) mediante electrocardiogramas intracavitarios antes y tras implante protésico. El objetivo principal del estudio es la necesidad de marcapasos definitivo en las primeras 72h tras el implante protésico. Se analizaron numerosas variables para predecir esta eventualidad.
ResultadosTras el implante, los intervalos PR y QRS se incrementaron de 173±47 a 190±52ms (p<0,01) y de 98±22 a 129±24ms (p<0,01), mientras que los intervalos AH y HV se alargaron de 95±39 a 108±41ms (p<0,01) y de 54±10 a 66±23ms (p<0,01). En total, 89 pacientes (49%) presentaron bloqueo de rama izquierda de novo y 33 (25%) precisaron marcapasos en las primeras 72h. Los predictores independientes de marcapasos fueron el bloqueo de rama derecha basal y la profundidad protésica. Los intervalos intracavitarios carecieron de valor predictivo. Además, 13 pacientes requirieron marcapasos después de las 72h.
ConclusionesEl implante de prótesis CoreValve produce alta incidencia de alteraciones de la conducción; la más frecuente es el bloqueo de rama izquierda; el 25% de los pacientes precisaron marcapasos definitivo. La necesidad de marcapasos se relacionó con el bloqueo de rama derecha basal y la profundidad protésica.
Palabras clave
El implante percutáneo de una prótesis valvular aórtica ha revolucionado el tratamiento de la estenosis aórtica para pacientes con alto riesgo quirúrgico, por su alta tasa de éxito y su baja mortalidad hospitalaria1. Sin embargo, se ha documentado un elevado porcentaje de pacientes que, tras el implante valvular, precisan un marcapasos definitivo por aparición de bloqueo auriculoventricular (BAV) avanzado2. Al tratarse de pacientes de edad avanzada con estenosis aórtica calcificada, no son pocos los que presentan determinados trastornos de conducción antes del tratamiento. Además, tras el implante del stent valvulado en el anillo aórtico y el tracto de salida del ventrículo izquierdo (TSVI), pueden producirse lesiones adicionales en el nódulo auriculoventricular, el haz de His y sus ramas que agraven dichos trastornos basales. Esta eventualidad la han analizado varios grupos2; sin embargo, apenas existe información acerca del análisis de la conducción auriculoventricular mediante electrogramas intracavitarios antes y después del implante valvular3,4. Este estudio trata de analizar la fisiopatología de la conducción auriculoventricular tras el implante de la válvula CoreValve, tanto mediante el electrocardiograma (ECG) de superficie como mediante electrogramas intracavitarios. Asimismo, analiza los factores clínicos, anatómicos, electrocardiográficos y electrofisiológicos que predicen la necesidad de un marcapasos definitivo tras el implante percutáneo.
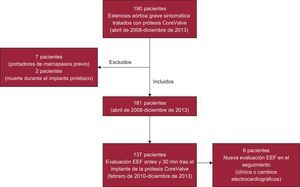
MÉTODOSPacientesDesde abril de 2008 hasta diciembre de 2013 se ha tratado a 190 pacientes con estenosis valvular aórtica degenerativa grave mediante implante de la prótesis aórtica Medtronic CoreValve®. Se trata de un estudio realizado en un solo centro, donde el grupo evaluó a todos los pacientes. De los 190 pacientes, se excluyó del análisis a 9: 7 por tener ya marcapasos definitivo y 2 por haber fallecido durante el procedimiento (figura 1).
A todos los pacientes se les realizó un estudio protocolizado que incluía: a) evaluación clínica; b) cateterismo diagnóstico; c) angiografía por tomografía computarizada (TC) cardiaca, que permite analizar las características anatómicas del anillo aórtico, el eje aortoiliaco y el TSVI, y d) ecocardiograma transesofágico, para el análisis de las dimensiones del anillo aórtico y el TSVI y descartar trombos auriculares. El riesgo quirúrgico se estimó mediante el EuroSCORE logístico y la clasificación de la Society of Thoracic Surgeons. El procedimiento de implante valvular se realizó con anestesia general y control ecocardiográfico con sonda transesofágica. El procedimiento fue percutáneo y la vía de abordaje fue la arteria femoral, salvo en 2 pacientes con síndrome de Leriche, en quienes el acceso arterial se efectuó mediante exposición quirúrgica de la arteria subclavia izquierda.
Análisis de la conducción cardiacaA todos los pacientes se les realizó un ECG de superficie a una velocidad de 25mm/s antes y después del implante valvular. Se analizaron el ritmo, la frecuencia cardiaca y los intervalos PR, QT y duración del QRS; se definió la presencia de bloqueos de rama, hemibloqueos de la rama izquierda, así como BAV avanzados, según los criterios diagnósticos recomendados por la Organización Mundial de la Salud y la International Society and Federation for Cardiology Task Force5.
Durante el procedimiento, todos los pacientes fueron monitorizados electrocardiográficamente con un registro de tres derivaciones, y a todos ellos se les introdujo un cable de marcapasos transitorio por vía transyugular en el ventrículo derecho, para la sobrestimulación cardiaca durante la valvuloplastia aórtica previa al implante de la prótesis, y como prevención en caso de BAV avanzados durante o tras el implante. Se realizó ECG de superficie al llegar a la planta de hospitalización, manteniéndose monitorización electrocardiográfica continua mediante telemetría al menos durante 2 días tras el procedimiento. El cable de marcapasos se mantuvo durante todo el procedimiento del implante protésico y en las 72h siguientes, y se retiraba en caso de que no se produjese alteración eléctrica que requiriese estimulación cardiaca permanente.
Desde febrero de 2010 hasta diciembre de 2013, se estudió a un subgrupo de 137 pacientes consecutivos (figura 1) mediante estudio electrofisiológico (EEF) antes y a los 30min del implante valvular. Se introdujo un electrocatéter tetrapolar a nivel de His para registro de los intervalos AH y HV (medidos en milisegundos). Se consideraron normales los intervalos AH y HV<120 y<60 ms, respectivamente.
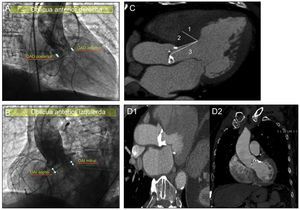
Estudio de la profundidad protésica en el ventrículo izquierdo y su relación con el septo interventricularEspecial énfasis se puso en el análisis de la profundidad del implante valvular y el estudio del septo interventricular. Para el estudio de la profundidad valvular, se realizaron dos proyecciones angiográficas ortogonales (figuras 2A y B), en oblicua anterior izquierda y oblicua anterior derecha.
A: determinación de la profundidad protésica en el tracto de salida del ventrículo izquierdo medida en proyección oblicua anterior derecha: «anterior» y «posterior». B: determinación de la profundidad protésica en el tracto de salida del ventrículo izquierdo medida en proyección oblicua anterior izquierda: «septal» y «mitral». C: análisis del septo interventricular mediante angiografía por tomografía computarizada; 1, medida del máximo grosor septal; 2, medida de la distancia desde el extremo del anillo aórtico al punto de máximo grosor septal; 3, medida de la distancia desde el centro del anillo aórtico al punto de máximo grosor septal. D: análisis de la presencia y la localización de calcificación subanular mediante angiografía por tomografía computarizada: calcificación subvalvular en relación con la válvula mitral (D1) y calcificación subvalvular en relación con el septo interventricular (D2). OAD: oblicua anterior derecha; OAI: oblicua anterior izquierda.
El anillo aórtico se consideró en la angiografía como la línea que une el punto más bajo de la cúspide coronariana derecha y el punto más bajo de la cúspide coronariana izquierda6. Las diferentes profundidades se midieron como la distancia desde el anillo aórtico hasta el último «rombo» de la prótesis introducido en el ventrículo izquierdo.
En la proyección oblicua anterior izquierda, se tomaron las siguientes medidas: profundidad de la prótesis en relación con la válvula mitral y profundidad de la prótesis en relación con el septo interventricular (figura 2B). En la proyección oblicua anterior derecha, se tomaron la profundidad de la prótesis «anterior» y la profundidad de la prótesis «posterior» (figura 2A). Para todos los pacientes se utilizó el mismo sistema de calibración angiográfica digital (Innova 2100, General Electric; Missouri, Estados Unidos).
En cuanto al estudio del septo interventricular, se analizó su grosor diastólico mediante TC (figura 2C): máximo grosor septal, distancia desde anillo aórtico al punto de máximo grosor septal y distancia desde el centro del anillo aórtico al punto de máximo grosor septal. Además, mediante TC se analizó la presencia o ausencia de calcificación a nivel subvalvular aórtico, así como su localización en relación con la válvula mitral o con el septo interventricular (figura 2D).
ObjetivosEl objetivo principal del estudio es analizar la necesidad de marcapasos definitivo en las primeras 72h tras el implante de la prótesis CoreValve. Este se indicó en caso de BAV de tercer grado o segundo grado Mobitz II, con o sin síntomas. Se hizo especial hincapié en el análisis de predictores de necesidad de marcapasos en las primeras 72h tras el implante de la prótesis aórtica CoreValve.
Asimismo, se analizaron los cambios que se producen en la conducción auriculoventricular de los pacientes que se someten a este tipo de tratamiento percutáneo, estudiados mediante ECG de superficie (intervalos PR y QRS, nuevos casos de bloqueo de rama derecha [BRD] o izquierda [BRI] y BAV completo) y electrogramas intracavitarios (intervalos AH y HV).
Como objetivo secundario, se analizó la progresión tardía de alteraciones en la conducción que hicieran necesario el implante ulterior de marcapasos definitivo. Este se indicó cuando tardíamente el paciente presentase síncope con graves trastornos en la generación y/o la conducción de impulsos.
Análisis estadísticoTodos los datos se presentan como media±desviación estándar para las variables cuantitativas, y en porcentaje, para las variables categóricas. La comparación de variables categóricas se efectuó con la prueba de la χ2 y la de las variables cuantitativas, la t de Student para datos apareados. Se aceptaron como estadísticamente significativos los resultados obtenidos con p<0,05. Para la predicción de la necesidad de marcapasos, se realizó estudio multivariable mediante regresión logística utilizando el método de exclusión por pasos (backward stepwise), en el que se incluyeron todas las variables que resultaron significativas en el análisis univariable. Se expresan los resultados mediante la odds ratio y el intervalo de confianza del 95%.
En el análisis de predictores se analizaron variables clínicas (sexo, síntomas), del ECG de superficie (presencia basal de fibrilación auricular, BRD, BRI, BAV primer grado, bloqueo bifascicular o hipertrofia ventricular, así como el análisis del PR medio y del QRS medio), estructurales o anatómicas (anillo aórtico por TC y ecocardiograma transtorácico, presencia de calcificación subvalvular aórtica por TC, localización de dicha calcificación subvalvular, profundidad del implante de la prótesis CoreValve en el TSVI y análisis del septo interventricular por TC: grosor y morfología) y de los electrogramas intracavitarios (análisis del intervalo AH y HV).
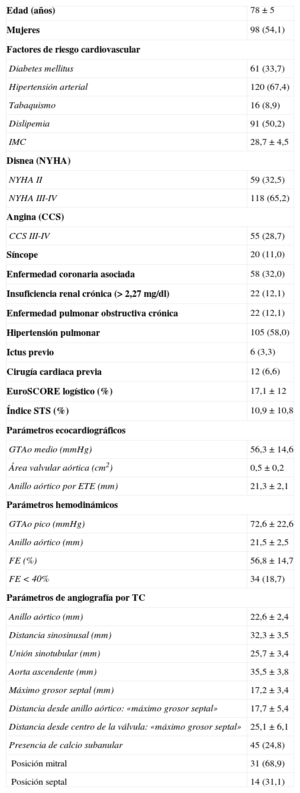
RESULTADOSLa media de edad fue 78±5 años, con un EuroSCORE logístico medio estimado del 17,1±12%. Los datos basales de la serie, tanto clínicos como los obtenidos mediante las diferentes técnicas diagnósticas realizadas, quedan recogidos en la tabla 1.
Características basales de los pacientes (n=181)
| Edad (años) | 78±5 |
| Mujeres | 98 (54,1) |
| Factores de riesgo cardiovascular | |
| Diabetes mellitus | 61 (33,7) |
| Hipertensión arterial | 120 (67,4) |
| Tabaquismo | 16 (8,9) |
| Dislipemia | 91 (50,2) |
| IMC | 28,7±4,5 |
| Disnea (NYHA) | |
| NYHA II | 59 (32,5) |
| NYHA III-IV | 118 (65,2) |
| Angina (CCS) | |
| CCS III-IV | 55 (28,7) |
| Síncope | 20 (11,0) |
| Enfermedad coronaria asociada | 58 (32,0) |
| Insuficiencia renal crónica (> 2,27 mg/dl) | 22 (12,1) |
| Enfermedad pulmonar obstructiva crónica | 22 (12,1) |
| Hipertensión pulmonar | 105 (58,0) |
| Ictus previo | 6 (3,3) |
| Cirugía cardiaca previa | 12 (6,6) |
| EuroSCORE logístico (%) | 17,1±12 |
| Índice STS (%) | 10,9±10,8 |
| Parámetros ecocardiográficos | |
| GTAo medio (mmHg) | 56,3±14,6 |
| Área valvular aórtica (cm2) | 0,5±0,2 |
| Anillo aórtico por ETE (mm) | 21,3±2,1 |
| Parámetros hemodinámicos | |
| GTAo pico (mmHg) | 72,6±22,6 |
| Anillo aórtico (mm) | 21,5±2,5 |
| FE (%) | 56,8±14,7 |
| FE < 40% | 34 (18,7) |
| Parámetros de angiografía por TC | |
| Anillo aórtico (mm) | 22,6±2,4 |
| Distancia sinosinusal (mm) | 32,3±3,5 |
| Unión sinotubular (mm) | 25,7±3,4 |
| Aorta ascendente (mm) | 35,5±3,8 |
| Máximo grosor septal (mm) | 17,2±3,4 |
| Distancia desde anillo aórtico: «máximo grosor septal» | 17,7±5,4 |
| Distancia desde centro de la válvula: «máximo grosor septal» | 25,1±6,1 |
| Presencia de calcio subanular | 45 (24,8) |
| Posición mitral | 31 (68,9) |
| Posición septal | 14 (31,1) |
CCS: Canadian Cardiovascular Society; ETE: ecocardiograma transesofágico; FE: fracción de eyección; GTAo: gradiente transaórtico; IMC: índice de masa corporal; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons; TC: tomografía computarizada.
Algo más de un tercio de los pacientes (68 [36%]) tenían algún grado de alteración electrocardiográfica basal, bien por alteración de la conducción auriculoventricular, bien por alteración de la conducción a nivel intraventricular. Del total de la serie, 51 pacientes (27%) presentaban fibrilación auricular, 14 de ellos de tipo paroxístico.
En cuanto a los parámetros electrocardiográficos analizados, se objetivaron varios trastornos de la conducción auriculoventricular: 26 pacientes (14%) presentaban una conducción auriculoventricular alterada: 6 casos ya disponían previamente de un marcapasos definitivo por BAV completo; 21 (11%) tenían un BAV de primer grado, 2 de ellos asociado a hemibloqueo anterior izquierdo, 4 asociado a BRD y otros 4 asociado a BRI. El intervalo PR medio de la serie fue de 173±47ms.
En 53 pacientes (28%) existían alteraciones de la conducción intraventricular: 17 de ellos presentaban basalmente un BRI (9%) y 20 (11%) tenían BRD, bien aislado (10 [5,2%]), bien asociado a otros trastornos de la conducción intraventricular (10 pacientes tenían bloqueo bifascicular). Además, hubo 16 casos de hemibloqueo anterior izquierdo aislado (8,4%). La duración media del QRS en todos los pacientes fue de 98±22ms.
Cambios electrocardiográficos tras el implante valvular. Necesidad de marcapasos permanente en las primeras 72h tras el implanteLa tabla 2 recoge los datos electrocardiográficos previos y posteriores al implante observados en todos los pacientes: 23 (13%) presentaron BAV de primer grado de nueva aparición y 89 (49%), BRI (en 11 de ellos fue transitorio y desapareció en las primeras 72h tras el implante). No se produjo ningún BRD de nueva aparición. El PR medio se incrementó significativamente, de 173±47 a 190±52ms (p<0,01), y el QRS medio pasó de 98±22 a 129±24ms (p<0,01).
Incidencia de trastornos de conducción antes y después del implante de prótesis CoreValve
| Características electrocardiográficas | Antes | Después | p |
|---|---|---|---|
| Pacientes | 181 | 181 | |
| Conducción auriculoventricular | |||
| Intervalo PR (ms) | 173±47 | 190±52 | < 0,01 |
| Conducción intraventricular | |||
| Complejo QRS (ms) | 98±22 | 129±24 < 0,01 | |
| Bloqueo de rama derecha | 20 (13 evolucionaron a BAV completo) | 7 (ninguno de novo) | |
| Bloqueo de rama izquierda | 17 (1 evolucionó a BAV completo) | 105 (89 de novo, 11 de ellos transitorios) | |
| Características electrofisiológicas | Antes | Después | |
|---|---|---|---|
| Pacientes | 137 | 137 | |
| Intervalo AH (ms) | 95±39 | 108±41 | < 0,01 |
| Incremento medio AH (ms) | 13±22 | 13±22 | |
| Intervalo HV (ms) | 54±10 | 66±23 | < 0,01 |
| Incremento medio HV (ms) | 10,5±16 | 10,5±16 |
BAV: bloqueo auriculoventricular.
Hubo una incidencia de BAV completo en las primeras 72h tras el implante valvular del 18% (33 pacientes que precisaron marcapasos definitivo). De estos pacientes, 15 no tenían alteraciones electrocardiográficas previas al implante, 3 presentaban un hemibloqueo anterior izquierdo aislado, otros 13 presentaban BRD (bien aislado o bloqueo bifascicular) y un caso, BRI. Un paciente con BAV de primer grado basal también experimentó BAV completo (tabla 3). En 7 pacientes se produjo un BAV completo transitorio que se resolvió en las primeras 72h de evolución tras el implante (4 de ellos quedaron con BRI definitivo), sin necesidad de marcapasos definitivo (tabla 3).
Evolución temporal de la necesidad de marcapasos permanente
| Necesidad precoz de marcapasos (< 72 h tras el implante de CoreValve) | 33 (18,2) |
| Marcapasos definitivo | |
| Sin alteraciones de conducción basales | 15 (45,5) |
| Con hemibloqueo anterior izquierdo basal | 3 (9) |
| Con bloqueo de rama derecha basal | 13 (39,5) |
| Con BAV de primer grado basal | 1 (3) |
| Con bloqueo de rama izquierda basal | 1 (3) |
| Necesidad tardía de marcapasos (> 72 h tras el implante de CoreValve) | 13 (7,2) |
| Por bloqueo auriculoventricular completo | 9 (69) |
| Antes de 2 meses | 2 |
| Después de 2 meses | 7 |
| Por síncope con trastornos de la conducción graves | 4 (31) |
| Por BAV de primer grado y bloqueo de rama izquierda (meses 1 y 10) | 2 |
| Por bloqueo de rama izquierda y PR normal (primer mes) | 1 |
| Por BAV de primer grado con bloqueo de rama derecha y hemibloqueo anterior izquierdo (primer mes) | 1 |
BAV: bloqueo auriculoventricular.
Los valores expresan n (%).
En el subgrupo de 137 pacientes a los que se determinaron los intervalos intracavitarios antes y después del implante, el AH medio se incrementó significativamente de 95±39 a 108±41ms (p<0,01), y algo similar ocurrió con el intervalo HV, que pasó de 54±10 a 66±23ms (p<0,01) (tabla 2).
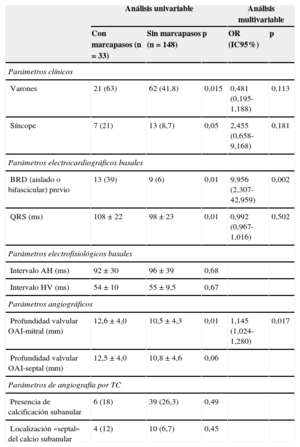
Predictores de marcapasos definitivo tras el implante valvularEn la tabla 4 se recogen las variables predictoras de implantación de marcapasos en los estudios univariable y multivariable. Los varones precisaron más marcapasos que las mujeres (p<0,02). La necesidad de implantar un marcapasos definitivo en las primeras 72h se relacionó con la anchura del QRS basal (108±22 frente a 98±23ms; p<0,01) y la presencia de un BRD basal, ya fuese aislado o asociado a hemibloqueo de la rama izquierda (p<0,01), así como con el antecedente de síncope (p<0,05). No hubo mayor proporción de necesidad de marcapasos en los pacientes con BRI basal. Ni la edad ni la presencia de fibrilación auricular resultaron ser predictoras de necesidad de marcapasos permanente. Los intervalos intracavitarios basales tampoco predijeron la necesidad de marcapasos tras el implante.
Factores predictores de necesidad de marcapasos definitivo en las primeras 72h tras el implante valvular
| Análisis univariable | Análisis multivariable | ||||
|---|---|---|---|---|---|
| Con marcapasos (n=33) | Sin marcapasos (n=148) | p | OR (IC95%) | p | |
| Parámetros clínicos | |||||
| Varones | 21 (63) | 62 (41,8) | 0,015 | 0,481 (0,195-1,188) | 0,113 |
| Síncope | 7 (21) | 13 (8,7) | 0,05 | 2,455 (0,658-9,168) | 0,181 |
| Parámetros electrocardiográficos basales | |||||
| BRD (aislado o bifascicular) previo | 13 (39) | 9 (6) | 0,01 | 9,956 (2,307-42,959) | 0,002 |
| QRS (ms) | 108±22 | 98±23 | 0,01 | 0,992 (0,967-1,016) | 0,502 |
| Parámetros electrofisiológicos basales | |||||
| Intervalo AH (ms) | 92±30 | 96±39 | 0,68 | ||
| Intervalo HV (ms) | 54±10 | 55±9,5 | 0,67 | ||
| Parámetros angiográficos | |||||
| Profundidad valvular OAI-mitral (mm) | 12,6±4,0 | 10,5±4,3 | 0,01 | 1,145 (1,024-1,280) | 0,017 |
| Profundidad valvular OAI-septal (mm) | 12,5±4,0 | 10,8±4,6 | 0,06 | ||
| Parámetros de angiografía por TC | |||||
| Presencia de calcificación subanular | 6 (18) | 39 (26,3) | 0,49 | ||
| Localización «septal» del calcio subanular | 4 (12) | 10 (6,7) | 0,45 | ||
BRD: bloqueo de rama derecha; IC95%: intervalo de confianza del 95%; OAI: oblicua anterior izquierda; OR: odds ratio; TC: tomografía computarizada.
Además, tenían mayor tendencia al BAV los pacientes cuyas prótesis alcanzaban mayor profundidad en el TSVI, sobre todo en el análisis de la profundidad en aortografía en la oblicua anterior izquierda en su relación con la válvula mitral (12,6±4,0 frente a 10,5±4,3mm; p<0,01). También había mayor tendencia hacia la necesidad de marcapasos cuando la prótesis quedaba implantada más profunda en el TSVI en relación con el septo interventricular, aunque sin alcanzar la significación estadística (12,5±4,0 frente a 10,8±4,6mm; p=0,06). No se hallaron diferencias respecto a las dimensiones del anillo aórtico, el grado de hipertrofia ventricular izquierda, la presencia de calcificación subvalvular ni su localización. En el estudio por TC, se observó tendencia a mayor necesidad de marcapasos en los pacientes con menor grosor del septo interventricular en su porción subaórtica, pero sin alcanzar la significación estadística (17,5±3,1 frente a 16,2±3,3mm; p=0,06) (figura 2C).
En el análisis multivariable, los únicos predictores independientes de la necesidad de marcapasos fueron la presencia de BRD basal (odds ratio=9,95; intervalo de confianza del 95%, 2,30-42,95; p=0,002) y la profundidad del stent valvulado en el ventrículo izquierdo, en su relación con la válvula mitral (odds ratio=1,14; intervalo de confianza del 95%, 1,02-1,28; p=0,017).
Necesidad tardía de marcapasos permanente. Análisis tardío de la conducción cardiaca mediante estudio electrofisiológicoEn 13 pacientes hubo necesidad tardía (más allá de las primeras 72h tras el implante de la prótesis CoreValve) de marcapasos definitivo por diferentes motivos: 9 experimentaron BAV completo en diferentes momentos de la evolución (2 en los primeros 2 meses y 7, después). Otros 4 pacientes requirieron marcapasos por presentar síncopes con trastornos graves de la conducción en el seguimiento (tabla 3).
Seis pacientes requirieron un nuevo EEF adicional tras el implante valvular, que se realizó entre el cuarto día y los 20 meses tras el implante. En este nuevo EEF se determinó el tiempo de recuperación sinusal y los intervalos AH y HV; con él se quiso dilucidar importantes cambios que se habían producido en la conducción cardiaca tras el implante valvular que precisaban una explicación electrofisiológica, y sirvió para tomar una firme decisión sobre implantar o no un marcapasos definitivo:
- •
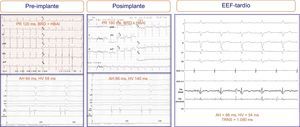
Dos pacientes experimentaron un importante deterioro de la conducción auriculoventricular tras el implante, que se normalizó en las siguientes 24h. Uno de ellos tras la suelta de la prótesis presentó BAV completo, que desapareció durante las primeras horas; en el nuevo EEF realizado a los 5 días, la conducción auriculoventricular estaba íntegra, con intervalos AH y HV normales. En el otro paciente, el implante de la válvula no alteró el ECG basal (BRD con hemibloqueo anterior izquierdo), aunque sí presentó un alargamiento significativo del HV (58 a 140ms); a los 7 días, una nueva valoración electrofisiológica objetivó la absoluta normalización de este (HV, 52ms) (figura 3). En ambos pacientes se decidió no implantar marcapasos y, tras un seguimiento de 29 y 30 meses respectivamente, no han presentado síntomas o eventos arrítmicos.
Figura 3.Electrogramas y electrocardiogramas de un paciente en el que no se registraron alteraciones electrocardiográficas tras el implante de la prótesis (se mantuvo el bloqueo bifascicular), si bien sí se presentaron cambios significativos en el electrograma intracavitario: alargamiento del intervalo HV (de 58 a 140ms). Una nueva valoración electrofisiológica tardía 7 días tras el implante objetivó la absoluta normalización de los intervalos intracavitarios. ADA, arteria descendente anterior; BRD: bloqueo de rama derecha del haz de His; EEF: estudio electrofisiológico; HBAI: hemibloqueo auricular izquierdo; TRNS: tiempo de recuperación del nodo sinusal; VD: ventrículo derecho.
(0.48MB). - •
En otros 3 pacientes el implante protésico no modificó los intervalos intracavitarios, pero en el seguimiento presentaron cuadros sincopales o astenia intensa. En uno de ellos, el nuevo EEF objetivó un BAV de alto grado con importante alargamiento del intervalo AH (180ms) a los 16 meses de seguimiento. En los otros dos, el EEF tardío no objetivó cambios en la conducción auriculoventricular, pero sí una disfunción sinusal al mes y los 20 meses de seguimiento respectivamente. Para estos 3 pacientes, la decisión fue implantar marcapasos definitivo.
- •
El paciente restante, tras el implante de la prótesis, quedó en ritmo sinusal con BAV de primer grado, y se objetivó un alargamiento significativo de los intervalos AH y HV. Durante las primeras 24h de evolución se observó un BAV completo de carácter paroxístico. Se realizó un nuevo EEF a los 4 días del implante, que puso de manifiesto un BAV completo a nivel infrahisiano. Se decidió implantar marcapasos definitivo.
Numerosas publicaciones han demostrado los beneficios del implante percutáneo de prótesis aórtica en el tratamiento de pacientes de edad avanzada con estenosis aórtica grave sintomática y de alto riesgo quirúrgico, si bien es un procedimiento que no está exento de mortalidad y morbilidad1,7. Entre las complicaciones que pueden aparecer con este tipo de prótesis, destaca el BAV con necesidad de estimulación cardiaca permanente. En nuestra serie, 46 pacientes (25%) requirieron antes o después el implante de marcapasos definitivo, cifra algo inferior a los datos procedentes de centros de nuestro entorno3,8; 33 de ellos (18%) lo experimentaron en las primeras 72h tras el implante protésico valvular. Los 13 restantes (7%) son pacientes que quedaron con trastornos de la conducción auriculoventricular y/o intraventricular y en el seguimiento precoz presentaron BAV completo o síntomas que aconsejaron implantar un marcapasos definitivo.
Cribier et al9 ya objetivaron en la etapa del tratamiento de la estenosis aórtica mediante valvuloplastia con balón que, tras el inflado con balón sobre la válvula aórtica calcificada, se puede producir un BAV hasta en el 3,5-4,0% de los casos, debido al traumatismo causado por el balón en el sistema de conducción. Con la prótesis tipo Edward-SAPIEN, la inciencia de necesidad de marcapasos definitivo está en torno al 3,4%1, pero hay grupos que no han tenido que hacer ningún implante de marcapasos10; esta incidencia es muy inferior a la comunicada por diferentes autores11,12 tras el tratamiento con la prótesis aórtica percutánea CoreValve (18-47%). En cuanto al recambio quirúrgico de la válvula aórtica estenótica, el BAV completo se produce en un 3,5-8,0% de los casos13, y parece relacionado con daño del sistema de conducción durante la escisión de la válvula enferma y con las suturas quirúrgicas14.
Sin embargo, el trastorno de la conducción que apareció con más frecuencia no fue el BAV completo, sino el BRI, como han descrito otros autores (40-71%)8,11. Este se produjo en 89 casos (49%). Probablemente se deba al anclaje del stent valvulado en el septo interventricular, en íntima relación con la rama izquierda del haz de His15.
En ocasiones, los trastornos de conducción auriculoventricular e intraventricular son de carácter transitorio. En esta serie, ello ha ocurrido en 7 pacientes con BAV completo y 11 de los BRI de nueva aparición, que recobraron la conducción a las 24–48h. Estos casos podrían ser secundarios al edema que se produce alrededor del territorio circundante al sistema de conducción. Al resolverse este edema, estos trastornos desaparecerían. En uno de los pacientes que presentó BAV completo de carácter transitorio y prolongado (> 24h), se realizó un EEF al desaparecer el bloqueo. En él, se objetivó normalización de los intervalos AH y HV, por lo que no se indicó implante de marcapasos.
Por otro lado, el presente estudio es la más amplia serie consecutiva de pacientes tratados con prótesis CoreValve en la que se hayan analizado los electrogramas intracavitarios antes e inmediatamente después del implante protésico. En este análisis, se objetivó un enlentecimiento de la conducción infrahisiana, datos concordantes con los obtenidos por otros autores tras el implante de prótesis Edwards-SAPIEN4. Sin embargo, para el presente grupo de estudio, el hallazgo más llamativo del estudio quizá sea el incremento del intervalo AH, que se presenta en la práctica totalidad de los pacientes. Este hallazgo indica que también hay cierto daño del nódulo auriculoventricular compacto, que no se puede explicar por la mera relación anatómica entre la válvula aórtica, el TSVI y el sistema de conducción, que es la explicación que habitualmente se da a las alteraciones de la conducción cardiaca tras el implante valvular16. Teniendo en cuenta que el nódulo auriculoventricular se encuentra alejado del TSVI, en la cara septal auricular derecha, este incremento casi sistemático del intervalo AH debe tener otro origen. Quizá la fuerza radial que ejerce el stent de soporte también pudiera producir compresión tisular en zonas alejadas de la válvula aórtica y de las ramas del sistema His-Purkinje. Estos datos vienen a corroborar los ya aportados por otra serie publicada3, que incluye un número de pacientes inferior. De igual forma, en la gran mayoría de los pacientes que experimentaron un BAV completo tras el implante, no se consiguió registrar el electrograma de His en el EEF psterior al implante, lo que indica un importante daño de todo el sistema de conducción (nódulo auriculoventricular e His).
Factores predictores de necesidad de marcapasos definitivo en las primeras 72h tras el implante de prótesis CoreValvePredictores clínicosSe ha encontrado una asociación entre el antecedente de síncope y la necesidad de marcapasos permanente tras el implante valvular aórtico. Por lo tanto, puede que los síncopes que presentan estos pacientes no se deban solo a reducción del flujo a través de la válvula aórtica estenótica, sino también a los efectos de un sistema de conducción enfermo, con episodios de BAV y bloqueo intraventricular paroxísticos previos. En esta serie, algo más de un tercio de los pacientes presentaban alguna alteración basal de la conducción auriculoventricular y/o interventricular. Además, 2 pacientes a los que se realizó EEF en la evolución ulterior tras el implante, presentaban cierto grado de disfunción sinusal (pausa sinusal > 8 s y fibrilación auricular lenta, con intervalos HV normales). Todo esto indica que frecuentemente se trata a pacientes que ya tienen diferentes grados de trastornos de la conducción que pueden estar propiciando un empeoramiento tras el implante.
Predictores electrocardiográficos de superficie e intracavitariosEntre los factores predictores de implante de marcapasos, destaca la existencia basal de una conducción por el sistema de His-Purkinje más enlentecida, puesta de manifiesto por un QRS basal más ancho en el grupo que requirió implante de marcapasos, si bien en la evaluación del intervalo HV no hubo diferencias significativas en los pacientes que precisaron marcapasos definitivo. Esto pudo ser a expensas de una mayor prevalencia de BRD, datos similares a los de otras series16. Esto es lógico considerando que son pacientes que ya tienen una rama del sistema de His enferma y que el trastorno de la conducción que más frecuentemente se produce en estos pacientes es el BRI, por lo que se puede producir un bloqueo de ambas ramas, con el consecuente bloqueo completo infrahisiano. En 2003 Koplan et al13 describieron una escala de riesgo para predecir la necesidad de marcapasos en pacientes que iban a ser sometidos a cirugía cardiaca. Entre los principales predictores de esta eventualidad también figuraba la presencia de un BRD basal, así como la realización de cirugía valvular, incluida la cirugía de válvula tricúspide, íntimamente relacionada con el nódulo auriculoventricular y el sistema de conducción del haz de His. Tampoco la evaluación del intervalo AH fue predictora de la necesidad de marcapasos definitivo.
Predictores estructurales o anatómicosLos pacientes con un septo interventricular de menor grosor o con la zona de máximo espesor más próxima a la válvula aórtica nativa presentaron más tendencia a presentar BAV completo tras el implante, pero sin alcanzar significación estadística. Estos hallazgos podrían explicarse porque un septo de mayor grosor puede suponer una almohadilla protectora del sistema de conducción. Cuando el máximo espesor septal está más cercano al plano valvular, fuerza su contacto con el stent valvulado en el tracto de salida, lo que explicaría el posible daño del sistema de His tras el implante (figura 2C).
La calcificación subvalvular y su localización no influyeron en la necesidad de marcapasos definitivo. Estos datos contradicen los publicados por Latsios et al12, que, más que un análisis cualitativo de la calcificación subvalvular como el que se realiza en este trabajo, realizó un análisis cuantitativo de la cantidad de calcificación en la zona de liberación del dispositivo valvular percutáneo mediante angiografía por TC.
En cuanto a la profundidad de la prótesis en el ventrículo izquierdo, numerosos estudios han marcado esta variable como predictora de necesidad de implante de marcapasos11,12,16. Cuanto más profundo es el implante, mayor esta necesidad. En este trabajo se ha podido objetivar esta asociación al analizar la profundidad protésica en relación con la válvula mitral. También hubo tendencia a mayor necesidad de marcapasos permanente cuando la prótesis estaba implantada más baja en el TSVI en su relación con el septo interventricular, por donde el haz de His lo atraviesa y se divide en sus ramas derecha e izquierda. El origen de la rama izquierda se encuentra por debajo de la comisura situada entre los velos derecho y no coronario de la válvula aórtica, en íntima relación con el velo anterior de la válvula mitral15.
De todas las variables estudiadas, los únicos factores independientes de la necesidad de marcapasos en el modelo de regresión han resultado ser la presencia de un BRD previo al implante y la profundidad que alcanza la prótesis en el ventrículo izquierdo en su relación con la válvula mitral. Estos factores, junto con los diferentes grados de trastorno basal de la conducción en la gran mayoría de los pacientes, predisponen a su agravamiento tras el implante valvular.
CONCLUSIONESLos pacientes sometidos a implante percutáneo de válvula aórtica tienen una alta prevalencia de alteraciones de la conducción auriculoventricular e intraventricular, que tienden a agravarse tras el implante protésico. El principal trastorno de la conducción que se produce es el bloqueo completo de la rama izquierda del haz de His. El BAV completo con necesidad de marcapasos definitivo se produce en una cuarta parte de los pacientes, la mayoría de las ocasiones en las primeras 72h tras el implante.
Además de producir una alteración de la conducción intraventricular por lesión del haz de His y sus ramas (puesto de manifiesto por un alargamiento sistemático del intervalo HV), el implante puede alterar la conducción auriculoventricular por el nódulo auriculoventricular compacto (alargamiento sistemático del intervalo AH), a pesar de estar en una posición distante de la estructura protésica.
Los únicos factores independientes predictores de necesidad de marcapasos permanente son el BRD basal y un implante del stent valvulado demasiado profundo en el TSVI.
CONFLICTO DE INTERESESNinguno.