La transposición de grandes vasos es una cardiopatía congénita frecuente, con alta supervivencia y escaso número de secuelas, especialmente si se interviene precozmente, en el periodo neonatal. Nuestro objetivo es describir las características y la evolución de los pacientes afectados y determinar posibles factores pronósticos de morbimortalidad precoz y a largo plazo.
MétodosEstudio retrospectivo mediante revisión de historias clínicas y base de datos de los pacientes con transposición de grandes vasos ingresados entre los años 2000 y 2011.
ResultadosIngresaron 136 pacientes afectados de transposición de grandes vasos, de los que 119 se sometieron a cirugía correctora durante el periodo neonatal. Los pacientes se dividieron en tres grupos: grupo I, 81 transposición de grandes vasos simple; grupo II, 24 con comunicación interventricular concomitante, y grupo III, 31 transposiciones «complejas». La supervivencia postoperatoria fue de 96,7% (115 de 119 pacientes), aunque ningún paciente del grupo I falleció. La duración de la cirugía, la intubación y el uso posquirúrgico de inotrópicos y el tiempo de ingreso fueron mayores para los pacientes de los grupos II y III. Tras una media de 6 años de seguimiento, el 90,4% (123 de 136) de los pacientes estaban vivos. La lesión residual más frecuente en el seguimiento fue la estenosis supravalvular pulmonar en 33 de 113 pacientes seguidos.
ConclusionesEn nuestro estudio, la supervivencia en el conjunto de pacientes con transposición de grandes vasos, y especialmente los sometidos a switch arterial, es alta. Los pacientes con formas más complejas tienen más complicaciones hospitalarias, pero no tras el seguimiento.
Palabras clave
La enfermedad cardiaca congénita es la malformación mayor más común y una importante causa de morbimortalidad en el periodo neonatal, que ocurre en 4-10/1.000 nacidos vivos1.
En las últimas tres décadas, se ha producido un incremento en la supervivencia de estos pacientes debido, principalmente, al progreso en el diagnóstico por ecocardiografía fetal y neonatal, la amplia utilización de la prostaglandina E1 y el avance en los aspectos técnicos en las unidades cardioquirúrgicas2.
Los defectos cardiacos críticos no reparados pueden resultar en daño secundario progresivo e irreversible de diferentes órganos. La cirugía reparadora en este periodo ofrece la oportunidad de disminuir la mortalidad y prevenir el daño secundario3.
La transposición de grandes vasos (TGV) representa un 5-7% de las cardiopatías congénitas. Durante las últimas décadas, la naturaleza de la TGV se ha estudiado con más precisión. Van Praagh et al4 han ayudado a clarificar la anatomía e incluye la TGV en las alteraciones del desarrollo conotruncal que conlleva mala posición de las grandes arterias. Dentro de este grupo se incluyen, además de la TGV, el ventrículo derecho de doble salida (VDDS), el ventrículo izquierdo de doble salida y la transposición corregida anatómicamente4.
Aproximadamente la mitad de los pacientes con TGV no tienen otras malformaciones cardiacas, lo que se denomina TGV simple4–6. El resto es la denominada TGV compleja, en la que hay otras malformaciones concomitantes.
El tratamiento principal de la TGV simple es la cirugía correctora en el periodo neonatal7. Existen varias técnicas quirúrgicas, pero la de elección es el switch arterial (SA), descrito por Jatene et al. en 19758. Con esta técnica se ha demostrado alta supervivencia, con escasas secuelas a medio y largo plazo9–11. Los objetivos de este estudio son:
- •
Conocer la evolución de los neonatos afectados de TGV que fueron intervenidos quirúrgicamente mediante SA en el periodo neonatal durante el periodo del estudio.
- •
Describir las diferencias en la evolución de los pacientes intervenidos mediante SA según estuvieran afectados de TGV simple, transposición con comunicación interventricular (CIV) o transposición compleja asociada a otras malformaciones.
- •
Determinar factores pronósticos de morbimortalidad en los pacientes intervenidos de SA simple o combinado con otra cirugía en el periodo neonatal.
- •
Conocer la evolución cardiológica a largo plazo de los pacientes afectados de TGV.
Se trata de un estudio retrospectivo en el que se incluyó de manera consecutiva a todos los pacientes ingresados en el servicio de neonatología con diagnóstico de TGV. Periodo de estudio: abril de 2000 a diciembre de 2011. Ingresaron en el servicio de neonatología 7.935 pacientes, y se diagnosticó de cardiopatía congénita a 781 (10,3%) de ellos. Del total de cardiopatías congénitas, 136 pacientes (17,4%) fueron TGV simples o complejas; 59 (43,6%) fueron ingresos internos (propia maternidad) y a 77 (56,6%) los habían remitido de otros centros.
El peso medio al nacimiento fue 3.227 ± 506 g y la edad gestacional media, 39 ± 1,7 semanas; 102 (75%) eran niños y 34 (25%), niñas.
Pacientes y grupos de estudioSe dividió a los pacientes en tres grupos según los hallazgos ecocardiográficos: grupo I, 81 recién nacidos con TGV simple (59%); grupo II, 24 recién nacidos con TGV y CIV (18%), y grupo III, 31 recién nacidos con TGV «complejas» susceptibles de tratamiento con SA: 12 casos con VDDS y arterias en transposición, 11 con coartación de aorta y/o arco aórtico hipoplásico y 8 con estenosis pulmonar y CIV (23%).
Metodología ecocardiográficaLos defectos cardiacos congénitos se identificaron en todos los casos por ecocardiografía bidimensional Doppler color. La clasificación de los defectos cardiacos se hizo según la propuesta en la International Nomenclature and Database Conference for Pediatric Cardiac Surgery12. En pacientes con más de un defecto cardiaco, la lesión con el mayor efecto hemodinámico fue la elegida.
Manejo inicial de los pacientesSegún el protocolo hospitalario, se transfiere a las gestantes con diagnóstico prenatal de cardiopatía para control prenatal y manejo neonatal precoz. Tras el nacimiento, se canaliza inmediatamente acceso venoso central para la administración de prostaglandina E1. En las primeras 24 h de vida, se realiza atrioseptostomía de Rashkind en los pacientes con TGV simple y foramen oval restrictivo. La cirugía correctora se programa en las primeras semanas de vida.
Técnica quirúrgicaLa cirugía correctora se realiza con circulación extracorpórea (CEC) e hipotermia y consiste en la técnica de SA descrita por Jatene et al8. Si el paciente presenta CIV, se corrige con parche de pericardio heterólogo en el mismo acto quirúrgico. En los casos de VDDS y TGV, se practica SA y cierre de la CIV siempre que sea posible la continuidad de los ventrículos con las grandes arterias. En caso de coartación de aorta, se corrige con coartectomía y anastomosis terminoterminal con extensión a la cara inferior del arco aórtico.
En caso de realizarse switch auricular (intervención de Senning), se procede a la práctica de plastias a nivel auricular que redistribuyen la sangre venosa procedente de las cavas hacia la arteria pulmonar y la sangre oxigenada a la aorta. El patrón coronario se describe en el momento quirúrgico siguiendo la clasificación de Leiden13.
Tratamiento posquirúrgico precozLos pacientes sometidos a cirugía reingresan en el servicio de neonatología, donde se los maneja según pautas establecidas. Tras el SA, se inicia perfusión de inotrópicos con milrinona y dopamina dosificadas según respuesta clínica. Todos los pacientes reciben analgesia con fentanilo y ventilación mecánica. A partir de las 24-48h, si no se constatan complicaciones respiratorias (edema pulmonar, atelectasia, neumonía), se programa la extubación.
Seguimiento tras el altaSe da seguimiento a los pacientes en consultas externas de cardiología. La primera visita tras el alta hospitalaria se realiza en el primer mes y después cada 6 meses si no se producen complicaciones. En la visita se realiza anamnesis orientada a la aparición de posibles complicaciones y exploración física, electrocardiograma y ecocardiograma. En caso de complicaciones, se amplía el estudio programando las pruebas que en cada caso se considere oportunas.
Análisis estadísticoLos datos categóricos se presentan como número y porcentaje y los datos cuantitativos, como media ± desviación estándar en caso de variables de distribución normal y mediana (intervalo) en caso de distribuciones no normales. Se utilizó el test de la χ2 o la prueba exacta de Fisher para comparar variables categóricas y la de la t de Student o la U de Mann-Whitney para comparar variables continuas asociadas con variables dependientes (dicotómicas). Para la comparación de las variables cuantitativas de los diferentes grupos, se realiza un análisis de la varianza. Los datos se analizan utilizando SPSS 19.0 para Windows.
RESULTADOSMuestra generalDe los 136 pacientes incluidos en el estudio, 49 (36%) tenían diagnóstico prenatal de TGV. Este porcentaje varió según fueran pacientes internos o remitidos desde otros hospitales. Así, tenían diagnóstico prenatal 44 (74,5%) de los 59 pacientes internos y 5 (6,5%) de los 77 pacientes remitidos de otros centros.
La mayoría de los pacientes sin diagnóstico prenatal de cardiopatía presentaron síntomas en las primeras 24 h de vida (75 de 87 [86%]).
La cianosis fue el signo clínico hallado más frecuentemente, tanto sola (27 casos [31%]) como junto con soplo (25 casos [28,7%]).
Manejo inicialSe administró prostaglandina intravenosa en 125 casos (92%). A 108 pacientes (79,4%) se les practicó atrioseptostomía de Rashkind a las 34 h de vida de media.
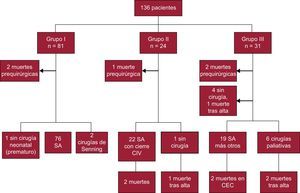
Tratamiento quirúrgico realizado según el grupo de estudioEn la figura se muestra el tratamiento quirúrgico de los pacientes según el grupo de estudio. Grupo I: de los 81 pacientes, 1 paciente fue prematuro extremo y no se hizo cirugía en el periodo neonatal, a 2 se les practicó una cirugía de Senning y a 76 pacientes, SA; 2 pacientes fallecieron antes de la cirugía. Grupo II: de los 24 pacientes, 1 falleció antes de la cirugía y a 1 se le dio el alta sin cirugía correctora neonatal por anatomía desfavorable. En 22 (91,6%), se realizó SA con cierre de la CIV. Grupo III: de los 31 pacientes, 10 no eran candidatos a SA por anatomía desfavorable y 2 fallecieron antes de la cirugía. Sin embargo, en 10 de12 con VDDS y TGV, 7 de 11 casos con coartación de aorta y/o arco aórtico hipoplásico y 2 de 8 casos con estenosis pulmonar y CIV, se practicó cirugía correctora definitiva (19 casos).
Así, en el periodo de estudio, se realizó cirugía correctora neonatal a 119 pacientes (87,5%). En 117 fue SA y en 2, cirugía tipo Senning. La media de edad en el momento de la cirugía fue 14 ± 9,4 días y la media de peso, 3.336 ± 430 g.
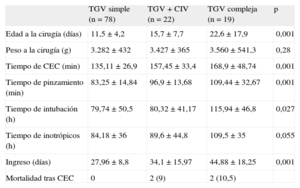
A los pacientes con TGV simple se los intervino de media a los 11,5 ± 0,4 días de vida, mientras que en las demás TGV la media de edad a la cirugía fue 19,6 ± 14 días. Estas diferencias son estadísticamente significativas (tabla 1).
Variables quirúrgicas y posquirúrgicas
| TGV simple (n = 78) | TGV + CIV (n = 22) | TGV compleja (n = 19) | p | |
| Edad a la cirugía (días) | 11,5 ± 4,2 | 15,7 ± 7,7 | 22,6 ± 17,9 | 0,001 |
| Peso a la cirugía (g) | 3.282 ± 432 | 3.427 ± 365 | 3.560 ± 541,3 | 0,28 |
| Tiempo de CEC (min) | 135,11 ± 26,9 | 157,45 ± 33,4 | 168,9 ± 48,74 | 0,001 |
| Tiempo de pinzamiento (min) | 83,25 ± 14,84 | 96,9 ± 13,68 | 109,44 ± 32,67 | 0,001 |
| Tiempo de intubación (h) | 79,74 ± 50,5 | 80,32 ± 41,17 | 115,94 ± 46,8 | 0,027 |
| Tiempo de inotrópicos (h) | 84,18 ± 36 | 89,6 ± 44,8 | 109,5 ± 35 | 0,055 |
| Ingreso (días) | 27,96 ± 8,8 | 34,1 ± 15,97 | 44,88 ± 18,25 | 0,001 |
| Mortalidad tras CEC | 0 | 2 (9) | 2 (10,5) |
CEC: circulación extracorpórea; CIV: comunicación interventricular; TGV: transposición de grandes vasos.
Los valores expresan media ± desviación estándar o n (%).
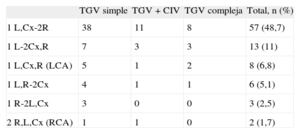
Respecto a los tiempos quirúrgicos, el tiempo medio de CEC de los 117 pacientes sometidos a SA fue 144 ± 34 min y el tiempo medio de pinzamiento, 90 ± 20 min. Al comparar variables intraoperatorias y postoperatorias según el grupo diagnóstico, se observaron diferencias significativas respecto tiempo de CEC, tiempo de pinzamiento, tiempo de intubación posquirúrgica y tiempo de inotrópicos posquirúrgicos (tabla 1). Los patrones coronarios hallados se muestran en la tabla 2. En 4 de 117 pacientes (3%), se hizo cierre diferido del tórax.
Patrones coronarios
| TGV simple | TGV + CIV | TGV compleja | Total, n (%) | |
| 1 L,Cx-2R | 38 | 11 | 8 | 57 (48,7) |
| 1 L-2Cx,R | 7 | 3 | 3 | 13 (11) |
| 1 L,Cx,R (LCA) | 5 | 1 | 2 | 8 (6,8) |
| 1 L,R-2Cx | 4 | 1 | 1 | 6 (5,1) |
| 1 R-2L,Cx | 3 | 0 | 0 | 3 (2,5) |
| 2 R,L,Cx (RCA) | 1 | 1 | 0 | 2 (1,7) |
CIV: comunicación interventricular; Cx: circunfleja; L: arteria coronaria izquierda; LCA: arteria coronaria izquierda única; R: derecha; RCA: arteria coronaria derecha única; TGV: transposición de grandes vasos.
Para los pacientes intervenidos de SA, la estancia hospitalaria total media fue 32 ± 13 días. Se hallaron diferencias significativas en el tiempo de ingreso entre grupos, con menor estancia hospitalaria para los afectados de TGV simple (tabla 1).
MortalidadMortalidad prequirúrgica: fallecieron 5 pacientes (2 del grupo I, 1 del grupo II y 2 del grupo III). Las causas fueron: shock cardiogénico refractario, enterocolitis necrosante en contexto de prematuridad extrema, taponamiento cardiaco tras cateterismo, parada cardiorrespiratoria durante el cateterismo y síndrome de Charge asociado. Tanto el paciente que ingresó en shock cardiogénico como el que presentó taponamiento cardiaco no tenían diagnóstico prenatal.
Mortalidad intraquirúrgica: 3 pacientes (3 de 117 [2,5%]) (tabla 1): 2 con VDDS y TGV y una tercera paciente (del grupo II) que entró en quirófano de urgencia por fallo hemodinámico en contexto de sepsis; se realizó SA, pero falleció en quirófano.
Mortalidad posquirúrgica precoz: una paciente del grupo II: (TGV y CIV) falleció tras requerir soporte con membrana de oxigenación extracorpórea por fallo multiorgánico secundario a sepsis por Candida tras cirugía.
En resumen, la mortalidad precoz post-SA (menos de 30 días tras cirugía) fue de 4 casos (3,4%).
Mortalidad tardía (tras el alta): 4 pacientes fallecieron tras el alta hospitalaria, 3 de ellos afectados de cardiopatías complejas y el cuarto afectado de TGV y CIV grande. A ninguno de estos pacientes se lo había considerado candidato a cirugía correctora neonatal.
Ningún paciente intervenido de SA murió tras el alta durante el seguimiento.
La baja mortalidad post-SA no permite obtener resultados estadísticamente significativos relacionados con las variables operatorias recogidas o el diagnóstico prenatal.
MorbilidadHubo sospecha analítica de infección (22 de 117 casos [18,8%]), sepsis con hemocultivo positivo (12 de 117 [10,2%]) e infección de orina en 4 casos (4 de 117 casos (3,4%). En 22 casos se produjeron arritmias en el postoperatorio inmediato, que requirieron colocación de marcapasos en 2 casos y tratamiento médico en 6; los demás se resolvieron espontáneamente. La complicación pulmonar más frecuente fue el edema pulmonar, asociado o no a derrame pleural (20 casos [17%]). Hubo 9 casos de parálisis diafragmática.
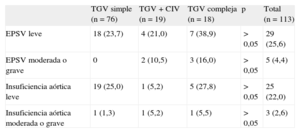
Seguimiento cardiacoSe recuperaron los datos de seguimiento cardiológico de 113 pacientes de los intervenidos entre 2000 y 2011. El periodo de seguimiento fue de entre 1 y 12 años (media, 6 años). La lesión residual más frecuente (tabla 3) fue la estenosis pulmonar supravalvular (34 de 113 [30%]). En 29 pacientes se catalogó como leve; en 1, moderada (fue necesario realizar angioplastia valvular pulmonar), y en 4 casos, grave (requirió angioplastia en 2 pacientes y ampliación del tracto de salida del ventrículo derecho con parche pericárdico en otros 2). En segundo lugar en frecuencia se observó insuficiencia aórtica valvular (28 pacientes [20,5%]): leve en 25 casos y moderada en 3. Ningún caso precisó reintervención.
Lesiones residuales tras el switch arterial (n = 113)
| TGV simple (n = 76) | TGV + CIV (n = 19) | TGV compleja (n = 18) | p | Total (n = 113) | |
| EPSV leve | 18 (23,7) | 4 (21,0) | 7 (38,9) | > 0,05 | 29 (25,6) |
| EPSV moderada o grave | 0 | 2 (10,5) | 3 (16,0) | > 0,05 | 5 (4,4) |
| Insuficiencia aórtica leve | 19 (25,0) | 1 (5,2) | 5 (27,8) | > 0,05 | 25 (22,0) |
| Insuficiencia aórtica moderada o grave | 1 (1,3) | 1 (5,2) | 1 (5,5) | > 0,05 | 3 (2,6) |
CIV: comunicación interventricular; EPSV: estenosis pulmonar supravalvular; TGV: transposición de grandes vasos.
Los datos expresan n (%).
En 2 pacientes con TGV y coartación, durante el seguimiento se produjo recoartación que precisó cateterismo y angioplastia. Uno de los pacientes con TGV y CIV tenía una CIV significativa que precisó recolocación de parche.
La presencia de lesiones residuales no es estadísticamente más frecuente en las TGV complejas.
DISCUSIÓNEn nuestro medio, el diagnóstico prenatal de TGV en esta serie es similar al 38% referido por otros autores, como Strauss et al3. El porcentaje más elevado entre los pacientes internos se explicaría por el traslado prenatal de la gestante con el fin de que el nacimiento se produzca en un hospital de tercer nivel.
Los pacientes con diagnóstico prenatal no presentaron diferencias en la evolución respecto a los que no lo tenían; ello puede deberse a la baja mortalidad observada y a la mejora en el transporte neonatal. Sin embargo, los dos únicos pacientes con TGV simple que fallecieron no tenían diagnóstico prenatal, y posiblemente su evolución habría mejorado de haberse diagnosticado prenatalmente.
Respecto al manejo inicial, en series como la de Hraska et al14, el 88% de los pacientes recibieron prostaglandina E1 y al 88% se le practicó atrioseptostomía (cifra más similar a la de la serie que presentamos).
Los grupos de estudio son similares a los incluidos por otros grupos como los de Prifti et al15, Swartz et al16, Fricke et al17 y Hraska et al14; en general, los autores comparan igualmente la evolución de pacientes sometidos a SA dividiéndolos en grupos: en ocasiones solo según se tratase de una TGV simple o TGV más CIV, y en otras poniendo como grupos aparte las TGV con coartación/hipoplasia del arco aórtico o VDDS. Al comparar el número de pacientes en cada grupo, se observa que la TGV simple suele estar entre el 66 y el 74% del total de las TGV, algo mayor que lo observado en nuestra serie (59%). Las TGV asociadas a CIV van del 26 al 29% (el 18% en nuestra serie) y las denominadas complejas, del 6 al 16% (el 23% en nuestra serie). Los porcentajes de cada serie pueden depender de a qué pacientes se incluya o se rechace para cirugía de SA en cada centro; en este sentido, en nuestra serie hay un porcentaje de pacientes con TGV complejas discretamente mayor.
El patrón coronario más frecuente fue 1L,C-2R, aunque en un porcentaje menor que en otros estudios7,12,18–22. En algunos artículos se relaciona el patrón anormal (como coronarias intramurales o una arteria coronaria única) con aumento del riesgo quirúrgico18,20,21,23; sin embargo, en estudios más recientes9,12,22,24 no se ha hallado una relación significativa, al igual que en nuestro estudio. La mortalidad a largo plazo sí podría verse influida por esta complicación, aunque en nuestro estudio no hubo mortalidad asociada a obstrucción coronaria durante un seguimiento de hasta 12 años.
Kempny et al25 presentan la evolución en la edad adulta de una serie de pacientes intervenidos de SA. Tras un análisis para conocer las variables asociadas a mal pronóstico (definido por la evolución combinada de muerte o reintervención en la edad adulta), los autores encontraron que los patrones coronarios no comunes (tipo no A) fueron de las variables con más riesgo asociado a dicho mal pronóstico.
Respecto a las variables quirúrgicas, los tiempos de CEC14–17,26 en la serie de Prifti et al15 son de 135 min en TGV y 154 min en TGV más CIV u otras malformaciones, y en la de Fricke et al17, 156 y 180 min respectivamente, datos similares o discretamente superiores a los presentados aquí. La serie de Fricke et al17, sin embargo, abarca un gran número de pacientes (618) y en un periodo muy amplio (1983-2009), lo que conlleva que los resultados puedan ser diferentes en cada etapa, como los propios autores refieren. El tiempo de pinzamiento aórtico en la TGV simple es una media de 90 min en la serie de Prifti et al15 y 117 min en TGV más CIV y CIV complejas; Fricke et al17 publicaron tiempos de 80 y 103 min respectivamente. De nuevo son tiempos similares a los casos que ahora presentamos (tabla 1). La mayor dificultad para alcanzar la estabilización clínica que permita la cirugía puede ser la causa de que la edad a la que se realiza el SA a los pacientes con TGV y otro defecto sea mayor. Este mismo dato se recoge en otras series publicadas15,17.
La mortalidad tras el alta es infrecuente en las series publicadas14–17,26 y la mortalidad hospitalaria es mayor riesgo para el paciente. La literatura médica sitúa la mortalidad tras el switch en los últimos años entre el 0,8 y el 9%, similar a la que reportamos7,9,11,12,18,27.
La serie más recientemente publicada de pacientes intervenidos de TGV en nuestro país es la de García-Hernández et al19; presentan resultados de pacientes con datos epidemiológicos similares a los de nuestro centro: 121 pacientes intervenidos en un periodo de casi 15 años; 80 pacientes afectados de TGV simple y 41 pacientes con TGV y CIV. En cuanto a los datos, los tiempos de cirugía (CEC, pinzamiento aórtico) y ventilación mecánica son algo superiores a los de nuestros pacientes. Los autores ya comentan en este interesante artículo que los tiempos de CEC mayores de 150min se asocian con mayor mortalidad por la afección multiorgánica posterior a la CEC19,24. Otro factor que se asocia con peor evolución es el cierre diferido del tórax, realizado en quirófano en 38 pacientes (31,4%) en la serie de García-Hernández et al. Según estos autores, la tasa de mortalidad entre los pacientes con TGA y CIV fue del 0%, pero solo en una cuarta parte de los casos se corrige la CIV en el mismo acto quirúrgico. Es relevante la disminución progresiva de la mortalidad en su centro hasta cerca del 2% en los últimos 5 años.
Las lesiones cardiacas residuales más frecuentes en la literatura médica sobre pacientes intervenidos de SA son la estenosis pulmonar supravalvular, la insuficiencia aórtica y la obstrucción coronaria10,20–22,24.
La estenosis pulmonar supravalvular es inherente al propio procedimiento quirúrgico. La incidencia descrita en la literatura médica va desde el 6% del estudio de Brown et al20 hasta el 56% referido por De Koning et al10 a los 10 años de seguimiento y el 57,6% de Kempny et al25, con seguimiento hasta la edad adulta. De Koning et al10 describen una tasa de reintervención del 30% de los casos, la mayoría durante la edad pediátrica. Es la causa más frecuente de reintervención de pacientes con TGV.
Sufrió insuficiencia aórtica en el seguimiento aproximadamente un tercio de los pacientes intervenidos. Fue el segundo defecto residual hallado con más frecuencia, aunque en la gran mayoría se catalogó como leve. La incidencia recogida es de un 4-60%10,20,24,25, aunque el porcentaje de casos graves que podrían requerir reintervención quirúrgica es nulo10,20–22,24,25.
De Koning et al10 refieren que hasta en el 70% se puede presentar dilatación de la raíz aórtica, y Haas et al21 describen un aumento progresivo de insuficiencia aórtica durante el seguimiento.
En la literatura médica11,28 se considera la isquemia miocárdica una complicación que tener en cuenta en el seguimiento de estos pacientes, ya que puede ser causa de reintervención y mortalidad a largo plazo. En la serie que presentamos, ningún paciente sufrió isquemia miocárdica.
Aunque los defectos residuales hallados en nuestro estudio tienen escasa relevancia clínica, los autores con seguimientos largos refieren que algunas complicaciones pueden aparecer o empeorar con los años. Así, es imprescindible un adecuado seguimiento cardiológico.
Limitaciones del estudioEl estudio presenta la evolución cardiológica de los pacientes intervenidos en el periodo neonatal de cirugía correctora de TGV en un solo centro. El periodo de estudio es de 11 años, con lo que es posible que el tratamiento total de los pacientes no haya sido exactamente uniforme con el paso del tiempo.
Otra limitación está en los resultados de la evolución a largo plazo de los pacientes con TGV. El seguimiento no se ha podido realizar completamente y se ha perdido a algunos pacientes.
CONCLUSIONESLa evolución de los pacientes afectados de TGV intervenidos quirúrgicamente mediante SA en el periodo neonatal ha sido satisfactoria en cuanto a índices de supervivencia, reintervención o aparición de complicaciones importantes en el seguimiento.
Se pudo someter finalmente a cirugía correctora en el periodo neonatal solo a dos tercios de los pacientes con TGV asociada a malformaciones tipo coartación de aorta, estenosis pulmonar o VDDS.
Hay diferencias en tiempo quirúrgico, necesidad de tratamiento médico y duración del ingreso entre los pacientes intervenidos mediante SA según estuvieran afectados de TGV simple, TCV con CIV o TGV compleja.
Tener una TGV con CIV u otro defecto concomitante aumenta el riesgo de muerte hospitalaria, mientras que ningún paciente con TGV simple de la serie que presentamos falleció en el periodo de estudio.
En cuanto a la evolución a largo plazo de los pacientes afectados de TGV intervenidos en el periodo neonatal, la estenosis supravalvular pulmonar es el defecto residual más frecuente.
CONFLICTO DE INTERESESNinguno.