La terapia de resincronización cardiaca con desfibrilador aumenta la supervivencia y mejora la calidad de vida en insuficiencia cardiaca avanzada. Tradicionalmente, se ha excluido a los pacientes con fracción de eyección >35% calculada por ecocardiografía. Evaluamos el impacto pronóstico de dicha terapia en un grupo de pacientes con disfunción sistólica grave por ecocardiografía pero con fracción de eyección >35% por resonancia magnética cardiaca.
MétodosSe analizaron los ingresos por insuficiencia cardiaca entre 2004 y 2011 en clase funcional II-IV, QRS ≥120 ms, fracción de eyección por ecocardiografía ≤35% y estudio de resonancia magnética cardiaca según protocolo local. Se incluyó a los pacientes (n=103) con implante de dispositivo en prevención primaria. Se registró la incidencia de arritmias ventriculares, reingreso por insuficiencia cardiaca y mortalidad total. La muestra se dividió según la función sistólica por resonancia magnética fuera ≤35% o >35%.
ResultadosAmbos grupos mostraron mejoras comparables en clase funcional y fracción de eyección a los 6 meses. Se encontró una tendencia no significativa hacia mayor mortalidad total entre los pacientes con fracción de eyección ≤35% en el seguimiento a largo plazo. Al dividir la muestra por función sistólica y patrón de realce, encontramos que la presencia de necrosis identificaba a los pacientes con peor pronóstico de arritmias ventriculares y mortalidad total.
ConclusionesLa terapia de resincronización cardiaca con desfibrilador proporcionó un beneficio clínico similar a los pacientes con función sistólica por resonancia resonancia magnética cardiaca ≤35% y >35%. El patrón de realce tardío de gadolinio aporta información adicional sobre riesgo arrítmico y pronóstico a largo plazo de estos pacientes.
Palabras clave
En insuficiencia cardiaca (IC) avanzada, ensayos clínicos previos han demostrado que la terapia de resincronización cardiaca (TRC) con o sin desfibrilador automático implantable (DAI) aumenta la supervivencia y mejora la calidad de vida respecto al tratamiento farmacológico óptimo de pacientes sintomáticos en ritmo sinusal con QRS ≥120 ms y fracción de eyección del ventrículo izquierdo (FEVI) por ecocardiografía ≤35%1–4. Otros estudios han mostrado el papel beneficioso del desfibrilador en prevención primaria de pacientes con estos mismos criterios5,6.
Tradicionalmente, estos ensayos han excluido a los pacientes con disfunción sistólica moderada. Sin embargo, son ampliamente conocidas las limitaciones técnicas y la variabilidad interobservador de la ecocardiografía en la determinación exacta de la FEVI, y resulta todavía un método impreciso7,8. La resonancia magnética (RM) cardiaca, por su parte, se considera el método más exacto y reproducible en la evaluación de la función miocárdica general y regional9, y además permite el análisis de las áreas de necrosis mediante la detección de realce tardío de gadolinio (RTG)10, por lo que actualmente se la considera la técnica de referencia para identificar y cuantificar la extensión de la necrosis11. La relación entre la presencia de RTG y la aparición de arritmias ventriculares está sólidamente establecida12, y en estudios de mortalidad se ha demostrado que la RM tiene capacidad pronóstica independientemente de la FEVI13.
Estudios recientes han evaluado el efecto beneficioso de la TRC para pacientes con FEVI >35%, ya sea basándose en análisis ecocardiográficos posteriores realizados en laboratorios centrales experimentados14 o en estimaciones realizadas en estudios comparativos de RM15. Estos trabajos han encontrado beneficios similares en el grupo de pacientes con FEVI >35% comparado con los pacientes con disfunción grave, tanto en la mejoría clínica como en la incidencia de eventos cardiovasculares mayores. A pesar de la evidencia creciente, el riesgo arrítmico de los pacientes con disfunción moderada y portadores de TRC con desfibrilador (TRC-D) no se ha evaluado previamente.
Por lo tanto, decidimos analizar el impacto pronóstico de la TRC-D en el grupo de pacientes con disfunción grave por ecocardiografía pero reclasificados con FEVI >35% según el estudio de RM, incluyendo la detección de arritmias ventriculares y sus factores predisponentes.
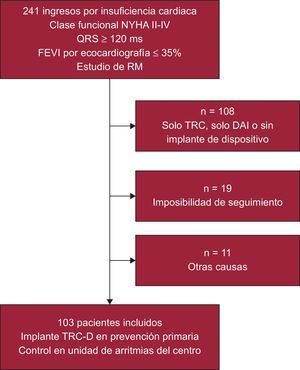
MÉTODOSPoblación de estudioSe estudió a 241 pacientes consecutivos en clase funcional de la New York Heart AssociationII-IV, con QRS ≥120ms y FEVI por ecocardiografía ≤35%, ingresados en nuestro centro con diagnóstico de IC descompensada desde enero de 2004 hasta diciembre de 2011, y con estudio de RM como parte de un protocolo local de IC avanzada. Se incluyó en la muestra final a todos los pacientes (n=103; media de edad, 65 ± 11 años; el 69% varones) con implante de TRC-D en prevención primaria y seguidos regularmente por la unidad de arritmias. Excepto por las condiciones descritas, no existían diferencias clínicas entre los pacientes excluidos y la muestra final (fig. 1). El estudio fue aprobado por el comité ético del centro y todos los pacientes firmaron el consentimiento informado previamente a la realización de la RM.
Diagrama de flujo de los pacientes incluidos en el estudio. DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association; RM: resonancia magnética; TRC: terapia de resincronización cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador.
Dos cardiólogos experimentados realizaron indistintamente ecocardiograma transtorácico bidimensional previo al implante del dispositivo a todos los pacientes. El estudio incluyó la medición de los diámetros del ventrículo izquierdo y el cálculo de la FEVI mediante el método de Simpson modificado. Se repitió la exploración a los 6 meses del implante para evaluar cambios en la FEVI y en las dimensiones ventriculares. Se utilizaron los equipos Philips i33® y Philips Sonos 7500® (Philips Healthcare; Estados Unidos).
Resonancia magnética cardiacaSe realizó de manera protocolizada, en un periodo no superior a 30 días desde el estudio ecocardiográfico inicial, con un equipo de 1,5 T (Magnetom Sonata®, Siemens; Alemania). Se determinaron la FEVI y los volúmenes telediastólico y telesistólico del ventrículo izquierdo indexados por la superficie corporal, mediante el trazado manual de los contornos endocárdico y epicárdico en secuencias cine steady-state free-precession en eje corto desde el plano mitral hasta el ápex ventricular. Se describió la presencia de necrosis cuando el patrón de RTG era subendocárdico o transmural y fibrosis miocárdica cuando era intramiocárdico, focal o lineal, tras administración intravenosa de gadobenato dimeglumina (Multihance®, Bracco Spa; Italia) a 0,15 mmol/kg según protocolo habitual. El análisis de las imágenes se realizó en una estación de trabajo específica (Argus, Siemens; Alemania).
Implante y seguimiento de los dispositivos de terapia de resincronización cardiaca con desfibriladorLa indicación de implante de los dispositivos se realizó según las guías clínicas16–18. Hicieron la programación de terapias según protocolo habitual indistintamente dos electrofisiólogos expertos19. En general, se establecieron tres zonas de detección de taquiarritmia: zona de fibrilación ventricular, con programación de terapia de desfibrilación; zona de taquicardia ventricular rápida, con programación de estimulación antitaquicárdica, y zona de taquicardia ventricular lenta, generalmente programado en modo monitorización. El seguimiento de los eventos arrítmicos se realizó periódicamente cada 3-6 meses en la unidad de arritmias de nuestro centro. En cada visita se evaluó clínicamente al paciente con optimización de tratamiento farmacológico y se interrogó al dispositivo para registrar cualquier evento arrítmico. Se consideraron para el análisis de resultados las terapias apropiadas del desfibrilador: estimulación antitaquicárdica por detección de taquicardia ventricular y descarga apropiada por detección de taquicardia ventricular o fibrilación ventricular.
Seguimiento de los pacientesSe consideraron eventos cardiovasculares mayores en el seguimiento tanto la hospitalización por IC como la mortalidad total, incluida la muerte súbita. Las arritmias ventriculares que requirieron terapia del dispositivo se incluyeron también en el análisis como evento adverso arrítmico.
Análisis estadísticoLas variables continuas se presentan como media±desviación estándar y las variables categóricas, como valores absolutos y porcentajes. Se dividió a los pacientes de la muestra en dos grupos en función de la FEVI-RM (≤35% o >35%), y las características basales se compararon usando la prueba de la t de Student para muestras independientes o el test de la χ2 respectivamente. Los cambios en las variables continuas en el seguimiento desde valores basales se analizaron utilizando la prueba de la t de Student para muestras apareadas. Se determinaron los predictores pronósticos de incidencia de eventos cardiovasculares mayores en un análisis univariable. Todas las variables estadísticamente significativas se incluyeron posteriormente en el análisis multivariable de regresión de Cox y se expresaron los riesgos proporcionales mediante hazard ratio (HR) con sus intervalos de confianza del 95% (IC95%). La tablas de supervivencia de construyeron según el método de Kaplan-Meier, y se compararon los grupos utilizando el log rank test. En el análisis de resultados, se consideró significativo p<0,05. El estudio estadístico se realizó usando el programa SPSS versión 17.0 (SPSS Inc.; Estados Unidos).
RESULTADOSLas características basales de la muestra se presentan en la tabla 1. Los pacientes con FEVI-RM >35% tenían menores diámetros y volúmenes ventriculares, con una distribución comparable de los factores de riesgo cardiovascular y tratamiento farmacológico. Ambos grupos eran homogéneos en la prevalencia de fibrilación auricular, cardiopatía isquémica subyacente y patrón de necrosis estimado por RM, así como en las características electrocardiográficas previas al implante, tanto en anchura de QRS como en prevalencia de bloqueo de rama izquierda del haz de His.
Características basales de los pacientes según la fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca
| FEVI-RMC ≤ 35% | FEVI-RMC > 35% | p | |
| Pacientes (n) | 86 | 17 | |
| Varones (%) | 66,0 | 82,3 | NS |
| Edad (años) | 65,5±12,0 | 66,0±10,0 | NS |
| Diabetes mellitus (%) | 43 | 41 | NS |
| Hipertensión (%) | 56 | 59 | NS |
| Dislipemia (%) | 50 | 59 | NS |
| Tabaquismo (%) | 21 | 23 | NS |
| Fibrilación auricular (%) | 23 | 29 | NS |
| Clase funcional NYHA | 3,17±0,80 | 3,11±0,90 | NS |
| Duración del QRS (ms) | 148,5±19,8 | 141,5±15,9 | NS |
| BCRIHH | 65 (75) | 11 (65) | NS |
| Cardiopatía isquémica | 39 (45) | 10 (58) | NS |
| Fármacos (%) | |||
| IECA o ARA-II | 87 | 94 | NS |
| Bloqueadores beta | 85 | 76 | NS |
| Diuréticos de asa | 91 | 82 | NS |
| Antagonistas de aldosterona | 50 | 29 | NS |
| Ecocardiografía | |||
| FEVI (%) | 24,6±6,4 | 32,3±3,3 | <0,001 |
| DTDVI (mm) | 67,0±8,6 | 58,1±6,2 | < 0,001 |
| DTSVI (mm) | 55,8±9,8 | 46,4±5,5 | < 0,001 |
| Resonancia magnética cardiaca | |||
| FEVI (%) | 21,3±6,5 | 37,1±1,6 | < 0,001 |
| VTDVIi (ml/m2) | 144,9±52,5 | 112,8±31,3 | < 0,001 |
| VTSVIi (ml/m2) | 111,2±46,1 | 73,4±22,5 | < 0,001 |
| Patrón de necrosis en RTG | 45 (52) | 9 (53) | NS |
ARA-II: antagonistas del receptor de la angiotensina II; BCRIHH: bloqueo completo de la rama izquierda del haz de His; DTDVI: diámetro telediastólico del ventrículo izquierdo en eje paraesternal largo; DTSVI: diámetro telesistólico del ventrículo izquierdo en eje paraesternal largo; FEVI-RMC: fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; NS: no significativo; NYHA: New York Heart Association; RTG: realce tardío de gadolinio; VTDVIi: volumen telediastólico del ventrículo izquierdo indexado por la superficie corporal; VTSVIi: volumen telesistólico del ventrículo izquierdo indexado por la superficie corporal.
Diferencias estadísticamente significativas, p≤0,05.
Salvo otra indicación, los datos expresan n (%) o media±desviación estándar.
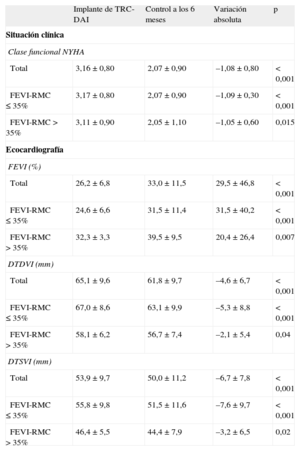
Al analizar los efectos clínicos de la TRC, encontramos beneficios similares en la clase funcional en ambos grupos en el seguimiento a los 6 meses (–1,05±0,6 en FEVI-RM >35% [p=0,01] frente a –1,09±0,3 en FEVI-RM ≤35% [p<0,001]). Asimismo, en las variables ecocardiográficas analizadas no se hallaron diferencias significativas entre los grupos, tanto en la mejora de la función sistólica (mejora proporcional de la FEVI, 20,4±26,4% frente a 31,5±40,2%; t de Student para muestras independientes; p=0,09) como en los diámetros ventriculares (variación porcentual del diámetro telediastólico del ventrículo izquierdo, –2,1±5,4% frente a –5,3±8,8% [p<0,37]; variación porcentual del diámetro telesistólico del ventrículo izquierdo, –3,2±6,5% frente a –7,6±9,7% [p<0,39]) (tabla 2).
Seguimiento clínico y ecocardiográfico tras terapia de resincronización cardiaca de ambos grupos muestrales
| Implante de TRC-DAI | Control a los 6 meses | Variación absoluta | p | |
| Situación clínica | ||||
| Clase funcional NYHA | ||||
| Total | 3,16±0,80 | 2,07±0,90 | –1,08±0,80 | < 0,001 |
| FEVI-RMC ≤ 35% | 3,17±0,80 | 2,07±0,90 | –1,09±0,30 | < 0,001 |
| FEVI-RMC > 35% | 3,11±0,90 | 2,05±1,10 | –1,05±0,60 | 0,015 |
| Ecocardiografía | ||||
| FEVI (%) | ||||
| Total | 26,2±6,8 | 33,0±11,5 | 29,5±46,8 | < 0,001 |
| FEVI-RMC ≤ 35% | 24,6±6,6 | 31,5±11,4 | 31,5±40,2 | < 0,001 |
| FEVI-RMC > 35% | 32,3±3,3 | 39,5±9,5 | 20,4±26,4 | 0,007 |
| DTDVI (mm) | ||||
| Total | 65,1±9,6 | 61,8±9,7 | –4,6±6,7 | < 0,001 |
| FEVI-RMC ≤ 35% | 67,0±8,6 | 63,1±9,9 | –5,3±8,8 | < 0,001 |
| FEVI-RMC > 35% | 58,1±6,2 | 56,7±7,4 | –2,1±5,4 | 0,04 |
| DTSVI (mm) | ||||
| Total | 53,9±9,7 | 50,0±11,2 | –6,7±7,8 | < 0,001 |
| FEVI-RMC ≤ 35% | 55,8±9,8 | 51,5±11,6 | –7,6±9,7 | < 0,001 |
| FEVI-RMC > 35% | 46,4±5,5 | 44,4±7,9 | –3,2±6,5 | 0,02 |
DTDVI diámetro telediastólico del ventrículo izquierdo mediante ecocardiografía en eje paraesternal largo; DTSVI: diámetro telesistólico del ventrículo izquierdo mediante ecocardiografía en eje paraesternal largo; FEVI-RMC: fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca; NYHA: New York Heart Association; TRC-DAI: terapia de resincronización cardiaca con desfibrilador automático implantable.
Análisis comparativo mediante prueba de la t de Student.
Los datos expresan media±desviación estándar.
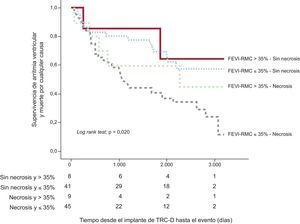
Por otra parte, al evaluar los eventos cardiovasculares mayores a largo plazo (seguimiento medio, 60 [1-110] meses), observamos una tendencia no significativa hacia mayor mortalidad total en los pacientes con FEVI-RM ≤35% (log rank test; p=0,109), con un riesgo similar en la incidencia de arritmias ventriculares u hospitalización por IC en ambos grupos (fig. 2).
Curva de Kaplan-Meier según la fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca: supervivencia acumulada de arritmias ventriculares, reingreso por insuficiencia cardiaca y mortalidad total. FEVI-RMC: fracción de eyección del ventrículo izquierdo por resonancia magnética cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador.
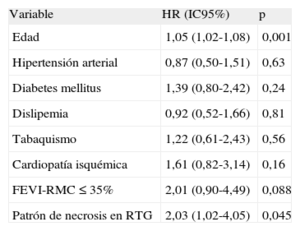
Con base en la información adicional que proporciona la RM, decidimos estudiar si el patrón de RTG tenía impacto pronóstico a largo plazo e independientemente del grado de gravedad de la disfunción sistólica, como se ha descrito en estudios previos. Para ello, se realizó un análisis multivariable mediante regresión de Cox en el que se incluyeron como variables, además de la edad y el patrón de necrosis como únicos factores con significación estadística en el análisis univariable, los factores de riesgo clásicos, los antecedentes de cardiopatía isquémica y la disfunción sistólica grave estimada por RM (tabla 3). Se encontró que tanto la edad como el patrón de necrosis en la RM se comportaban como factores de riesgo independientes en la predicción de eventos cardiovasculares adversos en estos pacientes (HR=1,05 [IC95%, 1,02-1,08]; p=0,001; y HR=2,03 [IC95%, 1,02-4,05]; p=0,045, respectivamente).
Análisis multivariable mediante regresión de Cox: estimación de riesgo proporcional de arritmia ventricular, reingreso por insuficiencia cardiaca y mortalidad total en el seguimiento a largo plazo
| Variable | HR (IC95%) | p |
| Edad | 1,05 (1,02-1,08) | 0,001 |
| Hipertensión arterial | 0,87 (0,50-1,51) | 0,63 |
| Diabetes mellitus | 1,39 (0,80-2,42) | 0,24 |
| Dislipemia | 0,92 (0,52-1,66) | 0,81 |
| Tabaquismo | 1,22 (0,61-2,43) | 0,56 |
| Cardiopatía isquémica | 1,61 (0,82-3,14) | 0,16 |
| FEVI-RMC ≤ 35% | 2,01 (0,90-4,49) | 0,088 |
| Patrón de necrosis en RTG | 2,03 (1,02-4,05) | 0,045 |
FEVI-RMC: fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca; HR: hazard ratio; IC95%: intervalo de confianza del 95%; RTG: realce tardío de gadolinio.
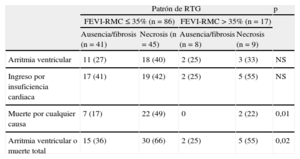
Con estos hallazgos, se construyó una curva de supervivencia de Kaplan-Meier dividiendo la muestra en cuatro grupos en función de la FEVI-RM y la presencia de necrosis mediante el RTG en la RM (tabla 4). Encontramos que la presencia de patrón de necrosis permitió identificar a los pacientes con mayor riesgo en el combinado de arritmias ventriculares y mortalidad total en el seguimiento en ambos grupos (FEVI-RM >35% y ≤35%). Además, la combinación de una FEVI-RM >35% y ausencia de necrosis en las secuencias de RTG reconoció a los pacientes con mejor pronóstico (fig. 3).
Eventos cardiovasculares mayores en el seguimiento. Distribución según el realce tardío de gadolinio y la función sistólica estimados por resonancia magnética cardiaca
| Patrón de RTG | p | ||||
| FEVI-RMC ≤ 35% (n=86) | FEVI-RMC > 35% (n=17) | ||||
| Ausencia/fibrosis (n=41) | Necrosis (n=45) | Ausencia/fibrosis (n=8) | Necrosis (n=9) | ||
| Arritmia ventricular | 11 (27) | 18 (40) | 2 (25) | 3 (33) | NS |
| Ingreso por insuficiencia cardiaca | 17 (41) | 19 (42) | 2 (25) | 5 (55) | NS |
| Muerte por cualquier causa | 7 (17) | 22 (49) | 0 | 2 (22) | 0,01 |
| Arritmia ventricular o muerte total | 15 (36) | 30 (66) | 2 (25) | 5 (55) | 0,02 |
FEVI-RMC: fracción de eyección del ventrículo izquierdo estimada por resonancia magnética cardiaca; NS: no significativo; RTG: realce tardío de gadolinio.
Los valores expresan n (%).
Curva de Kaplan-Meier en función de la fracción de eyección del ventrículo izquierdo y el patrón de necrosis en la resonancia magnética cardiaca: supervivencia de muerte cardiovascular y arritmias ventriculares. FEVI-RMC: fracción de eyección del ventrículo izquierdo por resonancia magnética cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador.
Este estudio observacional durante un periodo de 8 años incluye a pacientes que ingresaron en nuestro centro por descompensación aguda de IC con disfunción sistólica grave según el estudio ecocardiográfico inicial, a los que se implantó un dispositivo de TRC-D según las indicaciones recomendadas en las guías.
El análisis retrospectivo de los datos permitió dividir la muestra en dos grupos, con un 16% de los pacientes con FEVI >35% según el estudio de RM previo al implante de dispositivo. En primer lugar, se puso de manifiesto que ambos grupos se beneficiaron de manera comparable tras el implante de TRC-D, tanto en mejora de clase funcional como en función sistólica y volúmenes ventriculares. Esta evolución significativamente favorable en ambos grupos concuerda con lo descrito en estudios previos13,14, y se observan beneficios similares clínicos y de las variables ecocardiográficas tanto de los pacientes con disfunción grave según las dos técnicas de imagen como en los reclasificados como disfunción moderada tras el análisis de la RM.
Por otra parte, al evaluar los eventos cardiovasculares mayores en el seguimiento a largo plazo, encontramos un riesgo comparable en la incidencia de arritmias ventriculares y reingresos por IC en ambos grupos, con una tendencia no significativa hacia mayor mortalidad total entre los pacientes con FEVI-RM ≤35%. Estos resultados se encuentran también en la línea de los descritos por Foley et al14, que observaron una tendencia hacia mayor riesgo de muerte por cualquier causa o un combinado de muerte y hospitalización por IC entre los pacientes con FEVI-RM ≤35%, sin alcanzar la significación estadística, probablemente por el reducido tamaño muestral, al igual que ocurre con nuestro trabajo.
Conviene señalar que el valor de corte para FEVI ≤35% asumido por las guías de práctica clínica no es producto de estudios prospectivos multicéntricos, sino que más bien procede de los criterios de inclusión utilizados en los principales ensayos clínicos de IC y TRC1–6. Por lo tanto, según lo publicado hasta ahora y pese a haberse demostrado la asociación entre grado de disfunción sistólica e incremento del riesgo de eventos cardiovasculares, quizá no se debería asumir el valor numérico ecocardiográfico de FEVI ≤35% como umbral de pronóstico adverso en estos pacientes. Además, la ecocardiografía sigue siendo una técnica con diversas limitaciones, como la dependencia del operador, la ventana acústica variable o la visualización inadecuada de los bordes endocárdicos, además de la dependencia de presunciones geométricas. Asimismo, la FEVI no es en absoluto un parámetro constante y puede variar en diferentes situaciones clínicas. Por lo tanto, la utilización de valores numéricos específicos para determinar el grado de disfunción ventricular izquierda no debería ser criterio excluyente para implante de dispositivos de TRC-D. Así, el uso de la información conjunta que proporcionan la ecocardiografía y la RM permite una orientación más adecuada del paciente y probablemente se ajustaría con más fidelidad a la evidencia actual.
En este mismo sentido, el hallazgo más destacado del estudio quizá sea el valor añadido que proporciona el patrón de necrosis en la RM sobre el criterio estricto de FEVI ≤35% por ecocardiografía en la predicción de eventos adversos, especialmente sobre el riesgo arrítmico y la mortalidad total. Es bien conocido el papel pronóstico del RTG con patrón isquémico en la estratificación de riesgo de pacientes con indicación de DAI, y se ha descrito su capacidad para predecir arritmias ventriculares indepedientemente de la FEVI20. Recientemente se ha propuesto, además, la importancia pronóstica del tamaño de la cicatriz miocárdica, de forma que una mayor extensión de la escara transmural determinaría un riesgo incrementado de eventos adversos en estos pacientes, y no solo la presencia cualitativa de RTG10,21.
Con base en esta misma hipótesis, se diseñó en 2009 el estudio DETERMINE22. Se trata de un ensayo prospectivo, multicéntrico y aleatorizado sobre pacientes con enfermedad coronaria y disfunción sistólica moderada (FEVI >35%), con estudio de RM para determinar el tamaño del infarto. El objetivo era demostrar que los pacientes con escara necrótica >10% de la masa miocárdica total aleatorizados a implante de DAI más tratamiento médico óptimo tendrían menor mortalidad que aquellos con solo tratamiento médico. Por desgracia, el ensayo se detuvo prematuramente por la escasa inclusión de pacientes, aunque el papel de la RM en este contexto clínico sigue siendo creciente.
Así, tal y como indican las recomendaciones actuales16,18, la RM previa al implante es útil en la evaluación de la función cardiaca y añade información detallada de la extensión de la escara necrótica y el miocardio viable, de vital importancia en la colocación de los electrodos del dispositivo. Como indican nuestros resultados, la RM permitiría además optimizar la evaluación pronóstica de los pacientes con indicación de TRC-D, por el valor complementario que aporta el patrón de necrosis en las secuencias de RTG sobre la determinación cuantitativa de la FEVI por ecocardiografía.
Limitaciones del estudioSe consideran limitaciones del estudio tanto el reducido tamaño muestral, con solo 17 pacientes en el grupo con disfunción moderada según la RM, como el carácter unicéntrico del trabajo y el análisis retrospectivo de los datos. Sin embargo, dado que el objetivo del estudio es corroborar que el valor numérico de la FEVI estimada por ecocardiografía no debería ser un criterio restrictivo en la indicación de implante de dispositivos de TRC-D, tal y como se propone en la discusión, los autores consideran que el trabajo cumple su propósito en la generación de nuevas hipótesis. Por lo tanto, en el futuro son necesarios nuevos estudios para confirmar lo indicado por estos resultados.
Por otra parte, aunque se ha utilizado el registro de terapias apropiadas del DAI en los resultados como un criterio de valoración indirecto de su potencial beneficio en el pronóstico de los pacientes, como la reducción del riesgo de muerte súbita, se debe reconocer que dicho registro no es equivalente a la prevención de muerte cardiaca en todos los pacientes, pues depende en parte de la programación del dispositivo y el tipo de arritmia ventricular. Por otra parte, la prevención de muerte súbita no implica en todos los casos un incremento significativo en la esperanza de vida, pues algunos pacientes mueren después por IC u otras causas23.
CONCLUSIONESPodemos concluir que el implante de TRC-D en prevención primaria de pacientes con disfunción grave por ecocardiografía aporta beneficios clínicos comparables tanto en el grupo de pacientes con FEVI-RM ≤35% como en los reclasificados como disfunción moderada. El análisis del patrón de RTG en la RM previa al implante del dispositivo proporciona información adicional en la evaluación del riesgo arrítmico y el pronóstico a largo plazo de estos pacientes.
FINANCIACIÓNEste trabajo se ha realizado con el apoyo económico de los proyectos del Fondo de Investigación Sanitaria (PI 04/2579, PI 07/1039, PI 10/01112), Instituto de Salud Carlos III, Ministerio de Sanidad y Consumo, y el Programa I3 2007, 2011 y 2012 del Instituto de Salud Carlos III y la Generalitat Valenciana al Dr. Francisco Ridocci-Soriano.
CONFLICTO DE INTERESNinguno.