Pasada 1 década desde el primer implante percutáneo de la válvula pulmonar (IPVP) Melody en España, se exponen sus resultados en cuanto a la función valvular y las complicaciones a corto y medio plazo.
MétodosAnálisis descriptivo retrospectivo y multicéntrico nacional de los IPVP Melody en pacientes menores de 18 años desde el primer implante (de marzo de 2007 hasta el 1 de enero de 2016).
ResultadosSe reclutaron 9 hospitales que contaban un total de 81 IPVP en 77 pacientes, cuyas medianas [intervalo intercuartílico] de edad y peso eran 13,3 [9,9-15,4] años y 46 [27-63] kg respectivamente. La enfermedad cardiaca más frecuente fue la tetralogía de Fallot (n = 27) y el sustrato anatómico más común, el conducto valvulado de yugular bovina (n = 31). Las incidencias de complicaciones intraprocedimiento y agudas fueron del 6 y el 8% (no hubo muertes periprocedimiento). La mediana del tiempo de seguimiento fue 2,4 [1,1-4,9] años. Se diagnosticó endocarditis infecciosa (EI) a 4 pacientes (5,6%), de los que 3 precisaron el explante de la válvula. En el periodo de seguimiento, la mortalidad fue del 1,3%, relacionada con EI. A los 5 años de seguimiento, el 80 ± 6,9% y el 83 ± 6,1% de los pacientes estuvieron libres de reintervención y recambio valvular pulmonar respectivamente.
ConclusionesEl IPVP en pacientes pediátricos es una opción válida con buenos resultados hemodinámicos a corto y medio plazo. La incidencia de EI durante el seguimiento fue relativamente baja, si bien es la principal complicación que tener en cuenta.
Palabras clave
Los avances en cirugía cardiaca, intervencionismo percutáneo, cuidados intensivos y técnicas de imagen no invasiva han hecho que aumenten la expectativa de vida y el número de reintervenciones en las cardiopatías congénitas1. Consecuentemente y con base en el efecto perjudicial de la disfunción crónica de la válvula pulmonar en el ventrículo derecho (VD), la práctica clínica ha ido estableciendo tiempos de actuación más precoces2.
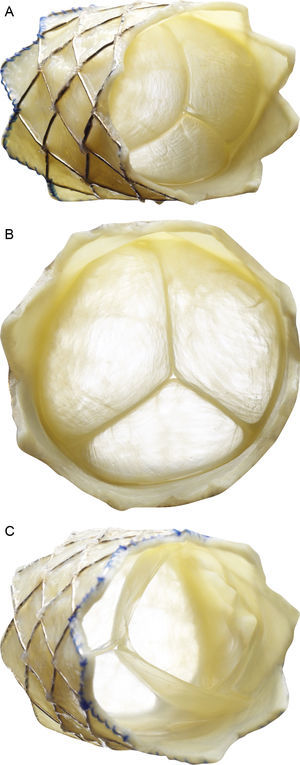
La técnica del implante percutáneo de la válvula pulmonar (IPVP) se describió por primera vez en el 20003. Actualmente ha alcanzado una amplia aceptación, y se han realizado hasta la fecha más de 10.000 implantes en todo el mundo. Las características valvulares y del sistema de implante se describen en la figura 1. Actualmente se utilizan varios dispositivos, pero en el momento de iniciar nuestro estudio tan solo la válvula Melody (Medtronic; Minnesota, Estados Unidos) obtuvo la aprobación de las entidades reguladoras (CE 9/2006 y FDA 01/2010).
Descripción de la válvula pulmonar percutánea Melody (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos). Stent no recubierto de platino-iridio de 34mm (CP stent, NuMED Inc.; Hopkinton, New York, Estados Unidos) con un segmento valvular de vena yugular bovina cosido a mano. A: vista frontolateral. B: vista frontal. C: vista desde el extremo distal. El dispositivo se repliega y se fija a un catéter balón en balón y se libera a través de una vaina larga modificada de 22 Fr (Ensemble Delivery System, Medtronic Inc.), disponible en diámetros del balón externo de 18, 20 y 22mm. La técnica de balón en balón permite la liberación de la válvula en 2 pasos y reposicionarla una vez inflado el balón de menor tamaño.
El objetivo principal de nuestro estudio es exponer la experiencia española de los IPVP Melody en pacientes pediátricos y, secundariamente, evaluar su evolución en términos de funcionamiento valvular y aparición de posibles complicaciones a corto-medio plazo.
MÉTODOSAnálisis descriptivo, retrospectivo y multicéntrico del IPVP Melody en menores de 18 años desde marzo de 2007 (fecha del primer implante en el país) hasta el 1 de enero de 2016. En el Grupo de Trabajo de Hemodinámica de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas, se elaboró un cuestionario que después cumplimentaron todos los centros con experiencia en IPVP pediátrico. Se procedió de conformidad a la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal. El plazo de seguimiento de los pacientes finalizó el 15 de mayo de 2016.
Se definió complicación mayor como aquella con impacto clínico, que pone en peligro la vida del paciente y que precisó tratamiento quirúrgico o percutáneo (p. ej., compresión coronaria, perforación de estructuras cardiacas, embolización de material protésico, etc.). Al resto de las complicaciones se las denominó menores4. Complicaciones intraprocedimiento fueron las acontecidas durante la realización del cateterismo hasta el traslado del paciente a cuidados intensivos y complicaciones agudas, las que aparecieron hasta 72 h después.
Análisis estadísticoPara el análisis estadístico, se empleó Statistics Data Analisis 13.1 (Stata, StataCorp LP; Estados Unidos). Las variables cuantitativas continuas se expresan en media ± desviación estándar si siguen distribución normal y en caso contrario, como mediana [intervalo intercuartílico]. Las variables nominales se expresan como números y porcentajes, y para comparar diferencias entre medias antes y después del implante, se utilizó el test de la t de Student. Para comparar variables categóricas, se usó la prueba de la χ2, el test de Wilcoxon o el test de la U de Mann-Whitney. Todas las pruebas se ajustaron por ambos lados, y se consideró estadísticamente significativo un valor de p < 0,05. El análisis del tiempo libre de evento se realizó mediante curvas de Kaplan-Meier. Los factores asociados con un evento (reintervención/endocarditis) durante seguimiento se incluyeron en un análisis univariable mediante regresión de Cox, y se consideró significativas aquellas con p ≤ 0,05.
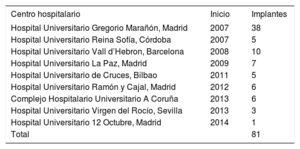
RESULTADOSDesde el primer implante en España hasta el 1 de enero de 2016, se implantaron un total de 173 válvulas Melody en 16 hospitales; de ellas, 81 se emplearon para IPVP en 77 pacientes pediátricos (tabla 1). Un paciente tuvo un doble implante porque tenía doble tracto de salida del ventrículo derecho (TSVD) (conducto + TSVD nativo) y 3 pacientes requirieron una segunda Melody (2 mediante técnica valve-in-valve y otro tras explante de la válvula inicial y reconstrucción quirúrgica del TSVD).
Lista de hospitales nacionales con experiencia en implante percutáneo de la válvula pulmonar Melody, ordenados por año de su primer implante
| Centro hospitalario | Inicio | Implantes |
|---|---|---|
| Hospital Universitario Gregorio Marañón, Madrid | 2007 | 38 |
| Hospital Universitario Reina Sofía, Córdoba | 2007 | 5 |
| Hospital Universitario Vall d’Hebron, Barcelona | 2008 | 10 |
| Hospital Universitario La Paz, Madrid | 2009 | 7 |
| Hospital Universitario de Cruces, Bilbao | 2011 | 5 |
| Hospital Universitario Ramón y Cajal, Madrid | 2012 | 6 |
| Complejo Hospitalario Universitario A Coruña | 2013 | 6 |
| Hospital Universitario Virgen del Rocío, Sevilla | 2013 | 3 |
| Hospital Universitario 12 Octubre, Madrid | 2014 | 1 |
| Total | 81 |
Para homogeneizar los datos, se analizaron los resultados de los 78 implantes que fueron primarios (77 pacientes). La descripción clínica de los pacientes y del procedimiento se detallan en la tabla 2 y la tabla 3 respectivamente. La técnica moderna de prestenting2 es la más empleada, salvo implantes realizados sobre prótesis valvular quirúrgica disfuncionante (6 casos) o experiencias iniciales (7 pacientes).
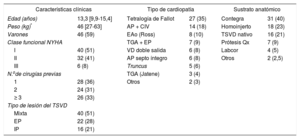
Características de los 78 implantes percutáneos de válvula pulmonar primarios en 77 pacientes menores de 18 años
| Características clínicas | Tipo de cardiopatía | Sustrato anatómico | |||
|---|---|---|---|---|---|
| Edad (años) | 13,3 [9,9-15,4] | Tetralogía de Fallot | 27 (35) | Contegra | 31 (40) |
| Peso (kg)* | 46 [27-63] | AP + CIV | 14 (18) | Homoinjerto | 18 (23) |
| Varones | 46 (59) | EAo (Ross) | 8 (10) | TSVD nativo | 16 (21) |
| Clase funcional NYHA | TGA + EP | 7 (9) | Prótesis Qx | 7 (9) | |
| I | 40 (51) | VD doble salida | 6 (8) | Labcor | 4 (5) |
| II | 32 (41) | AP septo íntegro | 6 (8) | Otros | 2 (2,5) |
| III | 6 (8) | Truncus | 5 (6) | ||
| N.ode cirugías previas | TGA (Jatene) | 3 (4) | |||
| 1 | 28 (36) | Otros | 2 (3) | ||
| 2 | 24 (31) | ||||
| ≥ 3 | 26 (33) | ||||
| Tipo de lesión del TSVD | |||||
| Mixta | 40 (51) | ||||
| EP | 22 (28) | ||||
| IP | 16 (21) | ||||
AP: atresia pulmonar; CIV comunicación interventricular; EAo: estenosis aórtica; EP: estenosis pulmonar; IP: insuficiencia pulmonar; NYHA: New York Heart Association; Qx: quirúrgico; TGA: trasposición de grandes arterias; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
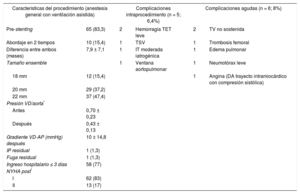
Características del procedimiento de 78 implantes percutáneos de válvula pulmonar primarios
| Características del procedimiento (anestesia general con ventilación asistida) | Complicaciones intraprocedimiento (n = 5; 6,4%) | Complicaciones agudas (n = 6; 8%) | |||
|---|---|---|---|---|---|
| Pre-stenting | 65 (83,3) | 2 | Hemorragia TET leve | 2 | TV no sostenida |
| Abordaje en 2 tiempos | 10 (15,4) | 1 | TSV | 1 | Trombosis femoral |
| Diferencia entre ambos (meses) | 7,9 ± 7,1 | 1 | IT moderada iatrogénica | 1 | Edema pulmonar |
| Tamaño ensemble | 1 | Ventana aortopulmonar | 1 | Neumotórax leve | |
| 18 mm | 12 (15,4) | 1 | Angina (DA trayecto intramiocárdico con compresión sistólica) | ||
| 20 mm | 29 (37,2) | ||||
| 22 mm | 37 (47,4) | ||||
| Presión VD/aorta* | |||||
| Antes | 0,70 ± 0,23 | ||||
| Después | 0,43 ± 0,13 | ||||
| Gradiente VD-AP (mmHg) después | 10 ± 14,8 | ||||
| IP residual | 1 (1,3) | ||||
| Fuga residual | 1 (1,3) | ||||
| Ingreso hospitalario ≤ 3 días | 58 (77) | ||||
| NYHA post* | |||||
| I | 62 (83) | ||||
| II | 13 (17) | ||||
AP: arteria pulmonar; DA: arteria coronaria descendente anterior; IP: insuficiencia pulmonar; IT: insuficiencia tricúspide; NYHA: New York Heart Association; TET: tubo endotraqueal; TSV: taquicardia supraventricular; TV: taquicardia ventricular; VD: ventrículo derecho.
Los valores expresan n (%) o media ± desviación estándar.
En cuanto a las complicaciones periprocedimiento, cabe destacar que no hubo ningún caso de compresión coronaria o muerte. El evento intraprocedimiento más importante fue la creación iatrogénica de una ventana aortopulmonar en 1 paciente con cirugía de Jatene (11 años, 66 kg), que se solventó inicialmente con implante percutáneo de dispositivo de cierre de comunicación interventricular muscular de 11mm y más tarde fue programado electivamente para cierre quirúrgico del shunt residual. El resto de las complicaciones fueron leves (tabla 3) y se solucionaron mediante tratamiento conservador. En las primeras horas tras el implante, hubo 1 paciente de 16 años (tetralogía de Fallot), con clínica transitoria de angina no relacionada con interferencia mecánica de la prótesis con el origen de las arterias coronarias (valorado por tomografía computarizada y angiografía), sino por compresión sistólica de un segmento coronario intramiocárdico de la arteria descendente anterior, que se resolvió mediante tratamiento con bloqueadores beta.
Se dio seguimiento a 75 casos, ya que se trasladó a 3 pacientes a su comunidad de origen (diferente a aquella donde se realizó el implante). La mediana del tiempo de seguimiento fue 2,4 [1,1-4,9] años. En el último control ecocardiográfico realizado durante el seguimiento, se describió gradiente pulmonar valvular pico promedio de 25 ± 26,5mmHg, insuficiencia pulmonar de grado > II en 3 pacientes (4%) y fuga perivalvular leve en 1 (1,3%).
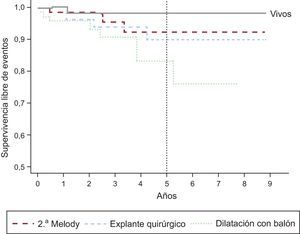
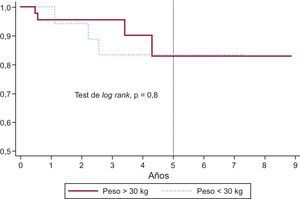
Trece pacientes requirieron algún tipo de reintervención: 8, sobredilatación con balón (3 de ellos sin pre-stent en el TSVD), 5 explantes (3 por EI y 2 por pérdida de integridad del stent por fractura y/o compresión esternal) y 2 implantes valve-in-valve (por disfunción valvular secundaria a fractura). El 97 ± 2%, el 95 ± 3% y el 80 ± 7% de los pacientes estaban libres de reintervención (sobredilatación con balón o valve-in-valve o explante) a 1, 2 y 5 años respectivamente. No hubo diferencias estadísticamente significativas entre pacientes por peso (referencia, 30 kg), sustrato anatómico o tipo de lesión del TSVD previa al implante. En la figura 2 se detalla el tiempo de supervivencia libre de los diferentes eventos. El 97 ± 2%, el 93 ± 3,5% y el 83 ± 6% de los pacientes estaban libres de recambio valvular pulmonar (percutáneo o quirúrgico) tras 1, 2 y 5 años de seguimiento respectivamente (figura 3). Hubo 1 fallecimiento (1,3%), relacionado con EI.
Curva de Kaplan-Meier de supervivencia libre de eventos. A 5 años, una media ± error estándar del 98 ± 1,8% de los pacientes continuaban vivos, el 93 ± 4,2% no requirieron un segundo implante percutáneo de válvula pulmonar Melody, el 88 ± 5,6% no sufrieron explantes y el 86 ± 5,8% estaban libres de sobredilatación con catéter-balón.
Curva de supervivencia libre de recambio de la válvula pulmonar (percutáneo o quirúrgico) en pacientes de peso > 30 y < 30kg. A los 1, 2 y 5 años de seguimiento, no habían requerido recambio valvular una media ± error estándar del 100%, el 95 ± 0,05% y el 84 ± 0,09% de los pacientes de menos de 30kg, frente al 96 ± 0,03%, el 96 ± 0,03% y el 83 ± 0,09% de los de más de 30kg. Sin diferencias estadísticamente significativas.
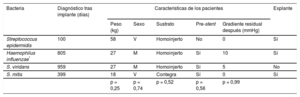
Se diagnosticaron 4 casos de EI (el 5,6% del total) (tabla 4), uno de ellos precoz en un paciente con antecedente de endocarditis preimplante por el mismo germen; 3 pacientes requirieron extracción quirúrgica de la válvula, realizada a los 9, 19 y 78 días tras el diagnóstico (que se corresponden con los 814, 418 y 178 días tras el implante). A los 5 años de seguimiento, el 92% de los pacientes estaban libres de dicha enfermedad, lo que resulta en un índice promedio de incidencia de EI del 1,8% por paciente-año.
Descripción de los pacientes diagnosticados de endocarditis infecciosa
| Bacteria | Diagnóstico tras implante (días) | Características de los pacientes | Explante | ||||
|---|---|---|---|---|---|---|---|
| Peso (kg) | Sexo | Sustrato | Pre-stent | Gradiente residual después (mmHg) | |||
| Streptococcus epidermidis | 100 | 58 | V | Homoinjerto | No | 0 | Sí |
| Haemophilus influenzae* | 805 | 27 | M | Homoinjerto | Sí | 10 | Sí |
| S. viridans | 959 | 27 | M | Homoinjerto | Sí | 5 | No |
| S. mitis | 399 | 18 | V | Contegra | Sí | 0 | Sí |
| p = 0,25 | p = 0,74 | p = 0,52 | p = 0,56 | p = 0,99 | |||
M: mujer; V: varón.
La durabilidad de las intervenciones quirúrgicas en el TSVD para las cardiopatías congénitas complejas es muy variable según la edad del paciente y el tipo de material utilizado5,6. Uno de los estudios con mayor tamaño muestral describió una supervivencia media libre de intervención de 11,2 años para conductos de tamaño adulto (> 18 mm)7. La disfunción del TSVD sobreviene finalmente con el paso del tiempo por diversos mecanismos: regurgitación pulmonar, crecimiento somático, anastomosis estenóticas, estenosis valvulares, acodamiento del conducto, compresión esternal, proliferación intimal, calcificación o dilataciones aneurismáticas8. La reconstrucción del TSVD puede realizarse con baja mortalidad, pero puede asociarse con alta morbilidad, especialmente si se tiene en cuenta la necesidad de reintervenciones quirúrgicas. Limitarlas sin perjuicio para el volumen y la función ventricular sería la estrategia de elección del IPVP. La principal controversia se encuentra en el momento de valvular el TSVD y los criterios de preferencia entre IPVP y cirugía. Dada la dificultad intrínseca de las cardiopatías congénitas, por volumen y variaciones, hasta la fecha no se han realizado estudios que comparen directamente el IPVP frente a la cirugía, por lo que los trabajos multicéntricos descriptivos son la principal fuente de información disponible.
Según la guía europea de 2010, se debería tratar, en general, a los pacientes sintomáticos con presión en el VD > 60mmHg y/o insuficiencia pulmonar moderada/grave, los pacientes asintomáticos con estenosis pulmonar o insuficiencia pulmonar grave con disminución de la capacidad de esfuerzo, dilatación progresiva o disfunción sistólica del VD, insuficiencia tricuspídea progresiva, gradiente pulmonar > 80mmHg o taquicardias auriculares o ventriculares sostenidas9. En 2011, la American Heart Association recomendó (IIa B) considerar el IPVP para pacientes portadores de conducto entre el VD y la arteria pulmonar con estenosis pulmonar moderada/grave o insuficiencia pulmonar según los criterios de inclusión/exclusión de cada válvula10.
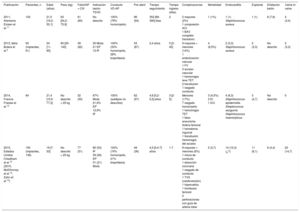
Hoy en día, varios países han publicado registros nacionales prospectivos del IPVP Melody, y muestran excelentes resultados a corto y medio plazo (tabla 5)4,11–15. El procedimiento se describe como exitoso (Melody implantada en localización deseada, insuficiencia pulmonar residual leve o menor, gradiente VD-arteria pulmonar < 35mmHg, ausencia de explante a las 24 h tras el procedimiento)16 en el 93-99% de los casos4,14,17. Como en nuestro estudio, se ha descrito la reducción significativa de la relación de presión VD/aorta4,12–15 y mejora general de los parámetros hemodinámicos17 y la clase funcional de la New York Heart Association13,14,16. Pero nuestra serie es la primera en analizar los resultados exclusivamente en la población pediátrica, incluidos pesos < 20-30kg y variados sustratos anatómicos para el implante.
Características de los principales registros publicados de implante percutáneo de la válvula pulmonar Melody: estudios observacionales prospectivos y multicéntricos
| Publicación | Pacientes, n | Edad (años) | Peso (kg) | Fallot/AP + CIV | Indicación lesión TSVD | Conducto VD-AP | Pre-stent | Tiempo seguimiento | Tiempo ingreso (días) | Complicaciones | Mortalidad | Endocarditis | Explante | Dilatación balón | Valve-in-valve |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2011, Alemania Eicken et al.11 | 102 | 21,5 [16,2-30,1] | 63 [54,2-75,9] | 61 (60) | No descrito | 100% (79% homoinjerto) | 96 (94) | 352 [99-390] días | 2 | 2 mayores (2%) 1 compresión ACI 1 BAV completo transitorio | 1 (1%) | 1 (1) Staphilococcus aureus | 1 (1) | 8 (7,8) | 4 (3,4) |
| 2013, Italia Butera et al.4 | 63 (implantes, 61) | 24 [11-65] | 60 [30-140] | 39 (62) | 30 Mixta 21 EP 12 IP | 100% (33% homoinjerto, 28% bioprótesis) | 53 (87) | 2,4 años | 5 [3-45] | 9 mayores + menores (14%) 1 embolización valvular 1 FV 3 acceso vascular 1 hemorragia leve TET 2 transfusión 1 rasgado conducto | 4 (6,5%) | 2 (3,3) Staphilococcus aureus | 2 (3,3) | No descrito | 2 (3,3) |
| 2014, Francia Fraisse et al.12 | 64 | 21,4 [10,5-77,3] | No descrito > 25 kg | 32 (50) | 67% Mixta 21,9% EP 12,9% IP | 100% (subtipos no descritos) | 62 (97) | 4,6 [0,2-5,2] años | 3 [2-5] | Menores (17%) 7 rasgado homoinjerto 1 hemorragia TET 1 falso aneurisma Arteria femoral 1 hematoma inguinal 1 transfusión hemorragia del acceso | 3 (4,5%) 2 EI 1 ICC | 4 (6,3) Staphilococcus epidermidis Streptococcus sanguinis Staphilococcus haemolyticus | 3 (4,7) | No descrito | 0 |
| 2015, Estados Unidos Cheatham et al.13 (2010, McElhinney et al.14, Zahn et al.15) | 150 (implantes, 136) | 19 [7-53] | No descrito > 25 kg | 77 (51) | 80 (53) IP 39 (26) EP 31 (21) Mixta | 100% (74% homoinjerto, 21% bioprótesis) | 49 (36) | 4,5 [0,4-7] años | 1-7 | 8 mayores + menores (6%) 1 rotura de conducto 1 disección coronaria 1 rasgado de conducto 1 TVS (cardioversión) 1 hipercarbia 1 trombosis femoral 2 perforaciones con guía de arteria lobar | 5 (3,7) | 14 (10,3) (¿?) | 11 (8,1) | 6 (4,4) | 20 (14,7) |
ACI: arteria coronaria izquierda; AP: arteria pulmonar; CIV: comunicación interventricular; BAV: bloqueo auriculoventricular; EI: endocarditis infecciosa; EP: estenosis pulmonar; FV: fibrilación ventricular; ICC: insuficiencia cardiaca congestiva; IP: insuficiencia pulmonar; TET: tubo endotraqueal; TSVD: tracto de salida del ventrículo derecho; TVS: taquicardia ventricular sostenida; VD ventrículo derecho.
Salvo otra indicación, los valores expresan n (%) o mediana [intervalo intercuartílico].
La tasa general de complicaciones periprocedimiento descrita es de alrededor del 6%, con un 2,7% de complicaciones mayores (rotura del conducto, perforación de arterias pulmonares, lesión de la válvula tricúspide, desplazamiento valvular, compresión de arterias coronarias u obstrucción de arteria pulmonar) y un 11,9% de complicaciones menores16. Nuestra serie reflejó tasas de complicaciones agudas mayores del 2,6% (n= 2, ventana aortopulmonar y lesión tricuspídea) y menores del 3,8%. El intento de predecir el riesgo de compresión coronaria es uno de los pasos más difíciles del procedimiento y es el evento que con más frecuencia se asocia con mortalidad en la sala de cateterismo. Se cree que un 5-6% de todos los posibles candidatos a IPVP podrían tener una anatomía coronaria susceptible de compresión durante el implante4,11. En cuanto a la rotura/desgarro del TSVD, hay más riesgo en los conductos muy calcificados y en los homoinjertos18. Afortunadamente en nuestra serie no se produjo ninguno de estos casos.
En el seguimiento a corto y medio plazo, la mortalidad total comunicada es de un 0-5% y en general no relacionada con el dispositivo16, salvo casos graves de EI. La causa más frecuente de reintervención percutánea o quirúrgica es la reestenosis del stent valvular, causada por recoil tardío o por pérdida de fuerza radial secundaria a fracturas16. Los factores de riesgo de aparición de fracturas son menor edad, gradiente VD-arteria pulmonar significativo antes y después del procedimiento, menor diámetro angiográfico del conducto, recoil o compresión del injerto y posición directamente por debajo del esternón19,20. De ahí la importancia de acondicionar el TSVD con pre-stent antes del implante. La aparición de insuficiencia pulmonar significativa por lesión a nivel de los velos valvulares es una rara condición asociada generalmente con EI21,22. En general, la supervivencia libre de disfunción valvular o reintervención es superior al 90, el 80 y el 70% en seguimientos a 1, 2 y 4 años respectivamente14,19,23, al igual que en nuestro estudio. Concretamente, el US Investigational Device Exemption Trial describe una supervivencia libre de reintervención y explante a los 5 años del 76 ± 4% y el 92 ± 3% respectivamente13. Los factores asociados con la reintervención son un gradiente residual elevado (gradiente medio > 25mmHg)13,23 o compresión del stent/recoil inmediatamente tras la liberación de la válvula18. En cambio, son factores protectores la colocación de un pre-stent13,18 que dé estabilidad al TSVD y la experiencia del operador23. El pre-stent puede colocarse en el mismo procedimiento o con 2-3 meses de antelación para permitir el crecimiento endotelial con mayor fijación24. Comparando nuestros resultados con una serie nacional de implante quirúrgico de válvula pulmonar analizada retrospectivamente, la curva de supervivencia libre de recambio valvular por disfunción protésica en el grupo de edad < 20 años se situaba en torno al 90%25 a los 5 años (si bien nuestra serie incluye la experiencia inicial de IPVP sin implante de stent para acondicionamiento del TSVD en 7 pacientes).
El riesgo de EI a medio plazo se ha estimado en el 2,4% por paciente-año21, aunque más de la mitad no afectan directamente a los velos valvulares y la mayoría responden al tratamiento antibiótico. En cualquier caso, es la principal causa de explante quirúrgico y de mortalidad secundaria a sepsis4,11,21. La turbulencia por gradiente residual relevante, trombosis in situ y la transgresión de la profilaxis antibiótica posiblemente sean los mecanismos fisiopatológicos implicados4,26. Este riesgo no es exclusivo del IPVP; sirva de ejemplo la serie de Oliver et al.25: una incidencia de EI tras la cirugía del 11,5% en una mediana de seguimiento de 7 años. En cuanto al tejido yugular bovino, en general, se asocia con mayor riesgo infeccioso que otros materiales protésicos quirúrgicos biológicos o sintéticos27,28. Un estudio in vitro recientemente publicado señala que su manipulación durante el procedimiento percutáneo podría inducir cambios histológicos y microfracturas29. Por todo ello, se recomienda a estos pacientes antiagregación con ácido acetilsalicílico de por vida y valoración dental previa al IPVP. En nuestra serie se obtuvo una incidencia de EI relativamente inferior a la publicada, seguramente en relación con el menor peso de nuestros pacientes (menores problemas dentales y dermatológicos) y el 19% de los TSVD nativos libres de conducto.
La resolución de la disfunción del TSVD mediante IPVP también se ha asociado con fenómenos de remodelado inverso del VD11,12,14,30, mejora del llenado ventricular izquierdo30 e incluso del grado de insuficiencia tricuspídea31.
El IPVP también modifica el sustrato electrofisiológico ventricular32, y en el periodo agudo tras el implante pueden aparecer nuevas arritmias en un 7-15% de los pacientes, generalmente extrasístoles o taquicardia ventricular no sostenida32,33. Se describe como un fenómeno transitorio con resolución espontánea, por lo general en los primeros 6 meses, que ocurre especialmente en los pacientes de menor tamaño y requiere tratamiento conservador (y valorar los bloqueadores beta). Otro mecanismo posiblemente asociado sea la colocación de la endoprótesis en contacto con el TSVD muscular. En nuestra serie se describe un 2,6% de pacientes con episodios de taquicardia ventricular no sostenida durante el periodo agudo tras el procedimiento, a los que se trató con bloqueadores beta durante 12-18 meses y tuvieron evolución favorable.
Como hemos comentado, el IPVP está oficialmente aprobado para pacientes de más de 30kg con conductos quirúrgicos en el TSVD con disfunción y diámetros de 18-22mm para Melody y 23-26mm para SAPIEN (Edwards Lifescience LLC; California, Estados Unidos). Pero se estima que menos del 20% de los pacientes con cardiopatía congénita y disfunción del TSVD cumplirían dichos criterios. Por eso la mayoría de los pacientes serían posibles candidatos a indicación de IPVP off label2. En nuestra serie constituyen el 47,4% (37/78) de los pacientes: por colocación en un sustrato anatómico diferente del conducto (n = 23) y/o por peso < 30kg (n = 22).
Hay pocos artículos que hagan referencia al IPVP en menores de 5 años, dado que técnicamente está más limitado por el alto perfil de la vaina (22-24 Fr). En una serie de 25 pacientes publicada en 2010 (mediana de edad, 8 años; mediana de peso, 21,4 kg), se observó que los resultados hemodinámicos a corto plazo son buenos34. La incidencia de complicaciones mayores fue del 16%, pero solo se relacionó con el menor peso la aparición de un hematoma abdominal. Por eso, se recomienda la realización de venografía femoral si se obtiene acceso a ese nivel, utilizar el acceso yugular para los de menos de 20kg, para obtener una curvatura favorable en el VD y no sobredilatar el conducto más del 110% del tamaño inicial. En una mediana de seguimiento de 16 meses a 22 pacientes, hubo 1 recambio quirúrgico del conducto, 2 fracturas tratadas mediante IPVP valve-in-valve y 2 endocarditis. Otros autores postulan que los pacientes de menos edad son los que más se benefician de los efectos hemodinámicos del IPVP en cuanto al remodelado inverso del VD y el consumo máximo de oxígeno35.
Por otro lado, diversos trabajos muestran buenos resultados hemodinámicos del IPVP Melody sobre el TSVD nativo o ampliado con parche36,37 o sobre bioprótesis valvulares quirúrgicas38. En este último caso, la supervivencia libre de reintervención fue > 90% a los 2 años y sin mortalidad relacionada con el procedimiento.
También se han obtenido buenos resultados tras el implante de una segunda Melody por técnica valve-in-valve, siempre que no haya obstáculos externos que impidan la correcta expansión válvular (p. ej., compresión esternal)39.
CONCLUSIONESLos resultados del IPVP Melody en pacientes pediátricos en España demuestran que es una técnica factible, exitosa y segura, incluso en pacientes de menos de 30kg o con TSVD nativo. Los resultados hemodinámicos a corto y medio plazo son excelentes y hay baja morbimortalidad. Nuestro índice de incidencia de EI fue relativamente bajo, posiblemente en relación con la menor edad y la ausencia de conductos en muchos de nuestros pacientes. Consideramos nuestro trabajo como una puerta abierta a nuevos estudios prospectivos de colaboración interhospitalaria que incluyan a la población adulta y arrojen luz sobre datos de remodelación ventricular y esperanza de vida de estos pacientes.
CONFLICTO DE INTERESESJ.L. Zunzunegui es proctor de implante percutáneo de válvula pulmonar para Medtronic.
- –
La aproximación clásica al tratamiento de la disfunción del TSVD, desde hace ya 4 décadas, ha sido la interposición de material protésico quirúrgico entre el ventrículo y la arteria pulmonar. Durante su evolución, los pacientes han requerido frecuentemente cirugías de recambio debido al crecimiento y la degeneración temporal de dicho material. Posteriores avances con la llegada del tratamiento percutáneo han evolucionado desde la angioplastia con balón de alta presión y la colocación de stents hasta el IPVP. Hoy múltiples estudios muestran que el IPVP es factible y tiene excelentes resultados.
- –
Nuestro estudio muestra la experiencia nacional acumulada con el IPVP Melody en pacientes pediátricos, poniendo el foco de atención en el funcionamiento valvular durante el seguimiento y la aparición de posibles complicaciones, especialmente la endocarditis.
Grupo de Trabajo de Hemodinámica de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas.