Determinar el valor del péptido natriurético auricular, el péptido natriurético cerebral, la copeptina, la región medial de la proadrenomedulina (MR-proADM) y la troponina I cardiaca (cTn-I) como indicadores de síndrome de bajo gasto cardiaco posoperatorio en niños con cardiopatía congénita intervenidos en circulación extracorpórea (CEC).
MétodosEstudio piloto prospectivo observacional, realizado durante 2 años, que incluyó a 117 niños (edad, 10 días-180 meses) intervenidos de cardiopatías congénitas en CEC, clasificados según presentaran o no síndrome de bajo gasto cardiaco. Los biomarcadores se determinaron tras 2, 12, 24 y 48 h del posoperatorio. Se utilizó un modelo de regresión logística multivariable para evaluar los factores asociados al bajo gasto cardiaco.
ResultadosTenían síndrome de bajo gasto cardiaco 33 pacientes (29%). Tras el ajuste por las demás variables, los valores plasmáticos de cTn-I>14 ng/ml a las 2 h de CEC (odds ratio=4,05; intervalo de confianza del 95%, 1,29-12,64; p=0,016) y de MR-proADM>1,5 nmol/l a las 24 h (odds ratio=15,54; intervalo de confianza del 95%, 4,41-54,71; p<0,001) fueron los únicos predictores independientes de bajo gasto cardiaco.
ConclusionesLos resultados indican que las concentraciones de cTn-I elevadas 2 h después de la CEC son, por sí solas, un predictor independiente de síndrome de bajo gasto cardiaco. Este valor predictivo se incrementa cuando se asocia con cifras de MR-proADM elevadas 24 h tras CEC. Estos 2 biomarcadores cardiacos podrían ayudar en la toma de decisiones terapéuticas en cuidados intensivos pediátricos, incluidas modificaciones en el tipo de soporte circulatorio.
Palabras clave
El síndrome de bajo gasto cardiaco (SBGC) es una potencial complicación tras la cirugía cardiaca que conlleva importantes alteraciones hemodinámicas y fisiológicas1. Su incidencia en los pacientes pediátricos varía de un 25 a un 60% de los intervenidos. La aparición de un SBGC sigue un curso predecible en las horas posteriores a la circulación extracorpórea (CEC), con una disminución del rendimiento miocárdico frente a una elevación de la demanda de gasto cardiaco. Cuando la demanda supera el aporte, se produce un shock y la identificación y la intervención tempranas pueden reducir la morbilidad y la mortalidad2.
Se ha descrito una gran variedad de marcadores cardiacos en los adultos con insuficiencia cardiaca. Sin embargo, se ha estudiado poco el comportamiento de los biomarcadores cardiacos (región media del propéptido natriurético auricular [MR-proANP], péptido natriurético cerebral [BNP], copeptina, región media de la proadrenomedulina [MR-proADM] y troponina cardiaca I [cTn-I]) en el periodo posoperatorio tras la cirugía cardiaca en CEC de los niños con cardiopatías congénitas. Se han publicado estudios en niños con insuficiencia cardiaca aguda3, pero la mayoría se ha centrado en los niños con insuficiencia cardiaca crónica4. En estos estudios se han observado correlaciones positivas entre las concentaciones plasmáticas de ANP y BNP y el grado de insuficiencia cardiaca5. Actualmente se considera que ambos son marcadores pronósticos de la insuficiencia cardiaca.
La copeptina, que es más estable que el péptido arginina-vasopresina, es un marcador pronóstico de infarto agudo de miocardio e insuficiencia cardiaca crónica en los pacientes adultos6,7. La cTn-I y la troponina T son marcadores muy sensibles y específicos de la lesión miocárdica y sus concentraciones se asocian al estado hemodinámico tras la cirugía cardiaca de recién nacidos y niños8. Algunos autores han descrito una correlación entre SBGC y valores de cTn-I, que se puede considerar predictores precoces de la evolución posoperatoria inicial y pueden ser útiles para identificar a los niños pequeños con mayor riesgo de SBGC y muerte tras la cirugía cardiaca en CEC9.
Se ha publicado que la adrenomedulina (ADM) se asocia a la fisiopatología del SBGC. La ADM es también un indicador pronóstico de la insuficiencia cardiaca crónica en los adultos, así como de la desestabilización aguda y la disfunción ventricular izquierda isquémica10,11. Las concentraciones elevadas de ADM se relacionan con una peor evolución clínica tras una lesión miocárdica. Sin embargo, la ADM apenas se ha estudiado en la población pediátrica.
El objetivo de este estudio es determinar si alguno de estos biomarcadores cardiacos se correlacionan con el estado hemodinámico de los niños tras la cirugía correctora de cardiopatías congénitas con CEC. Si se estableciera esta relación, se podría usar estos biomarcadores cardiacos como marcadores pronósticos del SBGC, lo que facilitaría la toma de decisiones terapéuticas en la práctica clínica en la unidad de cuidados intensivos pediátricos.
MÉTODOSDiseño del estudio: poblaciónEste estudio piloto prospectivo observacional unicéntrico se realizó durante un periodo de 2 años. Se incluyó consecutivamente a 117 pacientes (edad, 10 días-180 meses) ingresados en la unidad de cuidados intensivos pediátricos tras la cirugía correctora de cardiopatías congénitas en CEC. Los criterios de exclusión fueron: a) infección; b) insuficiencia renal; c) síndromes de malformaciones múltiples; d) defectos metabólicos congénitos, y e) enfermedades crónicas. También se excluyó del estudio a los pacientes que fallecieron durante la operación o en las primeras 6 h tras la intervención quirúrgica.
Tras el ingreso en la unidad de cuidados intensivos, el tratamiento y la monitorización de los pacientes se realizaron según lo establecido en un protocolo específico para cada tipo de cardiopatía congénita. La monitorización hemodinámica posoperatoria incluyó: a) inserción de una vía arterial (catéter PiCCO en arteria femoral; en los pacientes con 5-15kg de peso, se utilizó un catéter de 3 Fr —PV 2013 L07 Pulsiocath— y en los de peso superior, uno de 4 Fr —PV 2014 L08 Pulsiocath, Pulsion Medical Systems AG; Múnich, Alemania—; teniendo en cuenta los problemas que puede causar el cateterismo, se prescindió de la colocación de un catéter PiCCO en los pacientes con peso<5 kg; b) colocación de un catéter venoso central (con el extremo distal situado en la aurícula derecha), que se verificó mediante una radiografía de tórax, y c) en los pacientes en riesgo de disfunción ventricular izquierda posoperatoria, se colocó otro catéter en la aurícula izquierda. Todos los pacientes recibieron ventilación mecánica y sedación con midazolam y fentanilo.
Tras la cirugía correctora, se dividió a los pacientes en 2 grupos, según la presencia (grupo 1) o ausencia (grupo 2) de SBGC. El SBGC se diagnosticó cuando se cumplían los 2 criterios principales: a) fracción de eyección del ventrículo izquierdo<40% (Teicholz) determinada mediante ecocardiografía, y b) índice cardiaco<2,5 l/min/m2 determinado con un catéter de termodilución arterial (PiCCO) en todos los niños de peso ≥ 5kg. A los niños con peso<5kg se los diagnosticó de SBGC si presentaban una fracción de eyección<40% (ventrículo izquierdo, con la excepción del síndrome de corazón izquierdo hipoplásico, en el que el ventrículo derecho actúa como ventrículo sistémico) y cumplían al menos 3 de los siguientes criterios secundarios: a) presión arterial sistólica<p5 para la edad y el sexo; b) diuresis<1 ml/kg/h sin empleo de diuréticos; c) lactato ≥ 3,5 mmol/l o HCO3<18 mEq/l; d) puntuación inotrópica ≥ 2012, y e) cociente de extracción de oxígeno>35%.
Extracción de muestras de sangreLas muestras de sangre se obtuvieron a partir de un catéter venoso central antes de la cirugía correctora y a 2, 12, 24 y 48 h tras la CEC. La hematimetría, los parámetros de bioquímica general y la cuantificación de BNP y cTn-I se realizaron en el departamento de análisis clínicos del hospital. Las muestras de sangre para las determinaciones de los restantes biomarcadores se centrifugaron a 3.500 g durante 10 min. Se separó el suero en alícuotas y se congelaron a –82°C hasta su análisis.
El BNP y la cTn-I se determinaron mediante la técnica de inmunoanálisis de electroquimioluminiscencia automático (Architect system, Abbott Diagnostics Division; Illinois, Estados Unidos). Los límites de detección de la prueba de BNP y cTn-I fueron ≤ 10 pg/ml y ≤ 0,01 ng/ml respectivamente. Las determinaciones de MR-proANP, MR-proADM y copeptina se realizaron empleando un inmunoanálisis de detección simultánea de múltiples analitos BRAHMS KRYPTOR compact (Hennigsdorf, Alemania), con kits de análisis y la tecnología de detección Luminex xMAP. Los límites de detección analíticos fueron 0,05 nmol/l para la MR-proADM, 4,8 pmol/l para la copeptina y 2,1 pmol/l para el MR-proANP.
Análisis estadísticoLos datos se expresan en forma de media±desviación estándar o mediana [intervalo intercuartílico]. Las comparaciones entre los grupos 1 y 2 se realizaron con la prueba de la t de Student para las variables continuas cuando la distribución era normal (prueba de Kolmogorov-Smirnov) y con la prueba de la U de Mann-Whitney cuando la distribución no era normal. Las relaciones entre las variables discretas se evaluaron con la prueba de la χ2 o la prueba exacta de Fisher. Las comparaciones de los diversos momentos de valoración se realizaron con una prueba de ANOVA de diseños mixtos con la corrección de Sidak como prueba post hoc. Todos los análisis se ajustaron por edad y peso y las concentraciones de cTn-I se ajustaron también por tiempo de isquemia y tiempo de CEC.
Las correlaciones entre los valores máximos posoperatorios de cada uno de los biomarcadores enumerados se realizaron con la prueba de correlación de Spearman. Se realizó una regresión logística univariable a las 48 h de la operación para identificar los factores independientes predictivos del SBGC. Las relaciones entre las variables se evaluaron mediante la odds ratio (OR) con el intervalo de confianza del 95%. Se determinaron los factores de riesgo de sufrir SBGC mediante análisis univariable y los que resultaron significativos (p<0,05) fueron incluidos en el modelo multivariable. El estadístico de Hosmer-Lemeshow se empleó para valorar la bondad de ajuste, y el área bajo la curva, para determinar la capacidad discriminante del modelo. Mediante la construcción de curvas ROC, se determinó el valor de corte de la cTn-I y la MR-proADM que identificaban mejor los pacientes con SBGC. Se calculó asimismo la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo de los puntos de corte de la MR-proADM, la cTn-I y la combinación de ambos biomarcadores. Todas las pruebas fueron bilaterales y los resultados se consideraron estadísticamente significativos si p<0,05. Los datos se analizaron con el programa SPSS 18.0.0 2010 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
Historia clínica de los pacientesSe obtuvieron los datos de la historia clínica de cada uno de los niños participantes tras la firma del consentimiento informado por los padres o los tutores legales de los pacientes. El estudio fue aprobado por el comité de ética biomédica del hospital y se siguieron las normas éticas establecidas en la Declaración de Helsinki de 1964.
RESULTADOSSe incluyó a 117 pacientes de edad entre 10 días y 180 meses (media, 39,3±52,4 meses) con cardiopatías congénitas: un total de 19 niños (16%) tenían menos de 30 días.
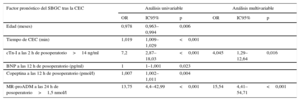
El tipo de cardiopatía congénita de los pacientes se describe en la tabla 1. En total, 33 pacientes (29%) tenían SBGC (grupo 1) tras la cirugía correctora y a los 84 restantes (71%) se los incluyó en el grupo 2. Sufrieron shock cardiogénico 6 pacientes (2 recién nacidos), que precisaron soporte mediante oxigenador extracorpóreo de membrana (ECMO) en las primeras 48 h siguientes a la CEC. Un paciente precisó ECMO en el quirófano, 2 en las primeras 12 h y 3 pacientes, 24-48 h tras la operación.
Descripción de los pacientes según el tipo de cardiopatía congénita
| Pacientes, n (%) | ||
|---|---|---|
| Tipo de CC | Tetralogía de Fallot | 18 (15,4) |
| Defecto del canal auriculoventricular | 15 (12,8) | |
| CoA/cayado aórtico interrumpido | 13 (11,1) | |
| Atresia de la pulmonar | 12 (10,3) | |
| TGV | 14 (12) | |
| CIV/CIA | 22 (18,8) | |
| TAC | 8 (6,8) | |
| SCIH | 6 (5,1) | |
| Insuficiencia mitral/aórtica | 3 (2,6) | |
| DVPTA | 3 (2,6) | |
| Otras | 3 (2,6) |
CC: cardiopatía congénita; CIA: comunicación interauricular; CIV: comunicación interventricular; CoA: coartación de aorta; DVPTA: drenaje venoso pulmonar total anómalo; SCIH: síndrome de corazón izquierdo hipoplásico; TAC: tronco arterial común; TGV: transposición de los grandes vasos.
Las características de todos los pacientes y de los recién nacidos de menos de 30 días, así como los datos de la operación y la clasificación de los pacientes en grupos según la presencia o ausencia de SBGC tras la CEC, se presentan en la tabla 2. Los niños del grupo 1 eran de menos edad y peso que los niños del grupo 2. El tiempo de isquemia y el tiempo de CEC fueron mayores en el grupo 1 (p<0,001). La distribución de sexos fue homogénea en los 2 grupos.
Características de los pacientes diferenciados según los grupos de estudio
| Todos los pacientes | Pacientes de menos de 30 días | |||||
|---|---|---|---|---|---|---|
| Grupo 1 n=33 | Grupo 2 n=84 | p | Grupo 1 n=8 | Grupo 2 n=11 | p | |
| Sexo, varones | 36 (60%) | 27 (47,4%) | 0,171 | 4 (50%) | 9 (81,8%) | 0,319 |
| Anomalías genéticas | 10 (16,7%) | 8 (14%) | 0,693 | 1 (12,5%) | 0 | 0,421 |
| Edada | 8,5 (1,25-9,7)b | 38 (10,5-92,5) | <0,001 | 8,5±4c | 9,5±4 | 0,609 |
| Peso (kg)a | 6,5 (3,7-10) | 12,7 (6,7-21,6) | <0,001 | 3,37±0,45 | 3,36±0,52 | 0,951 |
| PA (min)a | 82 (35-105) | 35 (15-65) | <0,001 | 81±30 | 89±38 | 0,637 |
| Tiempo de CEC (min)a | 130 (105-170) | 90 (62-120) | <0,001 | 172 (111-180) | 175 (130-190) | 0,442 |
| Puntuación Aristotlea | 9 (8-10) | 6 (6-8) | <0,001 | 10 (7-11) | 10 (10-11) | 0,598 |
| Duración de la VM (h)a | 109 (24-240) | 10 (5,5-24) | <0,001 | 156 (109-774) | 96 (48-120) | 0,012 |
| Estancia en la UCIP (días)a | 15 (9-23) | 6 (5-8,5) | <0,001 | 22,5 (12-39) | 11 (9-16) | 0,062 |
| Mortalidad | 4 (12,1%) | 2 (2,4%) | 0,05 | 2 (25%) | 1 (9,1) | 0,546 |
CEC: circulación extracorpórea; PA: pinzamiento aórtico; UCIP: unidad de cuidados intensivos pediátricos; VM: ventilación mecánica.
Grupo 1: pacientes con síndrome de bajo gasto cardiaco; Grupo 2: pacientes sin síndrome de bajo gasto cardiaco.
Los valores de p en negrita son estadísticamente significativos.
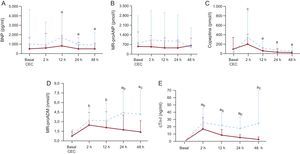
A las 2h del ingreso, las concentraciones de los siguientes biomarcadores mostraron aumentos estadísticamente significativos frente a las basales: cTn-I, 12,3 [4,6-36,1] frente a 0,02 [0-0,04] ng/ml (p<0,001); MR-proADM, 2,24 [1,34-3,26] frente a 0,51 [0,35-0,99] nmol/l (p<0,001), y copeptina, 132,8 [46,64-309,5] frente a 6,9 [4,7-28,5] pmol/l (p<0,001). Las cifras de BNP alcanzaron un pico máximo a las 12 h de la CEC: 441,4 [241,9-1.023,5] frente a 50,5 [25,7-186,15] pg/ml (p=0,020). Las concentraciones de MR-proANP no se modificaron con respecto a los valores basales en ningúno de los tiempos medidos.
La cTn-I fue el biomarcador del SBGC que mostró diferencias significativas de manera más precoz (a las 2 h tras la CEC) entre los grupos. Las concentraciones de copeptina y de BNP fueron muy similares entre ambos grupos en los distintos tiempos. Sin embargo, los valores de cTn-I y MR-proADM, tras alcanzar un valor máximo a las 2 h de la CEC, descendieron en el grupo 2 y se incrementaron en el grupo 1 (figura 1). Los biomarcadores posoperatorios de los recién nacidos mostraron un perfil similar al de los demás pacientes (figura 2).
Modificaciones de las concentraciones de los biomarcadores cardiacos en el posoperatorio de niños con cardiopatía congénita intervenidos en circulación extracorpórea y estratificados según la presencia o ausencia de síndrome de bajo gasto cardiaco en el posoperatorio de cirugía cardiaca. A: BNP. B: MR-proANP. C: copeptina. D: MR-proADM. E: cTn-I. BNP: péptido natriurético cerebral; CEC: circulación extracorpórea; cTn-I: troponina cardiaca I; MR-proADM: región media de la proadrenomedulina; MR-proANP: región media del propéptido natriurético auricular.
— — — Grupo 1.
— Grupo 2.
• Indica la media, y las barras de error corresponden a la desviación estándar.
aDiferencias significativas entre el grupo 1 y el grupo 2.
bDiferencias significativas frente al valor basal en ambos grupos (p<0,05).
cDiferencias significativas frente al valor basal en el grupo 1 (p<0,05).
Modificaciones de las concentraciones de los biomarcadores cardiacos en el posoperatorio de neonatos de menos de 30 días en circulación extracorpórea y estratificados según la presencia o ausencia de síndrome de bajo gasto cardiaco. A: BNP. B: MR-proANP. C: copeptina. D: MR-proADM. E: cTn-I. BNP: péptido natriurético cerebral; CEC: circulación extracorpórea; cTn-I: troponina cardiaca I; MR-proADM: región media de la proadrenomedulina; MR-proANP: región media del propéptido natriurético auricular.
— — — Grupo 1.
— Grupo 2.
• Indica la media, y las barras de error corresponden a la desviación estándar.
aDiferencias significativas entre el grupo 1 y el grupo 2.
bDiferencias significativas frente al valor basal en ambos grupos (p<0,05).
cDiferencias significativas frente al valor basal en el grupo 1 (p<0,05).
El BNP, el MR-ANP, la MR-proADM y la copeptina se mantuvieron inalterados en los diferentes momentos de valoración en comparación con los valores basales en los 6 pacientes que necesitaron ECMO. Sin embargo, las concentraciones de cTn-I alcanzaron un pico máximo a las 2 h de la operación: 19,33 [3,7-32,5] frente a 0,02 [0,01-0,03] ng/ml (p<0,001), para mantenerse sin cambios significativos en los siguientes tiempos posoperatorios.
CorrelacionesLos valores máximos de cTn-I a las 2 h estaban correlacionados con el tiempo de CEC (r=0,408; p<0,001). Sin embargo, el pico máximo de MR-proADM presentaba una correlación inversa con la edad del paciente (r=–0,560; p<0,001) y una correlación directa con el tiempo de CEC (r=–0,408; p<0,001) y los días de ingreso en la unidad de cuidados intensivos pediátricos (r=0,490; p<0,001).
Se observó una asociación positiva entre las concentraciones plasmáticas de MR-proADM (48 h después de la operación) y las de lactato en el grupo 1 (r=0,572; p<0,001), pero no en el grupo 2 (r=0,247; p<0,12). No se observó correlación alguna entre el cociente de extracción de oxígeno y las cifras de MR-proADM en los 2 grupos. Tampoco hubo correlación alguna entre concentraciones de cTn-I y de lactato o el cociente de extracción de oxígeno.
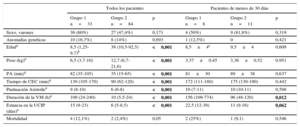
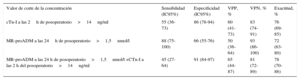
Análisis de regresión logísticaEn la tabla 3 se describen los parámetros más significativos obtenidos en los análisis de regresión logística univariable y multivariable en relación con la predicción del SBGC tras la CEC. Las concentraciones de cTn-I (> 14 ng/ml) a las 2 h de la cirugía correctora cardiaca en CEC y las de MR-proADM (> 1,5 nmol/l) a las 24 h del posoperatorio fueron factores independientes predictores de SBGC. Los resultados de la regresión logística y del área bajo la curva para cTn-I y la MR-proADM se muestran en la figura 3. Las comparaciones de las áreas bajo la curva de estos biomarcadores no mostraron diferencias estadísticamente significativas. Se calculó la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo con los valores de corte de 14 ng/ml para la cTn-I y 1,5 nmol/l para la MR-proADM (tabla 4). La combinación de MR-proADM y cTn-I tuvo gran especificidad y aportó una detección del SBGC más exacta que la obtenida usando solo la MR-proADM.
Regresión logística univariable y multivariable para la predicción del síndrome de bajo gasto cardiaco tras la cirugía cardiaca en circulación extracorpórea
| Factor pronóstico del SBGC tras la CEC | Análisis univariable | Análisis multivariable | ||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| Edad (meses) | 0,978 | 0,963–0,994 | 0,006 | |||
| Tiempo de CEC (min) | 1,019 | 1,009–1,029 | <0,001 | |||
| cTn-I a las 2 h de posoperatorio>14 ng/ml | 7,2 | 2,87–18,03 | <0,001 | 4,045 | 1,29–12,64 | 0,016 |
| BNP a las 12 h de posoperatorio (pg/ml) | 1 | 1–1,001 | 0,023 | |||
| Copeptina a las 12 h de posoperatorio (pmol/l) | 1,007 | 1,002–1,011 | 0,004 | |||
| MR-proADM a las 24 h de posoperatorio>1,5 nmol/l | 13,75 | 4,4–42,99 | <0,001 | 15,54 | 4,41–54,71 | <0,001 |
BNP: péptido natriurético cerebral; CEC: circulación extracorpórea; cTn-I: troponina cardiaca I; IC95%: intervalo de confianza del 95%; MR-proADM: región media de la proadrenomedulina; OR: odds ratio; SBGC: síndrome de bajo gasto cardiaco.
Prueba de Hosmer-Lemeshow, 2,93; p=0,711.
Curvas ROC para el diagnóstico del síndrome de bajo gasto cardiaco a las 48 h del posoperatorio. El área bajo la curva de MR-proADM a las 24 h del posoperatorio fue de 0,848 (IC95%, 0,771-0,924); el área bajo la curva de cTn-I a las 2 h del posoperatorio fue de 0,702 (IC95%, 0,581-0,812); el área bajo la curva de cTn-I>14 ng/ml a las 2 h del posoperatorio+MR-proADM>1,5 mmol/l a las 24 h del posoperatorio fue de 0,885 (IC95%, 0,823-0,947). cTn-I: troponina cardiaca I; IC95%: intervalo de confianza del 95%; MR-proADM: región media de la proadrenomedulina; ROC: características operativas del receptor.
Valor diagnóstico de las concentraciones de troponina cardiaca I y de la región media de la proadrenomedulina para la predicción del síndrome de bajo gasto cardiaco
| Valor de corte de la concentración | Sensibilidad (IC95%) | Especificidad (IC95%) | VPP, % | VPN, % | Exactitud, % |
|---|---|---|---|---|---|
| cTn-I a las 2h de posoperatorio>14ng/ml | 55 (36-73) | 86 (78-94) | 60 (41-73) | 83 (74-91) | 76 (69-85) |
| MR-proADM a las 24h de posoperatorio>1,5nmol/l | 88 (75-100) | 66 (55-76) | 50 (36-64) | 93 (86-100) | 72 (63-80) |
| MR-proADM a las 24 h de posoperatorio>1,5nmol/l +CTn-I a las 2 h del posoperatorio>14ng/ml | 45 (27-64) | 91 (84-97) | 65 (44-87) | 81 (72-89) | 78 (70-86) |
cTn-I: troponina cardiaca I; IC95%: intervalo de confianza del 95%; MR-proADM: región media de la proadrenomedulina; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La monitorización de los marcadores bioquímicos cardiacos tras la cirugía correctora es muy eficaz en los adultos con insuficiencia cardiaca4. Sin embargo, hay pocos estudios en los que se haya examinado su efectividad en niños tras la cirugía correctora en CEC1,3. El presente estudio piloto observacional prospectivo se realizó en una muestra amplia y con una variabilidad mínima en el tratamiento de los pacientes. Se observa que la predicción del SBGC se refuerza al utilizar un valor de corte de cTn-I>14 ng/ml a las 2 h de la CEC, con independencia de la edad de los pacientes, el tipo de cardiopatía congénita y la duración de la CEC. La cTn-I es un marcador sensible y específico de la lesión miocárdica tras la cirugía cardiaca y puede predecir los resultados hospitalarios iniciales. La predicción del SBGC es de por sí evidente, pero se vio reforzada cuando se combinaron los valores de la cTn-I a las 2 h de la CEC con MR-proADM>1,5 nmol/l a las 24 h de la CEC. No se observó que las determinaciones seriadas de BNP, MR-ANP y copeptina tengan utilidad en el diagnostico precoz de SBGC.
El SBGC se define como la incapacidad del corazón de mantener un volumen-minuto suficiente para aportar oxígeno y nutrientes al tejido. Este concepto implica la influencia que el gasto cardiaco y la resistencia al flujo sanguíneo de los vasos periféricos tienen en la adecuada perfusión tisular. Tras la cirugía cardiaca en CEC, la disminución de la función ventricular alcanza un máximo entre las 8 y las 12 h, y luego se recupera gradualmente a las 24-48 h de la CEC1. Además de los métodos de monitorización ordinarios, la función ventricular puede evaluarse también mediante el análisis de los biomarcadores cardiacos.
Existen pocos estudios sobre los valores de referencia de los biomarcadores en la población pediátrica, lo que dificulta su interpretación. Todos los estudios estadísticos realizados en este estudio se han ajustado tanto por la edad como por el peso de los pacientes, con objeto de evitar que estas variables influyeran en los resultados. Aunque no hay estudios que hayan descrito modificaciones asociadas al sexo en los biomarcadores cardiacos, la distribución de sexos en este estudio fue homogénea.
La elevación de las concentraciones plasmáticas de los biomarcadores estudiados, con independencia de que los pacientes tuvieran o no un SBGC, indica que se producen cambios importantes en los niños expuestos a la CEC durante la reparación quirúrgica. En algunos estudios se ha observado un aumento de pro-BNP l y pocas modificaciones en el MR-ANP9,13. Los valores plasmáticos de esos 2 biomarcadores cardiacos parecen variar en función del estado hemodinámico del paciente y las características de la cardiopatía congénita14.
El BNP se elimina a través del proceso de hemofiltración, de manera similar a los mecanismos de ultrafiltración, en la última fase de la CEC15. Por consiguiente, la actividad biológica del sistema hormonal natriurético puede disminuir y la infusión de hormonas natriuréticas podría aportar un beneficio clínico16,17. En varios estudios se ha observado asociación entre el aumento de pro-BNP l y una mayor incidencia de complicaciones en el posoperatorio16. Carmona et al.9 han observado correlación entre el SBGC y las concentraciones preoperatorias de pro-BNP, pero no con las cifras tras la cirugía correctora. No existen estudios sobre concentraciones posoperatorias de copeptina en los niños sometidos a intervenciones de cirugía cardiaca. En el presente estudio, la determinación secuencial de la copeptina no fue eficaz.
La cTn-I y la troponina T indican necrosis de las células miocárdicas. Las concentraciones de cTn-I aumentan rápidamente tras la lesión cardiaca y podrían servir de biomarcador cardiaco predictivo durante el curso posoperatorio de los pacientes con cardiopatías congénitas a los que se practica una operación cardiaca9,18. Estudios previos han indicado que los valores de cTn-I a las 4 h de la CEC permiten a los clínicos predecir el curso posoperatorio de los pacientes pediátricos tras la cirugía cardiaca19. Bojan et al.20 han determinado que un aumento precoz de la cTn-I puede ser útil para predecir el curso posoperatorio de los recién nacidos y los lactantes a los que se interviene de cirugía cardiaca. No se puede obviar que el tiempo de isquemia puede incrementar las concentraciones de cTn-I21. Con un valor de corte de cTn-I de 13 ng/ml a las 4 h de la CEC, Froese et al.22 han demostrado que la determinación temprana de cTn-I puede permitir a los clínicos identificar la aparición de SBGC tras la cirugía cardiaca en los niños. En cambio, en este estudio es un valor umbral más precoz tras la CEC de cTn-I>14 ng/ml el que mostró altas sensibilidad y especificidad para identificar el SBGC. La cTn-I es un marcador específico y sensible de la lesión miocárdica tras la cirugía cardiaca y constituye de por sí un predictor precoz del SBGC independiente, sea cual sea la edad del paciente, el defecto cardiaco fisiológico y la duración de la CEC.
Hay pocos estudios que valoren los efectos de la CEC en la concentración plasmática de MR-proADM. La ADM es difícil de determinar en el plasma; sin embargo, la MR-proADM es más estable que la molécula activa y se secreta en cantidades equimolares respecto a la ADM. La cantidad de ADM circulante está aumentada en la insuficiencia cardiaca y se relaciona con la disminución de la fracción de eyección del ventrículo izquierdo. Así pues, la secreción de ADM parece ser un mecanismo compensatorio en el SBGC, y desempeña también un papel importante en la homeostasis de los líquidos.
Nuestros resultados difieren de los descritos por Abella et al.23, que han mostrado una disminución inicial de ADM durante y después de la CEC en los niños con SBGC. Takeuchi et al.24 han descrito también una disminución de ADM plasmático a las 24 h de la CEC. Ambos estudios se llevaron a cabo con un pequeño número de pacientes, por lo que estos resultados deben interpretarse con precaución. Parece plausible deducir que, en la mayoría de los pacientes críticos, las concentraciones de ADM deben de estar aumentadas. El aumento de la ADM en el SBGC podría ser un mecanismo de compensación que aumentara la adenosina monofosfato cíclico, activara la proteincinasa A y estimulara la contractilidad miocárdica, el flujo coronario y el gasto cardiaco23. Dado el bajo número de pacientes que necesitaron ECMO en nuestro estudio, no consideramos apropiado realizar un análisis estadístico de los biomarcadores cardiacos estudiados. El tránsito de la sangre por el circuito extracorpóreo puede dar lugar a la degradación o el secuestro de estos biomarcadores. Según lo descrito por Luyt et al.25, la monitorización de estos biomarcadores cardiacos en los pacientes con ECMO no sería útil para la toma de decisiones terapéuticas.
La determinación posoperatoria de la cTn-I y la MR-proADM, podría utilizarse en los pacientes con una cardiopatía congénita para determinar el riesgo de SBGC tras la cirugía correctora en CEC. La monitorización de parámetros hemodinámicos y respiratorios, la cuantificación seriada del lactato sérico y las determinaciones de la saturación de oxígeno tisular mediante espectroscopia del infrarrojo cercano siguen siendo esenciales para apoyar el diagnóstico de SBGC. Determinar las concentraciones de estos biomarcadores puede ser útil también en la evaluación del gasto cardiaco y la oxigenación tisular. Esto facilitaría la toma de decisiones terapéuticas en la práctica clínica y permitirá a los clínicos modificar el tipo de soporte utilizado. El análisis de los biomarcadores cardiacos estudiados a las 2 y a las 24 h de la cirugía no puede considerarse por separado, sino que debe complementarse con los datos de otras monitorizaciones que suelen realizarse en el posoperatorio.
LimitacionesLas limitaciones del presente estudio afectan principalmente a los aspectos genómicos de los biomarcadores cardiacos, las interacciones entre esos biomarcadores, que pueden ser complejas, y el hecho de que las variaciones individuales de esos biomarcadores puedan ser grandes. En el análisis multivariable, se obtuvo una amplia gama de intervalos de confianza de las OR. Sin embargo, este factor escapa a nuestra influencia y depende principalmente de la variabilidad de las determinaciones. No se puede descartar que se hayan excluido del análisis multivariable algunas variables que puedan influir en el SBGC. La variabilidad en la complejidad posoperatoria clínica de los pacientes que se someten a CEC y las diferentes intervenciones quirúrgicas dificultan una monitorización exhaustiva de todas las posibles variables predictivas del SBGC. No obstante, se realizó previamente un análisis descriptivo y univariable para evitar esa variabilidad. La validez de nuestros resultados está respaldada también por los altos valores de OR obtenidos.
Los principales puntos fuertes del estudio son el gran tamaño muestral y la variabilidad mínima en el tratamiento de los pacientes. El SBGC se estableció con unos criterios de inclusión restrictivos y objetivos.
CONCLUSIONESEste estudio demostró que la predicción del SBGC a las 48 h se reforzaba con el empleo de un valor de corte de cTn-I>14 ng/ml a las 2 h de la CEC. La cTn-I es un marcador sensible y específico de la lesión miocárdica tras la cirugía cardiaca. La predicción temprana del SBGC es evidente por sí misma, con independencia de cuál sea el defecto cardiaco fisiológico y la duración de la CEC. Este resultado se vio respaldado cuando se combinaron los valores de la cTn-I a las 2 h de la CEC con un valor de corte de MR-proADM>1,5 nmol/l a las 24 h de la CEC. Los valores de los biomarcadores cardiacos, combinados con una monitorización de los parámetros hemodinámicos y respiratorios, podrían aportar una información complementaria para facilitar la toma de decisiones terapéuticas y prevenir el deterioro hemodinámico en el periodo posoperatorio inmediato en la cardiopatía congénita.
- –
Se ha descrito una gran variedad de marcadores cardiacos en los adultos con insuficiencia cardiaca. Sin embargo, el comportamiento de los biomarcadores cardiacos en el periodo posoperatorio tras la cirugía cardiaca en CEC de los niños con cardiopatías congénitas se ha estudiado muy poco.
- –
Si alguno de los biomarcadores cardiacos estudiados tuviera correlación con el estado hemodinámico de los niños tras la cirugía correctora de la cardiopatía congénita, podría utilizarse en la toma de decisiones terapéuticas en la práctica clínica tras la cirugía.
- –
La predicción del SBGC se vio reforzada con el empleo de un valor de corte de cTn-I>14 ng/ml a las 2 h de la CEC. La predicción temprana del SBGC es evidente por sí misma, con independencia de cuál sea el defecto cardiaco fisiológico y la duración de la CEC. Este resultado se vio respaldado cuando se combinaron los valores de la cTn-I con un valor de corte de MR-proADM>1,5 nmol/l a las 24 h de la CEC.
- –
Las concentraciones de estos biomarcadores cardiacos podrían aportar información complementaria para facilitar la toma de decisiones terapéuticas y prevenir el deterioro hemodinámico en el periodo inmediato tras la CEC.
Este estudio fue financiado por BRAHMS GmbH Biotechnology Centre, Hennigsdorf, Berlín, Alemania. El promotor del estudio no intervino en modo alguno en el diseño del estudio ni en la obtención, el análisis y la interpretación de los datos y no participó en la redacción del artículo.
CONFLICTO DE INTERESESNinguno.