Palabras clave
INTRODUCCIÓN
Cribier et al1 implantaron en el año 2002 la primera válvula percutánea en posición aórtica para el tratamiento de la estenosis aórtica severa sintomática. El procedimiento se realizó en un paciente con múltiples comorbilidades y en shock cardiogénico que había sido rechazado para remplazo valvular aórtico (RVA) quirúrgico. Siguiendo esta experiencia pionera, la implantación percutánea de prótesis valvulares aórticas (IPPVA) se ha extendido muy rápidamente, y actualmente ya se han implantado más de 5.000 válvulas percutáneas aórticas en todo el mundo. Cabe destacar que el impresionante desarrollo de esta tecnología se ha producido a pesar de haberse restringido a pacientes con riesgo quirúrgico muy alto o prohibitivo. De hecho, la gran mayoría de los pacientes que hasta el momento han recibido este tratamiento son octogenarios con un riesgo estimado de mortalidad operatoria > 20% según el EuroSCORE logístico o > 8% según el score de la Sociedad Norteamericana de Cirujanos Torácicos (STS). Además, los pacientes con un menor riesgo quirúrgico (< 20% por EuroSCORE logístico o < 8% por STS score) que recibieron tratamiento de IPPVA presentaban otras comorbilidades importantes, como fragilidad extrema y/o aorta de porcelana, ninguna de las cuales está incluida en los scores de cálculo de riesgo quirúrgico. De hecho, y a diferencia de otros procedimientos percutáneos, la IPPVA se ha desarrollado en una población de riesgo extremo, y este hecho debería tenerse en cuenta al evaluar los resultados obtenidos con este procedimiento hasta el momento. Los objetivos principales de este artículo son revisar: a) los principales aspectos del procedimiento, los resultados y las complicaciones que este conlleva; b) los resultados clínicos y hemodinámicos a corto y medio plazo, y c) discutir brevemente diversos aspectos de la evolución futura del procedimiento y la expansión potencial de sus indicaciones en un futuro próximo. Con este propósito, se realizó una búsqueda sistemática de la literatura médica en PubMed, EMBASE, Cochrane Library, y fuentes de información sobre estudios clínicos basadas en internet (www.clinicaltrials.gov, www.tctmd.com, www.cardiosource.com, www.theheart.org) desde noviembre de 2002 hasta septiembre de 2009 usando los términos «transcatheter/percutaneous/ transfemoral/transapical aortic valve implantation/ replacement/insertion» como palabras clave.
IPPVA. EL PROCEDIMIENTO
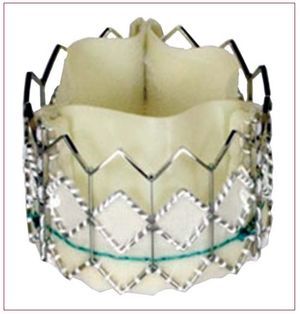
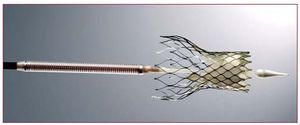
En los últimos años se han utilizado dos válvulas percutáneas en la práctica clínica: la válvula de Edwards (Cribier-Edwards; Edwards SAPIEN; SAPIEN XT) (Edwards Lifesciences Inc., Irvine, Estados Unidos) y la válvula CoreValve (CoreValve, París, Francia; Medtronic, Minneapolis, MN, Estados Unidos, desde febrero de 2009). La válvula Edwards SAPIEN está constituida por 3 velos de pericardio bovino y está montada (suturada) en el interior de una estructura metálica (stent) de acero inoxidable (cobalto-cromo para el modelo SAPIEN XT) (fig. 1). La válvula se pliega sobre un balón y se implanta mediante un mecanismo de expansión por inflado del balón. La válvula está disponible en diámetros de 23 y 26 mm. Los procedimientos se realizan en un laboratorio de hemodinámica o en una sala híbrida, bajo anestesia general y sin circulación extracorpórea. En la mayoría de los casos, se realiza una exposición quirúrgica de la arteria femoral que se sutura al final del procedimiento, a pesar de que el cierre percutáneo de la arteria se está ulitizando cada vez con mayor frecuencia. Se realiza sistemáticamente una valvuloplastia aórtica antes de la implantación de la válvula. La válvula ya plegada sobre un balón se avanza a través de un introductor de 22 Fr (válvula de 23 mm) o 24 Fr (válvula de 26 mm) mediante el catéter transportador Retroflex. Tras cruzar la válvula aórtica nativa, la nueva válvula se posiciona mediante fluoroscopia, angiografía y ecocardiografía transesofágica. La válvula se expande mediante la inflación del balón en la que está plegada y bajo sobreestimulación cardiaca (de 180 a 220 lat/min mediante marcapasos temporal) para minimizar el riesgo de embolización. Litchenstein et al2 describieron por primera vez el abordaje transapical como una alternativa al abordaje transfemoral en los casos con sistema iliofemoral desfavorable (pequeño diámetro, calcificación severa, enfermedad vascular periférica). El abordaje transapical consiste en una punción directa del ápex ventricular izquierdo a través de una pequeña toracotomía lateral izquierda, seguida del avance de un catéter de 26 Fr a través del ápex del ventrículo izquierdo hasta la porción media de la cavidad ventricular. Tras cruzar la válvula aórtica nativa con una guía, la preparación, el posicionamiento y la implantación de la válvula siguen pasos similares a los descritos para el abordaje transfemoral. Se ha demostrado que la utilización de este doble abordaje (transfemoral-transapical) hace posible el tratamiento de una gran proporción de pacientes previamente rechazados para RVA quirúrgico3,4. Resulta interesante destacar que en la experiencia de los centros que utilizaron las dos vías de abordaje, un alto porcentaje (32-52%) de los pacientes fueron tratados por vía transapical debido a la alta prevalencia de pequeñas arterias iliofemorales y/o enfermedad vascular periférica en los candidatos a IPPVA, así como al tamaño de los catéteres utilizados3-5. En un futuro próximo el tamaño de los catéteres se reducirá a menos de 20 Fr (modelo SAPIEN XT, 18 Fr para la válvula de 23 mm y 19 Fr para la válvula de 26 mm), lo cual limitará muy probablemente el uso de la vía transapical a menos del 30% de los pacientes. La válvula CoreValve está constituida por 3 velos de pericardio porcino montados (suturados) en el interior de un stent autoexpandible de nitinol (fig. 2). La válvula está disponible en diámetros de 26 y 29 mm, y se implanta por vía transfemoral usando catéteres de 18 Fr, lo cual permite el cierre percutáneo eficaz de la arteria femoral (sin exposición quirúrgica de la arteria) en la mayoría de los casos. Tras realizar una valvuloplastia aórtica, se atraviesa la válvula aórtica nativa mediante el catéter transportador de la válvula y, tras un posicionamiento guiado principalmente por angiografía, se autoexpande la válvula mediante la retirada de la porción externa del catéter transportador sin necesidad de sobreestimulación cardiaca. Recientemente se ha propuesto la vía subclavia como alternativa a la femoral en casos de enfermedad vascular periférica y/o arterias iliofemorales pequeñas6. Este abordaje precisa la exposición quirúrgica de la arteria subclavia. Finalmente, el primer caso de implantación de una válvula CoreValve por vía transapical se ha publicado recientemente7.
Fig. 1. Válvula Edwards SAPIEN.
Fig. 2. Sistema CoreValve Revalving.
RESULTADOS DEL PROCEDIMIENTO Y MORTALIDAD A 30 DÍAS
Primeros estudios en humanos y estudios de viabilidad
Los principales resultados de las series iniciales que incluyen el abordaje transfemoral y/o transapical se presentan en la tabla 12,3,8-15. La experiencia con la válvula Edwards se inició en el año 20021, y el primer registro monocéntrico (primer estudio en humanos) fue liderado por el Dr. Cribier en el hospital Charles Nicolle, Rouen, Francia8,16. Tras esta primera experiencia en humanos, el Dr. Webb comunicó la experiencia inicial del Hospital St. Paul's, Vancouver, Canadá, utilizando el abordaje retrógrado transfemoral9,17. La experiencia inicial con la válvula Edwards se completó con dos registros multicéntricos, el REVIVAL II en Estados Unidos (Transcatheter Endovascular Implantation of Valves; datos presentados en el Transcatheter Cardiovascular Therapeutics Meeting 2006) y el REVIVE II en Europa (Registry of Endovascular Implantation of Valves in Europe II; datos presentados en el Transcatheter Cardiovascular Therapeutics Meeting 2008). En 2006, Lichtenstein et al2 describieron los resultados de los primeros 7 pacientes tratados mediante abordaje transapical, y Whalter et al10 comunicaron la experiencia inicial (n = 30) del Leipzig University Heart Center, Leipzig, Alemania. La experiencia inicial con el abordaje transapical se completó con dos registros multicéntricos en Europa11 y Estados Unidos12, y el todavía no publicado registro TRAVERCE (Transapical Surgical Delivery of the Cribier-Edwards Aortic Bioprothesis Clinical Feasibility registry; datos presentados en el Transcatheter Cardiovascular Therapeutics 2008). Nuestro grupo fue el primero en comunicar la viabilidad y los resultados iniciales de un programa global que incluía los abordajes transfemoral y transapical para el tratamiento de la estenosis aórtica severa3. Los pacientes diagnosticados de estenosis aórtica severa sintomática rechazados para RVA quirúrgico, fueron evaluados por un equipo multidisciplinario compuesto por cardiólogos intervencionistas y cirujanos cardiacos, que determinó si el paciente era candidato a IPPVA y seleccionó el abordaje transfemoral o transapical según la anatomía aortoiliofemoral tras evaluación mediante angiografía y/o tomografía computarizada. Este proceso de selección introduce un sesgo que, a nuestro entender, impide una justa comparación entre los dos abordajes. De hecho, se ha demostrado que los pacientes seleccionados para abordaje transapical presentan un perfil de riesgo mayor que los seleccionados para abordaje transfemoral4,5. Grube et al18, en 2005, informaron de la primera implantación de una válvula de tipo CoreValve, y el mismo grupo publicó, en 2006, los resultados del primer registro con esta válvula, con un total de 55 pacientes13. A esta experiencia inicial le siguieron los resultados de una experiencia monocéntrica canadiense14 y un registro multicéntrico realizado en Alemania y Canadá15.
García et al19 y Moreno et al20 han comunicado recientemente la primera experiencia de IPPVA (n = 4 en ambos estudios) en España.
Registros recientes
Los resultados del procedimiento y la mortalidad a 30 días de los registros multicéntricos más importantes en relación con la IPPVA se detallan en la tabla 2. El registro PARTNER EU (Placement of Aortic Transcatheter Valve European Union; datos presentados en el EuroPCR meeting 2009) incluyó a 130 pacientes procedentes de 9 centros en Europa a quienes se realizó una IPPVA (abordaje transapical y transfemoral) utilizando la válvula Edwards SAPIEN, entre abril de 2007 y enero de 2008. A este registro le siguió el registro SOURCE (Edwards Sapien Aortic Bioprothesis European Outcome; datos presentados en el EuroPCR meeting 2009), que incluyó un total de 1.038 pacientes, procedentes de 34 centros europeos, a quienes se realizó una IPPVA utilizando la válvula Edwards SAPIEN. Los abordajes transapical y transfemoral se utilizaron en el 55 y el 45% de los casos, respectivamente. Este registro se inició inmediatamente después de que la válvula de Edwards obtuviera la marca CE (septiembre de 2007). También, tras la obtención de la marca CE, se realizó un registro europeo que incluía a 646 pacientes a quienes se realizó una IPPVA utilizando una válvula de tipo CoreValve21. Más recientemente, Laborde et al presentaron los resultados de un registro europeo que incluye un total de 1.243 pacientes tratados con el sistema CoreValve (18 Fr) (datos presentados en el Transcatheter Cardiovascular Therapeutics Meeting 2008).
Globalmente, estos registros multicéntricos recientes incluyeron a más de 2.000 pacientes y comunicaron unas tasas de éxito del procedimiento > 90% y una mortalidad a 30 días < 10%, lo que supone un paso importante para confirmar la seguridad y la eficacia de este procedimiento como alternativa al RVA en pacientes considerados en riesgo quirúrgico muy elevado o prohibitivo.
IPPVA. Factores predictores de éxito del procedimiento
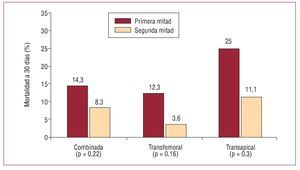
La IPPVA es un procedimiento complejo que hasta el momento se ha realizado exclusivamente en pacientes con muy alto riesgo. Además, la tecnología ha evolucionado muy rápidamente en los últimos 5 años, y ha dado lugar a catéteres transportadores de perfil más bajo y mejores sistemas de implantación de la válvula. Varios grupos han demostrado la importancia de la curva de aprendizaje comparando sus resultados iniciales con los obtenidos posteriormente. Webb et al5 comunicaron su experiencia con 168 pacientes consecutivos tratados con la válvula de Edwards (Cribier-Edwards, Edwards SAPIEN) implantada por vía transfemoral (n = 113) o transapical (n = 55). La mortalidad a 30 días disminuyó desde el 14,3% en los primeros 84 pacientes al 8,3% en la segunda mitad de la serie (fig. 3). Himbert et al4 también evidenciaron que la curva de aprendizaje en relación con la experiencia inicial de un centro fue el factor más importante asociado a la mortalidad hospitalaria y a medio plazo tras un procedimiento de IPPVA. Webb et al22 han comunicado recientemente que la combinación de experiencia y mejoras sustanciales en el diseño del catéter transportador de la válvula pueden conllevar resultados tan excepcionales como un éxito del procedimiento del 100% y la ausencia de mortalidad a 30 días. En la misma línea, Grube et al23 demostraron una reducción de la mortalidad a 30 días del 73% (de un 40 a un 10,8%) en una serie de 102 pacientes en quienes se utilizó el sistema CoreValve de 18 Fr, en comparación con una serie inicial de 10 pacientes tratados con una válvula CoreValve de primera generación (25 Fr). Tanto la compañía Edwards como CoreValve/Medtronic han establecido un programa de formación para los centros que quieren iniciar los procedimientos de IPPVA, consistente en un entrenamiento de 1-2 días en centros de gran experiencia, y posteriormente tratar los primeros casos con la supervisión de médicos expertos. No cabe ninguna duda de que este proceso de aprendizaje ha minimizado los errores en relación con la curva de aprendizaje y ha contribuido en gran manera a mejorar los resultados de los procedimientos de IPPVA. Debe añadirse también que la IPPVA es un procedimiento complejo y de riesgo que debería restringirse a centros con gran experiencia en intervenciones cardiacas percutáneas y quirúrgicas, con la implicación de equipos multidisciplinarios que incluyen cardiólogos intervencionistas, cirujanos cardiacos, ecocardiografistas, anestesistas e internistas/geriatras. La participación del equipo multidisciplinario en la selección de pacientes, tiempos de procedimiento y cuidados tras la intervención, y seguimiento de los pacientes puede ser un factor clave en el éxito de un programa de IPPVA.
Fig. 3. Resultados del procedimiento y a 30 días combinados (transfemoral y transapical) y separados por tipo de abordaje y grado de experiencia. Reproducido de Webb et al5, con el permiso del autor y de la editorial.
Rodés-Cabau et al24 han evaluado recientemente los factores pronósticos en la experiencia multicéntrica canadiense de IPPVA con la válvula de Edwards, con un total de 345 procedimientos consecutivos. Los predictores de mortalidad a los 30 días del procedimiento fueron la hipertensión pulmonar, la insuficiencia mitral severa y la necesidad de soporte hemodinámico (balón intraaórtico o bypass cardiopulmonar) durante el procedimiento. Buellesfeld et al25 demostraron que el estado funcional del paciente antes del procedimiento, evaluado mediante el índice de Karnofsky, fue el único predictor independiente de mortalidad intrahospitalaria tras IPPVA mediante el sistema CoreValve; lo que destaca una vez más la gran importancia del proceso de selección de los pacientes en los resultados de este procedimiento.
COMPLICACIONES MAYORES EN RELACIÓN CON EL PROCEDIMIENTO
El tipo y la incidencia de las principales complicaciones que conlleva el procedimiento de IPPVA se detallan en la tabla 3.
Mala posición y/o embolización valvular
La incidencia de mala posición y/o embolización de las válvulas percutáneas se ha reducido drásticamente desde las series iniciales (aproximadamente del 6%) a los estudios más recientes (aproximadamente del 2%)8-25. Este dato refleja claramente la importancia de la curva de aprendizaje en el proceso de posicionamiento e implantación de la válvula. Sin embargo, el hecho de que las dos válvulas disponibles actualmente en la clínica no sean recapturables y reposicionables tras la implantación impide eliminar completamente esta complicación. La válvula de Edwards se implanta mediante inflado de un balón bajo estimulación ventricular rápida y existe una mínima o nula posibilidad de reposicionamiento durante la implantación. La fluoroscopia y especialmente la angiografía continúan siendo el estándar para el posicionamiento y la implantación de la válvula, pero en nuestra experiencia, la ecocardiografía transesofágica tiene un papel muy importante en la mejora del posicionamiento valvular, especialmente en los casos de abordaje transapical3,29. Por otra parte, la válvula CoreValve tiene la ventaja de ser reposicionable cuando la válvula está sólo parcialmente desplegada. Sin embargo, no se han observado diferencias notables entre el sistema de Edwards y la CoreValve en relación con esta complicación (tabla 3)8-25. A pesar de que la mala posición y/o la embolización valvular pueden manejarse con éxito en la mayoría de los casos, en un futuro debería resolverse esta complicación potencial mediante el desarrollo de válvulas percutáneas completamente recapturables y reposicionables.
Necesidad de soporte hemodinámico. Conversión a cirugía cardiaca abierta
Los procedimientos de IPPVA pueden conllevar complicaciones hemodinámicas severas y necesitar soporte hemodinámico mediante circulación extracorpórea (femoral-femoral en la mayoría de los casos) o balón intraaórtico. Sin embargo, esta complicación potencialmente mortal y la necesidad de cirugía cardiaca abierta emergente se han reducido en las series recientes en comparación con las experiencias iniciales (de más del 3% a menos del 2%)8-25, una vez más esto señala el papel clave de la curva de aprendizaje para evitar y manejar las complicaciones asociadas a estos procedimientos. Ya pasó el tiempo en que algunas IPPVA se realizaban sistemáticamente mediante bypass cardiopulmonar10,13, pero creemos que la disponibilidad de una máquina de circulación extracorpórea y un equipo quirúrgico capaz de entrar al paciente en bypass cardiopulmonar en pocos minutos continúa siendo recomendable.
De hecho, en la experiencia canadiense24 la mayoría (64%) de los pacientes que precisaron soporte hemodinámico mediante circulación extracorpórea o balón intraaórtico durante el procedimiento sobrevivieron.
Complicaciones de acceso (transfemoral y/o transapical)
La utilización de catéteres de gran tamaño para el abordaje transfemoral (entre 18 y 24 Fr) y la aplicación de estos procedimientos a pacientes de edad muy avanzada determinan que la incidencia de complicaciones vasculares graves sea > 10% en la mayoría de las series de IPPVA8-25. Una evaluación precisa del tamaño, la tortuosidad y el grado de calcificación del sistema iliofemoral (mediante angiografía y tomografía computarizada, o ecografía intravascular en casos límite) parece ser un factor clave para evitar estas complicaciones. La experiencia con el sistema CoreValve indica que la reducción del tamaño del catéter transportador (de 25 a 18 Fr) puede tener un gran impacto en la reducción de las complicaciones vasculares (incidencia > 20% en series iniciales frente a menos del 5% en registros recientes)3-15,21,23. Por otra parte, mantener un tamaño del catéter ≥ 22 Fr en los procedimientos de IPPVA realizados con la válvula de Edwards se ha traducido en una incidencia estable de complicaciones vasculares a lo largo del tiempo, a pesar de una mayor experiencia de los operadores y centros que realizan dichos procedimientos8,9,16,17. Tener experiencia en el tratamiento de estas complicaciones y/o disponer de un soporte logístico con radiólogos intervencionistas o cirujanos vasculares son elementos de gran importancia para mejorar los resultados de estos procedimientos y reducir la mortalidad que conllevan. Por primera vez, las complicaciones vasculares no se relacionaron con una mayor mortalidad a 30 días en el registro SOURCE, lo que indica que la presencia de equipos experimentados en el tratamiento de estas complicaciones puede limitar su impacto en la mortalidad periprocedimiento.
Los procedimientos por vía transapical también se han asociado a complicaciones de acceso graves como desgarro ventricular y sangrado severo durante la reparación del ápex ventricular3-5,10-12,24,26. Nuestro grupo publicó recientemente la utilidad de la sobreestimulación ventricular mediante marcapasos transitorio para evitar los desgarros ventriculares durante la reparación del ápex ventricular30.
Infarto cerebral
El infarto cerebral como complicación potencial de la IPPVA ha sido una de las mayores preocupaciones desde el inicio del tratamiento valvular percutáneo aórtico. Sin embargo, si excluimos las series iniciales de implantación de la válvula CoreValve mediante circulación extracorpórea13-15, la incidencia de infarto cerebral ha sido < 5% en la gran mayoría de las series8-25, lo cual es probablemente inferior a la incidencia esperada en una población de pacientes octogenarios a los que se realiza una intervención valvular aórtica. De hecho, debe considerarse que en algunos estudios la incidencia de infarto cerebral asociada a los procedimientos de RVA quirúrgico en pacientes de edad avanzada ha sido superior al 5%31,32, lo que indica que el pinzamiento aórtico y la circulación extracorpórea pueden conllevar mayor riesgo de infarto cerebral que la manipulación de catéteres de gran tamaño en aorta y válvula aórtica nativa. También es interesante destacar que la vía transapical evita la manipulación de catéteres de gran tamaño en la aorta y algunos grupos han priorizado este abordaje frente al transfemoral en pacientes con aterosclerosis severa a nivel de la aorta ascendente/arco aórtico. Algunos estudios también han comunicado una tendencia hacia una menor incidencia de infarto cerebral asociada al abordaje transapical4. En cualquier caso, la ventaja potencial de este abordaje frente al transfemoral y/o la cirugía cardiaca convencional deberá demostrarse en futuros estudios.
Infarto de miocardio y obstrucción coronaria
La incidencia de infarto de miocardio (IM) en relación con la IPPVA es extremadamente variable de unas series a otras (del 0,2 al 17,5%)8-25. Una limitación importante en relación con esta complicación es la falta de una definición universal para el IM tras IPPVA. Además, en la mayoría de los estudios tampoco se ha especificado la definición de IM post-IPPVA. Aparte de la elevación asintomática de enzimas cardiacas o la aparición de nuevas ondas Q en el electrocardiograma, se han descrito casos de obstrucción sintomática del ostium coronario izquierdo tras IPPVA17,33,34. Actualmente se reconoce que la aparición de obstrucciones coronarias en relación con la IPPVA es secundaria al desplazamiento de una valva nativa severamente calcificada hacia el ostium coronario durante la implantación de la válvula y sin relación con un posible fenómeno de «jailing» de los ostia coronarios por el stent que contiene la válvula35. Varios grupos han insistido en la importancia de medir la distancia entre el anillo aórtico y los ostia coronarios antes de un procedimiento de IPPVA, especialmente en los casos con una válvula nativa severamente calcificada. Sin embargo, todavía no se ha establecido una distancia mínima entre el anillo aórtico y los ostia coronarios por debajo de la cual se deba contraindicar un procedimiento de IPPVA.
Insuficiencia renal aguda. Necesidad de hemodiálisis
Los pacientes candidatos a IPPVA presentan en la actualidad una alta prevalencia de insuficiencia renal crónica (IRC). De hecho, evitar un potencial deterioro de la función renal en pacientes con IRC se ha convertido en uno de los motivos para favorecer la IPPVA sobre el RVA en algunos de estos casos. Sin embargo, los procedimientos de IPPVA implican la administración de sustancia de contraste, múltiples episodios de hipotensión extrema (sobreestimulación, valvuloplastia aórtica, implantación de la válvula), y la manipulación de catéteres de gran tamaño en la aorta de pacientes con una alta prevalencia de aterosclerosis difusa, con el subsiguiente riesgo de embolización de colesterol, todos ellos factores relacionados con la aparición de insuficiencia renal aguda (IRA). Aregger et al36 evaluaron la incidencia de IRA en 54 pacientes a los que se realizó una IPPVA mediante las válvulas CoreValve o Edwards. La mayoría de los pacientes (56%) mejoraron su función renal tras el procedimiento, pero la incidencia de IRA llegó hasta el 28% y el 7,4% de los pacientes precisaron hemodiálisis durante la hospitalización. Bagur et al37 han publicado recientemente una incidencia de IRA del 11,7% tras IPPVA con la válvula Edwards, y esta complicación conllevó un incremento de hasta 4 veces del riesgo de mortalidad hospitalaria. En esa misma publicación, la incidencia de IRA en los pacientes con IRC previa fue inferior en los tratados mediante IPPVA en comparación con los que recibieron un RVA quirúrgico (del 9,2 frente al 25,9%; necesidad de hemodiálisis, del 2,5 frente al 8,7%).
Anomalías de conducción intraventricular. Necesidad de marcapasos permanente
Varios estudios han evidenciado una alta incidencia de anomalías de conducción intraventricular tras la IPPVA26-28. El stent que contiene la válvula percutánea puede dañar directamente el sistema de conducción por estrés mecánico o producir una inflamación que se extiende a la rama izquierda del haz de His. Cabe destacar que una posición baja (ventricular) de la válvula respecto al anillo aórtico se ha asociado a una mayor incidencia de anomalías de conducción intraventricular26,27. La proporción de pacientes que precisan la implantación de un marcapasos definitivo tras el procedimiento es muy variable según los estudios, aunque parece claramente superior tras la implantación de la válvula CoreValve (> 10% en la mayoría de los estudios, y hasta el 33% en algunas series) en comparación con la válvula de Edwards (< 7%)8-25. Estas diferencias podrían explicarse en parte por las diferencias en la composición (nitinol frente a acero inoxidable) y el diseño de la estructura metálica que contiene la válvula, con una mayor longitud del sistema de la válvula CoreValve (50 frente a 14-16 mm), que con frecuencia penetra más de 5 mm en el tracto de salida del ventrículo izquierdo27. Por otra parte, Jilahihawi et al28 comunicaron que, en casos de IPPVA con la válvula CoreValve, la presencia de un bloqueo de rama izquierda antes del procedimiento, un septum interventricular > 17 mm o una valva no coronaria con un espesor > 8 mm predecían el riesgo de necesidad de marcapasos permanente tras el procedimiento, con una sensibilidad del 75% y una especificidad del 100%. En cualquier caso, se precisan más estudios con un mayor número de pacientes para: a) determinar los factores predictores de la implantación de marcapasos permanente tras IPPVA, y b) establecer las medidas preventivas oportunas para evitar esta importante complicación.
HEMODINÁMICA DE LAS VÁLVULAS PERCUTÁNEAS AÓRTICAS
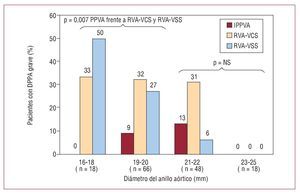
A diferencia del RVA quirúrgico en el que la válvula nativa se extrae antes de la implantación de la prótesis valvular, el mecanismo de la IPPVA consiste en la expansión de la estructura metálica que contiene la válvula contra una válvula aórtica nativa calcificada. Zegdi et al38 demostraron que la implantación de una bioprótesis percutánea dentro de una válvula nativa severamente calcificada puede dar lugar a una expansión incompleta y/o irregular de la válvula percutánea. Sin embargo, todas las series publicadas de IPPVA con la válvula de Edwards o la CoreValve han demostrado de manera sistemática excelentes resultados hemodinámicos, con gradientes residuales medios < 15 mmHg y áreas valvulares > 1,5 cm2 tras la implantación de la válvula, y estos resultados se han mantenido en el seguimiento a medio plazo8-25. Nuestro grupo comparó los resultados hemodinámicos de la válvula Cribier-Edwards/Edwards SAPIEN (n = 50) con los obtenidos en una población macheada a la que se realizó un RVA quirúrgico mediante una prótesis valvular con stent (Magna, Edwards Lifesciencies Inc.) y sin stent (Freestyle, Medtronic)39. El estudio demostró que las válvulas percutáneas presentaban unos resultados hemodinámicos superiores a los de las prótesis quirúrgicas en cuanto a gradiente transvalvular y área valvular, y eso se tradujo en una menor incidencia del fenómeno de desajuste severo paciente-prótesis aórtica, especialmente en pacientes con anillos valvulares de pequeño tamaño (< 20 mm) (fig. 4). La IPPVA se realiza sistemáticamente con una válvula sobredimensionada con respecto al anillo aórtico, lo que probablemente da lugar a una cierta distensión del anillo para acomodar la nueva válvula, mientras que el diámetro de la válvula quirúrgica durante el RVA está limitado por las dimensiones del anillo aórtico. Éste es probablemente un mecanismo importante que podría explicar la obtención de mejores resultados hemodinámicos con las válvulas percutáneas. Además, a pesar de que las válvulas percutáneas están montadas en el interior de un stent, la estructura metálica de dicho stent es mucho más delgada que el stent utilizado en las válvulas quirúrgicas, lo que comporta un menor grado de obstrucción al flujo sanguíneo. Sin embargo, la incidencia de insuficiencia aórtica paravalvular residual tras IPPVA es alta (entre el 65 y el 85%), y muy superior a la observada tras RVA quirúrgico39. Una válvula nativa severamente calcificada entre la válvula percutánea y el anillo aórtico impide probablemente el cierre completo del espacio paravalvular, lo que da lugar a un cierto grado de insuficiencia aórtica paravalvular residual en la mayoría de los casos. Es importante resaltar que la gran mayoría de las fugas paravalvulares tras IPPVA son mínimas o ligeras, con una incidencia de insuficiencia aórtica moderada y severa inferiores al 10% (0-26%) y el 5% (0-10%), respectivamente8-25,39. Se ha indicado que la implantación de una segunda válvula percutánea (valve-in-valve) puede ser eficaz para el tratamiento de insuficiencias moderadas a severas intravalvulares y paravalvulares tras IPPVA3,40. Finalmente, resulta relevante el hecho de que el grado de insuficiencia paravalvular residual permanece estable o incluso mejora a medio plazo39. Détaint et al41 también indicaron que un menor índice «diámetro válvula percutánea/anillo valvular aórtico» puede ser un factor determinante de un mayor grado de insuficiencia paravalvular tras IPPVA. La mejora tecnológica de las válvulas percutáneas en un intento de reducir la incidencia y la severidad de las fugas paravalvulares debería ser una de las prioridades de la investigación en el campo de la IPPVA en un futuro próximo. Mientras tanto, y teniendo en cuenta la falta de datos en relación con la progresión de la insuficiencia paravalvular a largo término, las válvulas percutáneas deberían utilizarse con mucha cautela en los pacientes que tienen una esperanza de vida prolongada.
Fig. 4. Incidencia de desajuste severo paciente-prótesis aortica en tres tipos de bioprótesis aórticas (válvula percutánea, válvula quirúrgica con stent y válvula quirúrgica sin stent), según el tamaño del anillo aórtico, a un seguimiento de 6 a 12 meses tras la intervención. DPPA: desajuste paciente-prótesis aórtica; IPPVA: implante percutáneo de prótesis valvular aórtica; RVA-VCS: recambio valvular aórtico-válvula con stent; RVA-VSS: recambio valvular aórtico-válvula sin stent. Modificado de Clavel et al39, con el permiso del autor y la editorial.
IPPVA: RESULTADOS A MEDIO PLAZO
Existen relativamente pocos datos sobre los resultados a medio plazo en relación con los procedimientos de IPPVA. La supervivencia a los 12 meses del procedimiento de IPPVA por vía transfemoral se ha incrementado de menos del 80% en las series iniciales al 80% o más en series más recientes como el registro SOURCE4,5,8,17,23,24. Es interesante destacar el reciente trabajo de Webb et al5 en el que se demuestra que la mayoría de las muertes después de 30 días tras el procedimiento son debidas a causas no cardiacas (fig. 5), lo que subraya una vez más la importancia de una correcta selección de los pacientes para la obtención de buenos resultados a medio-largo plazo. Los procedimientos de IPPVA por vía transapical se han asociado con una supervivencia a 12 meses < 80%, incluso en series recientes como el registro SOURCE, probablemente debido a las características de base de mayor riesgo de los pacientes seleccionados para abordaje transapical12-14,24. La experiencia multicéntrica canadiense24, que incluía abordajes transfemoral y transapical, demostró que la presencia de comorbilidades no cardiacas como la insuficiencia renal crónica y la enfermedad pulmonar obstructiva crónica eran dos de los factores pronósticos más importantes de mortalidad tardía. Finalmente, no se han evidenciado fallos estructurales de las válvulas percutáneas en el seguimiento a medio plazo.
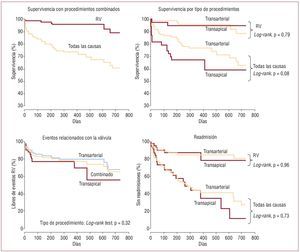
Fig. 5. Curvas de Kaplan-Meier de supervivencia, mortalidad relacionada con la válvula, y ausencia de eventos (muerte, infarto de miocardio, infarto cerebral, reintervención) y readmisión relacionados con la válvula (RV). La mortalidad tardía se relacionó sobre todo con comorbilidades no cardiacas. Reproducido de Webb et al5, con el permiso del autor y la editorial.
VÁLVULAS AÓRTICAS PERCUTÁNEAS: EL FUTURO
Placement of Aortic Transcatheter Valve (PARTNER)
PARTNER es un estudio prospectivo y aleatorizado que se lleva a cabo en Estados Unidos y Canadá y que incluye a pacientes diagnosticados de estenosis aórtica severa sintomática, divididos en dos cohortes: a) los pacientes considerados no operables son aleatorizados a IPPVA transfemoral con la válvula Edwards SAPIEN o a tratamiento médico (objetivo primario: ausencia de muerte al año de seguimiento; diseño de superioridad), y b) los pacientes considerados de alto riesgo quirúrgico son aleatorizados a IPPVA transfemoral o transapical con la válvula Edwards SAPIEN o a RVA quirúrgico (objetivo primario: ausencia de muerte durante la duración del estudio; diseño de no inferioridad). El estudio se inició en abril de 2007, la fase de aleatorización finalizó en septiembre de 2009 y los primeros resultados se esperan para finales de 2010. Los estudios de viabilidad y los registros han evidenciado resultados prometedores en relación con la IPPVA. El estudio PARTNER debería proporcionar una evidencia definitiva para el tratamiento mediante IPPVA de los pacientes con estenosis aórtica severa sintomática considerados inoperables o con muy alto riesgo quirúrgico.
Tratamiento «válvula dentro de válvula»
Las válvulas biológicas tienen una durabilidad limitada y un gran número de pacientes a los que se realiza un RVA van a precisar de una reintervención en el futuro. Se han publicado varios casos de tratamiento de bioprótesis aórtica disfuncionante mediante implantación de válvula percutánea42-44, lo cual representa una nueva alternativa para el tratamiento de este difícil grupo de pacientes. Además, este tratamiento se ha probado eficaz para prótesis aórticas disfuncionales con (stented) y sin stent (stentless). Futuros estudios con un mayor número de pacientes deberán confirmar la eficacia y la seguridad de esta estrategia terapéutica.
Seguimiento a largo plazo
Todavía no hay datos sobre durabilidad y ausencia de fallos estructurales de las válvulas percutáneas a largo plazo. La obtención de estos datos de manera prospectiva y científicamente rigurosa es de gran importancia, ya que, entre otros aspectos, determinará si esta tecnología puede aplicarse potencialmente a pacientes más jóvenes y de menor riesgo con estenosis aórtica severa sintomática.
Tecnología valvular percutánea: investigación y desarrollo
Existen múltiples nuevos modelos de válvula percutánea actualmente en fase de ensayo preclínico o con los que ya se han realizado los primeros ensayos en humanos («first-in-human»)45 (AorTx, Hansen Medical; Direct Flow, Direct Flow Medical; Enable, ATS [3F]; Heart Leaflet, Heart Leaflet Technologies; JenaValve, JenaValve Technology; Lotus, Sadra Medical; Lutter, German Research Foundation; Paniagua, Endoluminal Technology Research; Perceval, Sorin Group; PercValve, Advanced Bioprosthetic Surfaces; ValveXchange, ValveXchange; Zegdi, Zegdi, Coremove). En la mayoría de estos nuevos modelos de válvula percutánea la válvula está constituida por pericardio animal y la estructura metálica que contiene la válvula es de nitinol, con lo que la gran mayoría son recapturables y reposicionables. Además, los dos modelos de válvulas percutáneas de las que disponemos de datos clínicos actualmente, la válvula de Edwards y la CoreValve, van a continuar mejorando su perfil (18-19 Fr para la válvula de Edwards; 16 Fr para la CoreValve) y su facilidad de implantación, incrementarán los tamaños de válvula disponibles, y consolidarán nuevas alternativas de abordaje (p. ej., la vía subclavia). Todas estas mejoras tecnológicas deberían traducirse en una reducción de los riesgos del procedimiento, lo que a su vez debería contribuir a la extensión del tratamiento valvular percutáneo a un mayor número de pacientes con estenosis aórtica severa. También en los próximos años se generará un gran número de datos clínicos y ecocardiográficos en relación con el seguimiento a medio y largo plazo de las válvulas percutáneas que serán de extrema importancia en la consolidación y expansión de estos procedimientos. Sin embargo, deberán demostrarse unos resultados a corto y largo plazo similares a los obtenidos mediante el RVA quirúrgico antes de aplicar los procedimientos de IPPVA a una población con bajo riesgo y con larga expectativa de vida.
ABREVIATURAS
IM: infarto de miocardio.
IPPVA: implante percutáneo de prótesis valvular aórtica.
IRA: insuficiencia renal aguda.
IRC: insuficiencia renal crónica.
RVA: recambio valvular aórtico.
Full English text available from: www.revespcardiol.org
Conflicto de intereses: El Dr. Josep Rodés-Cabau es consultor de Edwards Lifesciences Inc.
Correspondencia: Dr. J. Rodés-Cabau.
Quebec Heart and Lung Institute.
2725 chemin Ste-Foy. G1V 4G5 Quebec city. Québec. Canadá.
Correo electrónico: josep.rodes@criucpq.ulaval.ca