La fibrilación auricular (FA) y la enfermedad renal crónica (ERC) son 2 entidades muy prevalentes, especialmente en pacientes ancianos y con otras comorbilidades, como hipertensión, diabetes mellitus, insuficiencia cardiaca y enfermedad vascular. La relación entre ambas parece ser bidireccional: la ERC predispone a la aparición de FA y esta favorece la progresión de la ERC. La prevención del ictus es fundamental en la FA, pero especialmente en los pacientes con FA y ERC, pues tienen un riesgo incrementado de ictus, mayor mortalidad, eventos cardiacos y hemorragias. Para la prevención del ictus en FA es necesario el uso de anticoagulantes orales, bien sean antagonistas de la vitamina K (p. ej., warfarina) o los nuevos anticoagulantes orales no dependientes de la vitamina K (NACO). Aunque los NACO se han mostrado efectivos en pacientes con FA y grados leves o moderados de insuficiencia renal, no hay datos sobre su efectividad y su seguridad en el caso de la insuficiencia renal grave y terminal. La primera parte de esta revisión comenta la evidencia existente sobre el uso de los NACO en la ERC. La segunda parte resume el conocimiento actual sobre la eficacia y la seguridad de los NACO para la prevención del ictus y la embolia sistémica en pacientes con insuficiencia renal grave y terminal.
Palabras clave
Tanto la fibrilación auricular (FA) como la enfermedad renal crónica (ERC) tienen gran prevalencia, en especial con el aumento de la edad y la presencia de comorbilidades como hipertensión, diabetes mellitus, insuficiencia cardiaca y enfermedad vascular. La relación entre la FA y la ERC parece ser bidireccional: la ERC predispone a la FA, mientras que la aparición de FA al parecer lleva a la progresión de la ERC. Es importante señalar que la concomitancia de FA y ERC conduce a un aumento del riesgo de complicaciones tromboembólicas, como ictus, tromboembolia sistémica e infarto de miocardio1. Sin embargo, paradójicamente, la ERC es por sí sola un factor de riesgo de hemorragia2.
La prevención del ictus es la piedra angular del tratamiento de la FA y requiere el empleo de anticoagulantes orales (ACO), que pueden ser tanto antagonistas de la vitamina K (AVK) (p. ej., warfarina) como los nuevos anticoagulantes orales no dependientes de la vitamina K (NACO)3. Aunque los NACO han resultado eficaces en la disfunción renal leve a moderada, hay pocos datos relativos a su uso en la disfunción renal grave y la enfermedad renal terminal (ERT).
En esta revisión se analiza primero la evidencia existente respecto al uso de NACO en la ERC y, en segundo, se resume el conocimiento actual respecto a la eficacia y la seguridad de los NACO para prevenir el ictus y la embolia sistémica relacionados con FA en la ERT.
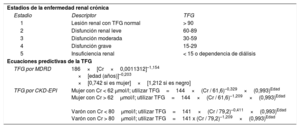
DEFINICIONES Y CONSIDERACIONES EPIDEMIOLÓGICASLa ERC se clasifica en los estadios 1 a 5 según los criterios de la Kidney Disease Improving Global Outcomes, que se basan en la tasa de filtrado glomerular (TFG) o la albuminuria de duración> 3 meses. La TFG puede estimarse mediante las ecuaciones de Modification of Diet in Renal Disease (MDRD) o del grupo Chronic Kidney Disease-Epidemiology Collaboration (CKD-EPI)4 (tabla 1). La disfunción renal grave implica5 una TFG <30 ml/min/1,73 m2. Existen diferencias en la definición de la ERT utilizadas en los ensayos clínicos; sin embargo, un marco de referencia propuesto para el diagnóstico de la ERT es la uremia sintomática que requiere una terapia sustitutiva renal crónica (> 30 días)6. La terapia sustitutiva renal puede aplicarse con métodos extracorpóreos (hemodiálisis) o paracorpóreos (diálisis peritoneal)7.
Estadios de la enfermedad renal crónica y ecuaciones predictivas del filtrado glomerular
| Estadios de la enfermedad renal crónica | ||
| Estadio | Descriptor | TFG |
| 1 | Lesión renal con TFG normal | > 90 |
| 2 | Disfunción renal leve | 60-89 |
| 3 | Disfunción moderada | 30-59 |
| 4 | Disfunción grave | 15-29 |
| 5 | Insuficiencia renal | < 15 o dependencia de diálisis |
| Ecuaciones predictivas de la TFG | ||
| TFG por MDRD | 186×[Cr×0,0011312]–1,154 ×[edad (años)]–0,203 ×[0,742 si es mujer]×[1,212 si es negro] | |
| TFG por CKD-EPI | Mujer con Cr < 62 μmol/l; utilizar TFG=144×(Cr / 61,6)–0,329×(0,993)Edad Mujer con Cr > 62μmol/l; utilizar TFG=144×(Cr / 61,6)–1,209×(0,993)Edad Varón con Cr < 80μmol/l; utilizar TFG=141×(Cr / 79,2)–0,411×(0,993)Edad Varón con Cr > 80μmol/l; utilizar TFG=141 x (Cr / 79,2)–1,209×(0,993)Edad | |
CKD-EPI: Chronic Kidney Disease-Epidemiology Collaboration; Cr: creatinina; MDRD: Modification of Diet in Renal Disease; TFG: tasa de filtrado glomerular.
La prevalencia de la FA en la ERT oscila entre el 7 y el 27% en diferentes estudios, lo cual es de 10 a 20 veces mayor que en la población general8. Por ejemplo, en el estudio prospectivo de la Chronic Renal Insufficiency Cohort (CRIC), con 3.267 pacientes con ERC leve a moderada (media de TFG, 43,6±13,4 ml/min/1,73 m2), tenía FA un 18% de los participantes, lo cual indica que los procesos que subyacen a la aparición de la FA pueden darse en una fase temprana de la ERC9.
La FA puede contribuir también a la progresión de la ERC. En un análisis de subgrupos del estudio CRIC, se observó una tasa de progresión a la ERT en los pacientes con ERC y FA incidente (11,8/100 personas-año) superior a la de los pacientes con ERC sin FA (3,4/100 personas-año) tras una media de seguimiento de 5,9 años10. Así pues, la relación entre la FA y la disfunción renal es bidireccional. Es de destacar que la mortalidad relacionada con FA incidente es superior en los pacientes con ERC (supervivencia del 63,4-68,3% a los 12 meses) que en aquellos sin ERC (supervivencia del 79,3% a los 12 meses)11.
ESTRATEGIA DE BÚSQUEDAPara esta revisión, se llevó a cabo una búsqueda de estudios publicados, utilizando bases de datos bibliográficas (PubMed, MEDLINE, Scopus y la base de datos Cochrane) y un examen detallado de las listas de referencias bibliográficas de artículos publicados. Los términos de búsqueda utilizados fueron los siguientes: “NOAC”, “chronic kidney disease”, “atrial fibrillation”, “dialysis”, “apixaban”, “rivaroxaban”, “edoxaban” y “dabigatran”. Se hizo especial hincapié en los ensayos controlados y aleatorizados (ECA) y en las presentaciones de datos originales.
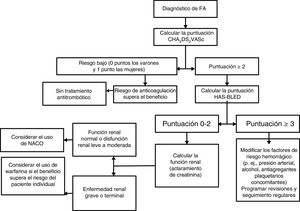
ICTUS, RIESGO DE HEMORRAGIA Y PROFILAXIS ANTITROMBÓTICA EN LA FIBRILACIÓN AURICULARLa FA aumenta el riesgo de ictus en la FA, pero este riesgo no es homogéneo y depende de varios factores. Los más frecuentes y validados factores de riesgo de ictus se han utilizado para elaborar puntuaciones para estratificarlo, como la puntuación CHA2DS2-VASc12. Nótese que el riesgo de ictus no es estático, y es necesario reevaluarlo regularmente, dado que la edad y la incidencia de factores de riesgo aumentan con el paso del tiempo13.
Reconociendo que la ERC tiene un efecto aditivo respecto al riesgo de ictus, algunos estudios han propuesto añadir la ERC o variables indirectas indicativas de la función renal (p. ej., la proteinuria) a las puntuaciones de riesgo como ATRIA14 o R2CHADS215. Sin embargo, en otros estudios no se ha observado un valor aditivo de la ERC en cuanto a la predicción del ictus16–18. Tal vez esto no sea de extrañar, puesto que la ERC muestra gran relación con cada uno de los componentes de la puntuación CHA2DS2-VASc. La puntuación CHA2DS2-VASc se ha estudiado en pacientes dializados, en los que se ha validado para la predicción del ictus13.
La ERC predispone también a un aumento del riesgo hemorrágico. Aunque se han descrito numerosos factores de riesgo hemorrágico, entre ellos diversos biomarcadores, los factores de riesgo de hemorragia y de ictus con frecuencia son similares, por lo que las tasas de ictus y de hemorragia siguen la misma senda. En este sentido, se ha propuesto emplear la puntuación HAS-BLED, que incorpora los factores de riesgo hemorrágico validados más frecuentes, para evaluar el riesgo de hemorragia19. El uso apropiado de la puntuación HAS-BLED es dirigir la atención a los factores de riesgo hemorrágico modificables y «marcar» a los pacientes con alto riesgo hemorrágico para revisiones y seguimiento más frecuentes20. En este sentido, para la predicción del riesgo hemorrágico, un enfoque centrado solo en los factores de riesgo hemorrágico modificables es una estrategia inferior que con la puntuación HAS-BLED13,21,22.
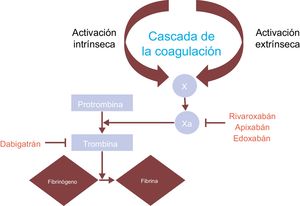
La profilaxis antitrombótica en la FA requiere el empleo de anticoagulantes orales, como AVK bien llevados (p. ej., warfarina) o NACO (p. ej., apixabán, rivaroxabán, edoxabán y dabigatrán)3. Aunque la warfarina y los NACO actúan sobre la vía de la coagulación, sus mecanismos de acción difieren. La warfarina inhibe los factores de la coagulación II, VII, IX y X, no dependientes de la vitamina K, y de esta forma influye en la razón internacional normalizada (INR): una INR baja aumenta el riesgo trombótico, mientras que una alta aumenta el riesgo hemorrágico. En cambio, los NACO actúan sobre proteínas de la coagulación específicas: apixabán, rivaroxabán y edoxabán inhiben directamente el factor X, y dabigatrán es un inhibidor directo de la trombina23 (figura 1).
En un estudio prospectivo con 565 pacientes tratados con warfarina, se demostró que los pacientes con disfunción renal grave (TFG <30 ml/min/1,73kg/m2) necesitaban menores dosis de warfarina y tenían tiempos en rango terapéutico (TRT) más breves. Además, la tasa de incidencia de hemorragias mayores fue más alta en la disfunción renal grave (30,5/100 pacientes-año) que en la disfunción renal leve (6,2/100 pacientes-año) o moderada (8,3/100 pacientes-año)24. Por otro lado, el uso de warfarina se complica también por las múltiples interacciones con alimentos y fármacos y una reducción de la proteína de matriz G1a dependiente de la vitamina K, que da lugar a un aumento de la calcificación vascular25. La nefropatía asociada con la warfarina que es consecuencia de la hemorragia glomerular y la obstrucción tubular causada por cilindros eritrocitarios se observa también con más frecuencia en los pacientes con ERC26.
Los NACO han modificado el panorama de la prevención del ictus en la FA, si bien hay evidentes diferencias regionales al respecto27. A diferencia de lo que ocurre con la warfarina, los NACO tienen menos interacciones con fármacos y con la dieta, un inicio de acción rápido y una semivida más corta, y no requieren una vigilancia analítica regular28. La semivida breve hace que la adherencia y el cumplimiento del tratamiento sean cruciales, y los pacientes necesitan instrucción sanitaria y asesoramiento al respecto29.
Cuando hay un deterioro del filtrado glomerular, la eliminación de los NACO se reduce, y ello hace que su semivida plasmática se prolongue. Esto puede implicar un aumento de la exposición total al fármaco, o área bajo la curva (AUC), que aumenta el riesgo de complicaciones hemorrágicas30. El dabigatrán tiene una eliminación renal sustancial (un 80% de excreción renal), y se observa eliminación renal con edoxabán (50%), rivaroxabán (33%) y apixabán (27%)31. Los datos existentes respecto a los NACO en pacientes con un deterioro renal grave o ERT (aclaramiento de creatinina [AclCr] según Cockcroft-Gault <25-30 ml/min) son escasos, ya que en los ensayos aleatorizados de fase III se excluyó a estos pacientes32 (tabla 2).
Nuevos anticoagulantes orales: eliminación renal y posología
| NACO | Objetivo | Biodisponibilidad oral (%) | Eliminación renal del fármaco absorbido | Tmáx (h) | Semivida (h) | Dosis para función renal normal (ESC) | Dosis para función renal normal (FDA) | Dosis para disfunción renal moderada (ESC) | Dosis para disfunción renal moderada (FDA) | Dosis para disfunción renal grave (ESC) | Dosis para disfunción renal grave (FDA) | Dosis para ERT/diálisis (ESC) | Dosis para ERT/diálisis (FDA) | Dializable |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Apixabán | Factor Xa | 50 | 27% | 3-4 | 8-13 | 5mg 2 veces al día | 5mg 2 veces al día | 5mg 2 veces al día | 2,5-5mg 2 veces al día* | No | 2,5-5,0mg 2 veces al día | No | 2,5-5,0mg 2 veces al día | No |
| Rivaroxabán | Factor Xa | 80-100 | 30% | 2-4 | 5-13 | 20mg 1 vez al día | 20mg 1 vez al día | 15mg/día | 15mg/día (AclCr 30-50 ml/min) | No | 15mg/día | No | No | No |
| Edoxabán | Factor Xa | 62 | 50% | 1-2 | 10-14 | 60mg/día | 60mg/día | 30mg/día | 60mg/día (AclCr 15-50 ml/min) | No | 30mg/día | No | No | No |
| Dabigatrán | Trombina | 6,5 | > 80% | 2-6 | 12-14 | 150mg 2 veces al día | 150mg 2 veces al día | 110mg 2 veces al día | 150mg 2 veces al día (AclCr > 30 ml/min) | No | 75mg 2 veces al día | No | No | Sí |
AclCr: aclaramiento de creatinina; ERT:enfermedad renal terminal; ESC:Sociedad Europea de Cardiología; FDA: Food and Drug Administration; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Los ensayos de fase III que respaldan el uso de NACO para prevenir las tromboembolias en la FA se realizaron con una posología de los NACO y unos criterios de exclusión de pacientes específicos. Los pacientes con AclCr <30 ml/min (dabigatrán, rivaroxabán y edoxabán) o <25 ml/min (apixabán) fueron excluidos de los ensayos clínicos fundamentales con fines de registro33–36.
Las recomendaciones de la Sociedad Europea de Cardiología respecto a la ERC moderada (TFG, 30-59 ml/min) se basan en análisis secundarios de los ensayos de fase III de los NACO37. En cambio, la Food and Drug Administration (FDA) de Estados Unidos ha autorizado el empleo de una dosis reducida de dabigatrán 75 mg 2 veces al día, apixabán 5 mg 2 veces al día (apixabán 2,5 mg 2 veces al día si la edad es ≥ 80 y el peso ≤ 60 kg) y rivaroxabán 15 mg 2 veces al día para pacientes con AclCr 15-29 ml/min, basándose principalmente en datos de modelos farmacológicos con AclCr 15-29 ml/min (tabla 3)38–42.
Nuevos anticoagulantes orales: ensayos clave y criterios de exclusión renales
| Nuevo anticoagulante oral | Ensayo | Dosis | Población del estudio | Criterios de exclusión renales | Método | Conclusión clave: riesgo de ictus y embolia sistémica en comparación con warfarina | Riesgo de hemorragia en comparación con warfarina |
|---|---|---|---|---|---|---|---|
| Apixabán frente a warfarina | ARISTOTLE39 | Apixabán 2,5-5mg 2 veces al día | 18.201 pacientes | AclCr < 30 ml/min | Ensayo aleatorizado y a doble ciego | Riesgo inferior | Riesgo inferior |
| Rivaroxabán frente a warfarina | ROCKET-AF40 | Rivaroxabán 20mg/día | 14.264 pacientes | Creatinina > 221 mmol/l o AclCr < 25 ml/min | Ensayo aleatorizado y a doble ciego | No inferior | Riesgo similar |
| Edoxabán frente a warfarina | ENGAGE-AF TIMI41 | Edoxabán 30-60mg | 21.105 pacientes | AclCr < 30 ml/min | Ensayo aleatorizado y a doble ciego | No inferior | Riesgo inferior |
| Dabigatrán frente a warfarina | RE-LY42 | Dabigatrán 110-150mg | 18.113 pacientes | AclCr < 30 ml/min | Ensayo aleatorizado de no inferioridad | Dabigatrán 150 mg, riesgo inferior | Dabigatrán 150 mg, riesgo similar |
AclCr: aclaramiento de creatinina.
En el ensayo ARISTOTLE (Apixaban for Reduction In Stroke and Other Thromboembolic Events in Atrial Fibrillation), se comparó el apixabán en dosis de 5 mg 2 veces al día con la warfarina (objetivo de INR 2-3). La tasa de ictus o embolia sistémica fue significativamente inferior en los pacientes tratados con apixabán (el 1,27% al año) que en los tratados con warfarina (el 1,60% al año). El uso de apixabán se asoció también con reducciones del 31% en las hemorragias mayores y el 11% en la mortalidad por cualquier causa, en comparación con la warfarina. Nótese que se excluyó del ensayo a los pacientes con creatinina en suero> 2,5 mg/dl (221 μmol/l) o AclCr calculado <25 ml/min39.
Hohnloser et al.43 evaluaron los resultados del ensayo ARISTOTLE en relación con la función renal. El apixabán fue más eficaz que warfarina para prevenir el ictus y la embolia sistémica en los 3 subgrupos definidos según la función renal (TFG> 80,> 50-80 y ≤ 50 y AclCr> 25 ml/min). Los pacientes con mayor deterioro de la función renal (TFG ≤ 50) fueron los que obtuvieron la mayor reducción de las hemorragias mayores con el empleo de apixabán.
Con el tiempo, la función renal puede empeorar en los pacientes con FA, pero el apixabán se asoció con un menor riesgo de ictus y hemorragia mayor que la warfarina incluso en los pacientes con un empeoramiento pronunciado de la función renal (deterioro de la TFG> 20%)44.
RivaroxabánEn el ensayo ROCKET-AF (Rivaroxaban Once Daily Oral Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism), se comparó el rivaroxabán con la warfarina (objetivo de INR 2-3) en pacientes con AclCr> 30 ml/min. Hay que remarcar que la dosis de rivaroxabán se redujo a 15 mg/día para los pacientes con AclCr de 30-49ml/min (rivaroxabán 20 mg/día para un AclCr> 50 ml/min). El estudio ROCKET-AF demostró que el rivaroxabán es no inferior a la warfarina en la prevención del ictus y la tromboembolia sistémica, y no se aprecian diferencias en la tasa de hemorragias mayores40.
Un análisis de subgrupo del rivaroxabán en pacientes con disfunción renal moderada (AclCr 30-49 ml/min) puso de manifiesto la no inferioridad frente a la warfarina en la prevención del ictus y la tromboembolia sistémica, en concordancia con los resultados del ensayo inicial. Hubo menos hemorragias mortales con rivaroxabán (el 0,28% cada 100 pacientes-año) que con warfarina (el 0,74% cada 100 pacientes-año) en los pacientes con disfunción renal moderada45. En otro estudio, los resultados clínicos observados en los pacientes con FA y ERC moderada a grave en tratamiento con warfarina o rivaroxabán (emparejados según sus características demográficas, comorbilidades, factores de riesgo de ictus y de hemorragia y medicaciones) también mostraron ausencia de diferencias significativas en las tasas de tromboembolias o hemorragias mayores46.
Kubitza et al.47 examinaron la farmacocinética de una dosis única de rivaroxabán 10 mg en 24 pacientes con disfunción renal en comparación con 8 pacientes con función renal normal. La disfunción renal progresiva aumentó la exposición farmacológica al rivaroxabán (aumento del AUC, el 44% en leve, el 52% en la moderada y el 64% en la grave grave, en comparación con la función renal normal) y aumentó el porcentaje de inhibición del factor Xa (el 50% en leve, el 86% en moderada y el 100% en la grave, en comparación con la función renal normal). Hubo un aumento del 26% en la concentración máxima de rivaroxabán en 8 pacientes con un valor medio de AclCr de 43 ml/min30,47.
EdoxabánEl edoxabán se evaluó en el ensayo ENGAGE-AF TIMI 48 (Effective Anticoagulation with Factor Xa Next Generation in Atrial Fibrillation–Thrombolysis in Myocardial Infarction 48). Se aleatorizó a los pacientes al tratamiento con warfarina (objetivo de INR 2-3), a edoxabán 60 mg 1 vez al día o edoxabán 30 mg 1 vez al día. La dosis de edoxabán se redujo a la mitad si el AclCr era de 30-50ml/min, el peso corporal era ≤ 60 kg o el paciente recibía tratamiento con verapamilo o quinidina. Se excluyó del ensayo a los pacientes con AclCr <30 ml/min. Ambas pautas de tratamiento de edoxabán fueron no inferiores a la warfarina en la prevención del ictus o la embolia sistémica, y en un análisis según el tratamiento, el edoxabán 60 mg produjo una reducción del 21% de los eventos de ictus o embolia sistémica. El edoxabán se asoció de manera dependiente de la dosis con un menor número de episodios de hemorragia mayor: respectivamente un 20 y un 53% de episodios menos con edoxabán 60 mg 1 vez al día y edoxabán 30 mg 1 vez al día, en comparación con warfarina37,41,48.
En un examen de los resultados del estudio ENGAGE-AF TIMI 48 se analizaron los subgrupos de pacientes definidos según el AclCr de 30-50,> 50-95 y> 95 ml/min. En los pacientes con una disfunción renal moderada (AclCr 30-50 ml/min), el edoxabán 30 mg 1 vez al día continuó siendo comparable a la warfarina en la prevención de tromboembolias, con un menor número de episodios de hemorragia mayor. Aunque en total hubo menos episodios tromboembólicos en los pacientes con función renal normal (> 95 ml/min), el edoxabán 60 mg 1 vez al día mostró una eficacia numéricamente inferior que la warfarina en la prevención de los episodios tromboembólicos en este subgrupo, y ello se atribuyó a que la eliminación renal óptima hacía que la posología fuera subterapéutica49.
En un estudio multicéntrico, a lo largo de un periodo de 12 semanas, no hubo diferencias significativas en los episodios hemorrágicos en los pacientes con disfunción renal grave (AclCr 15-30 ml/min) tratados con edoxabán 15 mg/día en comparación con los pacientes con función renal normal o levemente deteriorada (AclCr> 50 ml/min) tratados con edoxabán 30 mg o 60 mg 1 vez al día50. La FDA ha autorizado el uso de una dosis inferior de edoxabán, de 30 mg 1 vez al día, para pacientes con AclCr de 15-50ml/min32. Esta reducción de la dosis se basa en los datos farmacocinéticos de 1.281 pacientes tratados con edoxabán, cuya limitada función renal implicaba mayor riesgo hemorrágico51.
DabigatránEn el estudio RE-LY se incluyó a 18.113 pacientes a los que se aleatorizó a la administración de warfarina o dabigatrán a dosis de 110 o 150 mg 2 veces al día en un periodo de seguimiento de 2 años. El dabigatrán a dosis de 150 mg 2 veces al día se asoció con un número significativamente inferior de episodios de ictus o embolia sistémica (el 1,11% al año) en comparación con la warfarina (el 1,69% al año). Con el dabigatrán a dosis de 110 mg 2 veces al día, hubo un 20% menos de episodios de hemorragia mayor, pero el fármaco fue no inferior a la warfarina en la prevención del ictus y la embolia sistémica (el 1,53% al año)42. En un análisis de subgrupos del estudio RE-LY, se utilizaron los valores iniciales de creatinina para estimar la TFG según las ecuaciones de Cockcroft-Gault y de CKD-EPI para dividir la población del estudio en 3 grupos: TFG ≥ 80, 50-80 y <50 ml/min. El dabigatrán a dosis de 150 mg 2 veces al día continuó siendo superior y el dabigatrán a dosis de 110 mg 2 veces al día fue no inferior a la warfarina en la prevención del ictus y la embolia sistémica en todo el espectro de la función renal, con independencia del método utilizado para el cálculo de la TFG. Además, el dabigatrán 110 mg 2 veces al día se asoció con un menor número de episodios hemorrágicos y el dabigatrán 150 mg 2 veces al día tuvo un número de episodios hemorrágicos, similar al de la warfarina, en los diversos subgrupos de función renal. En los pacientes con una TFG> 80 estimada mediante la ecuación CKD-EPI, ambas dosis de dabigatrán se asociaron con tasas de hemorragia mayor inferiores52.
En la ERC grave, la FDA recomienda el empleo de dabigatrán 75 mg 2 veces al día, aunque no hay una evidencia clínica que respalde esta posología. La reducción de la dosis se basa en un estudio de farmacocinética realizado mediante la obtención de muestras de sangre y orina de 23 pacientes con diferentes grados de disfunción renal a los que se administró una dosis única de dabigatrán por vía oral. En comparación con los pacientes con función renal normal, se observó que el AUC era 1,5, 3,2 y 6,3 veces superior en los pacientes con disfunción renal leve, moderada o grave respectivamente53.
COMPARACIÓN DE LOS NACO EN LA ENFERMEDAD RENAL CRÓNICAEn un metanálisis de 13.878 pacientes con FA y una ERC moderada, se compararon los NACO analizando las curvas de superficie bajo la ordenación acumulada (SUCRA). El dabigatrán 150 mg 2 veces al día fue el tratamiento más eficaz (SUCRA, 0,96), seguido del apixabán, el rivaroxabán y el edoxabán (SUCRA, 0,67, 0,53 y 0,51 respectivamente). El apixabán (SUCRA, 0,84) y el edoxabán (SUCRA, 0,61) fueron los que mostraron el perfil de seguridad más favorable54.
NACO EN LA DISFUNCIÓN RENAL TERMINALLos pacientes con FA en diálisis plantean un dilema clínico complejo. La incidencia máxima de FA es la que se observa en los pacientes en hemodiálisis (15,1%), en comparación con los pacientes con ERC no terminal (9,6%) y los de función renal normal (2,6%)2. La disfunción renal terminal aumenta el riesgo hemorrágico secundario a una disfunción plaquetaria (alteración de los gránulos alfa, los fragmentos de fibrinógeno que se unen al receptor de glucoproteína (GP) IIb/IIIa de la superficie plaquetaria, las toxinas urémicas y la movilización anormal del calcio son factores que contribuyen a que la agregación y la adhesión de las plaquetas se reduzcan)34.
No hay ningún ECA en el que se haya investigado el uso de NACO en la ERT. Los pacientes con ERT han quedado excluidos incluso de los ECA de la warfarina para la prevención del ictus en la FA. No obstante, hay datos sobre la warfarina derivados de cohortes de observación, en las que un control de buena calidad de la anticoagulación es crucial para minimizar los riesgos de ictus y de hemorragia en esos pacientes con alto riesgo55,56. En cambio, los datos de estudios de observación de Norteamérica, que generalmente no presentan el TRT, indican que el ictus isquémico no se reduce, pero que las hemorragias graves aumentan de manera significativa en los pacientes en insuficiencia renal terminal (ERT)57,58.
Por ejemplo, Harel et al. realizaron un metanálisis de 14 estudios de observación en los que se examinó el uso de warfarina en la prevención del ictus isquémico en la ERT. No hubo diferencias significativas en los ictus isquémicos ni en las hemorragias intracraneales en los pacientes tratados con warfarina. Las limitaciones clave de este metanálisis son que las definiciones de ictus y de hemorragia no fueron uniformes en los diversos estudios (p. ej., el accidente isquémico transitorio se contabilizó como evento de la variable de valoración principal en algunos estudios, mientras que no se registró en otros). En los estudios incluidos no se tuvo en cuenta tampoco la calidad de la anticoagulación obtenida con warfarina (es decir, el TRT)59,60.
Por otra parte, un estudio prospectivo del tratamiento con warfarina en la ERT (mediana de TRT del 54%) puso de manifiesto que un TRT superior reducía el riesgo de hemorragia55, lo cual implica que el uso de warfarina en la ERT debe acompañarse de una vigilancia adecuada de la INR para obtener el beneficio máximo. En un registro de Dinamarca, con un periodo de estudio de 15 años, se subdividió a los pacientes con FA entre aquellos con ERC no terminal (11.128 pacientes) y los tratados con terapia sustitutiva renal (1.728). El riesgo de muerte fue inferior con el tratamiento de warfarina tanto en el grupo con ERC no terminal (hazard ratio [HR]=0,64; intervalo de confianza del 95% [IC95%], 0,60-0,69) como en el de terapia sustitutiva renal (HR=0,85; IC95%, 0,72-0,99). En la ERC no terminal, se observó menos riesgo de ictus mortal y hemorragia (HR=0,71; IC95%, 0,57-0,88)61.
La eliminación de los fármacos durante la hemodiálisis es mayor para las moléculas pequeñas (< 1.500 Da) y los fármacos sin una unión intravascular a proteínas (bajo volumen de distribución), ya que atraviesan con mayor facilidad la membrana de diálisis30. Teniendo en cuenta estas consideraciones, se sabe que el dabigatrán es el único NACO dializable. Sorprendentemente, los registros de pacientes con ERT describen el uso de NACO en estos pacientes. De hecho, los datos del US Renal Data System indican que el uso de NACO, respecto al de warfarina, aumentó del 0,16 al 29,16% (p de tendencia <0,001) entre octubre de 2010 y diciembre de 201562.
Un estudio ha comparado directamente las tasas de hemorragia de los pacientes con FA y ERT en hemodiálisis que comenzaban rivaroxabán, dabigatrán o warfarina. La tasa de hemorragia mayor más alta fue la de los pacientes con ERT tratados con dabigatrán (83,1 eventos/100 pacientes-año) y con rivaroxabán (68,4 eventos/100 pacientes-año) en comparación con los tratados con warfarina (35,9 eventos/100 pacientes-año). Además, la mortalidad de los pacientes tratados con dabigatrán (19,2 muertes/100 pacientes-año) fue mayor que con rivaroxabán (16,2 muertes/100 pacientes-año) o warfarina (10,2 muertes/100 pacientes-año), lo cual planteó una cierta preocupación por el uso de dabigatrán en la ERT63.
Los estudios actualmente en marcha podrán esclarecer mejor el uso de los NACO en los pacientes con ERT. El ensayo RENAL-AF NCT02942407(Renal Haemodialysis Patients Allocated Apixaban Versus Warfarin in AF) está aleatorizado a 762 pacientes a apixabán 2,5-5,0 mg 2 veces al día o warfarina, para determinar luego los resultados de eventos de hemorragia mayor, ictus y muerte durante un periodo de 15 meses (que finaliza en mayo de 2019). El ensayo AXADIA es un estudio prospectivo y multicéntrico de Alemania que ha incluido a 222 pacientes para examinar la seguridad del apixabán en comparación con el AVK fenprocumón en pacientes con FA en hemodiálisis (finaliza en abril de 2019)38. En futuros estudios, será necesario tener en cuenta en mayor medida las diferencias de eficacia y seguridad en los pacientes en hemodiálisis frente a los que reciben diálisis peritoneal, puesto que la excreción de los NACO puede diferir entre estas 2 terapias de sustitución renal.
ApixabánEn un pequeño estudio de grupos paralelos de 8 pacientes hemodializados, una dosis única de 5 mg de apixabán después de la diálisis resultó en una exposición al fármaco (AUC) un 36% superior, pero sin un aumento de la concentración sérica máxima (Cmáx) en comparación con los pacientes con función renal normal. La observación de que el apixabán fue bien tolerado en este estudio de la ERT contribuyó a la autorización de la FDA para el apixabán a dosis de 5 mg 2 veces al día en la disfunción renal grave y la ERT (dosis reducida de apixabán 2,5 mg 2 veces al día para pacientes de edad ≥ 80 años y peso ≤ 60 kg)30,64.
Otro estudio de farmacocinética indica que el apixabán 2,5 mg 2 veces al día en la ERT da lugar a una exposición al fármaco comparable a la de la dosis estándar de apixabán de 5 mg 2 veces al día para pacientes con función renal normal, mientras que la dosis estándar de apixabán utilizada en la ERT produce concentraciones supraterapéuticas65.
Stanton et al. evaluaron retrospectivamente a 146 pacientes con disfunción renal grave (AclCr <25 ml/min) o ERT (en hemodiálisis o diálisis peritoneal) tratados con apixabán o warfarina. Hubo menos episodios de hemorragia mayor entre los pacientes tratados con apixabán (9,6%) en comparación con los tratados con warfarina (17,8%) y menos episodios de la variable combinada de hemorragias (hemorragia mayor, hemorragia no mayor clínicamente relevante y hemorragia menor) en el grupo de tratamiento con apixabán (27,4%) que en el de warfarina (21,9%), aunque estos resultados no fueron estadísticamente significativos. La frecuencia del ictus isquémico fue similar en los 2 grupos. Se propuso que el apixabán es una alternativa segura a la warfarina en la ERT en este estudio66.
En cambio, se ha presentado un caso en el que el uso de una dosis inferior de apixabán, de 2,5 mg 2 veces al día, en un paciente con ERT produjo unas cifras de antifactor Xa máximas/mínimas elevadas y llevó a hemorragia gastrointestinal67. En otro estudio de 30 pacientes con ERT en hemodiálisis de mantenimiento tratados con apixabán, hubo una incidencia del 13,3% de hemorragia mayor, lo cual llevó a los autores a recomendar precaución en la prescripción de apixabán a pacientes dializados68.
RivaroxabánEl rivaroxabán no es dializable, debido a sus fuerte unión a las proteínas (> 90%)69. De hecho, el AUC al administrar rivaroxabán antes de la hemodiálisis fue tan solo un 5% inferior a la observada cuando se administró después, lo cual indica una repercusión mínima de la hemodiálisis en la farmacocinética del rivaroxabán70. En un estudio de 18 pacientes en hemodiálisis crónica, la administración de 10 mg de rivaroxabán produjo una exposición al fármaco (AUC) comparable a la obtenida con 20 mg de rivaroxabán en pacientes con función renal normal. No hubo una acumulación significativa con la administración diaria71.
De hecho, Dias et al.70 observaron que una dosis de 15 mg de rivaroxabán producía un AUC un 56% superior en los pacientes con ERT que en los controles sanos. Considerados conjuntamente, estos datos indican la necesidad de reducir la dosis de rivaroxabán en la ERT.
EdoxabánNo se recomienda el edoxabán para pacientes con AclCr <15 ml/min. En 1 estudio, se aleatorizó a 10 pacientes en hemodiálisis a un tratamiento con 15 mg de edoxabán antes o después de la hemodiálisis. Hubo una disminución no significativa del AUC cuando el edoxabán se administró antes de la diálisis, lo cual indica que la hemodiálisis no lo elimina de manera efectiva del torrente circulatorio. Aunque los pacientes con ERT en este estudio toleraron bien el edoxabán, sus limitaciones están en que se administró 1 sola dosis de edoxabán, el tiempo de seguimiento fue muy breve y la cohorte de pacientes fue pequeña72.
DabigatránEl dabigatrán es el NACO con mayor eliminación renal (80%) y el único que se puede eliminar mediante diálisis. En una presentación de 1 caso de diálisis del dabigatrán por una hemorragia con peligro para la vida, hubo un aumento de rebote de la concentración del fármaco durante el proceso de eliminación, posiblemente debido a un gran volumen de distribución73.
CONSIDERACIONES CLÍNICASEn el contexto clínico, debemos hacer lo posible por utilizar el AclCr para estimar la función renal con objeto de decidir la estrategia de anticoagulación adecuada, ya que esto es lo que refleja con mayor exactitud lo realizado en los ensayos clínicos. De hecho, en estudios previos se ha observado una disparidad en la estimación de la TFG mediante las ecuaciones de Cockcroft-Gault, CKD-EPI y MDRD52.
Los pacientes a los que se prescriben NACO deben tener vigilada la función renal, con objeto de verificar que en todo momento se les prescriba la dosis correcta. Por ejemplo, un estudio de atención primaria ha puesto de manifiesto que la determinación anual de la función renal permite identificar a los pacientes sobrecoagulados o infracoagulados74. Además, se ha demostrado que la adherencia a la vigilancia de la función renal aumenta la probabilidad de una posología de NACO adecuada en un seguimiento de 1 año75.
Por otra parte, se debe considerar la posible necesidad de un ajuste de las dosis de NACO en la lesión renal aguda sobre la crónica. En un estudio de observación de 162 pacientes con FA e insuficiencia cardiaca concomitantes, la fluctuación medida de la función renal requirió un ajuste de la posología (el 44, el 35 y el 29% de los pacientes tratados con dabigatrán, rivaroxabán y apixabán, respectivamente, necesitaron ajustes de dosis)76.
CONCLUSIONESLa decisión de anticoagular a los pacientes con FA y ERC depende del estadio de la ERC, dado el delicado equilibrio existente entre la prevención de las tromboembolias y el exceso de sangrado, en especial en la ERT (figura 2). En la ERC moderada, los datos disponibles indican que los NACO son, como mínimo, no inferiores a warfarina en la prevención del ictus y la embolia sistémica, con un perfil de seguridad similar o superior. En la insuficiencia renal grave (TFG 15-20 ml), no se recomienda el uso sistemático de NACO, puesto que los ensayos fundamentales con fines de registro excluyeron a esos pacientes. La guía práctica de la EHRA se decanta en general por el empleo de warfarina en este grupo de pacientes48. Aunque la FDA ha autorizado el uso de una dosis reducida de los NACO en la disfunción renal grave, esto se basa en estudios farmacocinéticos y no en ensayos clínicos prospectivos.
Es necesario un enfoque individualizado para evaluar el riesgo y el beneficio de la anticoagulación en pacientes con FA y ERT, puesto que hay evidencias a favor y en contra de su empleo. No se ha realizado ningún ECA que haya explorado el empleo de los NACO en la ERT. Es de destacar que en el más amplio ensayo existente de comparación directa de pacientes tratados con dabigatrán, rivaroxabán o warfarina, surgió la preocupación respecto al uso de los NACO (y en particular del dabigatrán) en la hemodiálisis, debido al aumento del riesgo de hemorragia77. Así pues, actualmente la warfarina dispone de más evidencia favorable a su uso en pacientes con FA y ERT para la prevención del ictus y la tromboembolia sistémica.
CONFLICTO DE INTERESESG.Y.H. Lip es consultor de Bayer/Janssen, BMS/Pfizer, Medtronic, Boehringer Ingelheim, Novartis, Verseon y Daiichi-Sankyo y ha dictado conferencias para Bayer, BMS/Pfizer, Medtronic, Boehringer Ingelheim y Daiichi-Sankyo; declara no recibir directamente ningún pago personal derivado de estas actividades.