Palabras clave
INTRODUCCIÓN
La disfunción sistólica ventricular derecha postoperatoria se asocia a múltiples factores, como la isquemia miocárdica perioperatoria, la parada cardiaca hipotérmica, la lesión pericárdica y las adherencias1-10. La disfunción ventricular derecha aparecida tras la cirugía de bypass arterial coronario puede persistir hasta 1 año después de la operación11,12. Hasta el momento, la disfunción ventricular derecha tras la cirugía valvular aislada no se ha estudiado de manera detallada. La evaluación de los tejidos mediante Doppler pulsado para valorar el movimiento del anillo tricuspídeo es una técnica apropiada y relativamente fiable para valorar la función sistólica del ventrículo derecho13.
La aceleración miocárdica durante la contracción isovolumétrica (AIV) y la velocidad miocárdica de contracción isovolumétrica (VIV) se ven menos afectadas por las condiciones de carga; en consecuencia, estos parámetros predicen las funciones ventriculares izquierda y derecha de una forma relativamente independiente de la carga14,15. La determinación de la AIV parece ser una técnica más sensible que la determinación de la velocidad sistólica máxima determinada mediante Doppler tisular para predecir la contractilidad16,17. Un reciente estudio ha puesto de manifiesto la fiabilidad de la determinación de la AIV para predecir la disfunción sistólica ventricular derecha en pacientes con estenosis mitral18. Hemos estudiado la utilidad de los parámetros preoperatorios convencionales y de ecocardiografía Doppler tisular para predecir la recuperación funcional postoperatoria en pacientes a los que se practican intervenciones de cirugía valvular aislada.
MÉTODOS
Se incluyó en el estudio a un total de 63 pacientes candidatos a una intervención de cirugía valvular aislada en el Kosuyolu Heart Education and Research Hospital. Se excluyó a los pacientes con antecedentes de enfermedad coronaria significativa (estenosis angiográfica > 50%, antecedentes de síndrome coronario agudo o bypass arterial coronario), enfermedad pulmonar obstructiva o restrictiva crónica, apnea obstructiva del sueño, insuficiencia cardiaca congestiva, insuficiencia renal crónica (creatinina sérica > 1,5 mg/dl en los varones y > 1,3 mg/dl en las mujeres) o cáncer. Se excluyó también a los pacientes con una mala calidad de la exploración de imagen ecocardiográfica (8 pacientes). Todos los pacientes dieron su consentimiento informado para participar en el estudio, que fue aprobado por el comité ético del centro.
Intervenciones de cirugía valvular
Tras la esternotomía media, se abría el pericardio y se canulaban la aorta y las venas cavas superior e inferior. Se inducía parada cardiaca mediante cardioplejia con sangre levemente hipotérmica anterógrada y retrógrada. La cirugía de la válvula mitral se realizó tras una auriculotomía izquierda y exploración valvular mitral. Tras la resección de la válvula nativa, se llevaba a cabo una sustitución por una válvula mitral mecánica, y la válvula artificial se fijaba con sutura de ticrón 2.0. Se utilizó cardioplejia con sangre anterógrada en todos los casos de cirugía de la válvula mitral. En los casos apropiados se realizó una reparación valvular mitral. La cirugía de la válvula aórtica se llevaba a cabo tras la aortotomía y la resección de la válvula nativa. La sustitución por la válvula aórtica mecánica se realizó con cardioplejia con sangre retrógrada continua, tras la cardioplejia con sangre anterógrada. Se utilizó una cardioplejia con sangre anterógrada y retrógrada combinada en los pacientes a los que se practicaron intervenciones por una insuficiencia aórtica o intervenciones mitrales y aórticas combinadas. Todos los pacientes estudiados fueron evaluados mediante ecocardiografía antes de la operación cardiaca y 1 semana después de ésta. Se obtuvieron los datos de tiempo de pinzamiento aórtico, duración de la operación y del bombeo y grado máximo de hipotermia a partir de los registros de cirugía. Las exploraciones ecocardiográficas se repitieron 1 y 6 meses tras la operación en todos los pacientes. La recuperación funcional se definió por la presencia de una mejoría de al menos una clase de la NYHA en la evaluación postoperatoria realizada a los 6 meses.
Exploraciones ecocardiográficas
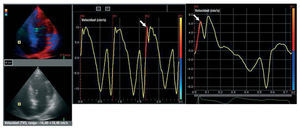
Las exploraciones ecocardiográficas se realizaron en todos los pacientes en decúbito lateral izquierdo, con las proyecciones estándar y un equipo comercial (Vivid 5, GE Vingmed, Noruega). Se midieron la dimensión sistólica auricular izquierda y las dimensiones internas del ventrículo izquierdo, así como el grosor de la pared, mediante los registros de ecocardiografía en modo M con guía bidimensional obtenidos a nivel de la parte media de las cuerdas tendinosas en la proyección de eje largo paraesternal, según los criterios establecidos por la American Society of Echocardiography19. Se calculó el acortamiento fraccional porcentual y la fracción de eyección con la fórmula de Teichholz20. La exploración con Doppler color tisular se realizó con la proyección de cuatro cámaras apical, utilizando un transductor de 2,5 MHz. Se realizó un ajuste del calibrado de ganancia, los filtros y la frecuencia de repetición de pulsos para optimizar la saturación del color y se utilizó una frecuencia de rastreo del Doppler color de 100-140 Hz. Las imágenes se obtuvieron tras espiración. Se indicó a los pacientes que aguantaran la respiración tras la espiración con objeto de mejorar la calidad de la imagen, y se digitalizaron todas las imágenes. Se elaboraron curvas de velocidad regional miocárdica a partir de las imágenes digitalizadas21. El análisis de los perfiles de velocidad del Doppler tisular se realizó offline mediante un programa informático comercial (Echopac, GE-Vingmed). Los perfiles de velocidad miocárdica del tabique basal y del anillo mitral lateral se obtuvieron mediante la colocación de un volumen de muestra de 7 x 7 mm en la zona de unión del anillo mitral con el tabique y la pared miocárdica lateral. Las velocidades miocárdicas en el anillo tricuspídeo lateral se obtuvieron de manera similar, colocando el volumen de muestra en la zona de unión del anillo valvular tricuspídeo y la pared libre VD (RVs). La medición de las velocidades anular mitral lateral y del tabique máximas, sistólica, protodiastólica y telediastólica, así como de las velocidades anulares tricuspídeas máximas, sistólica, protodiastólica y telediastólica, se realizó en tres ciclos cardiacos consecutivos en los pacientes que estaban en ritmo sinusal y en 10 ciclos cardiacos consecutivos en los pacientes con fibrilación auricular, y se calcularon los promedios. La velocidad sistólica máxima en ecografía Doppler tisular ventricular izquierda general (LVs) se definió como el valor medio de las velocidades sistólicas lateral y del tabique máximas. La onda de contracción isovolumétrica se determina mediante la onda que precede a la onda sistólica que se inicia antes del máximo de la onda R del ECG. La AIV se midió dividiendo la velocidad máxima (VIV) por el lapso transcurrido desde el inicio de la onda (cruce del valor cero) durante la contracción isovolumétrica hasta el momento de velocidad máxima de esta onda, según lo descrito anteriormente (fig. 1)15. Las variabilidades entre observadores y del observador en las determinaciones de la AIV fueron del 4,4 y el 3,4% respectivamente. La recuperación ecocardiográfica ventricular derecha (recuperación de RVs, AIV y VIV) a los 6 meses de la operación se definió como la obtención de los parámetros ecocardiográficos existentes antes de la operación o la mejora de las medidas ecocardiográficas respecto a las preoperatorias.
Fig. 1. Cálculo de la velocidad sistólica máxima en el anillo tricuspídeo y la aceleración miocárdica durante la contracción isovolumétrica ventricular derecha a partir de las curvas de velocidad anular tricuspídea obtenidas de exploraciones con Doppler tisular digitalizadas.
Análisis estadístico
El análisis estadístico se llevó a cabo con un programa informático (SPSS for Windows, versión 13.0; SPSS Inc., Chicago, Illinois, Estados Unidos). Los datos se presentan en forma de mediana, con un control respecto a la distribución normal con la prueba de Kolmogorov-Smirnov, y se comparan con pruebas no paramétricas (prueba de la U de Mann-Whitney y prueba de Wilcoxon). La correlación de las variables continuas se analizó mediante el análisis de correlación de Pearson y la de las variables discretas, mediante el de Spearman. Las comparaciones de mediciones repetidas se realizaron con la prueba de Friedman con corrección de Bonferroni y las diferencias entre cada dos mediciones se compararon con la prueba de Wilcoxon. La comparación de más de dos grupos se realizó con la prueba de Kruskal-Wallis con corrección de Bonferroni y las diferencias entre cada dos grupos se compararon con la prueba de la U de Mann-Whitney. Los datos de variables discretas de los dos grupos se compararon con la prueba de la χ2 de Pearson. Se realizó un análisis de regresión logística para determinar los factores predictivos de la recuperación funcional. En este modelo se incluyeron los parámetros ecocardiográficos preoperatorios y las concentraciones de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) como parámetros independientes. Además, se evaluaron también con otro análisis de regresión logística las diferencias entre los valores preoperatorios y los obtenidos a los 6 meses para la presión arterial pulmonar (Δ-PAP), velocidad sistólica máxima en la ecografía Doppler tisular ventricular izquierda (Δ-LVs) y los parámetros de recuperación ecocardiográfica ventricular derecha, incluidas las velocidades miocárdicas del anillo tricuspídeo lateral (Δ-RVs) y (Δ-AIV VD). Se consideró significativo un valor de p < 0,05.
Se analizó la variabilidad del observador (diferencia media entre dos mediciones independientes) y entre observadores (diferencia media entre dos observadores independientes) en 20 exploraciones elegidas aleatoriamente, y se expresó como error porcentual medio (diferencia dividida por el número de observaciones).
RESULTADOS
Formaron inicialmente la población de estudio 80 pacientes; 7 fallecieron durante el periodo perioperatorio y se los excluyó del análisis; 10 pacientes no acudieron a la visita de seguimiento al cabo de 1 y/o 6 meses, y también se los excluyó. La media de edad de los 63 pacientes restantes era 49 ± 16 años (34 mujeres y 29 varones). En la tabla 1 se muestran las características clínicas y ecocardiográficas de la población en estudio. Estaban en ritmo sinusal 40 (63,5%) pacientes y 23 (36,5%) estaban en fibrilación auricular en el momento de la intervención. Las intervenciones de cirugía valvular realizadas y la enfermedad subyacente fueron las siguientes: en 16 pacientes (25,5%) con insuficiencia mitral grave, 18 (28,5%) con estenosis mitral grave y 4 (6,5%) con estenosis e insuficiencia mitral combinadas, se practicó una sustitución de la válvula mitral (SVM) o una cirugía de reparación (CR); en 8 (12,5%) pacientes con insuficiencia aórtica grave y 9 (14,5%) con estenosis aórtica grave, se utilizó una sustitución de la válvula aórtica (SVA); en 8 (12,5%) pacientes con valvulopatía aórtica y mitral grave, se aplicó una SVA y SVM. Este grupo de pacientes constituía el 72% del total de operaciones valvulares practicadas en nuestro centro en un periodo de 3 meses.
En el seguimiento realizado a los 6 meses, las capacidades funcionales de los pacientes presentaron una mejoría significativa (clase funcional [CF] de la NYHA preoperatorias: CF II, 27 pacientes; CF III, 35 pacientes; CF IV, 1 paciente; a los 6 meses: CF I, 20 pacientes; CF II, 36 pacientes; CF III, 7 pacientes; p < 0,026). A los 6 meses, 38 presentaron una recuperación funcional. Sin embargo, 25 pacientes no alcanzaron una recuperación funcional en comparación con el periodo preoperatorio. Los tamaños de la aurícula izquierda (AI), telesistólico ventricular izquierdo y telediastólico ventricular izquierdo (DTDVI) fueron significativamente menores que en el preoperatorio: medianas para la prueba de Wilcoxon, 4,14 frente a 4,22 cm (p = 0,034), 3,28 frente a 2,99 cm (p = 0,01) y 5,17 frente a 4,88 cm (p = 0,008), respectivamente. Hubo un aumento significativo de la LVs (5,09 frente a 7,12 cm/s; p < 0,001). Los valores de presión arterial pulmonar sistólica (PAP) mejoraron también significativamente (40 frente a 32 mmHg; p < 0,001). No se observó una correlación significativa entre la PAP sistólica y los parámetros ecográficos sistólicos ventriculares derechos (RVs, AIV VD, VIV VD) en las determinaciones preoperatorias ni en las obtenidas a los 6 meses de la operación.
Se realizó un análisis de regresión logística para evaluar los factores que predecían de manera independiente la recuperación funcional. Se incluyeron en el modelo los valores preoperatorios de NT-proBNP, AI, fracción de eyección ventricular izquierda (FEVI), PAP, LVs, RVs, AIV VD y duración de bombeo perioperatorio como parámetros independientes. El análisis indicó que los valores de AIV VD (odds ratio [OR] = 3,1; intervalo de confianza [IC] del 95%, 1,01-9,64; p = 0,047) y de PAP (OR = 1,07; IC del 95%, 0,99-1,15; p = 0,07) predecían de manera independiente la recuperación funcional a los 6 meses de la operación.
Los efectos de Δ-PAP, Δ-AIV, Δ-RVs y Δ-LVs en la recuperación funcional se evaluaron también con otro modelo de regresión logística. Se observó que los valores de Δ-PAP (OR = 1,09; IC del 95%, 1,02-1,16; p = 0,006) y Δ-AIV (OR = 3,25; IC del 95%, 1,27-8,33; p = 0,014) predecían de manera independiente la recuperación funcional a los 6 meses de la operación.
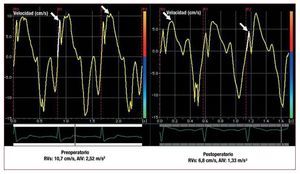
Los valores de RVs mostraron una reducción significativa en la evaluación postoperatoria temprana realizada al cabo de 1 mes y también a los 6 meses de la operación (p < 0,001 en todos los casos). Los valores de AIV y VIV derivados del anillo tricuspídeo disminuyeron en el periodo postoperatorio inmediato y a 1 mes (postoperatorio inmediato: AIV, p < 0,001; VIV, p < 0,001; 1 mes después de la operación: AIV, p < 0,001; VIV, p < 0,001). Sin embargo, esta disminución se recuperó en el seguimiento realizado a los 6 meses, y en ese momento los valores fueron incluso superiores a los basales (AIV, 2,45 frente a 2,62 m/s2; p = 0,014; VIV, 8,6 frente a 10,5 cm/s; p < 0,001) (tabla 2). En el seguimiento realizado a los 6 meses, 11 pacientes presentaron una recuperación de la RVs; 52 pacientes continuaban estando por debajo de los valores iniciales. Sin embargo, 39 pacientes habían presentado una recuperación de los valores de AIV VD y 48 presentaban una recuperación de los valores de VIV VD. Se observó una intensa correlación positiva entre la recuperación funcional y la recuperación de la AIV (r = 0,499; p < 0,001). No hubo correlación entre la recuperación de la RVs y la VIV VD. De los 38 pacientes que presentaron recuperación funcional, 31 habían alcanzado una recuperación de la AIV; 17 de los 25 pacientes que no presentaron recuperación funcional tampoco alcanzaron una recuperación de la AIV (χ2 = 15,717; p < 0,001). No hubo correlación alguna entre la recuperación funcional y la recuperación de RVs y VIV. En la figura 2 se muestran los valores de RVs y AIV VD antes y 1 mes después de la operación.
Fig. 2. Valores de velocidad sistólica máxima en el anillo tricuspídeo (AIV) y aceleración miocárdica durante la contracción isovolumétrica del ventrículo derecho preoperatorios y 1 mes después de la operación de un paciente. Determinación de la AIV a partir de dos curvas de velocidad diferentes: se divide la velocidad sistólica máxima (VIV) por el tiempo entre el inicio de la onda (cruce del cero) durante la contracción isovolumétrica y el momento de velocidad máxima de esa onda.
Se clasificó a los pacientes en subgrupos según el tipo de operación: SVA (n = 18), SVM o CR (n = 37), SVA+SVM (n = 8), con objeto de evaluar la influencia del tipo de cirugía en los datos ecocardiográficos postoperatorios. Los datos de la ecografía preoperatoria pusieron de manifiesto que los pacientes del grupo de SVM o CR tenían mayor tamaño de AI (4,5 frente a 3,9 cm; p = 0,007) y menor tamaño telediastólico ventricular izquierdo (5,1 frente a 5,4 cm; p = 0,026) que los del grupo de SVA. El grupo de SVA+SVM presentó valores de RVs inferiores a los de los grupos de SVM o CR antes de la operación (8,9 frente a 11,3 cm/s; p = 0,005). El grupo de SVA+SVM tenía mayor tamaño de la AI (4,5 frente a 3,9 cm; p = 0,011) y un valor de RVs inferior (8,9 frente a 12,1 cm/s; p = 0,003) que el grupo de SVA. Otros parámetros ecocardiográficos preoperatorios fueron estadísticamente similares en los tres subgrupos.
Se analizaron también los subgrupos de SVA, SVM o CR, y SVA+SVM según los valores de RVs para evaluar las funciones ventriculares derechas. Los valores de RVs se redujeron en el periodo postoperatorio inmediato y esta disminución persistía a los 6 meses de la operación. En cambio, aunque los valores de AIV y de VIV disminuyeron en el periodo postoperatorio inmediato y 1 mes después de la operación, se recuperaron los valores iniciales en el seguimiento realizado a los 6 meses (tabla 3).
Se comparó a los pacientes a los que se había practicado una CR de la válvula mitral (n = 11) con los casos de SVM (n = 26). Los valores de RVs fueron mayores en los pacientes con CR en el postoperatorio inmediato y 1 mes después de la intervención (CR frente a SVM, postoperatorio inmediato, 6,18 frente a 5,03 cm/s; p = 0,027; 1 mes después de la operación, 7,14 frente a 5,48 cm/s; p = 0,007). En la evaluación realizada a los 6 meses de la operación, esta diferencia había desaparecido (10,5 frente a 9,6 cm/s; p = 0,118). Sin embargo, los valores de AIV fueron similares en el postoperatorio inmediato, al mes y a los 6 meses (1,4 frente a 1,2 m/s2; p = 0,337; 2,1 frente a 1,75 m/s2; p = 0,201; 2,93 frente a 2,49 m/s2; p = 0,056).
Se comparó a los pacientes que estaban en ritmo sinusal el día de la operación con los que estaban en fibrilación auricular (FA). La evaluación ecocardiográfica preoperatoria reveló que los pacientes que estaban en ritmo sinusal tenían menor tamaño de la AI (4 frente a 4,8 cm; p = 0,003) y menor PAP sistólica (36,5 frente a 46 mmHg; p = 0,026) que los pacientes con FA. Sin embargo, los valores de RVs (sinusal frente a FA, 11,5 frente a 11,1 cm/s; p = 0,096) y AIV (2,58 frente a 2,29 V; p = 0,53) eran similares. Durante el seguimiento postoperatorio, los valores de RVs fueron similares (postoperatorio inmediato, 6,4 frente a 5,7 cm/s; p = 0,123; 1 mes después de la operación, 6,7 frente a 5,7 cm/s; p = 0,078; 6 meses después de la operación: 10,2 frente a 9,5 cm/s; p = 0,057). De forma análoga, los valores de AIV fueron similares en los dos grupos (postoperatorio inmediato, 1,08 frente a 1,19 m/s2; p = 0,575; 1 mes después de la operación, 1,64 frente a 1,89 m/s2; p = 0,372; 6 meses después de la operación, 2,66 frente a 2,69 m/s2; p = 0,977). Los valores de RVs en el seguimiento realizado a los 6 meses en ambos grupos fueron más bajos que los valores preoperatorios (sinusal 11,5 frente a 10,2 cm/s; p < 0,001; FA, 11,1 frente a 9,5 cm/s; p < 0,001). Los valores de AIV se recuperaron en el seguimiento realizado a los 6 meses de la operación (sinusal, 2,58 frente a 2,66 m/s2; p = 0,273; FA, 2,29 frente a 2,69 m/s2; p = 0,002).
La intervención quirúrgica se practicó en 37 pacientes con cardioplejia de sangre anterógrada, en 18 pacientes con cardioplejia retrógrada y en 8 con una combinación de cardioplejia anterógrada y retrógrada. No hubo diferencias significativas de la recuperación funcional y de la AIV a los 6 meses entre los distintos grupos de cardioplejia (tabla 4). Tampoco hubo correlación significativa entre los parámetros ecocardiográficos y el tiempo de pinzamiento aórtico, la duración de la operación o del bombeo o el grado máximo de hipotermia en nuestro estudio.
DISCUSIÓN
La disfunción ventricular derecha puede producirse durante el postoperatorio y se asocia a un aumento de la mortalidad22-25. En los pacientes a los que se ha practicado un bypass arterial coronario, puede persistir hasta 1 año11,12. Sin embargo, que nosotros sepamos, no se han realizado estudios para investigar la función ventricular derecha en pacientes a los que se practican intervenciones valvulares cardiacas aisladas. Hemos estudiado las funciones ventriculares derechas mediante ecocardiografía Doppler tisular en pacientes a los que se practicaron este tipo de intervenciones. Uno de los resultados importantes de nuestro estudio fue el deterioro de los valores de RVs preoperatorios en el postoperatorio inmediato y la persistencia de este deterioro al cabo de 1 y 6 meses tras la operación. Sin embargo, el nuevo indicador específico de las funciones sistólicas del ventrículo derecho (valores de AIV VD) mostró recuperación a los 6 meses, correlacionada con la recuperación funcional de estos pacientes. Otro resultado importante de nuestro estudio fue la demostración de que los valores preoperatorios de AIV VD y PAP (y la mejora de dichos valores en el postoperatorio) fueron los únicos factores que predecían de manera independiente la recuperación funcional postoperatoria y aportaban más información que otros parámetros ecocardiográficos y bioquímicos.
Hedman et al11 demostraron la recuperación de la capacidad de ejercicio a los 3 meses de la operación, a pesar de que en su grupo de estudio la disfunción ventricular derecha persistió hasta 1 año. La determinación de la AIV VD parece ser una técnica más sensible que la determinación de la velocidad sistólica máxima obtenida con el Doppler tisular para predecir la contractilidad16,17. Sobre la base de estas informaciones, la recuperación significativa de los valores de AIV VD puede ayudar a explicar la mejora de la capacidad de ejercicio observada en estos pacientes. Hemos demostrado que la recuperación de la AIV VD estaba presente en los pacientes con recuperación funcional. Esta observación indica que las determinaciones consecutivas de la AIV VD pueden predecir las funciones ventriculares derechas a los 6 meses de la operación en los pacientes a los que se practica una intervención de cirugía valvular cardiaca aislada. El deterioro perioperatorio de la función ventricular derecha puede retrasar o reducir la recuperación funcional tras la cirugía valvular satisfactoria. La determinación de la AIV VD en estos pacientes puede ser útil para la evaluación clínica. Se ha descrito una disfunción ventricular derecha en casi todos los pacientes a los que se practica un bypass arterial coronario, con independencia del tiempo de bypass cardiopulmonar, el tiempo de pinzamiento aórtico o la técnica de cardioplejia utilizada1-4,22,23. Además, no parece que la cirugía cardiaca sin bombeo proteja el ventrículo derecho en mayor medida que la cirugía de bypass arterial coronario con bombeo26. La disfunción ventricular derecha parece relacionada con la cirugía cardiaca en sí, puesto que no se observó correlación alguna entre el tiempo de pinzamiento aórtico, el tiempo de bombeo, el grado de hipotermia máxima y el tipo de protección cardiopléjica utilizada en nuestros pacientes, que no presentaban enfermedad coronaria. Además, la tasa de disfunción ventricular derecha fue similar en los subgrupos de SVM, SVA y SVM+SVA. Esta observación respalda la hipótesis de que la disfunción ventricular derecha se produce de manera independiente también de la enfermedad valvular subyacente. Sin embargo, la recuperación de los valores de AIV VD 6 meses después de la cirugía valvular puede ayudar a explicar la mejoría funcional significativa durante el postoperatorio. Aunque hubo una disminución persistente de los valores de RVs, los valores de AIV VD se recuperaron en la ecografía obtenida a los 6 meses de la operación y mostraron correlación con la recuperación funcional. La determinación de la AIV VD puede ser útil y fiable en el seguimiento postoperatorio de la función ventricular derecha de los pacientes, con independencia del ritmo auricular.
Limitaciones del estudio
El uso de cualquier parámetro concreto y específico para el estudio de la función sistólica ventricular derecha tras la cirugía tiene la limitación de la falta de un marcador de referencia que permita hacer comparaciones apropiadas. Además, las determinaciones de la velocidad miocárdica con métodos de Doppler tisular que utilizan una codificación con colores reflejan las contracciones activas y también los movimientos pasivos del miocardio. En consecuencia, un nuevo análisis de nuestra hipótesis con métodos más específicos, como la strain y la tasa de strain del miocardio, podrían ser más fiables que los parámetros de Doppler tisular convencionales. Por último, será útil disponer de estudios con un mayor número de pacientes y nuevas modalidades de exploración ecocardiográfica para determinar la asociación de la recuperación funcional con la función sistólica ventricular derecha.
CONCLUSIONES
Nuestro estudio ha revelado que los valores preoperatorios de la AIV VD obtenida mediante Doppler tisular y la PAP sistólica predicen de manera independiente la recuperación funcional 6 meses tras la cirugía valvular cardiaca aislada. Además, la mejora de estos parámetros durante el postoperatorio y su relación con la recuperación funcional pueden ser útiles para la evaluación clínica de los pacientes tras la cirugía valvular cardiaca.
AGRADECIMIENTOS
Queremos dar las gracias a Ferit Un (Statistics and Reporting Manager, Plato Statistics Medical Research, Estambul, Turquía) por su gran esfuerzo en el análisis estadístico de nuestra base de datos. También queremos agradecer al Dr. Kenneth Nugent (Texas Tech University Health Sciences Center, Lubbock, Texas) su ayuda para la redacción en inglés durante la preparación de este manuscrito.
ABREVIATURAS
AI: aurícula izquierda.
AIV: aceleración miocárdica durante la contracción isovolumétrica.
LVs: velocidad sistólica máxima en la ecografía
Doppler tisular del ventrículo izquierdo.
PAP: presión arterial pulmonar sistólica.
RVs: velocidad sistólica máxima en el anillo tricuspídeo en la ecografía Doppler tisular.
SVA: sustitución de válvula aórtica.
SVM: sustitución de válvula mitral.
VIV: velocidad miocárdica de contracción isovolumétrica.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. C. Cevik.
Department of Internal Medicine. Texas Tech University Health Sciences Center.
3601 4th Street. 79430 Lubbock. Texas. Estados Unidos.
Correo electrónico: cihan.cevik@ttuhsc.edu
Recibido el 21 de abril de 2009.
Aceptado para su publicación el 2 de diciembre de 2009.