La tetralogía de Fallot (TDF) es la cardiopatía congénita cianótica más frecuente. La reparación quirúrgica temprana ha mejorado radicalmente su pronóstico. Sin embargo, a pesar del éxito de los abordajes quirúrgicos contemporáneos con reparación completa a edades tempranas, estos distan de ser curativos y las complicaciones tardías son frecuentes. La disfunción del tracto de salida del ventrículo derecho (TSVD) es la complicación más frecuente, afecta a la mayoría de los pacientes en forma de insuficiencia pulmonar, estenosis pulmonar o ambas y puede llevar a la aparición de síntomas de intolerancia al ejercicio, arritmias o muerte súbita. El momento óptimo para restaurar la función del TSVD sigue siendo objeto de debate. El implante percutáneo de válvula pulmonar, introducido hace casi 2 décadas, ha supuesto un punto de inflexión en el tratamiento de la disfunción del TSVD. En este artículo se revisa la fisiopatología, las actuales indicaciones y opciones terapéuticas para la disfunción del TSVD en pacientes con TDF reparada, con especial énfasis en el papel del implante percutáneo de válvula pulmonar en el abordaje terapéutico de estos pacientes.
Palabras clave
La prevalencia total de las cardiopatías congénitas en adultos se calcula en aproximadamente 3.000 casos por millón de habitantes1. La tetralogía de Fallot (TDF) es la cardiopatía congénita cianótica más frecuente y da cuenta del 10% de todas las malformaciones cardiacas congénitas2. La reparación quirúrgica temprana ha mejorado de modo radical el desenlace clínico de esta enfermedad, y se ha pasado de una tasa de supervivencia en la edad adulta < 25% sin cirugía3 a una supervivencia a los 30 años de aproximadamente el 90% de los pacientes sometidos a una reparación completa a edades tempranas4. Los abordajes terapéuticos han evolucionado desde la paliación quirúrgica inicial en el caso de las fístulas de Blalock-Taussig5 y la descripción de la primera reparación intracardiaca6, una época de reparación por etapas con paliación de las fístulas previa a la reparación intracardiaca, y finalmente un abordaje de reparación completa directa a edades tempranas en las últimas 2 décadas. Las técnicas quirúrgicas utilizadas para la reparación completa evolucionaron de una ventriculotomía derecha a veces extensa, pasando por el cierre del defecto septal ventricular y la resección de la estenosis infundibular, junto con un parche transanular para atenuar la obstrucción del tracto de salida del ventrículo derecho (TSVD), a los abordajes transauricular y transpulmonar, cuyo objetivo es preservar el anillo de la válvula pulmonar y, siempre que sea posible, la válvula pulmonar, y reducir al mínimo la formación de cicatrices ventriculares7,8.
No obstante, este abordaje contemporáneo con reparación completa a edades tempranas está lejos de ser curativo y las complicaciones tardías tras la reparación de la TDF son frecuentes. En una cohorte muy grande de pacientes con TDF reparada, la mitad de los supervivientes se habían sometido a una reintervención quirúrgica 30 años después de la primera reparación4. La disfunción del TSVD es la complicación más frecuente y a la mayoría de los pacientes les afecta en forma de regurgitación pulmonar (RP), sobre todo a los que llevan parche transanular9.
En algunos casos, la anatomía cardiaca impide la reparación quirúrgica completa, tal como ocurre en los pacientes con atresia pulmonar o ausencia de válvula pulmonar o con una arteria coronaria anómala que cruza el TSVD. En estos casos, se requiere un conducto desde el ventrículo derecho (VD) hasta la arteria pulmonar para atenuar la obstrucción del TSVD. Estos conductos también se utilizan en otros tipos de cirugía para cardiopatías congénitas, como en la reparación de un tronco arterial común o en algunas formas de transposición compleja de los grandes vasos (intervención de Rastelli), así como en intervenciones para atenuar obstrucciones del corazón izquierdo, como las intervenciones de Ross o de Ross-Konno. La degeneración de estos conductos también puede causar disfunción del TSVD.
En este contexto, a menudo es necesario restablecer la funcionalidad del TSVD. El implante percutáneo de válvula pulmonar (IPVP), introducido hace casi 2 décadas, se ha convertido en el principal gran cambio en el tratamiento de la disfunción del TSVD.
En este artículo se revisan la fisiopatología, las indicaciones actuales y las opciones terapéuticas para la disfunción del TSVD, y se hace hincapié en la función del IPVP en el abordaje terapéutico de estos pacientes.
FISIOPATOLOGÍA DE LA DISFUNCIÓN DEL TSVDMás de la mitad de los pacientes sometidos a reparación primaria de la TDF terminan presentando disfunción del TSVD en algún momento de su vida. Del mismo modo, los pacientes con un conducto que va del VD a la arteria pulmonar experimentan antes o después un deterioro en el funcionamiento del conducto, que ocasiona estenosis, regurgitación o ambas cosas.
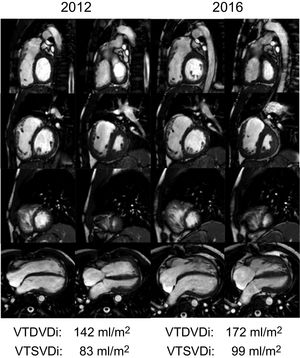
Se sabe que la RP crónica causa sobrecarga de volumen en el VD, algo que en general se tolera bien10, pero que a la larga puede causar dilatación y disfunción del VD11 (figura 1), que a su vez se relaciona con arritmias auriculares12 y ventriculares, muerte súbita13-15, intolerancia al ejercicio, insuficiencia cardiaca y exceso de mortalidad16-19.
Dilatación progresiva del ventrículo derecho tras la reparación de la tetralogía de Fallot e insuficiencia pulmonar demostrada por cardiorresonancia magnética. Pila de cortes en eje corto (basal, fila superior; medioventricular, segunda fila; apical, tercera fila) y vista de 4 cámaras (fila inferior) por medio de imágenes de cine en las fases telediastólica (primera y tercera columnas) y telesistólica (segunda y cuarta columnas) del mismo paciente en los años 2012 y 2016. Obsérvese la progresión de la dilatación del ventrículo derecho. VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado.
Además, la obstrucción residual del TSVD en todos los niveles (infundíbulo, válvula pulmonar, arteria pulmonar principal o sus ramificaciones) también puede contribuir a la disfunción del VD. La estenosis pulmonar causa sobrecarga de presión en el VD y, a su vez, disfunción de este debido a un aumento en la proporción masa:volumen del VD, lo cual un estudio retrospectivo de gran tamaño15 ha constatado que es predictivo de arritmias ventriculares y muerte.
Debido a esta frecuente progresión a disfunción del VD, tanto por sobrecarga de volumen como de presión en el VD, tras reparación de la TDF y su relación con eventos clínicos, hay que considerar el restablecimiento de la funcionalidad del TSVD mediante sustitución de la válvula pulmonar (SVP) cuando estos cambios estructurales se traduzcan en problemas clínicos. Es algo aceptado que los pacientes sintomáticos con disfunción del TSVD se benefician de la intervención en cuanto a alivio de los síntomas20-24, sobre todo los pacientes en quienes predomina la estenosis pulmonar. No obstante, no se ha demostrado que se produzca una mejora uniforme de la capacidad funcional objetiva según las pruebas de ejercicio cardiopulmonar20,22,24,25. Del mismo modo, la SVP mejora parámetros hemodinámicos del VD, como su tamaño20; sin embargo, en la mayoría de los estudios no se ha demostrado claramente que tenga lugar un aumento de la funcionalidad del VD20,22,24-28 o una mejora del funcionamiento del ventrículo izquierdo22,28.
Aunque muchos pacientes pueden permanecer asintomáticos durante años, varios estudios muestran que la mortalidad es mayor entre los pacientes con RP significativa no sometidos a cirugía29. No obstante, hasta la fecha no se ha demostrado de manera fehaciente que la SVP tenga algún impacto en la mortalidad20,30 o las arritmias ventriculares tardías y la muerte súbita20. En realidad, un estudio retrospectivo muy reciente, que ha evaluado los desenlaces clínicos en una cohorte de gran tamaño formada por pacientes con TDF, sometidos o no a SVP, volvió a poner de manifiesto que no hay diferencias significativas en cuanto a mortalidad y taquicardia ventricular sostenida entre los pacientes intervenidos y no intervenidos para SVP tras un seguimiento medio de 5,3 años31. Además, se ha observado un aumento tardío de la mortalidad en los pacientes sometidos a reparación de la TDF incluso tras SVP21,30,32, probablemente debido a que en numerosos pacientes el volumen y la funcionalidad del VD no se recuperan tras la SVP. En consecuencia, hay discusión sobre el momento óptimo para llevar a cabo la SVP, con la intención de equilibrar las ventajas de una restauración temprana de la funcionalidad del TSVD, en lo que respecta a reversibilidad de las anomalías estructurales del VD, con los peligros del implante de una válvula con riesgo de degeneración y la necesidad de posteriores y múltiples intervenciones quirúrgicas para la sustitución de la válvula en el futuro.
INDICACIONES ACTUALES Y MOMENTO ÓPTIMO PARA RESTAURAR LA FUNCIONALIDAD DEL TSVDDados los efectos deletéreos de la disfunción del TSVD en la funcionalidad del VD, los abordajes terapéuticos actuales tienen por objetivo evitar una intervención quirúrgica demasiado tardía e intervienen cuando las anomalías estructurales del VD aún son reversibles33.
La guía europea vigente recomienda la SVP para los pacientes sintomáticos con disfunción del TSVD tras reparación de la TDF en presencia de RP intensa o estenosis pulmonar grave (definida como una presión sistólica del VD > 60 mmHg). Cuantificar la RP es difícil y queda fuera del alcance de esta revisión34. Asimismo, a veces tratar los síntomas clínicos es complicado en este grupo de pacientes y las pruebas de esfuerzo cardiopulmonar desempeñan un papel importante en la evaluación de los síntomas y la reserva cardiopulmonar en este contexto35.
Las indicaciones para la restauración de la funcionalidad del TSVD de pacientes asintomáticos con disfunción del TSVD tras reparación de la TDF sigue siendo una importante cuestión de controversia en la cardiología congénita. La vigente guía europea recomienda la intervención en presencia de RP intensa o estenosis pulmonar y una disminución de la capacidad objetiva para realizar ejercicio según las pruebas de ejercicio cardiopulmonar, en caso de dilatación progresiva del VD, disminución progresiva de la función sistólica del VD, insuficiencia tricuspídea progresiva (como mínimo moderada), obstrucción muy grave del TSVD con presión sistólica del VD > 80 mmHg y arritmias auriculares o ventriculares sostenidas36.
Puesto que las indicaciones de cirugía para pacientes asintomáticos se basa mucho en las anomalías estructurales del VD, evaluarlas es crucial para la selección de candidatos que podrían beneficiarse de la intervención. Aunque la ecocardiografía sigue siendo una modalidad de primera línea importante para este propósito, la geometría del VD y su posición retroesternal impiden una evaluación cuidadosa solo con esta técnica. Dadas su reproducibilidad y excelente resolución espacial, las imágenes obtenidas con cardiorresonancia magnética se han convertido en la piedra angular de la evaluación de las anomalías estructurales del VD tras la reparación de la TDF34.
No obstante, sigue siendo difícil saber en qué momento hay que llevar a cabo la intervención en pacientes asintomáticos con anomalías estructurales del VD conocidas. La evolución temporal de la dilatación y la disfunción del VD en pacientes con disfunción del TSVD sigue sin estar muy clara. En este contexto, la vigente guía recomienda un seguimiento minucioso en centros especializados para detectar la progresión de las anomalías estructurales de los pacientes asintomáticos36. Se ha constatado que el volumen y la funcionalidad del VD permanecen estables en la mayoría de los pacientes37,38. Un estudio reciente ha mostrado que la dilatación y la disfunción del VD, así como la disfunción del ventrículo izquierdo, avanzan lentamente en la mayoría de los pacientes tras la reparación de la TDF. Sin embargo, en aproximadamente el 15% de los pacientes, tuvo lugar un empeoramiento considerable de los parámetros ventriculares y no fue fácil de predecir38. Tradicionalmente se ha adoptado una estrategia de espera vigilante (watchful waiting)para la mayor parte de los pacientes asintomáticos, dado el riesgo de las múltiples intervenciones de cirugía cardiaca mayor, que para esta población se ha considerado demasiado alto. Además, un abordaje más agresivo para restablecer la funcionalidad del TSVD en pacientes asintomáticos se basa en los datos volumétricos del VD derivados de las imágenes obtenidas mediante cardiorresonancia magnética, y hasta la fecha no se ha demostrado que mejore los resultados.
Numerosos estudios han intentado dilucidar cuál es el umbral óptimo de dilatación del VD que indique la necesidad de intervención y determinar el mejor parámetro para controlar el rendimiento del VD a lo largo del tiempo. Un estudio de Geva et al.24 mostró que una reducción en la fracción de eyección del VD < 45% se relaciona con disfunción persistente del VD tras la SVP. Sin embargo, la fracción de eyección puede estar conservada en los ventrículos con sobrecarga de volumen en los cuales ya hay remodelado patológico. Se han estudiado exhaustivamente las imágenes de cardiorresonancia magnética de los volúmenes telediastólico y telesistólico del VD como indicadores de remodelado patológico y se han llevado a cabo muchos esfuerzos para hallar valores discriminatorios decisivos del volumen telediastólico del VD indexado (VTDVDi) y del volumen telesistólico del VD indexado (VTSVDi) por encima de los cuales ya no es posible conseguir un remodelado corregido completo y, en consecuencia, debería estar indicada la intervención. Estos valores discriminatorios propuestos fueron reduciéndose progresivamente desde el VTDVDi > 170 ml/m2 o VTSVDi > 85 ml/m2 del estudio de Therrien et al.39 hasta el VTDVDi > 160 ml/m2 de Oosterhof et al.26. Lee et al.28 propusieron valores discriminatorios del VTDVDi < 168 ml/m2 y VTSVDi < 80 ml/m2. En los últimos años, se ha centrado más la atención en el volumen telesistólico del VD y se ha establecido como el indicador más importante del rendimiento hemodinámico del VD. Un estudio reciente de Bokma et al.40 ha mostrado que la SVP con un VTSVDi preoperatorio < 80 ml/m2 se relaciona con normalización de los volúmenes del VD y que una intervención demasiado tardía con un VTSVDi > 95 ml/m2 se relaciona con eventos clínicos adversos. Más recientemente, Ling Hen et al.41 han demostrado que inmediatamente después de una SVP con reducciones tanto del VTDVDi como del VTSVDi tiene lugar un remodelado inverso considerable, seguido de un proceso continuo de posterior remodelado biológico que se refleja mediante la posterior reducción del VTSVDi, lo cual pone de relieve la función de este parámetro a la hora de monitorizar la función miocárdica en este contexto, y se propone un VTSVDi < 82 ml/m2 como el mejor umbral para la normalización de la función del VD, de acuerdo con informes previos.
Algunos grupos han propuesto umbrales incluso menores para la intervención. Un estudio de Frigiola et al.22 mostró un mayor índice de normalización de los volúmenes del VD y una mejora en la función biventricular acompañada de un aumento de la capacidad para realizar ejercicio utilizando un abordaje más liberal y realizando la cirugía cuando el VTDVDi excede los 150 ml/m2. No obstante, sigue habiendo controversia, ya que en los pacientes asintomáticos un abordaje más liberal también puede tener consecuencias no deseadas. Bokma et al.31 mostraron que los pacientes que se sometían a una SVP con un umbral volumétrico inferior (VTDVDi < 160 ml/m2) presentan mayor incidencia de insuficiencia cardiaca, arritmia auricular y taquicardia ventricular no sostenida.
Otro aspecto que puede influir en la programación de la intervención de estos pacientes es la hipótesis que sostiene que los efectos de la restauración de la funcionalidad del TSVD puede verse influida por la edad del paciente en el momento de la intervención. En el estudio de Frigiola et al.22, resultó más probable que alcanzaran las mejoras objetivas en la capacidad funcional los pacientes sometidos a cirugía cuando tenían menos de 17 años. Este abordaje más liberal con respecto a la edad también se ha cuestionado. Un estudio reciente ha mostrado que la SVP antes de los 16 años no mejora la supervivencia libre de eventos comparado con la SVP después de esa edad42. Complicaciones como muerte, endocarditis y nueva SVP aparecían claramente antes en los pacientes intervenidos para SVP antes de los 16 años.
ENFOQUES TERAPÉUTICOS ACTUALES PARA RESTABLECER LA FUNCIONALIDAD DEL TSVDEn la mayoría de los pacientes, tras la reparación primaria de la TDF, la SVP quirúrgica es el tratamiento de elección, ya que se ha demostrado que mejora el flujo sanguíneo pulmonar, reduce la insuficiencia tricuspídea y mejora la mecánica del VD, lo que resulta en una mejora clínica18,22,24,31. La SVP puede llevarse a cabo con mortalidades temprana y tardía bajas en población tanto pediátrica como adulta43. Según series recientes, la mortalidad perioperatoria es tan baja como del 1% en la época actual43-45. Existen varias opciones quirúrgicas para restablecer la funcionalidad del TSVD.
Las válvulas mecánicas en posición pulmonar se asocian con complicaciones mayormente relacionadas con la necesidad de anticoagulación crónica y la posibilidad de trombosis valvular. Raramente se implantan para restablecer la funcionalidad del TSVD, pese a su mayor durabilidad46. Además, impiden el posterior acceso a la circulación pulmonar en caso de que sea necesaria alguna intervención en la vasculatura pulmonar.
Entre las opciones de válvulas de tejido disponibles para la SVP, los alotrasplantes valvulares, los conductos valvulados de vena yugular bovina y las prótesis valvulares de pericardio bovino o porcino stent o sin él son las opciones preferibles por su menor riesgo de trombosis y porque no es necesaria la anticoagulación sistémica. No obstante, los pacientes que requieren este tipo de válvulas, como parte de la reparación primaria o como intervención secundaria para tratar la disfunción del TSVD, corren el riesgo de fallo valvular debido a la degeneración.
Los alotrasplantes aórticos y pulmonares eran tradicionalmente las válvulas más utilizadas. Un inconveniente importante es su escasa disponibilidad y su alto coste, así como su degeneración acelerada, sobre todo en los pacientes jóvenes, cuya respuesta inmunitaria puede estar aumentada47,48.
Una alternativa relativamente frecuente al alotrasplante en la reconstrucción del TSVD son los conductos de vena yugular bovina. No obstante, al igual que ocurre con los alotrasplantes, estos conductos son poco durables. Aunque según un estudio los conductos de vena yugular bovina tienen mayor durabilidad que los conductos de los alotrasplantes, la mayor parte de los estudios muestran que no existen diferencias de rendimiento significativas entre los distintos tipos de conductos49-52.
Por último, las válvulas bioprotésicas están disponibles en una amplia variedad de tamaños y son la opción preferida para los adultos que se someten a una SVP quirúrgica. Es sabido que las válvulas bioprotésicas en posición pulmonar degeneran y llevan a insuficiencia21,27,47,53. Esta poca durabilidad se relaciona con el tipo de válvula y la edad del paciente en el momento del implante, con una durabilidad media de aproximadamente 15 años si se implantan en la tercera década de la vida53,54.
El implante quirúrgico de válvula pulmonar perfecto no existe, y casi todos los pacientes que reciben válvulas o conductos de tejido para la reparación primaria o la SVP secundaria deberán someterse a varias reintervenciones debido a la degeneración.
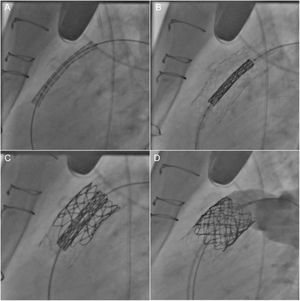
Con la aparición del IPVP el año 200055, el abordaje terapéutico para restablecer la funcionalidad del TSVD ha experimentado un cambio considerable. Esta técnica tiene la ventaja de que evita la reesternotomía y la derivación cardiopulmonar y se ha convertido en una alternativa atractiva a la SVP quirúrgica para pacientes seleccionados (figura 2).
Implante percutáneo de válvula pulmonar en un tracto de salida del ventrículo derecho disfuncional (alotrasplante). Tras la colocación previa de un stent extenso (A y B), se colocó una válvula Melody de 22 mm (C) y se abrió satisfactoriamente, sin que se produjera insuficiencia tras la intervención (D).
Para candidatos seleccionados apropiadamente, principalmente aquellos a quienes ya se ha implantado un conducto entre el VD y la arteria pulmonar, se ha visto que el IPVP es una opción segura y fiable para restablecer la funcionalidad del TSVD, con una incidencia baja de RP posquirúrgica, una reducción en los síntomas de los pacientes, una mejora de los parámetros hemodinámicos del VD y una mejora de la capacidad funcional56-59. Actualmente existen 2 dispositivos muy utilizados para el IPVP.
La válvula Melody (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos) es un stent de platino en el que se ha insertado una válvula de vena yugular bovina. Actualmente se halla disponible en 2 diámetros, 20 y 22 mm, que pueden implantarse en conductos cuyo diámetro oscila entre 16 y 22 mm.
La válvula Edwards SAPIEN (Edwards Lifesciences Corp.; Irvine, California, Estados Unidos) es una válvula de pericardio bovino insertada dentro de un stent expandible con balón. En su origen, el sistema se creó para el implante transcatéter de válvula aórtica y se utilizó por primera vez en la posición pulmonar en 200660. Actualmente ya se encuentra disponible con prótesis de segunda y tercera generación (SAPIEN XT y SAPIEN 3 respectivamente). Ambas utilizan stents de cromo-cobalto y se utilizan para el IPVP en una amplia variedad de tamaños, que van de 20 a 29 mm61.
En los últimos años, la experiencia ha cobrado fuerza y los resultados son prometedores. El IPVP con la válvula Melody proporcionó buenos resultados clínicos y hemodinámicos, con tasas de supervivencia libre de reintervención y explantación a los 7 y los 5 años del 76 y el 92% respectivamente62. Aunque habitualmente se implanta a través de la vena femoral, pueden utilizarse con éxito vías de acceso alternativas, como la yugular o la transhepática, en pacientes con obstrucciones venosas63. No obstante, esta técnica también está sujeta a complicaciones y son numerosos los factores técnicos que desempeñan un papel importante en el desenlace clínico. En experiencias anteriores, la fractura del stent debida a la posición anterior de la válvula en el tórax con aumento del estrés mecánico fue una causa frecuente de insuficiencia valvular. La tendencia actual y prácticamente generalizada de implantar previamente un stent ha disminuido radicalmente esta complicación62. Los pacientes de poca edad, cuyos conductos son pequeños, suponen un reto y, a pesar de los buenos resultados del IPVP en la población pediátrica64, puede producirse rotura o perforación del conducto. Esta complicación puede superarse utilizando stents recubiertos. La obstrucción coronaria debida a compresión en el momento del implante puede tener lugar en hasta el 5% de los pacientes65. Para evitar esta complicación, se requiere una evaluación cuidadosa de la anatomía coronaria con hinchado simultáneo del balón. La endocarditis puede ser una complicación importante, con tasas de hasta el 2,4%66. Los pacientes tratados con IPVP se hallan expuestos a otras complicaciones menos frecuentes, hoy mejor conocidas y estudiadas en pacientes tratados con válvulas transcatéter en posición aórtica. Se ha observado trombosis valvular no infecciosa tras el IPVP y, aunque habitualmente se resuelve con anticoagulación, esta puede generar una morbilidad considerable en esta población67-69.
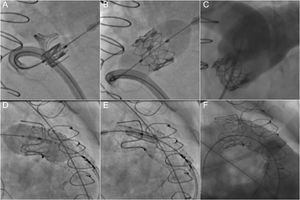
La necesidad de una zona estable de destino para anclar la válvula limita el IPVP a aproximadamente un 15% de los pacientes con disfunción del TSVD70. No obstante, este abordaje se ha convertido en una opción interesante para las intervenciones de TSVD secundarias en pacientes con una válvula bioprotésica, ya que el implante transcatéter de una válvula puede evitar la necesidad de reintervenir a estos pacientes71,72 (figura 3). Los nuevos avances pueden facilitar la ampliación de las indicaciones a los pacientes con TSVD nativos de mayor diámetro y sin implante previo de conductos o válvulas73-75. Asimismo, las válvulas percutáneas modernas, con diámetros de hasta 29 mm, permiten tratar disfunciones del TSVD de mayor tamaño61. Además, el uso ampliamente extendido de los abordajes quirúrgicos modernos que respetan la válvula pulmonar a expensas de cierta estenosis residual puede aumentar el número de posibles candidatos a esta técnica.
Implante percutáneo de válvula pulmonar en una bioprótesis disfuncional (implante transcatéter de una válvula). A-C: implante de una válvula SAPIEN XT en una bioprótesis Perimount sin colocación previa de stent. D-F: implante de una válvula SAPIEN 3 en una bioprótesis Carpentier-Edwards con colocación previa de stent para preparar la zona de destino.
Sin embargo, todavía sigue habiendo un gran número de pacientes con dilatación del TSVD debido a los extensos parches transanulares en quienes el implante de una válvula percutánea sigue siendo difícil, y habitualmente se los remite a SVP quirúrgica. Se están desarrollando nuevos dispositivos para ampliar las técnicas percutáneas a estos pacientes. Los resultados son prometedores con la válvula P Venus (MedTech; Shanghái, China), que consta de un stent de nitinol autoexpandible con una válvula de pericardio porcino con expansiones proximales y distales, y la válvula pulmonar transcatéter Harmony (Medtronic Inc.), que es una válvula de pericardio porcino de 22 mm cosida a un stent asimétrico de nitinol autoexpandible, también con extremos proximales y distales más grandes para acomodarse a las distintas morfologías del TSVD76-78.
REDEFINICIÓN DEL MOMENTO DE LA REINTERVENCIÓN DEL TSVD EN LA ERA DEL IPVPLa vigente guía europea recomienda el IPVP con las mismas indicaciones que la SVP para los candidatos apropiados36. En la práctica, el IPVP suele ofrecerse como primera opción a los pacientes con disfunción del TSVD que son candidatos técnicamente apropiados, ya que en general estos pacientes no son buenos candidatos para cirugía. No obstante, ningún estudio clínico aleatorizado ha comparado cara a cara la SVP quirúrgica con el IPVP transcatéter y sigue sin estar claro si debería priorizarse el IPVP sobre la SVP quirúrgica para los pacientes candidatos a cirugía con riesgo quirúrgico bajo. Además, solo los pacientes con conductos o SVP previa suelen ser candidatos técnicamente apropiados para el IPVP, mientras que la mayor parte de aquellos con TSVD nativo actualmente no lo son. A pesar de la actual aplicabilidad a solo un subgrupo de pacientes con disfunción del TSVD, la aparición del IPVP ha llevado a un cambio de hipótesis en el abordaje general de la restauración de la funcionalidad del TSVD tras reparación de la TDF más allá de la «competición» de ambas técnicas.
Como ya se ha mencionado, uno de los principales inconvenientes de la reparación de la TDF es la necesidad de restablecer la funcionalidad del TSVD en algún momento tras la reparación. La mayoría de los pacientes recibirán una válvula o conducto que al cabo de los años se degenerará inevitablemente, lo que implicará varias reparaciones a lo largo de la vida, con la morbilidad y la mortalidad asociadas14,66.
Esto ha contribuido a cierta resistencia de los cardiólogos especializados en enfermedades congénitas a remitir a los pacientes con disfunción del TSVD a SVP quirúrgica mientras se mantengan asintomáticos. La posibilidad de realizar el IPVP como una intervención transcatéter de una válvula en una bioprótesis degenerada puede evitar futuras reintervenciones y es algo ampliamente aceptado en este escenario clínico71,72, ya que actualmente el IPVP puede realizarse con muy poco riesgo. Las series más contemporáneas, que dan cuenta de la práctica casi generalizada actual de colocar stents, muestran resultados excelentes a corto y medio plazo79. En este sentido, según un metanálisis reciente llevado a cabo con 19 estudios y 1.044 pacientes sometidos a IPVP transcatéter, el grado de satisfacción de las intervenciones fue de más del 96%, con incidencias de rotura del conducto del 4,1% y de complicación coronaria del 1,3%. La incidencia de reintervención fue de 4,4/100 personas-año en general y considerablemente inferior en estudios que informaban de un porcentaje más alto de colocación previa de stents80. Además, los pacientes con una válvula pulmonar transcatéter estenótica (p. ej., debido a fractura del stent) también podrían sacar provecho de una reintervención percutánea62.
No obstante, el número de intervenciones percutáneas que vuelven a realizarse es pequeño, ya que el diámetro interno máximo efectivo del conducto o la bioprótesis disminuye inevitablemente tras la colocación de cada válvula. Por otra parte, aunque se carece de datos a largo plazo, se espera que las válvulas pulmonares percutáneas degeneren al cabo de varios años de un modo parecido a sus homólogas quirúrgicas. Además, queda por demostrar si las válvulas percutáneas influyen en la supervivencia al evitar nuevas intervenciones. Asimismo, parece poco probable que las válvulas percutáneas eviten por completo la cirugía en estos pacientes. La mayor edad y, a la larga, el aumento de la comorbilidad pueden conferir mayor riesgo a una intervención probablemente inevitable. Además, la presencia de numerosos stents y válvulas en el TSVD puede aumentar la complejidad quirúrgica y, por lo tanto, el riesgo quirúrgico.
Sin embargo, la disponibilidad de una alternativa percutánea a la cirugía con un perfil de riesgo bajo para las válvulas degeneradas respaldaría la intervención previa en pacientes con disfunción del TSVD tras reparación de la TDF, incluso si la cirugía es la primera opción antes de que las anomalías estructurales del VD sean irreversibles. Si aparecen síntomas o anomalías estructurales del VD que satisfagan los criterios para la SVP durante la infancia tardía o la adolescencia, a menudo puede insertarse una bioprótesis de tamaño de adulto. A esas alturas los cirujanos deberían tener en cuenta la posibilidad de implantar otra válvula percutánea en caso de que haya degeneración de la válvula quirúrgica cuando se elija el tipo de válvula (prótesis valvular de pericardio bovino o porcino con stent en lugar de alotrasplantes criopreservados) y el tamaño de la válvula (por lo menos 25 mm), para permitir el implante de válvulas percutáneas sucesivas. Si esto no es posible porque el tórax del paciente no puede acomodar este tipo de válvula, puede utilizarse un conducto de vena yugular bovina, ya que datos recientes muestran que el IPVP es factible incluso con los menores tamaños de la gama81.
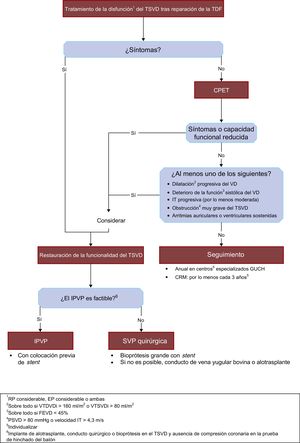
La figura 4 resume en un algoritmo el abordaje utilizado en el tratamiento de la disfunción del TSVD de pacientes sometidos a reparación de la TDF.
Algoritmo propuesto para el tratamiento de la disfunción del TSVD tras la reparación de la TDF. CPET: prueba de esfuerzo cardiopulmonar; CRM: cardiorresonancia magnética; EP: estenosis pulmonar; FEVD: fracción de eyección del ventrículo derecho; GUCH: cardiopatía congénita del adulto; IPVP: implante percutáneo de válvula pulmonar; IT: insuficiencia tricuspídea; PSVD: presión arterial sistólica del ventrículo derecho; RP: regurgitación pulmonar; SVP: sustitución de válvula pulmonar; TDF: tetralogía de Fallot; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado.
Encontrar el mejor momento para la restauración de la funcionalidad del TSVD en pacientes con disfunción del mismo tras la reparación de la TDF sigue siendo una cuestión controvertida. No obstante, la aparición del IPVP ha provocado un cambio de paradigma hacia una reparación más temprana del TSVD en caso de IP, incluso si se requiere cirugía en un primer momento. Una vez que se ha implantado un anillo bioprotésico del tamaño adecuado, el IPVP es factible, tiene bajo riesgo y buenos resultados a corto y medio plazo. Sin embargo, todavía queda por demostrar si una SVP más temprana con IPVP posterior para evitar las reintervenciones tiene un impacto en los resultados clínicos.
CONFLICTO DE INTERESESF. de Torres-Alba declara haber recibido apoyo económico para asistencia a congresos de Edwards Lifesciences. G. Kaleschke declara haber recibido apoyo económico para asistencia a congresos de Edwards Lifesciences y Medtronic. H. Baumgartner declara haber recibido apoyo económico para asistencia a congresos de Edwards Lifesciences, Abbott y Medtronic, así como honorarios de conferenciante de Edwards Lifesciences.