En los últimos años ha emergido un interés creciente sobre la relación entre el cáncer y las enfermedades cardiovasculares. El aumento de la esperanza de vida de ambas enfermedades ha condicionado su coexistencia cada vez más frecuente en un mismo paciente, con lo cual se ponen de relieve reacciones adversas farmacológicas que suponen un mayor riesgo para los pacientes. Esto es especialmente relevante en el caso de la ateroesclerosis, que parece compartir un sustrato fisiopatológico común con el cáncer. En esta revisión se analizan estos factores de riesgo comunes y de forma específica la relación entre los diferentes tratamientos del cáncer y el riesgo de enfermedad coronaria o cerebrovascular, así como la evidencia científica actual sobre la posible relación entre la terapia antiagregante y el riesgo de cáncer. Se repasan también de manera bidireccional la incidencia y el pronóstico del cáncer en pacientes con ateroesclerosis y viceversa, documentado en la información de los últimos estudios publicados en el campo de la cardiooncología.
Palabras clave
Las enfermedades cardiovasculares (ECV) y las neoplasias ocupan el primer y el segundo lugar, respectivamente, entre las causas de muerte en el mundo1. Sin embargo, la tendencia decreciente en la incidencia y la mortalidad que las ECV han registrado en las últimas décadas no se ha observado en las neoplasias, que han mostrado un incremento en su incidencia sin reducciones relevantes de la mortalidad en la mayoría de los casos2. Solo en Europa, en 2012 se produjeron más de 3,5 millones de nuevos casos de cáncer y cerca de 2 millones de fallecimientos por estas enfermedades3. Estimaciones nacionales auguran incrementos de la incidencia de cáncer superiores al 30% en España respecto a décadas pasadas, fundamentalmente debido al envejecimiento de la población y los cambios en los factores de riesgo4.
En los últimos años ha crecido el interés por la incidencia y la mortalidad de las ECV en los pacientes tratados por neoplasias, ya que hasta el 30% de los fallecimientos de pacientes con cáncer pueden ser de causa cardiovascular5. Pero, además, la progresiva reducción de la mortalidad de los pacientes con síndrome coronario agudo (SCA) o cardiopatía isquémica crónica estable ha llevado a una mayor supervivencia a largo plazo de estos pacientes, que tienen mayor riesgo de presentar neoplasias de novo o recidivas de enfermedades previas, lo que supone un gran reto para la atención clínica y condiciona el pronóstico de estos pacientes.
FACTORES DE RIESGO COMUNES A CÁNCER Y ATEROESCLEROSISLa convergencia de factores de riesgo de ambas entidades hace que la concomitancia de cardiopatía isquémica y neoplasias en una misma persona no sea infrecuente, de modo tal que un 4-10% de los pacientes con SCA o cardiopatía isquémica crónica tienen un antecedente de cáncer6,7. En el registro RECALCAR (REcursos y CALidad en CARdiología) se describió una prevalencia de tumores malignos del 2,77% en los pacientes ingresados por SCA, asociada con una mayor mortalidad hospitalaria (odds ratio=2,26; intervalo de confianza del 95% [IC95%], 1,99-2,55)6. En un estudio prospectivo de todos los pacientes ingresados por SCA en único centro español entre 2009 y 2016, se observó que la prevalencia de neoplasias en el momento del ingreso era del 3,4% (IC95%, 2,7-4,4), y las localizaciones más frecuentes fueron colon, vejiga, pulmón y próstata8. La mediana de tiempo entre el diagnóstico de la neoplasia y el SCA fue de 5,5 años, y la mayoría había tenido una cirugía específica por el cáncer (74,2%) o quimioterapia (46,8%). Un dato interesante es que, en el momento de ingreso por SCA, se consideró libre de enfermedad tan solo al 41,9% de los pacientes, lo cual tuvo importantes implicaciones en el tratamiento durante la fase hospitalaria y el pronóstico a largo plazo.
La edad, el sedentarismo, el tabaquismo y la dieta rica en grasas y carbohidratos son factores establecidos del riesgo de ECV, pero también de neoplasias9. Datos actualizados de REDECAN (Red Española de Registros de Cáncer) en España muestran que las neoplasias más frecuentes en varones son las de próstata, colon, pulmón y vejiga, mientras que en las mujeres son las de mama, colon, útero y pulmón10, lo cual coincide con grandes registros de Europa3 y Estados Unidos2. El tabaquismo es el factor de riesgo que presenta una asociación más fuerte con la cardiopatía isquémica y las neoplasias y, de hecho, se lo considera la primera causa de mortalidad evitable por su impacto sobre las 2 primeras causas de muerte en el mundo11. El análisis de la encuesta nacional de salud de 2011-2012 y las estadísticas vitales del Instituto Nacional de Estadística mostraron que la prevalencia total del tabaquismo en España en 2012 era del 23,6%, y se estimó que cada día 125 varones y 40 mujeres fallecían por causas atribuibles al consumo de tabaco, sumando más de 60.000 muertes en 1 año12. Cabe mencionar que el cáncer de tráquea-bronquios-pulmón en varones y las cardiopatías en mujeres fueron las principales causas de muerte relacionadas con el tabaco. El tabaquismo es uno de los principales factores de riesgo en la incidencia de SCA, especialmente en gente joven12. Dado que la mortalidad de los pacientes con SCA jóvenes es muy baja, la mayoría de los pacientes sobreviven a muy largo plazo y son susceptibles de tener neoplasias con el tiempo. De hecho, datos recientes muestran que ser fumador o exfumador en el momento del SCA multiplica por 3 el riesgo de presentar una neoplasia tras el SCA.
La diabetes mellitus es uno de los factores de riesgo cardiovascular que más aumentan el riesgo de muerte por cardiopatía isquémica. El amplio seguimiento de más de 400.000 personas con diabetes en Suecia, comparado con más de 2 millones de controles, demostró que los diabéticos presentaban un exceso de mortalidad por ECV, pero también por cáncer13. Además, este estudio demostró que el control metabólico de la diabetes, valorado mediante la glucemia y la concentración de glucohemoglobina, tenía una clara asociación con la mortalidad por causas cardiovasculares y no cardiovasculares, y reveló el papel clave de la hiperglucemia en la activación de otras vías fisiopatológicas. La mayor presencia de factores de riesgo cardiovascular incrementa de forma lineal los marcadores séricos de inflamación, como la proteína C reactiva, que se ha demostrado como marcador independiente del riesgo de incidencia y mortalidad por cardiopatía isquémica14. Entre todos, la diabetes mellitus es el que conlleva por sí solo valores más altos de proteína C reactiva y también el factor de riesgo de cardiopatía isquémica con la asociación más fuerte14. Aunque la etiología de las neoplasias es muy heterogénea, en la base fisiopatológica de casi todas ellas se encuentra un estado inflamatorio crónico y una falta de resolución de los estímulos proinflamatorios que alteran el sistema inmunitario; este fenómeno es muy similar a la activación de los macrófagos en la pared arterial por la acumulación de lipoproteínas de baja de densidad15. Por lo tanto, la activación crónica del sistema inmunitario y el estado inflamatorio subyacen a la fisiopatología tanto de la ateroesclerosis como de las neoplasias, lo cual explicaría muchos de los hallazgos del estudio CANTOS16. Este demostró que el tratamiento con canakinumab, un anticuerpo monoclonal que bloquea la acción de la interleucina 1ß que se encuentra en la vía de acción de la interleucina 6 y la proteína C reactiva, reducía la incidencia de complicaciones cardiovasculares mayores y cáncer en personas con infarto agudo de miocardio (IAM) previo y proteína C reactiva elevada (> 2 mg/l)16. La reducción en la incidencia del objetivo primario (IAM, accidente cerebrovascular o muerte de causa cardiovascular) se relacionó con la dosis de canakinumab recibida, que a su vez también tuvo asociación muy estrecha con las reducciones de proteína C reactiva e interleucina 6. En un subanálisis posterior, se demostró que en los pacientes que recibieron canakinumab la incidencia de cáncer de pulmón y la mortalidad por cáncer fueron marcadamente inferiores que con placebo y, además, dependientes de la dosis17. Dado que el canakinumab no tiene efecto en la concentración sérica de glucosa o lípidos18 ni tampoco acción directa alguna en la oncogénesis, parece bien probado que la inflamación tiene un papel crítico tanto en la ateroesclerosis como en la aparición de neoplasias.
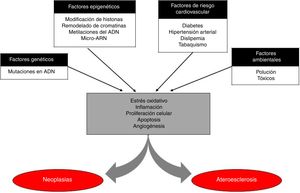
Aparte de la inflamación, que parece además un posible objetivo de tratamiento común, la enfermedad aterotrombótica y las neoplasias comparten muchas vías fisiopatológicas (figura 1). La proliferación celular y la apoptosis son 2 de los mecanismos fundamentales de la homeostasis tisular; la alteración de su equilibrio es el origen —en gran parte— de las neoplasias, pero también se ha relacionado con el desarrollo y la inestabilización de las placas de ateroma coronarias19. Otro de los mecanismos característicos de las neoplasias es la neoangiogénesis, que se ha relacionado además con su capacidad de invasión local y a distancia, ya que la proliferación celular precisa de oxígeno y nutrientes. De modo similar, la formación de neovasos dentro de la placa, los denominados vasa vasorum, configura uno de los principales puntos de entrada para lipoproteínas, eritrocitos y células inflamatorias en las placas. El papel de estos neovasos es un tanto dual, ya que puede ser un mecanismo de recuperación tras la disminución de lipoproteínas debida al tratamiento intensivo con hipolipemiantes; sin embargo, también se ha descrito que gran parte de estos neovasos son altamente disfuncionantes, promueven el paso de partículas a la placa y propician su inestabilización19. Otro gran mecanismo fisiopatológico común entre el cáncer y la ateroesclerosis son las micropartículas de ARN, que son microfragmentos no codificantes de ARN mensajero y regulan la expresión postranscripcional de los genes. Estas micropartículas se liberan como una respuesta celular ante cualquier agresión y se han relacionado claramente con el estrés oxidativo y la inflamación, de modo que no es sorprendente que se hayan identificado varias moléculas relacionadas tanto con la ateroesclerosis como con las diferentes neoplasias20.
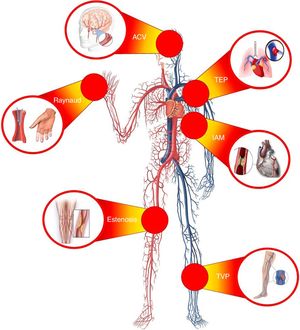
ENFERMEDAD ATEROESCLERÓTICA EN PACIENTES CON CÁNCER: INCIDENCIA Y PRONÓSTICOLos continuos progresos en el tratamiento de los procesos neoplásicos han llevado a un aumento significativo de la supervivencia del paciente oncológico y, consecuentemente, a la aparición de una tasa relevante de comorbilidades y complicaciones médicas asociadas o favorecidas por el cáncer. En este sentido, las ECV son una de las mayores causas de morbimortalidad de los pacientes con neoplasias malignas (figura 2). Por ejemplo, en las mujeres con diagnóstico precoz de cáncer de mama, las ECV se asocian con una tasa de mortalidad mayor que la del propio cáncer21.
En comparación con los pacientes no diagnosticados de cáncer, los adultos que experimentan un proceso neoplásico tienen un incremento significativo del riesgo de ECV. Un estudio reciente ha demostrado que los pacientes con diagnóstico reciente de cáncer tienen casi el triple de riesgo (hazard ratio [HR]=2,9; IC95%, 2,8-3,1) de IAM que la población de control22, y ese aumento del riesgo es proporcional al estadio oncológico (significativamente mayor en los pacientes con mayor carga tumoral o extensión de la enfermedad). Otro aspecto de especial interés de este estudio es que acota el periodo en que este exceso de riesgo cardiovascular es mayor (limitado al primer año tras el diagnóstico de cáncer), lo que podría ser de especial relevancia al plantearse posibles estrategias de prevención primaria como tratamiento antitrombótico o estatinas en dichas fases.
Aunque el cáncer puede causar ateroesclerosis por diferentes mecanismos, los más frecuentes son las secuelas de los fármacos antitumorales y la radioterapia (RT). Sin embargo, se debe tener en consideración que existe un sustrato común en muchos pacientes con cáncer y ECV, más allá de la RT y la quimioterapia, y que sirve de nexo entre ambas afecciones. Así, no es infrecuente encontrar en pacientes con cáncer alteraciones metabólicas y vasculares, entre las que destacan la obesidad abdominal, el metabolismo de la glucosa alterado, las alteraciones lipoproteicas y la hipertensión arterial23.
A continuación nos centraremos en el aumento del riesgo cardiovascular asociado con la RT y quimioterapia pero, antes de desarrollar estos apartados, es interesante mencionar el riesgo cardiovascular de los pacientes con neoplasias hematológicas que se han sometido a trasplante de células hematopoyéticas, fundamentalmente por enfermedad del injerto contra el huésped (lesión endotelial), aumento de los factores de riesgo cardiovascular debido al tratamiento inmunosupresor (ateroesclerosis acelerada) y la vida sedentaria (hábitos proateroescleróticos). El estudio de Chow et al.24 demostró en más de 1.000 pacientes sometidos a trasplante de células hematopoyéticas que el riesgo de un evento coronario fue más del triple que el del grupo de control, en coincidencia con estudios previos que habían comunicado que hasta 1 de cada 5 pacientes que habían recibido trasplante hematopoyético alogénico tenía diagnóstico de ECV a los 20 años, con lo que se adelantaba en unos 10-15 años la edad de inicio de la cardiopatía isquémica frente a la población de control.
Radioterapia y riesgo ateroescleróticoLa RT torácica —utilizada fundamentalmente para el tratamiento del cáncer de mama y el linfoma de Hodgkin— se asocia con mayor riesgo de cardiopatía isquémica, mientras que la RT cerebral—empleada en tumores primarios del sistema nervioso central— se ha asociado con un incremento del riesgo de enfermedad cerebrovascular25. En este sentido, se ha descrito que la RT torácica incrementa entre 5 y 10 veces el riesgo relativo de IAM o muerte súbita, mientras que la RT cerebral incrementa el riesgo de ictus unas 20 veces26. El fundamento fisiopatológico es el daño de la pared vascular: la RT induce disfunción endotelial que incrementa la permeabilidad capilar y activa la inflamación, lo que da lugar a proliferación de la íntima, formación y depósito de colágeno y fibrosis, que favorecen la formación de las placas de ateroesclerosis. Aunque no se ha descrito un umbral aparente por debajo del cual no hay riesgo de cáncer, sí se sabe que hay una asociación directa entre la dosis de RT y el riesgo de cáncer. En un estudio en mujeres con adenocarcinoma de mama tratadas con RT, se observó que, por cada 7Gy de radiación recibida, aumentaba el riesgo de evento coronario un 7,4%27; el riesgo de cardiopatía isquémica era especialmente alto con dosis de RT ≥ 10Gy (incremento del 116%; IC95%, 59-195). Ese riesgo se materializa al cabo de 5 años y se extiende hasta los 30 años tras la RT. Así, en el caso de la RT torácica tras un linfoma de Hodgkin, se observó que a los 11 años hasta un 10% de los pacientes tratados habían presentado un evento cardiovascular28. Finalmente, hay que destacar el estudio de Heidenreich et al. que, tras analizar a 300 pacientes asintomáticos que habían recibido RT por un linfoma de Hodgkin unos 15 años antes, observaron que 1 de cada 5 tenía un ecocardiograma anormal, 1 de cada 7 tenía un defecto de perfusión en el ecocardiograma de estrés y 1 de cada 14 tenía enfermedad arterial documentada con una estenosis coronaria> 50%29.
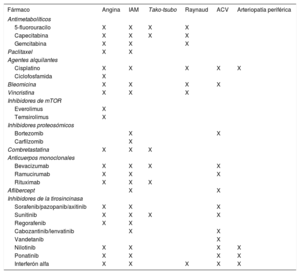
Quimioterapia y enfermedad ateroescleróticaSon varios los fármacos quimioterápicos que se han asociado con un incremento en la incidencia de ECV ateroesclerótica (tabla 1), aunque, por lo general, la incidencia acumulada de cardiopatía isquémica es inferior a 5 casos/100 pacientes al año, a los que se trata con quimioterápicos30. En particular, de los fármacos quimioterápicos con mayor riesgo ateroesclerótico, destacan los antimetabolitos, los antimicrotubulares y los inhibidores de la tirosincinasa. Así, en el caso del fluorouracilo, la tasa de vasoespasmo ronda entre el 40 y el 70% de los pacientes, en las diferentes series, y el evento se produce a las pocas horas o días del tratamiento31. En relación con este fármaco, se debe evitar administrarlo durante más de 3 h y su combinación con cisplatino. Con los inhibidores de la tirosincinasa, en especial con el nilotinib, se ha descrito una arterioesclerosis acelerada, de manifestación particularmente periférica, que se describe en aproximadamente un 10-25% de los pacientes32, riesgo que no se extrapoló al imatinib. También se ha descrito un mayor riesgo de trombosis arterial.
Agentes quimioterápicos asociados con enfermedades cardiovasculares
| Fármaco | Angina | IAM | Tako-tsubo | Raynaud | ACV | Arteriopatía periférica |
|---|---|---|---|---|---|---|
| Antimetabolíticos | ||||||
| 5-fluorouracilo | X | X | X | X | ||
| Capecitabina | X | X | X | X | ||
| Gemcitabina | X | X | X | |||
| Paclitaxel | X | X | ||||
| Agentes alquilantes | ||||||
| Cisplatino | X | X | X | X | X | |
| Ciclofosfamida | X | |||||
| Bleomicina | X | X | X | X | ||
| Vincristina | X | X | X | |||
| Inhibidores de mTOR | ||||||
| Everolimus | X | |||||
| Temsirolimus | X | |||||
| Inhibidores proteosómicos | ||||||
| Bortezomib | X | X | ||||
| Carfilzomib | X | |||||
| Combretastatina | X | X | X | |||
| Anticuerpos monoclonales | ||||||
| Bevacizumab | X | X | X | X | ||
| Ramucirumab | X | X | X | |||
| Rituximab | X | X | X | |||
| Aflibercept | X | X | ||||
| Inhibidores de la tirosincinasa | ||||||
| Sorafenib/pazopanib/axitinib | X | X | X | |||
| Sunitinib | X | X | X | X | ||
| Regorafenib | X | X | ||||
| Cabozantinib/lenvatinib | X | X | ||||
| Vandetanib | X | |||||
| Nilotinib | X | X | X | X | ||
| Ponatinib | X | X | X | X | ||
| Interferón alfa | X | X | X | X | X | |
ACV: accidente cerebrovascular; IAM: infarto agudo de miocardio; mTOR: mammalian target of rapamycin.
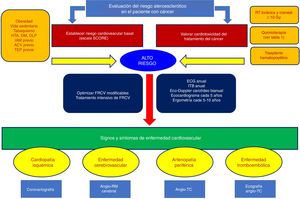
No existen recomendaciones firmes sobre la necesidad de realizar periódicamente pruebas para el diagnóstico de ateroesclerosis subclínica a estos pacientes, aunque hay varios documentos de consenso en diferentes sociedades científicas4,31,33, que se agrupan en la figura 3. Los pacientes que han recibido RT torácica, quimioterapia con fármacos de alto riesgo o trasplante de células hematopoyéticas deberían ser considerados en alto riesgo cardiovascular. Para estos pacientes, se debería recomendar hábitos de vida saludables y un control estricto de los factores de riesgo. No existe una recomendación para el empleo profiláctico de antiagregantes. Para pacientes con angina, se recomienda optimizar el tratamiento antianginoso y controlar los precipitantes, como la anemia. En caso de síntomas persistentes, son candidatos a test de detección de isquemia y eventual revascularización que permita tolerar la terapia, valorando riesgos y beneficios. Los protocolos de actuación en caso de SCA son similares que para los pacientes no oncológicos, individualizando la estrategia de revascularización y el régimen antitrombótico. Pese a ello, se suele tratar a los pacientes con cáncer y un IAM sin ceñirse a las recomendaciones científicas actuales, lo cual condiciona en parte un peor pronóstico en cuanto a mortalidad34. Según datos de la Clínica Mayo35, hasta 1 de cada 10 pacientes con IAM tiene antecedentes de cáncer, y estos pacientes tienen mayores tasas de mortalidad no cardiovascular, sin diferencias en las tasas de mortalidad cardiaca a corto y largo plazo cuando se los trata conforme a las recomendaciones de las guías de práctica clínica. Es importante tener en consideración que los pacientes con cáncer que presentan un SCA tienen un riesgo incrementado de eventos hemorrágicos36, tanto hospitalarios como en el seguimiento, por eso es muy importante para dichos pacientes conseguir un equilibrio meticuloso entre el riesgo isquémico y el riesgo hemorrágico a la hora de optimizar la medicación antiagregante37.
Algoritmo para la valoración de los riesgos ateroesclerótico y trombótico en pacientes con cáncer. ACV: accidente cerebrovascular; DLP: dislipemia; DM: diabetes mellitus; ECG: electrocardiograma; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; ITB: índice tobillo-brazo; RM: resonancia magnética; RT: radioterapia; TC: tomografía computarizada; TEP: tromboembolia pulmonar.
La incidencia de neoplasias en los pacientes con SCA se ha estudiado muy poco en series contemporáneas, pese a la gran evidencia que avala la existencia de una fisiopatología común. En un reciente estudio sobre una cohorte de pacientes con SCA, se demostró que la incidencia de neoplasias era del 3,1% (IC95%, 2,4-4,0) durante un seguimiento medio de 33 meses, y las localizaciones más frecuentes fueron colon, pulmón, vejiga y páncreas8. La mediana de tiempo hasta la aparición de nuevas neoplasias fue de 25,0 [intervalo intercuartílico, 12,0-56,0] meses y los factores que se asociaron con la aparición de cáncer fueron la edad (HR=1,03; IC95%, 1,01-1,06; p=0,01) y ser fumador o exfumador (HR=2,68; IC95%, 1,11-6,49; p=0,03)8. Destaca que los pacientes que contrajeron cualquier tipo de neoplasia durante el seguimiento tuvieron la mayor de mortalidad durante el seguimiento (64,2%), seguidos de los pacientes con neoplasias ya conocidas en el momento del SCA (40,0%); además, más de la mitad de los fallecimientos se atribuyeron directamente a las neoplasias. Sin embargo, los pacientes con neoplasias incidentes no tuvieron mayor mortalidad por causa cardiovascular, cosa que sí se observó en los pacientes con neoplasias presentes en el SCA, lo que los autores atribuyen a un tratamiento menos agresivo del SCA, como menor utilización de stents farmacoactivos o revascularización completa. Estos datos muestran el pronóstico claramente diferente y peor de los pacientes con SCA que ya tienen o contraen neoplasias, y revelan la necesidad de un seguimiento y un tratamiento muy específico para estos pacientes.
Diferentes estudios prospectivos y multicéntricos han puesto de manifiesto que la mortalidad a largo plazo de los pacientes con SCA o cardiopatía isquémica crónica por causas no cardiovasculares es superior a la de causas cardiovasculares8,34; sin embargo, el análisis específico del impacto de las neoplasias se ha analizado en pocas series. Por ejemplo, en el estudio SYNTAX18, realizado con pacientes con cardiopatía isquémica crónica estable, la mortalidad de causa no cardiovascular fue del 4,3% de los pacientes revascularizados por vía percutánea y el 5,3% de los tratados mediante cirugía, mientras que la mortalidad por cáncer fue del 2,2 y el 2,4% respectivamente18.
TRATAMIENTO ANTIAGREGANTE Y RIESGO DE CÁNCEREl efecto de los fármacos antiagregantes en el crecimiento tumoral, y sus implicaciones pronósticas en los pacientes con cáncer, aunque no es novedoso, se ha puesto de relevancia en la investigación científica en los últimos años. Algunos autores defienden una asociación causal, que resulta compleja y se atribuye a una acción directa de ciertos fármacos antitrombóticos en los procesos cancerígenos, inhibiendo el crecimiento tumoral y la diseminación metastásica. Sin embargo, la mayoría de los científicos abogan por una asociación casual, mediada por factores confusores, que se fundamenta en el lema de que el cáncer sigue al sangrado, lo cual da consistencia a la asociación indirecta entre la medicación antitrombótica y el cáncer. A continuación, se describe la evidencia existente sobre la asociación entre cáncer y los diferentes fármacos antiagregantes.
Ácido acetilsalicílicoHa mostrado un perfil antitumoral favorable cuando su uso se extiende a varios años. Esto es especialmente relevante para la prevención de los cánceres gastrointestinales, con algunas controversias sobre su beneficio en el cáncer vesical y de próstata38. Los mecanismos son muy diversos: la inhibición directa de la ciclooxigenasa-2, la prevención de la activación de agentes cancerígenos mediante la inhibición de la sulfatación por la P-fenolsulfotransferasa, la reducción del flujo a través de la ornitina descarboxilasa promoviendo la actividad antiproliferativa de las células tumorales colónicas, el bloqueo de la respuesta inflamatoria en la transcripción génica, la reducción de la apoptosis mediante la liberación de los citocromos mitocondriales o mediante la regulación positiva de marcadores apoptóticos (Bcl-2 y Bax) y la supresión de factor de crecimiento del endotelio vascular37.
ClopidogrelLa evidencia actual basada en ensayos clínicos y estudios observacionales no muestra ninguna asociación firme entre el clopidogrel y el riesgo de cáncer, si bien es cierto que existen muchos resultados contradictorios. Los estudios CAPRIE39 y CHARISMA40 mostraron que, a 30 meses, el clopidogrel frente a placebo (en adición al ácido acetilsalicílico) no se asoció con mayor riesgo de cáncer. Es cierto que en el estudio CURE41 clopidogrel numéricamente mostró el doble de cánceres colorrectales en comparación con placebo, aunque dicho hallazgo no se confirmó en el CAPRIE o el CHARISMA. También es cierto que el clopidogrel (frente a placebo) se asoció con un exceso de cáncer de pulmón en el CURE (12 frente a 7) y en el CREDO42 (5 frente a 0), pero no en el CAPRIE (72 frente a 74) o el CHARISMA (70 frente a 63). Frente a ello, en un potente estudio con 183.912 pacientes y más de 20.000 casos de cáncer, la combinación de clopidogrel con ácido acetilsalicílico se asoció incluso con menos cáncer que el ácido acetilsalicílico en monoterapia (HR=0,92; IC95%, 0,86-0,97)43. Recientemente, Kotronias et al.44 han publicado un metanálisis con 282.084 pacientes, y no encontraron asociación (ni positiva ni negativa) entre el clopidogrel y la aparición de cáncer. Esta controversia volvió a ponerse de manifiesto cuando se decidió prolongar la doble antiagregación más allá del primer año. Los resultados del estudio DAPT45 objetivaron un aumento significativo (el 0,62 frente al 0,28%; p=0,02) de las muertes por cáncer al prolongar la doble antiagregación con clopidogrel o prasugrel. Estos hallazgos concordaban con los datos del registro KOREA46, en el que prolongar la doble antiagregación 30 meses frente a 12 meses se asoció con un incremento significativo de la incidencia de cáncer (el 4,15 frente al 4,04%; HR=1,22; IC95%, 1,06-1,41; p=0,005). Sin embargo, estudios posteriores no han objetivado un mayor riesgo de cáncer con la prolongación de la doble antiagregación con clopidogrel más allá del primer año, como es el caso del metanálisis que han publicado recientemente Emariah et al.47, en el que la mortalidad por cáncer fue similar entre aquellos con doble antiagregación> 12 meses y aquellos a ≤ 12 meses (el 0,93 frente al 0,99%; p=0,59).
PrasugrelDiversos estudios en ratones han indicado una relación dependiente de la dosis entre el prasugrel y ciertos cánceres sólidos, como los intestinales, pulmonares y hepáticos37. En el estudio TRITON-TIMI 3848, hubo 174 cánceres en el grupo de prasugrel y 175 en el de clopidogrel. Tras excluir los cánceres de piel distintos del melanoma y los tumores cerebrales, se adjudicaron 92 nuevos cánceres sólidos en el grupo de prasugrel, en comparación con 64 en el grupo de clopidogrel; el riesgo relativo de estos cánceres sólidos fue 1,44 con prasugrel respecto a clopidogrel (p=0,024). Esa asociación de un mayor riesgo de cánceres con prasugrel en comparación con clopidogrel no se confirmó en el estudio TRILOGY-ACS49 (HR=1,04; IC95%, 0,77-1,42; p=0,79; mediana de exposición al tratamiento, 15 meses) ni en el metanálisis de Kotronias et al.44 (HR=1,10; IC95%, 0,89-1,37).
TicagrelorEn animales los datos son contradictorios, con estudios experimentales que muestran un potencial rol cancerígeno, mientras que otros muestran una función protectora contra la aparición de cáncer y su extensión37. En el PLATO50, no hubo diferencias en la tasa de nuevas neoplasias entre el ticagrelor y el clopidogrel (132 frente a 155; p=0,17), incluidas neoplasias malignas (115 frente a 121; p=0,69) y benignas (18 frente a 35; p=0,02). En contraste con el PLATO, en el PEGASUS51 sí hubo un número significativamente mayor de muertes por cáncer con el ticagrelor frente a placebo (odds ratio=1,46; IC95%, 1,02-2,06; p=0,034), si bien es cierto que no se aclaró si la mayor tasa de sangrado podría justificar dicha asociación. Un estudio reciente ha encontrado una asociación entre el ticagrelor y una menor tasa de diagnóstico de cáncer tras un SCA en comparación con el clopidogrel y el prasugrel52, aunque la naturaleza retrospectiva de dicho estudio no permite demostrar una relación causal entre los diferentes inhibidores del receptor plaquetario P2Y12 y la posterior aparición de cáncer.
VorapaxarNo existe evidencia sólida para la asociación entre el vorapaxar y el cáncer en estudios animales. En seres humanos, los datos del estudio TRACER53 mostraron 27 muertes por cáncer en el grupo de vorapaxar frente a 18 en el de placebo. Sin embargo, este exceso de cánceres sólidos con el vorapaxar frente a placebo en el TRACER (HR=1,4; IC95%, 1,1-1,8; p=0,012) no se confirmó en el otro estudio potente con vorapaxar, el TRA2P54, en el que no hubo diferencias en las tasas de cáncer entre vorapaxar y placebo.
De todo ello se puede concluir que, si bien es cierto que el uso prolongado de ácido acetilsalicílico puede reducir la incidencia de cáncer colorrectal, no se ha demostrado una asociación causal consistente entre los otros antiagregantes y un mayor o menor riesgo de cáncer. Son muchas las variables confusoras que afectan a la relación de riesgo entre el cáncer y el tratamiento antiagregante. Es muy probable que el mayor riesgo de sangrado asociado con una estrategia antitrombótica más agresiva (fármacos antiagregantes más potentes o mayor duración de la doble antiagregación) permita diagnosticar un mayor número de cánceres. Esto podría valorarse de forma positiva, tratando de realizar una búsqueda activa y sistemática de cáncer ante determinados tipos de sangrado en pacientes que reciban doble antiagregación, lo cual podría permitir un diagnóstico precoz de muchos de estos cánceres y, consecuentemente, un aumento de la posibilidad de supervivencia de estos pacientes.
CONCLUSIONESEn los países desarrollados, el cáncer y las ECV son las principales causas de muerte. Hasta 1 de cada 10 pacientes con cardiopatía isquémica tiene antecedente de cáncer, mientras que 1 de cada 30 pacientes con cardiopatía isquémica contrae un cáncer de novo. Ambas enfermedades comparten diferentes factores de riesgo, y la teoría inflamatoria es un mecanismo fisiopatológico común. Aunque el cáncer puede causar ateroesclerosis por diferentes mecanismos, los más frecuentes son los asociados con los fármacos antitumorales y la RT, que se asocian con un riesgo más que considerable de ECV y han llevado a una organización cooperativa entre cardiólogos y oncólogos para el seguimiento de los pacientes oncológicos. Pero además, ambas afecciones condicionan el pronóstico del paciente de manera bidireccional, de modo que las ECV son una de las principales causas de morbimortalidad de los pacientes con neoplasias malignas, mientras que el cáncer duplica el riesgo de mortalidad de los pacientes con ECV.
CONFLICTO DE INTERESESNo se declara ninguno.