Palabras clave
INTRODUCCIÓN
La miocardiopatía hipertrófica es una enfermedad genética que se transmite con herencia autosómica dominante1; la descendencia directa de los individuos afectados tiene un 50% de probabilidades de presentar la enfermedad. Afecta al sarcómero cardíaco y se caracteriza por la presencia de hipertrofia ventricular primaria, con variada expresión clínica y evolución2,3. Los estudios genéticos permitirían identificar a los individuos que tienen posibilidades de desarrollar la enfermedad y podrían ser útiles en la estratificación del riesgo de presentar eventos cardíacos adversos4, definiendo así a la población que requeriría diferentes tratamientos5-7.
En la población general su prevalencia es del 0,2% y es la causa más frecuente de síncope y/o muerte súbita de origen cardíaco en pacientes < 30 años, incluidos los deportistas. Su mortalidad anual es de 1%, pero puede llegar al 6% durante la niñez y la adolescencia; la muerte súbita puede ser el primer síntoma de la enfermedad8.
En general, el diagnóstico se realiza por el hallazgo de hipertrofia ventricular en el ecocardiograma, en ausencia de una enfermedad sistémica o cardíaca que la justifique. La hipertrofia miocárdica se desarrolla habitualmente durante la pubertad y es menos común que aparezca a mayor edad9. Además, la distinta expresión fenotípica de la enfermedad puede variar en el sitio y la magnitud de la hipertrofia, y en algunos portadores se observa una gran alteración miofibrilar con una mínima hipertrofia.
Cuando esta entidad se presenta con una hipertrofia ventricular importante, el diagnóstico es fácil de realizar, pero cuando el ecocardiograma y el Doppler mitral y tricuspídeo no muestran anormalidades, la presencia de disfunción diastólica en el Doppler pulsado tisular (DPT) podría preceder al fenotipo manifiesto de la enfermedad10.
El objetivo de este trabajo fue evaluar la función miocárdica regional, mediante DPT, en familiares de primer grado de pacientes con miocardiopatía hipertrófica familiar (MHF), para detectar anormalidades precoces.
PACIENTES Y MÉTODO
Población
En la consulta de miocardiopatía hipertrófica se realizó un cribado de los familiares de primer grado (padres, hermanos e hijos) de pacientes con miocardiopatía hipertrófica y se encontraron, entre marzo de 2002 y agosto de 2004, 18 familias con MHF, con al menos 2 familiares de primer grado afectados3 (fig. 1).
Fig. 1. Diagrama de flujo que representa la población estudiada. MH: miocardiopatía hipertrófica.
A todos ellos se les realizó exámenes clínicos y de laboratorio, electrocardiograma (ECG), radiografía de tórax, eco-Doppler cardíaco y DPT. Se estudió a 47 familiares de primer grado de estas familias, que constituyeron el grupo I, con una edad promedio de 18 ± 8 años (6 a 36 años) y 24 mujeres, y se los comparó con 47 sujetos voluntarios sanos (20 eran mujeres), que conformaron el grupo grupo II, con una edad promedio de 19 ± 6 años (6 a 35 años). Todos los sujetos estudiados estaban asintomáticos, no recibían medicación cardiovascular alguna, presentaban un examen físico normal y la batería de pruebas diagnósticas efectuadas fue normal.
Los familiares de primer grado (GI) fueron divididos en 2 subgrupos según presentasen o no anormalidades en la función diastólica regional.
Los criterios de exclusión para ambos grupos fueron: obesidad, realización de deportes competitivos, inadecuada ventana ultrasónica, edad > 36 años, enfermedades coexistentes que pudieran producir hipertrofia ventricular o anormalidades diastólicas (hipertensión arterial, hipertensión pulmonar, enfermedad coronaria, valvulopatía, miocardiopatía, pericardiopatía, cardiopatía congénita o enfermedad sistémica).
Grupo control
Estaba formado por 47 voluntarios sanos no entrenados, pertenecientes a familiares no consanguíneos (p. ej., cónyuge) de las familias estudiadas, que fueron citados con el fin de constituir el grupo control sano. Todos tenían un examen clínico, unas determinaciones de laboratorio, un ECG y un ecocardiograma normales.
Ecocardiograma
Con el fin de descartar la presencia de hipertrofia ventricular derecha e izquierda, se realizó un ecocardiograma bidimensional con un equipo Hewlett-Packard Sonos 1.000, con un transductor de 2,5 MHz. Se utilizaron las visiones de los ejes largo y corto paraesternal izquierdo, del tracto de entrada del ventrículo derecho (VD), 4 y 2 cámaras apical y 4 cámaras subcostal. Del eje menor paraesternal izquierdo se derivó el nivel 1 del ecocardiograma en modo M y a partir de éste se obtuvieron las dimensiones cavitarias (en diástole y en sístole), el espesor diastólico del septo y de la pared posterior del ventrículo izquierdo (VI) y la fracción de acortamiento, según las recomendaciones publicadas11.
Doppler pulsado del flujo sanguíneo
El Doppler pulsado del flujo sanguíneo se realizó inmediatamente después del ecocardiograma bidimensional, con un equipo ATL Ultramark 8, con un transductor de 2,5 MHz.
Para evaluar la función diastólica «global» de los ventrículos izquierdo y derecho se colocó el volumen de muestra del Doppler pulsado convencional en la punta de las válvulas mitral y tricuspídea, respectivamente, obteniéndose las curvas espectrales típicas del llenado ventricular izquierdo y derecho.
Se midieron las velocidades pico del llenado rápido (E) y de la contracción auricular (A) en cm/s. Se midió el tiempo de desaceleración del llenado rápido en milisegundos.
La disfunción diastólica «global» de los ventrículos izquierdo o derecho se definió como la presencia de cualquier anormalidad en el flujo mitral y tricuspídeo, respectivamente. Se consideraron 3 grados progresivos de disfunción diastólica, según la presencia de un patrón de relajación prolongada, seudonormal o restrictivo12.
Doppler pulsado tisular
El DPT se realizó con un equipo ATL Ultramark 8, con un transductor de 2,5 MHz.
Se alineó el cursor lo más paralelo posible al segmento miocárdico analizado y se optimizaron los controles13: se aumentó la muestra del Doppler a 10 mm, se disminuyó el límite de Nyquist colocándolo entre 20 y 30 cm/s y se utilizaron el menor filtro posible, la ganancia más baja, el rechazo más alto y la mayor velocidad de barrido (50 mm/s).
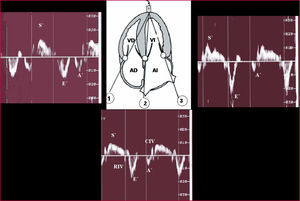
Para la cuantificación de la función sistólica y diastólica «regional» de ambos ventrículos se empleó la visión de 4 cámaras apical y se colocó la muestra Doppler en el segmento basal del septo interventricular y en las paredes laterales de ambos ventrículos (fig. 2).
Fig. 2. Doppler pulsado tisular: metodología. A': sístole auricular; E': llenado ventricular rápido; S': contracción sistólica; CIV: contracción isovolumétrica; RIV: relajación isovolumétrica; AD: aurícula derecha; AI: aurícula izquierda; VD: ventrículo derecho; VI: ventrículo izquierdo; 1: anillo tricuspídeo; 2: septo interventricular basal; 3: anillo mitral.
Se midieron las velocidades pico sistólica S', diastólica precoz E' y diastólica tardía A' en centímetros/segundo y los períodos de contracción (CIV) y relajación isovolumétricos (RIV) en segundos, los cuales fueron corregidos para la frecuencia cardíaca según la fórmula CIV/√(R - R) y RIV/√(R - R), respectivamente.
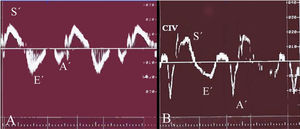
Se consideró que había un patrón de relajación normal tisular cuando la relación E'/A' fue > 1 y un patrón de relajación prolongada si la relación E'/A' era < 1 (fig. 3)14-16.
Fig. 3. Doppler pulsado tisular: definición de patrón de relajación ventricular normal y prolongada. A: Doppler pulsado tisular del ventrículo derecho normal; B: varón de 19 años sin hipertrofia ventricular proveniente de la familia 9, con 2 familiares de primer grado afectados de miocardiopatía hipertrófica, con un patrón de relajación prolongada en el ventrículo derecho. A': sístole auricular; E': llenado ventricular rápido; S': contracción sistólica; CIV: contracción isovolumétrica.
Para minimizar las variaciones de las mediciones con los ciclos respiratorios se tomaron los promedios de 3 latidos consecutivos.
Los estudios de los primeros 20 sujetos del grupo I fueron grabados en vídeo y analizados por el mismo observador en dos oportunidades, y por un tercer investigador de manera independiente para valorar las concordancias intraobservador e interobservador.
Análisis estadístico
Los datos cuantitativos fueron expresados como media ± desviación estándar. Para la medición del coeficiente de correlación intraclase se realizó un ANOVA para medidas repetidas y, previamente, las pruebas paramétricas necesarias de independencia, normalidad y homocedasticidad.
En 20 sujetos se midió la concordancia intraobservador para 2 mediciones y la concordancia interobservador a partir del promedio de las medidas intraobservador y una medición interobservador.
Para la comparación de los 3 grupos se realizó la prueba de ANOVA; previamente se realizaron también las pruebas paramétricas necesarias y a posteriori la prueba de comparación múltiple de Tukey.
Se consideraron estadísticamente significativos los valores de p < 0,05.
Estos análisis estadísticos fueron realizados con el software Paquete Estadístico para Ciencias Sociales (SPSS Inc., versión 11.01) para Windows.
RESULTADOS
En las 18 familias con MHF se encontraron todas las variantes morfológicas de distribución de la hipertrofia (tabla 1).
Las características ecocardiográficas de los sujetos estudiados se muestran en la tabla 2.
No se observaron diferencias estadísticamente significativas en el tamaño auricular izquierdo ni en los espesores del ventrículo izquierdo entre los 2 grupos.
Todos los sujetos del grupo control (GII) presentaron en el Doppler pulsado tisular un patrón de relajación ventricular «regional» normal (fig. 3A). Sin embargo, en el grupo de familiares de primer grado de pacientes con MHF (GI) se observó que 10 de los 47 sujetos (21,3%) presentaban en el VD un registro Doppler de disfunción diastólica regional caracterizado por un patrón de relajación prolongada (fig. 3B). Dos de estos sujetos (4,3%) mostraban, además, hallazgos similares en el septo interventricular.
Sobre la base de estos hallazgos, el grupo de estudio se dividió en dos subgrupos: GIa, con sujetos con patrón de relajación normal en el DPT de la pared lateral del VD y, por tanto, función diastólica normal, y GIb, con sujetos con patrón de relajación prolongada en la pared lateral del VD, es decir, con disfunción diastólica «regional». Para el análisis posterior se constituyeron 3 grupos (tablas 3 y 4): GIa (familiares de primer grado con relajación normal), GIb (familiares de primer grado con relajación prolongada) y GII (control).
Los hallazgos ecocardiográficos de los 3 subgrupos de estudio se muestran en la tabla 3. Cabe destacar que en el GIb los diámetros diastólicos y sistólicos del VI fueron normales, aunque menores que en el grupo GII (p < 0,001). También presentaron una fracción de acortamiento mayor (p < 0,007). Por otro lado, en todos los grupos, la función diastólica «global» de ambos ventrículos fue normal, pero en el GIb se observó una mayor velocidad pico A mitral (59 ± 13 cm/s; p < 0,001) y tricuspídea (44 ± 7 cm/s; p < 0,001), con una menor relación E/A en los ventrículos izquierdo (1,43 ± 0,4; p < 0,001) y derecho (1,20 ± 0,2; p < 0,07).
Los hallazgos del Doppler pulsado tisular de los 3 grupos de estudio se muestran en la tabla 4. No hubo diferencias estadísticamente significativas entre el GIa y el GII. Sin embargo, el GIb presentó alteraciones en la funci&oacu te;n miocárdica regional, con una mayor cantidad de parámetros afectados significativamente en el VD y menos en el septo interventricular y en la pared lateral del VI:
1. En la pared lateral del VD el GIb presentó una prolongación de la relajación isovolumétrica corregida (37,5 ± 25) frente al GII (19,9 ± 23; p < 0,01) o al GIa (23,7 ± 28; p < 0,03), un aumento de la velocidad pico A' (17,8 ± 3 cm/s) frente al GII (9,3 ± 2,6 cm/s; p < 0,001) o al GIa (9,4 ± 1,9 cm/s; p < 0,001) y una disminución de la velocidad pico E' (12,4 ± 2,5 cm/s) frente al GII (16,7 ± 3,6 cm/s; p < 0,001) o al GIa (16,4 ± 3,1 cm/s; p < 0,003). La velocidad S' y la contracción isovolumétrica corregida no presentaron variaciones significativas.
2. En el septo interventricular el GIb tuvo un aumento de la velocidad pico A' (8,5 ± 2,4 cm/s) frente al GII (7,2 ± 1,4 cm/s; p < 0,02) o al GIa (6,8 ± 1,3; p < 0,006), con una reducción de la relación E'/A' (1,57 ± 0,49) frente al GII (2,03 ± 0,53; p < 0,01) o al GIa (2,07 ± 0,41; p < 0,01). La velocidad pico S' estaba disminuida (9,9 ± 1,5 cm/s) frente al GII (12,4 ± 1,03 cm/s; p < 0,05). La velocidad pico E' y los tiempos de contracción y relajación isovolumétricos corregidos no presentaron variaciones significativas.
3. En la pared lateral de VI, el GIb sólo presentó un aumento de la velocidad pico A' (10,8 ± 2,7 cm/s) frente al GII (7,6 ± 1,9 cm/s; p < 0,0001) o al GIa (8,4 ± 1,9; p < 0,004).
Concordancia intraobservador e interobservador de las mediciones del Doppler pulsado tisular
La concordancia intraobservador medida por el coeficiente de correlación intraclase varió entre 0,995 para las velocidades de ambos ventrículos y 0,882 para los tiempos. La concordancia interobservador varió entre 0,993 para las velocidades y 0,832 para los tiempos.
DISCUSIÓN
Nuestro estudio demuestra por primera vez que entre los familiares de primer grado de pacientes con MHF, el DPT pone de manifiesto la presencia de un subgrupo (21,3%) que no tiene expresión fenotípica de la enfermedad, pero presenta anormalidades en la función diastólica regional del VD que podrían ser un signo precoz de la enfermedad.
Datos experimentales recientes17-19 han sugerido que el DPT del VI de familiares jóvenes de pacientes con MHF podría ser útil para el diagnóstico preclínico de la enfermedad. Las velocidades miocárdicas regionales (sistólicas y diastólicas) son anormalmente bajas en pacientes con mutaciones genéticas (genotipo positivo), antes de que se produzca el desarrollo de la hipertrofia ventricular izquierda (fenotipo positivo). Sin embargo, hasta ahora no se había evaluado la función miocárdica regional del VD en estos pacientes.
En el presente estudio, 10 de 47 familiares de primer grado de pacientes con MHF (21,3%) tuvieron alteraciones de la relajación ventricular derecha regional no acordes con la edad, que podrían ser un marcador temprano del compromiso miocárdico. Esta disfunción diastólica regional del VD se caracterizó por una disminución de la velocidad pico E' y de la relación E'/A', con aumento de la velocidad pico A y de la relajación isovolumétrica (RIV) corregida. Además, 2 de ellos tenían un patrón de relajación prolongada en el DTI del septo interventricular. El ecocardiograma y el Doppler pulsado del flujo mitral fueron normales, pero con menores diámetros cavitarios y mayor contractilidad ventricular.
Estos cambios precoces en familiares de pacientes con miocardiopatía hipertrófica en ausencia de hipertrofia ventricular podrían atribuirse a la particular disposición de las fibras longitudinales del VD y a su baja poscarga, que lo harían más sensible que el VI. Las fibras longitudinales se hallan en el subendocardio y subepicardio del VD, en tanto que el mesocardio posee fibras circunferenciales. Las primeras pueden evaluarse desde las visiones apicales con DPT y las segundas, en las visiones paraesternales con la fracción de acortamiento.
Tabata et al20 han observado que los pacientes con miocardiopatía hipertrófica desarrollan inicialmente un deterioro en el movimiento de las fibras longitudinales, que son más vulnerables a los cambios patológicos, con un aumento compensador de la función de las fibras circunferenciales. Esto puede explicar nuestros hallazgos, con disfunción diastólica regional en el eje longitudinal del VD con función contráctil conservada.
Varios autores demostraron que la miocardiopatía hipertrófica afecta mucho más frecuentemente al VD de lo que se informa en la práctica diaria21,22, encontrándose que entre el 44 y el 62% de los que tienen hipertrofia izquierda también tiene hipertrofia del VD.
El DPT es una herramienta particularmente útil para evaluar estas alteraciones, ya que permite analizar la función diastólica regional del VD13 y detectar alteraciones antes del desarrollo de hipertrofia ventricular. Los parámetros más utilizados son la RIV (que refleja la relajación activa con consumo de energía) y la relación E'/A'. La relación E'/A' < 1 del DPT es un indicador de anormalidad diastólica superior a la relación E/A del flujo tricuspídeo porque no está influida por la precarga23.
La relajación activa del VD es corta o está ausente en pacientes normales. Se ha informado24 que el VD se diferencia del VI porque comienza su llenado diastólico sin intervalo isovolumétrico debido a que trabaja contra una poscarga baja. La RIV se prolonga en todas las enfermedades que comprometen al VD, por aumento de la poscarga o por la presencia de disfunción miocárdica intrínseca25,26. En nuestro estudio se comprobó una prolongación significativa de la RIV del VD en el grupo Ib que podría ser un marcador precoz de daño miocárdico regional.
El DPT en jóvenes sanos muestra mayores velocidades miocárdicas regionales en el VD que en el VI. El deterioro fisiológico de la función diastólica relacionado con la edad y el aumento de la función auricular parece ser un mecanismo común en ambos ventrículos. Analizamos varios estudios22-30 que evaluaron mediante DPT distintos grupos etarios de sujetos sanos, y observamos que en el VD hay una disminución progresiva de la velocidad diastólica precoz E' con un aumento compensador de la función auricular a partir de los 36 años y aproximadamente una década después en el VI, lo que pone de manifiesto que las alteraciones de la relajación ventricular aparecen de manera más precoz en el VD que en el VI. En la conformación de los grupos de este estudio se decidió poner como edad máxima 36 años, ya que hay varias evidencias14,31 que muestran que los sujetos sanos pueden presentar alteraciones de la relajación ventricular derecha a partir de esa edad, como un fenómeno fisiológico.
Aunque el estudio genético representa una prueba de gran valor para la identificación de los pacientes con riesgo de desarrollar una miocardiopatía hipertrófica, su utilidad clínica está limitada por una penetrancia y una expresividad variables, por la baja frecuencia de cada mutación, por efecto de factores no genéticos4 y por las dificultades técnicas y económicas que aún hay para la tipificación genética de la miocardiopatía hipertrófica. Así, el DPT podría utilizarse para mejorar la identificación de los portadores silentes, sobre todo cuando hubiera una historia familiar de la enfermedad.
Por otra parte, varios autores32-37 han demostrado la utilidad del DPT en la evaluación de las funciones sistólica y diastólica en muchas situaciones clínicas, por lo que creemos que podría ser de gran ayuda para complementar el estudio genético y en el cribado ecocardiográfico de los familiares de pacientes con MH9,38, ya que permitiría la identificación precoz de los pacientes que desarrollarían la enfermedad. Así, se podrían implementar medidas preventivas para evitar la aparición de síntomas que puedan comprometer la vida del paciente39.
La relevancia clínica de estos hallazgos es aún incierta, ya que se desconoce si este subgrupo de pacientes tiene mayor riesgo de muerte súbita. Sin embargo, hay datos que sugieren que los familiares de los pacientes con MHF en los que se detectan anormalidades en el DPT tienen mayor riesgo de desarrollar una miocardiopatía hipertrófica manifiesta39.
Limitaciones del estudio
La presente investigación se desarrolló en sujetos jóvenes, menores de 36 años, sin enfermedades concomitantes. Como las velocidades del DPT disminuyen con la edad, la utilidad de esta técnica podría estar limitada en sujetos mayores, por lo que en un estudio posterior debería completarse con la inclusión de una población de mayor edad y con cardiopatías asociadas (hipertensión, enfermedad coronaria, valvulopatías o pericardiopatías), para saber si la edad es realmente una limitación.
Otra limitación es la ausencia de seguimiento clínico. Éste es un estudio preliminar que está siendo complementado con un seguimiento a largo plazo para saber si los sujetos con anormalidades diastólicas precoces en el VD desarrollan hipertrofia ventricular en la evolución.
Pese al pequeño número de pacientes estudiados, el interés del trabajo radica en la posibilidad de encontrar nuevas herramientas que permitan el diagnóstico precoz de la miocardiopatía hipertrófica.
CONCLUSIONES
En familiares de primer grado de pacientes con MHF, el DPT de la pared libre del VD es un método simple e incruento que permite identificar a un subgrupo de sujetos con alteración precoz de la función diastólica regional, lo cual podría ser un marcador preclínico de la enfermedad, y podría permitir en el futuro implementar medidas preventivas dirigidas a evitar el desarrollo de la enfermedad o sus síntomas.
Correspondencia: Dra. M.C. Saccheri.
Consultorio de Miocardiopatías Hipertróficas. División Cardiología.
Hospital del GCBA Dr. Cosme Argerich.
Raúl Scalabrini Ortiz, 3305, 14.° A. C1425DCB Ciudad Autónoma
de Buenos Aires. Argentina.
Correo electrónico: mcsaccheri@fibertel.com.ar
Recibido el 21 de diciembre de 2004.
Aceptado para su publicación el 18 de octubre de 2005.