Palabras clave
INTRODUCCIÓN
La enfermedad de Chagas o tripanosomiasis americana1 es un grave problema de salud pública en América Latina. Se estima en 20 millones el número de personas infectadas con Tripanosoma Cruzi, agente causal de la dolencia, y en 90 millones las personas expuestas al riesgo de infección2. Al concluir en 1983 un estudio epidemiológico longitudinal en pacientes Chagásicos3,4 evaluados cada 3 años, la afección cardíaca miocarditis chagásica crónica (MCHC) aumentó desde un 17% al inicio del estudio hasta un 49,4% al cabo de 15 años. Esto nos ha llevado a plantear la necesidad de desarrollar nuevos procedimientos que permitan establecer marcadores precoces en pacientes con infección (reacción inmunológica de Machado Guerreiro positiva), pero sin ninguna evidencia de MCHC demostrable con los procedimientos no invasivos habituales. Un logro de estas características permitiría realizar intervenciones de prevención y/o terapéuticas muy tempranas que evitarían la aparición de MCHC con su característico cuadro patológico5-7 y su grave evolución que lleva a la incapacidad y/o muerte en aproximadamente 20 años, sobre todo muerte por arritmia cardíaca.
En este contexto, nosotros evaluamos a un grupo de pacientes con infección chagásica y sin evidencia de MCHC y un grupo control de sujetos sanos con métodos no invasivos y estudios de la variabilidad de la frecuencia cardíaca (VFC). En una segunda etapa aplicamos una técnica de modelado no lineal a los registros electrocardiográficos de un subgrupo de 10 sujetos sanos, 10 pacientes con infección chagásica sin MCHC y 10 pacientes con infección chagásica y alteraciones electrocardiográficas mínimas o moderadas: bloqueo auriculoventricular de primer grado (BAV), bradicardia sinusal (BS) y/o bloqueo de rama derecha del haz de His (BRDHH), hemibloqueo anterior izquierdo (HAI), o ambos, basados en la premisa de que la teoría de los sistemas no lineales ha sido usada recientemente para caracterizar la dinámica del ritmo cardíaco8-11.
PACIENTES Y MÉTODO
Pacientes
Se evaluaron 2 grupos de pacientes y un grupo de sujetos controles sanos. A todos los pacientes y los controles sanos se les practicó examen clínico, electrocardiograma estándar de 12 derivaciones, registro ambulatorio de electrocardiografía dinámica de 24 h (Holter) para lo cual se usaron grabadoras de cintas magnéticas marca Rozzin modelo 151 y un procesador Rozzin electronics 718. Los datos fueron transferidos a un microcomputador y debidamente digitalizados para su análisis. También se practicó a los pacientes electrocardiograma de señales promediadas, estudio radiológico de tórax, prueba de esfuerzo en banda, protocolo de Bruce, ecocardiograma modo M y bidimensional, exámenes de laboratorio de rutina y estudios de VFC (dominio temporal y espectral). Para el estudio de VFC se utilizaron los datos digitalizados obtenidos del registro de Holter. La densidad del poder espectral fue calculada mediante el uso de un algoritmo de la transformada de Fourier que produjo una banda espectral desde 0,01 hasta 1,0 Hz de frecuencia. El poder de baja frecuencia (0,04-0,15 Hz) y de alta frecuencia (0,15-0,5 Hz) fueron calculados y la relación baja frecuencia/alta frecuencia fue usada en el análisis; se utilizaron unidades normalizadas. El análisis del dominio temporal de VFC incluyó SDNN, pNN50 y rmssd como ha sido definido en el Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology12 y la Sociedad Española de Cardiología13. Los grupos fueron divididos en: grupo CH1, constituido por 32 pacientes con infección chagásica sin evidencia de MCHC (electrocardiograma, radiografía de tórax, ecocardiograma modo M y bidimensional, prueba de esfuerzo y electrocardiograma de señales promediadas normales); grupo CH2 formado por 10 pacientes con infección chagásica y alteraciones electrocardiográficas mínimas o moderadas: BAV, BS, y/o BRDHH, HAI o ambos, y el grupo control, en el que fueron incluidos 30 sujetos voluntarios sanos y el cual se usó como grupo de comparación. Los sujetos del grupo control y del CH1 no tuvieron ninguna alteración en el electrocardiograma.
Primera fase
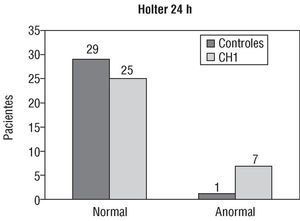
La comparación de los resultados entre los grupos CH1 y control constituyó la primera fase del estudio y se presenta en la tabla 1 y en la figura 1.
Fig. 1. Comparación entre el resultado del estudio de electrocardiografía dinámica de 24 h en 30 sujetos del grupo control frente a 32 pacientes
Segunda fase
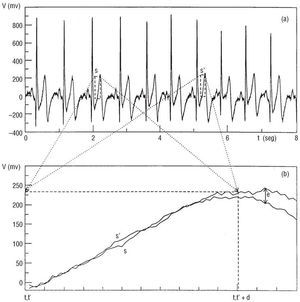
Como medida alternativa de la variabilidad en la actividad cardíaca evaluamos cuantitativamente el grado de similitud existente entre segmentos del ECG que suceden a continuación de segmentos muy parecidos. La idea básica está representada en la figura 2.
Fig. 2. A: ejemplo de dos segmentos electrocardiográficos parecidos (s y s') que comienzan en los instantes t y t', respectivamente. B: la diferencia (e) entre la señal que sigue a estos dos segmentos aumenta en el tiempo
A modo de ejemplo, en la figura 2 (a) se observan 2 segmentos de igual tamaño (d) de la señal de voltaje que son parecidos: s y s', que comienzan, respectivamente, a partir de los instantes t y t'. Como se indica en la ampliación de la figura 2 (b), la diferencia entre la señal que sigue a estos dos segmentos (e) tiende a aumentar con el tiempo, y sobre estas diferencias realizamos nuestro estudio cuantitativo.
A continuación ofrecemos una descripción detallada del procedimiento seguido:
Todas las señales electrocardiográficas fueron registradas a 625 Hz con una resolución de 12 bits. De esta manera, cada registro consiste en una serie de tiempo:
V (0), V (τ), V (2τ), V (3τ),..., V (t),...
en donde t = nτ (n = 0, 1, 2, 3,...) y τ = (1/625) segundos.
Para cada una de estas series construimos entonces todos los posibles segmentos de datos consecutivos:
S0 = (V (0), V (τ),..., V ((d - 1) τ)),
S1 = (V (τ), V (2τ),..., V (dτ))
:
Sp = (V (pτ), V ((p + 1) τ),..., V ((p + d - 1) τ))
:
y para cada uno de estos segmentos buscamos uno que sea muy parecido. Específicamente, el proceso de búsqueda lo llevamos a cabo mediante un ajuste de mínimos cuadrados, lo que significa que, para un segmento dado, digamos el segmento:
Sp = {V (pτ), V [(p + 1) τ],..., V [(p+ d - 1) τ]},
el más parecido será un segmento
Sq = {V (qτ), V [(q + 1) τ],_, V [(q +d - 1) τ]},
tal que:
{[V (pτ) - V (qτ)]2 + [V ((p+1) τ - V ((q+1) τ)]2 + ... + [V ((p+d-1) τ] - V ((q+d - 1) τ)]2}1/2
tome su mínimo valor. Una vez efectuado este proceso de búsqueda, pasamos entonces a evaluar las diferencias existentes entre los datos que suceden a continuación de segmentos parecidos en el ECG. Para fijar ideas, notemos que los datos que suceden a continuación del segmento genérico sp son:
V ((p + d) τ), V ( (p + d + 1) τ), ...
mientras que los que ocurren a continuación de su par más parecido, sq, son:
V ((q + d) τ), V ((q + d + 1) τ), ...
de manera que las diferencias buscadas vendrán dadas por:
e1 (p) = V [(p + d) τ] - V [(q + d) τ], e2 (p) = V [(p + d +1) τ] - V [(q + d + 1) τ], ...
Como primer aspecto, nos limitamos a considerar solamente las diferencias un paso delante, es decir, las e1 (p), y calculamos la raíz cuadrática media de éstas, normalizada por la desviación estándar de los datos:
E1 (d) = 1/σ (Σ e12 (p)) 1/2; σ2 = Σ (V (nτ) - VM)2
p=0n = 0
en donde, VM, es el valor medio de los datos.
Es importante resaltar el hecho de que el valor de E1 (d) dependerá, en general, del tamaño de los segmentos considerados, es decir de d. Esto, claro está, conduce al problema de establecer un criterio para definir un tamaño adecuado de los segmentos. En otras palabras, ¿comparamos lo que sucede a continuación de 2 segmentos parecidos, cada uno de ellos formado por 100 datos consecutivos, o de 50 datos, o de sólo diez?
Establecer un criterio a priori acerca del tamaño de los segmentos es un punto que consideramos delicado; entre otras razones, porque mientras mayor sea este tamaño, cada segmento tiende a contener más información que es propia del mismo y es cada vez más difícil, para valores grandes de d, conseguir dos segmentos muy parecidos en un registro dado. En el otro extremo, para valores muy pequeños de d, si bien es relativamente fácil conseguir pares de segmentos que son casi idénticos en un mismo registro, podría argumentarse que por la poca información que éstos contienen, la variación en lo que sucede a continuación de estos no tiene un significado claro.
En vista de todo esto, nuestra posición en el presente estudio fue la que podríamos calificar como de «dejar que los datos hablen» y, en lugar de fijar a priori el tamaño de los segmentos, evaluamos, para cada registro, los valores del índice E1 (d) correspondientes a un rango de valores de d, comenzando desde d = 1 y llegando hasta d = 50, a fin de determinar el valor característico de d = dc al cual el índice E1 (dc) toma su valor mínimo.
De esta manera, cada registro queda parcialmente caracterizado por dos índices: dc y E1 (dc), que son una medida cuantitativa de la variabilidad en la actividad cardíaca. En efecto, valores pequeños de E1 (dc) ocurren sólo si en promedio, el valor cuadrático de las diferencias encontradas es pequeño en comparación a la desviación estándar, o dicho de otra manera, cuando los valores del voltaje, observados a continuación de segmentos parecidos, son también parecidos. Por el contrario, valores grandes de E1 (dc) corresponden a una situación que, en cierto sentido, podríamos calificar como de mayor variabilidad en la actividad cardíaca, en la cual, después de dos segmentos parecidos en la curva de voltaje suelen presentarse diferencias significativas en los valores observados de éste.
Finalmente, como quiera que E1 (dc) cuantifica solamente las diferencias un paso adelante, mas no la velocidad con la que éstas aumentan, con la idea de tener una estimación rudimentaria de esta velocidad, para cada registro analizado procedimos a evaluar las diferencias dos pasos adelante, es decir, las e2 (p), a partir de las cuales calculamos la raíz cuadrática media normalizada por la desviación estándar de los datos:
E2 (dc) = 1/σ(σ e22 (p))1/2; σ2 = Σ (V (nτ) VM)2
p = 0 n = 0
y, como estimador de la velocidad exponencial de crecimiento, evaluamos el índice:
K = ln | E2 (dc) / E1 (dc)
Estos tres índices: dc, E1 (dc) y K, fueron evaluados para cada uno de los registros obtenidos en 10 pacientes del grupo CH1 seleccionados al azar, 10 sujetos control seleccionados al azar y 10 pacientes del grupo CH2 seleccionados también al azar.
En un ambiente tranquilo, a temperatura estable y después de un período de estabilización de 15 min en reposo supino, para cada uno de los casos se realizó un registro electrocardiográfico continuo de 30 min en posición supina, seguido de un registro similar en bipedestación. Todos los registros fueron obtenidos los mismos días de la semana e iniciados, aproximadamente, a la misma hora: viernes, 09:30 h. Todos los pacientes fueron de la consulta externa y debidamente informados del procedimiento, el cual aceptaron de manera voluntaria.
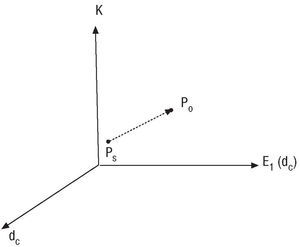
El procedimiento descrito fue aplicado sobre todos los registros generados con lo que, por cada caso, obtuvimos dos conjuntos de índices: uno correspondiente a la posición supina y el otro a la posición ortostática. Desde un punto de vista geométrico, en el espacio tridimensional generado por los ejes (dc, E1 (dc) y K), por cada caso registrado tendremos un punto inicial, Ps = (dcs,E1s (dcs), Ks) que corresponde a la posición supina y que se mueve hasta el punto final Po = (dco, E1o (dco), Ko) (fig. 3).
Fig. 3. Representación geométrica en el espacio tri dimensional generado con los 3 ejes (dc, E1 [dc], K). Nótese como el punto Ps (posición supina) se mueve hasta el punto final Po (posición ortostática); dc, E1 (dc) y K son dimensión mínima de empotramiento, error de predicción y entropía, respectivamente (véase texto para mayores detalles).
Sobre esos conjuntos de puntos efectuamos un análisis discriminante con el objeto de poder identificar regiones que contengan un porcentaje importante de puntos provenientes de sujetos controles sanos y que, además, contengan un porcentaje pequeño de pacientes del grupo CH2. El mismo análisis se aplicó a los pacientes del grupo CH1.
Análisis estadístico
En la primera fase se utilizaron los valores de promedio y desviación estándar en el análisis estadístico de los datos demográficos. En la comparación de los resultados del grupo control frente a los del CH1 se utilizó la prueba de la χ2, el test de la t de Student no pareada de una cola y la prueba exacta de Fisher de una sola cola, de acuerdo con los datos. Se consideró como significativo un valor de p < 0,05. En la segunda fase del protocolo se usó el test de la t de Student de una cola para el análisis de VFC y se determinaron la sensibilidad y especificidad en el caso de los resultados provenientes de aplicar técnicas de modelado no lineal.
RESULTADOS
Primera fase
En la tabla 1 se expone la comparación de los resultados de los datos demográficos y las exploraciones entre el grupo control y CH1. Como se puede apreciar, los grupos fueron comparables respecto a su edad y sexo. También se puede apreciar que, en los exámenes practicados, las únicas diferencias estadísticamente significativas fueron las relativas al estudio de Holter (fig. 1), pruebas de laboratorio y VFC. En el estudio de Holter, 7 pacientes del grupo CH1 presentaron anormalidades: en cinco se apreciaron salvas de taquicardia auricular no sostenida de 5-9 complejos y 2 pacientes presentaron arritmia ventricular grado II de la clasificación de Lown-Wolff, mientras un único enfermo del grupo control presentó arritmia de grado 1 de Lown-Wolff (p < 0,05). Con respecto a las pruebas de laboratorio, la única diferencia significativa se debió a la presencia de hipertrigliceridemia moderada en 8 casos del grupo CH1 frente a 2 casos del grupo control (p < 0,05). Las diferencias de VFC fueron más pronunciadas (p < 0,05) y se circunscribieron a parámetros relacionados con la actividad vagal (rmssd y PNN50); SDNN no fue estadísticamente diferente al comparar los dos grupos (p < 0,5), lo mismo que la relación baja frecuencia/alta frecuencia (p < 0,2).
Segunda fase
En la tabla 2 se exponen los datos demográficos de los 10 pacientes de los grupos control, CH1 y CH2. Como se puede apreciar, los grupos son bien compa rables en sexo y edad. Los trastornos electrocardio gráficos de los 10 pacientes del grupo CH2 se distri buyeron así: 3 pacientes presentaron BS, 3 pacientes HAI, uno BRDHH, uno BS + BRDHH, uno BAV y uno BRDHH+HAI. La VFC en estos 3 grupos de pacientes sólo se diferenció en el comportamiento de la relación baja frecuencia/alta frecuencia con los cambios de posición supina a ortostática. Así, el delta del incremento de baja frecuencia/alta frecuencia en el grupo control fue estadísticamente diferente en la posición de pie con respecto a supina (p < 0,01), mientras en el grupo CH1 y CH2 no lo fue (p < 0,08 y 0,19, re s pectivamente).
Técnicas de modelado no lineal
Los resultados de la aplicación de los índices descritos y definidos en el apartado Pacientes y métodos (segunda fase), así como de las regiones determinadas por el análisis discriminante nos dieron los siguientes resultados:
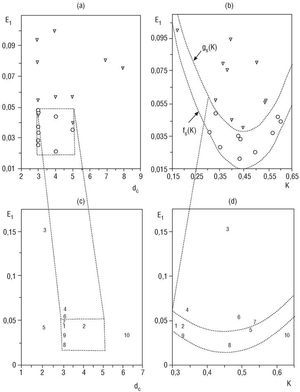
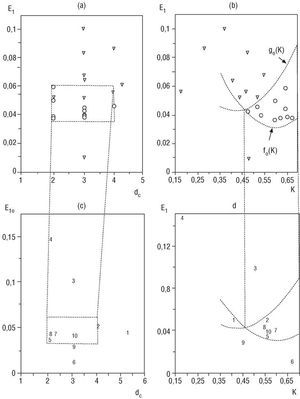
En el reposo supino las proyecciones en el plano (dc, E1) de los puntos de los sujetos controles se ubicaron, todos, en la caja definida por 3 <= dc <= 5, 0,015 <= E1 <= 0,05 (fig. 4a). Por el contrario, sólo dos proyecciones de pacientes CH2 se ubicaron dentro de la caja (sensibilidad 80% y especificidad 100%). En el plano (K,E1) todos los puntos de los sujetos controles están en la región definida por: fs (K) <= E1 <= gs (K) (fig. 4b), donde fs (K) = 0,015 + (x - 0,45)2 y gs (K) = 0,038 + (x 0,45)2. Otra vez sólo un punto de los pacientes del grupo CH2 está proyectado sobre esta región (sensibilidad 90% y especificidad 100%). En el caso del plano (K, dc) no pudimos encontrar regiones discriminantes significativas. En la figura 4c y d se presenta la posición de los puntos en los planos ortogonales correspondientes a los pacientes del grupo CH1 (numerados) en las regiones definidas anteriormente. Como se puede apreciar, las proyecciones correspondientes a los pacientes numerados 3, 4, 6 y 10 están fuera de ambas regiones, mientras los pacientes 5 y 7 tienen, al menos, una proyección dentro. El resto de los pacientes de este grupo CH1 tienen sus proyecciones dentro de ambas regiones. Un análisis similar, pero en bipedestación, se expone en la figura 5. Como se puede apreciar, todos los puntos de los sujetos del grupo control se proyectaron dentro de la caja definida por 2 <= dc <= 4, 0,034 <= E1 <= 0,06 en el plano (dc, E1), mientras sólo 3 proyecciones del grupo CH2 están incluidas (sensibilidad 70% y especificidad 100%). Así mismo, todos los puntos de los sujetos controles están proyectados dentro de la región definida por:
fo (K) <= E1 <= go (K) en el plano (K, E1), donde fo = 0,032 + 0,6 (x-0,6)2 y go = 0,043 + 0,6. (x-0,42)2, mientras todas las proyecciones de los pacientes del grupo CH2 están fuera (sensibilidad 100% y especificidad 100%). Tampoco encontramos en esta oportunidad regiones discriminantes en el plano (k, dc). Hay que hacer notar (figs. 5c y d) que los pacientes del grupo CH1 numerados como 1, 3, 4, 6 y 9 están fuera de estas dos regiones, mientras el resto de los pacientes del grupo CH1 tienen sus proyecciones dentro de ambas regiones. El resultado del análisis del comportamiento de los pacientes del grupo CH1 nos permitió distinguir cuatro diferentes subgrupos (figs. 4 y 5), a saber: subgrupo CH1-A que incluyó a los pacientes numerados 3, 4 y 6, con todas sus proyecciones fuera de las regiones discriminantes correspondientes. Subgrupo CH1-B constituido por los pacientes 1, 9 y 10, con dos proyecciones dentro y dos fuera, subgrupo CH1-C, pacientes 5 y 7 con tres proyecciones dentro y una fuera, subgrupo CH1-D integrado por los pacientes 2 y 8 con todas sus proyecciones dentro de las regiones de significación discriminante.
Además de estos resultados, es digno de mencionar que nosotros observamos, en promedio, una disminuida respuesta simpática en los pacientes chagásicos durante los cambios de la posición supina a la bipedestación. Así, tenemos que los valores promedio de los errores en cada grupo fueron: (E1s) control = 0,0356, (E1s) CH1 = 0,0535, y (E1s) CH2 = 0,0682, en posición supina y: (E1o) control = 0,04345, (E1o) CH1 = 0,0547, y (E1o) CH2 = 0,0626, en posición ortostática. Esto nos permitió calcular el incremento relativo del error definido por:
e = (E1o) - (E1s) /(E1s)
lo cual dio los siguientes valores: econtrol = 0,22, eCH1 = 0,024, y eCH2 = 0,08 para cada grupo respectivamente.
En la misma forma el incremento relativo de los valores promedio de la entropía, definidos por:
k = (Ko) - (Ks) /(Ks)
Obtuvimos los siguientes valores: kcontrol = 0,31, kCH1 = 0,14, y kCH2 = 0,012.
DISCUSIÓN
Demografía, VFC y modelado no lineal
Este estudio fue diseñado con el propósito de establecer marcadores precoces en pacientes seropositivos para enfermedad de Chagas, pero sin ninguna evidencia de cardiopatía. Los datos demográficos de nuestras poblaciones estudiadas: controles sanos y pacientes evidenciaron poblaciones muy semejantes respecto a la edad y sexo de los grupos estudiados. Los resultados demostraron que, si bien la VFC estableció cierta diferencia en la primera fase del estudio, no fue sólida cuando se redujo el tamaño de la muestra en la se gunda fase. En esta segunda fase sólo el cambio de la relación baja frecuencia/alta frecuencia al pasar de la posición supina a la bipedestación pudo separar significativamente al grupo de controles sanos (p < 0,01) y a los pacientes CH1 y CH2 (p < 0,08 y 0,19, respectivamente). Sin embargo, la aplicación de técnicas de modelado no lineal nos permitió establecer regiones significativamente discriminantes en los planos ortogonales construidos con los valores de los índices definidos (dc, E1 [dc] y K). Estos resultados marcaron una notable diferencia con una especificidad del 100% y una sensibilidad del 70%. La sensibilidad se pudo mejorar a 100% (figs. 4 y 5) al pasar de la posición supina a la bipedestación.
Fig. 4. Proyecciones ortogonales de los data de los vectores (dc, E1, K) sobre el plano (dc, E1): (a) - (c) y sobre el plano (K, E1): (b) - (d).
Fig. 5. Proyecciones ortogonales de los data de los vectores (dc, E1, K) sobre el plano (dc, E1): (a) - (c) y sobre el plano (K, E1): (b) - (d). Controles (o), CH1 (números) y CH2 (*) en bipedestación.
La aplicación de VFC en el estudio de la MCHC ha demostrado ser de utilidad en estudios anteriores14,15, aunque no de forma contundente. En el trabajo de Guzzetti et al14, así como en el de Loyo et al15, los resultados son sorprendentemente coincidentes con los aquí presentados. El uso de técnicas de modelado no lineal en el análisis de VFC y las arritmias cardíacas ha demostrado ser de gran utilidad en publicaciones recientes16-18. También se ha aplicado en la predicción de muerte súbita18. Por esta razón nos pareció procedente utilizarlos para establecer diferencias precoces en pacientes en quienes las intervenciones preventivas y/o terapéuticas podrían evitar el desarrollo de una cardiopatía grave que causa incapacidad y/o muerte en una considerable población en plena etapa productiva (tercera o cuarta década de la vida) en Latinoamérica. No hemos encontrado en la bibliografía la aplicación de este modelado no lineal en el análisis del ritmo cardíaco en la enfermedad de Chagas. Cada día se incrementan más las investigaciones en el terreno de la terapéutica de la enfermedad de Chagas con miras a prevenir el desarrollo de MCHC19,20. Por esto, proveer información de los pacientes infectados expuestos a riesgo es de fundamental importancia para diseñar esquemas terapéuticos en grupos de población. En nuestros resultados demostramos, primero, que las técnicas aplicadas discriminaron con alta sensibilidad y especificidad entre el grupo control y CH2, y segundo, que el comportamiento del grupo CH1 fue intermedio y pudo discriminarse en 4 subgrupos que en orden de presunta gravedad de riesgo definimos desde CH1-A (mayor riesgo) hasta CH1-D (el más vecino al control y, por tanto, de menor riesgo). Si bien es verdad que en el contexto de un programa terapéutico toados deberían ser tratados, opinamos que hay que priorizar e incluso jerarquizar los tratamientos en gran escala en las poblaciones infectadas. Esto sólo puede hacerse si se discrimina entre personas más o menos expuestas al riesgo; esto es, entre sujetos que, siendo portadores de infección chagásica, demuestren mayor o menor anormalidad en los parámetros de evaluación con técnicas de análisis no lineal. Superponible a los hallazgos de Guzzetti14 sobre el no incremento de la relación baja frecuencia/alta frecuencia con el ortostatismo en pacientes chagásicos con ECG normal, fueron nuestros resultados en la segunda fase del estudio al comparar el incremento de la relación baja frecuencia/alta frecuencia en los 3 grupos con los cambios de posición. En la misma di-rección se comportaron el incremento relativo del promedio del índice E1 y el incremento relativo de los valores promedio de K al pasar de posición supina a la bipedestación: el incremento fue mayor en los controles que en los CH1 y en estos, a su vez, mayor que en CH2. Estos hallazgos sugieren una disminuida actividad simpática durante el cambio de posición, que es la misma explicación que se ha dado para el menor incremento, o la falta de incremento de la relación baja frecuencia/alta frecuencia en pacientes chagásicos al pasar de posición supina a posición ortostática14. Los resultados aquí presentados corroboran lo que ya había sido sugerido con anterioridad14,15 sobre una disautonomía precoz en la enfermedad de Chagas, sólo que el modelado no lineal fue más robusto y consistente para demostrarlo (véanse los valores de sensibilidad y especificidad) y fue más fino en discriminar sobre la severidad de la afección (véanse los subgrupos definidos en CH1 de acuerdo con su ubicación en las regiones significantemente discriminantes). La disautonomía en la MCHC ha sido demostrada consistentemente desde el punto de vista estructural en estudios histopatológicos y en biopsias endomiocárdicas. En estos estudios histopatológicos se demostró denervación autonómica en pacientes chagásicos con ECG normal21,22. Esto constituiría el sustrato anatómico que explica las alteraciones de VFC y las aún más sutiles y precoces encontradas con técnicas de análisis no lineal y que presentamos en este trabajo.
Electrocardiografía dinámica de 24 h. Laboratorio
ostenida3-6. Esto constituyó prio, éstos se explican por razones de índole socioeconómica, dado el tipo de hábitos alimentarios de los sectores de población más frecuentemente afectados por la enfermedad: pobladores rurales de pocos ingresos económicos. Esto fue corroborado en las encuestas socioeconómicas sobre los hábitos alimentarios que se hicieron en el grupo control y en el grupo CH1.
Limitaciones del estudio
Entendemos que la división en 4 subgrupos del grupo CH1, después de la segunda fase del estudio, es tentativa y requiere estudios de seguimiento con una muestra más numerosa para poder establecer conclusiones válidas respecto al diferente comportamiento de los 10 pacientes del grupo CH1. Esto es una limitación, así lo señalamos anteriormente y debemos esperar resultados de estudios que en la actualidad adelantamos. Por otra parte, el haber reducido a 10 pacientes el número de cada grupo en la segunda fase del estudio se hizo con la intención de comparar muestras del mismo tamaño y facilitar la ejecución de los métodos de análisis no lineal. Esto podría constituir una limitación. Sin embargo, y a pesar de estas limitaciones, creemos haber iniciado un nuevo camino en la evaluación de pacientes desde el punto de vista de posible riesgo cardiovascular utilizando una novedosa metodología, que en esta etapa incipiente puso de manifiesto resultados alentadores.
Conclusiones
Ésta es la primera vez que en la evaluación de pacientes con infección chagásica se aplica esta técnica de modelado no lineal. El modelado no lineal dio resultados consistentes que mejoraron los resultados obtenidos con los métodos establecidos de análisis de VFC. Los resultados con el modelado no lineal fueron altamente específicos y sensibles para separar y diferenciar a los sujetos sanos de los CH1 y CH2. También fueron más sutiles, al permitirnos discriminar claramente a 4 subgrupos de pacientes en el grupo CH1. La importancia de nuestros hallazgos es evidente, dada la utilidad que prometen para plantear políticas de salud pública en el terreno de tratamientos tempranos que prevengan o intenten prevenir el desarrollo de la MCHC en sujetos infectados, aparentemente sanos. En este sentido, y si los estudios de seguimiento corroboran nuestros hallazgos iniciales, se debería considerar la utilización de dos conductas terapéuticas importantes: una sería el uso de quimioterapia para obtener la negativización de la parasitemia (xenodiagnóstico), la otra no menos importante sería la posibilidad de tratamientos que interrumpan la cadena inmunológica de la enfermedad de Chagas23. Un estudio con una población mayor y el seguimiento longitudinal de la misma está actualmente en desarrollo. Sus resultados deben corroborar nuestros hallazgos iniciales aquí presentados. Los resultados sugieren que el modelado no lineal que utilizamos es factible de aplicación en pacientes portadores de riesgo de otras cardiopatías distintas a la MCHC.
Financiado Parcialmente por el Consejo Nacional de Investigaciones Científicas y Tecnológicas, CONICIT, Proyecto G-97000675. Correspondencia: Dr. F. Moleiro. Avda. El Corozo. Residencias Cañaveral, apto. 6-C. Urbanización Colinas de Los Ruices. Caracas 1070. Venezuela. Correo electrónico: fmoleiro@reacciun.ve Recibido el 1 de agosto del 2000. Aceptado para su publicación el 8 de marzo del 2001