Sr. Editor:
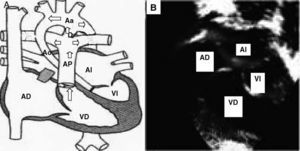
Exponemos el caso de una recién nacida que acudió con shock cardiogénico. Fue diagnosticada de síndrome de corazón izquierdo hipoplásico (SCIH) e ingresó en la UCI neonatal para comenzar tratamiento con prostaglandinas (PGE1), inotropos y medidas de sostén. El estudio ecocardiográfico mostró una forma muy extrema de SCIH, con una atresia mitroaórtica y una hipoplasia muy severa de aorta ascendente (diámetro de aorta ascendente, 2 mm) con flujo coronario retrógrado desde el arco aórtico dependiente del ductus (fig. 1).
Fig. 1. Situación preoperatoria. A: esquema ilustrativo de la fisiopatología del corazón izquierdo hipoplásico. Las flechas indican la dirección del flujo sanguíneo predominante, resaltando el paso desde AP por el ductus hacia arco aórtico y de forma retrógrada hacia aorta ascendente. B: imagen ecocardiográfica del corazón izquierdo hipoplásico. Aa: arco aórtico; AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta ascendente hipoplásica; AP: arteria pulmonar; D: ductus; VD: ventrículo derecho; VI: ventrículo izquierdo hipoplásico.
Los resultados de la cirugía (Norwood) empleada en la corrección inicial del SCIH están muy influidos por la anatomía y el estado clínico del paciente1-2. Por tal motivo se decidió realizar una técnica híbrida como alternativa a la corrección inicial tipo Norwood.
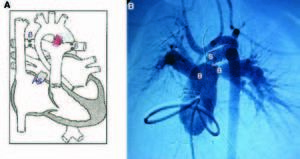
La paciente fue intervenida mediante esternotomía media, encontrando una anatomía típica de SCIH con un tronco pulmonar dilatado, un gran ductus sistémico, ausencia de cámara ventricular izquierda y una aorta ascendente extraordinariamente hipoplásica (diámetro menor, 2 mm) (fig. 1A). Ante esta anatomía tan extrema y el estado hemodinámico de la paciente, decidimos realizar un procedimiento híbrido, para lo cual se introdujo un stent de coronaria de un diámetro de 6 mm y una longitud de 18 mm (LifeStent SDS®) en el ductus, con objeto de mantenerlo abierto permanentemente y así asegurar el flujo sanguíneo sistémico; este stent se colocó a través de una bolsa de tabaco realizada en la base del tronco pulmonar, siendo liberado y dilatado mediante control digital en su correcta ubicación, asegurando su extremo distal en el istmo aórtico y su extremo proximal distal al origen de la rama pulmonar izquierda. El procedimiento se completó con la realización de un banding bilateral de ambas ramas pulmonares con objeto de equilibrar adecuadamente el flujo pulmonar respecto al sistémico. Cinco días más tarde se realizó una atrioseptostomía en la sala de hemodinámica, con objeto de conseguir un drenaje sin restricción de la aurícula izquierda (fig. 2).
Fig. 2. Situación tras el tratamiento híbrido. A: esquema ilustrativo del tratamiento híbrido. B: imagen del cateterismo 5 días después del tratamiento híbrido, durante el que se realizó una auriculoseptostomía. As: zona de auriculoseptostomía percutánea (Rashkind); B: banding sobre ambas ramas pulmonares; S: stent colocado en el ductus desde su nacimiento en la arteria pulmonar hasta su inserción en el istmo aórtico (en A aparece sombreado en rojo).
Tras la técnica la paciente evolucionó favorablemente, en tratamiento con digital, diurético y antiagregante. Actualmente sigue controles que incluyen ecocardiografía con objeto de valorar la adecuada permeabilidad del stent, en espera de completar en un futuro el segundo tiempo mediante la reconstrucción de la aorta ascendente y la anastomosis de Glenn bidireccional.
La supervivencia media de la cirugía tipo Norwood es de un 60-70% en centros experimentados1,2, muy relacionada con la forma anatómica del SCIH; en los casos con aorta muy hipoplásica (diámetro < 2-3 mm) y flujo coronario retrógrado, los resultados de este procedimiento se ensombrecen notablemente1-4.
El procedimiento híbrido descrito aquí cumple los objetivos del Norwood clásico; por un lado asegura el flujo sanguíneo sistémico al mantener el ductus abierto por efecto del stent, y por otro el cerclaje bilateral de las ramas pulmonares asegura un balance adecuado entre el flujo pulmonar y el sistémico, controlando la presión pulmonar. La septostomía auricular percutánea, siempre necesaria, asegura el drenaje no obstructivo de la aurícula izquierda en el tiempo.
Este procedimiento ofrece la posibilidad de abordar en una segunda etapa la reconstrucción de la aorta ascendente y arco aórtico sobre estructuras anatómicas de mayor tamaño, lo que debe suponer un riesgo menor respecto a la operación de Norwood en neonatos con formas extremas de SCIH.
La cirugía híbrida no requiere circulación extracorpórea (CEC) ni hipotermia profunda con parada circulatoria, lo que facilita la reoperación inevitable de estos pacientes y disminuye el riesgo de lesiones neurológicas.
Nuestro grupo de trabajo ha decidido aplicar esta técnica híbrida a las formas extremas de SCIH, donde en nuestra experiencia la técnica de Norwood obtiene peores resultados. Las ventajas de la técnica híbrida son su rapidez de realización, control gradual del flujo pulmonar y ausencia de CEC. Los buenos resultados iniciales aportados por algunos grupos de trabajo anglosajones2,5 (en nuestro país es el primer paciente con éxito que se publica), puede animarnos en un futuro a utilizar la técnica en las formas más extremas de pacientes con SCIH, aunque serán necesarios grupos de pacientes más numerosos para verificar la adecuada permeabilidad del stent colocado en el ductus y valoren la morbilidad inducida por el banding bilateral sobre las ramas pulmonares, hasta alcanzar el momento óptimo de completar la segunda etapa en la corrección quirúrgica de estos pacientes con SCIH.