Palabras clave
INTRODUCCIÓN
La angiografía coronaria está considerada la técnica de referencia para el diagnóstico de la enfermedad coronaria. Sin embargo, la mayor parte de los síndromes coronarios agudos se producen sobre lesiones angiográficamente no significativas1. Son la rotura de la placa vulnerable y la consecuente formación de trombo el mecanismo patogénico más frecuente en el síndrome coronario agudo2-4. Una adecuada técnica de imagen debería identificar estas placas.
Del mismo modo, la angiografía es la técnica de elección para guiar el implante de las prótesis endovasculares y su seguimiento. Sin embargo, se ha demostrado que la angiografía en muchos casos es una técnica poco precisa, en especial para la detección de complicaciones. Estas limitaciones de la angiografía han impulsado el desarrollo de nuevas técnicas de diagnóstico por imagen intravascular.
En esta revisión presentamos una de las técnicas de diagnóstico intravascular de mayor resolución: la tomografía de coherencia óptica (OCT).
TECNOLOGÍA
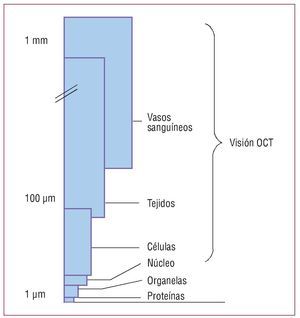
La OCT es una técnica de imagen tomográfica óptica, interferométrica, que ofrece una penetración de milímetros (aproximadamente 2-3 mm en el tejido) y una resolución axial y lateral de escala micrométrica5,6 (fig. 1).
Fig. 1. Marco de visión de la tomografía de coherencia óptica (OCT). La OCT permite la visión en la escala micrométrica y puede identificar células como macrófagos en la placa aterosclerótica5.
que se puede objetivar con mayor definición mediante OCT (C). La flecha señala la distancia entre los struts y la pared del vaso.
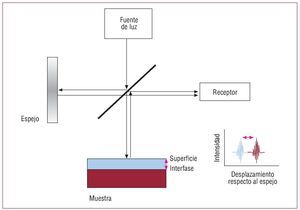
La interferometría o interferometría de baja coherencia, que es la base de la OCT, es una técnica que consiste en combinar la luz proveniente de diferentes receptores para obtener una imagen de mayor resolución (fig. 2).
Fig. 2. Esquema de obtención de imágenes con la tomografía de coherencia óptica (OCT). La luz en un sistema de OCT se divide en dos haces: uno se dirige hacia la muestra y otro hacia un espejo. La imagen se obtiene al integrar las características de la luz reflejada en el receptor6.
La luz en un sistema de OCT se divide en dos rayos. Un rayo de muestra (que se dirige hacia el objeto de interés) y un rayo de referencia (que se dirige hacia un espejo). La combinación de la luz reflejada del rayo-muestra y la del rayo-referencia da lugar a un patrón de interferencia. Las áreas de la muestra que reflejan mucha luz crean mayor interferencia que las áreas que no reflejan. Las imágenes tomográficas pueden obtenerse al combinar lateralmente una serie de estas exploraciones de profundidad axial.
Sistemas de obtención de imágenes
En un principio se comercializó la versión M2/ M3 (LightLab Imaging, Inc., Westford, Massachusetts) basada en la OCT-dominio de tiempo. La luz, en esta versión, permite la obtención de 20 imágenes/s recorriendo el vaso a 3 mm/s (se tardaba 20 s en estudiar un segmento de 6 cm).
La obtención de imágenes con este sistema se realiza con una guía de 0,019" con un extremo distal de 0,014". Esta guía consiste en fibra óptica en el interior de un cilindro y en la parte distal una lente, la cual se puede desplazar de distal a proximal por el interior del cilindro, realizando giros de 360°, emitiendo y recibiendo la luz reflejada (ImageWireTM, LightLab Imaging Inc., Westford, Massachusetts). La luz de un sistema de OCT no consigue penetrar a través de la sangre, por lo que se requiere un campo libre de células sanguíneas. Esto se solventó inicialmente con un balón over the wire de baja presión (Helios Occlusion Balloon Catether, LightLab Imaging Inc., Westford, Massachusetts), que permite la oclusión del vaso en estudio y la infusión distal de suero salino isotónico a 0,5 ml/h para crear el campo libre de células sanguíneas (fig. 3). Posteriormente, Prati et al7 describieron la posibilidad de obtener imágenes sin la utilización del balón de oclusión proximal, utilizando infusión de contraste isosmolar (iodixanol) desde el catéter guía.
Fig. 3. Metodología de la obtención de imágenes con el modelo M2/M3 de Lightlab. El microcatéter se introduce en la arteria coronaria en estudio. A continuación se crea un campo libre de células sanguíneas mediante la oclusión con balón y la infusión distal de suero. La guía dispone de una fuente de luz y un receptor que realiza la exploración de la lesión de distal a proximal. Cortesía de LightLab Imaging Inc. (Westford, Massachusetts).
Actualmente, se comercializa en Europa la versión C7 XR basada en la OCT-dominio de frecuencia. Este sistema utiliza láser, lo que condiciona una mayor rapidez en la obtención de imágenes.
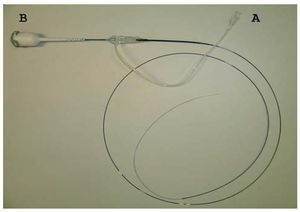
Con esta versión se puede obtener hasta 100 imágenes/s, lo que permite el recorrido del vaso a 20 mm/s. En esta versión, la lente y la fibra óptica están montadas sobre un catéter monorraíl que discurre sobre una guía convencional, al igual que en la ecografía intravascular (IVUS) (fig. 4). Dada la rapidez en la obtención de imágenes (6 cm de arteria en 3 s), el tiempo que el campo ha de estar libre de células sanguíneas es más corto, y por ello se puede utilizar una infusión de contraste a 4 ml/h a través del catéter guía. Este modelo consigue también una mayor penetración de la luz en la pared de la arteria, en concreto entre 2 y 3,5 mm frente a los 1,5-3 mm del sistema OCT-dominio de tiempo8.
Fig. 4. Sistema monorraíl del nuevo sistema C7 XR. No requiere oclusión del vaso para la obtención de la imagen. El propio catéter crea un flujo de suero y contraste que permite en pocos segundos la obtención de las imágenes. Por el punto A el catéter se conecta a una fuente de suero y contraste. Por el punto B se conecta a la consola. Cortesía de LightLab Imaging Inc. (Westford, Massachusetts).
Problemas y artefactos
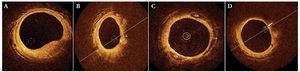
Nos referimos en este apartado a los artefactos y problemas más comunes con el nuevo sistema OCT-dominio de frecuencia9 (fig. 5).
Fig. 5. Artefactos más comunes con el nuevo sistema C7 XR9. A: artefacto de discontinuidad; el rápido movimiento de la guía produce un defecto de alineación de la pared del vaso, tal y como se observa en el ejemplo. B: artefacto por excentricidad de la guía; en la figura se puede observar la elongación (flecha) de los struts por pérdida de la resolución, en lo que se ha denominado el fenómeno del carrusel. C: artefacto de plegamiento; en bifurcaciones de grandes vasos se puede observar esta morfología en plegamiento (flecha), característica del nuevo sistema FD-OCT (Fourier Domine-Optical Coherence Tomography). D: artefacto por la presencia de células sanguíneas; la flecha señala tejido sanguíneo en el interior del vaso, que puede llegar a confundirse con un trombo intravascular. E: artefacto de saturación; la flecha señala el artefacto producido por el reflejo de la luz en los struts.
Error de medición por mal calibrado. Las mediciones por OCT requieren el calibrado inicial ajustando cuatro marcas de la pantalla con la superficie del catéter. Se ha objetivado que cambios de un 1% en el ajuste inicial pueden producir un 14% de error en la medición del vaso.
Atenuación en vasos de gran tamaño. El principal problema de la OCT es la falta de penetración del haz de luz en la pared de la arteria, lo cual produce problemas en la caracterización de la placa aterosclerótica y la medición de la arteria.
Artefacto por la presencia de células sanguíneas. La sangre en la arteria puede hacer que se pierda brillo en la pared del vaso y se confunda con la presencia de material trombótico intravascular.Artefacto por falta de rotación uniforme. La falta de rotación uniforme de la fibra óptica durante la obtención de imágenes, producida por tortuosidad proximal de la arteria coronaria, produce distorsión en la forma de la pared del vaso.
Artefacto de discontinuidad. El movimiento de la arteria coronaria o la guía puede producir falta de continuidad en la pared de la arteria.
Artefacto de saturación. La luz, reflejada en los struts (puntales) del stent, produce una señal fuera del límite de absorción del sistema. Se observa una distorsión del stent que dificulta la definición de la superficie de la arteria estudiada.
Artefacto de plegamiento. La luz reflejada fuera del campo de penetración del sistema —por ejemplo, en vasos grandes o en grandes ramos laterales— produce una distorsión característica en forma de vaso plegado.
Artefacto por excentricidad de la guía en la arteria. Observado fundamentalmente en el análisis de los stents, son fundamentalmente dos: el fenómeno del carrusel y el fenómeno del girasol. El fenómeno del carrusel se produce por las diferencias en la velocidad de barrido del haz de luz en las zonas más alejadas, lo que ocasiona pérdida de resolución lateral y da un aspecto más elongado a los puntales. El fenómeno del girasol consiste en una falsa alineación de los struts alrededor de la guía que no coincide con el centro de la arteria.
APLICACIONES
La OCT cobra especial importancia en dos campos fundamentalmente: en la caracterización de la placa arteriosclerótica y en el intervencionismo coronario.
La identificación de la placa causal es importante a la hora de guiar la revascularización. La OCT proporciona información relevante sobre las características de la placa arteriosclerótica10-15 y permite definir la placa causal o inestable16.
La frecuencia de las intervenciones coronarias aumenta exponencialmente y con ella las complicaciones derivadas. La OCT proporciona una adecuada visualización de las complicaciones relacionadas con el implante como la disección o la mala aposición del stent17,18. Es útil también para detectar la hiperplasia intimal tras la implantación del stent19.
Síndrome coronario agudo. Identificación de la placa vulnerable
La rotura de la placa arteriosclerótica y la formación de trombo son los mecanismos subyacentes en gran parte de los síndromes coronarios agudos2-4.
Algunas de las características de la placa que predisponen a la rotura han sido identificadas. Así, la presencia de un núcleo lipídico importante, una fina capa fibrosa o la acumulación de macrófagos son algunas de las características más nombradas2,20,21.
Medición de capa colágena sobre la placa
La presencia de una capa fibrosa fina es una característica esencial de la placa vulnerable2,20,21. La OCT es el único instrumento disponible en el momento actual con la resolución necesaria para medir el espesor de la capa colágena sobre la placa (fig. 6). Kume et al22, en un trabajo realizado en cadáveres sobre 35 placas ricas en contenido lipídico, encontraron una alta correlación entre los espesores de la capa colágena medidos por OCT y los datos histológicos: coeficiente de correlación (r) = 0,9, p < 0,001.
Fig. 6. Diferentes tipos de placas10-15. A: placa de características fibrosas; las placas de aspecto homogéneo con alta intensidad de señal corresponden con placas fibrosas (F). B: placa con alto contenido lipídico; las áreas de baja intensidad con señal de contorno mal delimitado se corresponden con núcleo lipídico (L). C: placa con alto contenido en calcio; las áreas de baja intensidad con señal de contorno bien definido se corresponden con calcio (Ca). D: la flecha señala la capa fibrosa de una placa de fibroateroma con capa fibrosa fina, y bajo ésta se encuentra una región de hipodensidad mal definida que se corresponde con un núcleo lipídico.
En estudios realizados in vivo se ha mostrado que el espesor de la capa colágena medido por OCT es significativamente menor en pacientes que presentan un síndrome coronario agudo que en aquellos que presentaron angina estable15.
En este sentido, la OCT ha permitido objetivar la potencial estabilización de la placa arteriosclerótica con el tratamiento con estatinas. En un estudio observacional reciente sobre 40 pacientes tras un infarto de miocardio, se observó que el tratamiento con estatinas producía un mayor aumento de la capa fibrosa medido por OCT (incremento del 188 ± 64% frente al 117 ± 39%; p < 0,01). Este incremento fue más marcado en los pacientes con una capa fibrosa basalmente más fina 23.
Contenido lipídico de la placa
La presencia de alto contenido lipídico de la placa es una de las características que se ha relacionado con la inestabilidad de la placa. Las placas con alto contenido lipídico se presentan en OCT como señal de baja intensidad mal delineada en sus bordes10 (fig. 6).
Hay tendencia a una mayor proporción de este tipo de placas en pacientes que presentan un síndrome coronario agudo en comparación con quienes sufren angina estable15.
La OCT ha mostrado gran sensibilidad y especificidad para la detección de contenido lipídico de la placa10-14. En todos los estudios revisados se ha mostrado superior a la IVUS6 (tabla 1).
Las variabilidades entre observadores y del observador son uno de los puntos débiles en la detección de contenido lipídico de la placa. En el trabajo de Manfrini et al13 sobre caracterización de la placa, se realizó un análisis de las placas con alto contenido en lípidos y se obtuvo un coeficiente de concordancia (k) = 0,27 (intervalo de confianza [IC] del 95%, 0,05-0,48). Esto probablemente esté relacionado con la baja penetración de la luz en las placas de alto contenido fibroso, como se apunta en la discusión. En este trabajo se obtuvo un 45% de sensibilidad en la detección de placas de alto contenido lipídico.
El significado de fibroateroma con capa fibrosa fina
Las placas con alto contenido en lípidos (dos o más cuadrantes de la imagen con lípidos) y con una capa fibrosa fina (< 65 mm) se denominan fibroateroma con capa fibrosa fina (TCFA)15 (fig. 6).
En pacientes con síndrome coronario agudo, el porcentaje de TCFA fue significativamente mayor que en los pacientes con angina estable y es un hallazgo frecuente al explorar el vaso causal15.
La frecuencia de las lesiones con TCFA según la arteria coronaria estudiada es más alta en los segmentos proximales de la arteria coronaria izquierda. Este hallazgo no se produce al explorar la arteria coronaria derecha, donde la distribución es igual en toda la arteria24.
El remodelado (según el índice de remodelado por IVUS) positivo en comparación con el remodelado negativo del vaso se asoció, en un trabajo sobre 54 lesiones, con mayor proporción de TCFA en OCT, en definitiva, con mayores porcentajes de placa vulnerable25.
Contenido en calcio de la placa
Las placas con alto contenido en calcio se presentan en la OCT como regiones de baja intensidad bien definidas en sus bordes10 (fig. 6). La definición de los bordes es la característica que las diferencia de las placas con alto contenido lipídico.
La proporción de calcio en placas de pacientes que se presentan con síndrome coronario agudo es significativamente más alta que en placas de pacientes con cardiopatía isquémica estable15.
En la mayor parte de los trabajos publicados la sensibilidad y la especificidad para detectar calcio mediante OCT fueron similares a las observadas con IVUS10-14,26 (tabla 1).
La detección del calcio cobra importancia a la hora de elegir una técnica de revascularización determinada, puesto que se ha documentado que las lesiones con alto contenido en calcio presentan mayores tasas de mala aposición del stent27.
Las variabilidades entre observadores y del observador analizadas en el trabajo de Manfrini et al13 eran ligeramente superiores a las dadas para la detección de placas con alto contenido en lípidos (k = 0,4; IC del 95%, 0,17-0,63).
Contenido en macrófagos de la placa
El contenido en macrófagos de la placa aterosclerótica se ha relacionado directamente con su inestabilidad2,20,21. El estudio mediante OCT permite objetivar la densidad y la distribución de los macrófagos en la placa arteriosclerótica28.
Tearney et al28 describieron una correlación positiva entre los datos histológicos y los datos de OCT sobre la densidad de macrófagos sobre la capa fibrosa de la placa (r = 0,84; p < 0,0001). El sistema de OCT mide la intensidad de la luz reflejada sobre la placa. Las placas con gran heterogeneidad del índice de refracción muestran mayor intensidad de señal.
En un estudio realizado in vivo sobre 119 placas ricas en contenido lipídico, se observó una concentración de macrófagos significativamente superior en pacientes con angina inestable e infarto de miocardio con elevación del segmento ST, respectivamente (media ± desviación estándar, 5,86 ± 1,148% y 5,54 ± 2,01%), en comparación con pacientes con angina estable (4,14 ± 1,81%). En el mismo trabajo se encontraron mayores concentraciones de macrófagos en la proximidad de la rotura de la placa en comparación con regiones alejadas (6,95 ± 1,6% frente a 5,29 ± 1,17%; p = 0,002)29.
No se han encontrado diferencias en la densidad de macrófagos entre pacientes diabéticos y no diabéticos (5,94 frente a 5,94%; p = 0,37)30.
Rotura de la placa
La rotura de la placa es una de las características que permiten identificar el vaso causal2-4. La rotura de la placa arteriosclerótica se ha definido, en imágenes obtenidas por OCT, como discontinuidad de la capa fibrosa y formación de una cavidad en la placa. La pérdida de la continuidad endotelial sin formación de cavidad se ha denominado erosión31.
En el trabajo de Kubo et al32 en 41 pacientes con síndrome coronario agudo con elevación del segmento ST (SCACEST), esta característica se encontró en el 73% de los pacientes, porcentaje significativamente superior al encontrado con IVUS (40%; p = 0,009) y angioscopia (47%; p = 0,035). Estos datos contrastan con un trabajo previo de Jang et al15, en el que la detección de la rotura de la placa se objetivó en un porcentaje inferior (el 25% de los pacientes tras SCACEST). Así, en ese trabajo no se encontraron diferencias entre los pacientes agrupados por síndrome clínico de presentación. Una posible explicación se encontraría en las diferencias en el tiempo desde la presentación clínica hasta la obtención de imágenes en ambos trabajos. Mientras en el grupo de Kubo et al fue de 3,8 ± 1 h, en el de Jang et al fue de 4,6 ± 5,3 días.
En un trabajo transversal reciente se ha documentado un menor porcentaje de rotura de placa en los pacientes tratados con estatinas y mejor control lipídico33. La presentación clínica de los pacientes fue: SCACEST en un 39,6%, angina inestable en un 35,4% y angina estable en un 25%.
Contenido trombótico
La presencia de material trombótico es una constante en los pacientes estudiados con OCT que presentan infarto de miocardio con elevación del ST. La detección mediante IVUS es significativamente inferior32.
En el trabajo de Kubo et al32 en pacientes con infarto agudo de miocardio comentado previamente, se observó que la detección de material trombótico mediante OCT fue en el 100%, frente al 33% detectado por IVUS.
La resolución de la OCT permite incluso la caracterización del trombo, diferenciando entre rojo y blanco. El trombo rojo, de alto contenido en fibrina, produce una atenuación de la señal, o sombra, mayor que el trombo blanco, puesto que la luz no puede penetrar. Esto parece deducirse del trabajo de Kume et al34 realizado en cadáveres. Los hallazgos se confirmaron en otro trabajo realizado in vivo, en animales de experimentación35.
Sin embargo, en esos estudios se incluyó sólo a pacientes seleccionados con muy alta probabilidad de presencia de trombos previa al test. Algunos autores consideran que la distinción entre trombo y otras imágenes anormales intraluminales puede ser ambigua, especialmente en estudios en que el operador desconoce la clínica del paciente9.
Además, pese a la gran resolución de la OCT, la presencia de sangre residual en el vaso durante su realización podría determinar la presencia de un artefacto que se puede etiquetar erróneamente como trombo9.
Intervencionismo coronario
Mucha es la información que puede aportar la OCT en comparación con las demás técnicas de diagnóstico endovascular en el intervencionismo coronario percutáneo36.
La mayor resolución de la OCT frente a otras técnicas de diagnóstico intravascular permite una adecuada medición del diámetro y el área luminal del vaso para la elección de la adecuada prótesis endovascular. Además, esta técnica tiene más sensibilidad para la detección de disecciones, mala aposición del stent o mínimos prolapsos de placa que la IVUS.
El significado clínico y pronóstico de estos hallazgos con IVUS es discutido: mientras que algunos estudios han mostrado tasas de eventos adversos similares en pacientes con y sin mala aposición aguda del stent o prolapso de placa valorada por IVUS37-39, otros han demostrado la alta prevalencia de anomalías en el estudio de IVUS tras el implante de stent en pacientes con trombosis aguda de éste40.
Actualmente se desconoce la implicación pronóstica de estos hallazgos valorados por OCT y se precisan estudios con seguimientos a medio-largo plazo para establecer su importancia.
Mediciones del área luminal
Datos de un trabajo reciente de Suzuki et al41 en animales de experimentación indican que hay una alta correlación entre la medición del área luminal realizada por OCT in vivo y los datos histológicos del vaso (r = 0,98; p < 0,001), superior a la observada con IVUS (r = 0,803; p < 0,001). La variabilidad del observador en ese mismo trabajo fue inferior a la obtenida por IVUS (el 3,7% para la OCT frente al 4,3% para la IVUS). En un trabajo reciente publicado en esta Revista42 se aportan datos in vivo sobre esta correlación. Los datos por IVUS son mayores que los obtenidos por OCT en sujetos vivos y se señala que hay diferencias según la metodología de la obtención de imágenes con OCT; los valores obtenidos por la técnica oclusiva son ligeramente menores que con la técnica no oclusiva.
Sin embargo, en el momento actual los valores de corte para la toma de decisiones clínicas han sido establecidos para la IVUS pero no son aplicables a la OCT.
Se debe tener en cuenta que en la OCT la calibración de la imagen se realiza de forma semimanual, y se ha comprobado que un cambio del 1% en la magnitud de la calibración puede inducir a errores del 12-14% en el área medida9. Además, pequeños cambios en la calibración podrían amplificar la distorsión del contorno del vaso, lo que conllevaría interpretaciones erróneas de la imagen.
Complicaciones del implante: inadecuada aposición del stent
Dada la gran resolución de la OCT se han podido caracterizar diferentes grados de aposición del stent43 (fig. 7). La frecuencia de la detección de inadecuada aposición del stent es superior mediante OCT que con IVUS. En el trabajo reciente de Kubo et al44in vivo, la detección mediante OCT fue del 47% de 55 pacientes, mientras que la IVUS detectó el 18% (p < 0,001) de los mismos pacientes. Similares resultados se habían encontrado en el trabajo de Bouma et al45 5 años antes en un trabajo experimental en animales.
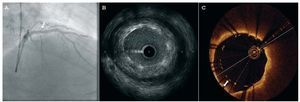
Fig. 7. Imágenes angiográficas, por ecografía intravascular (IVUS) y por tomografía de coherencia óptica (OCT) tras el implante de un stent en la arteria descendente anterior. La angiografía (A) presupone un resultado óptimo (flecha). La IVUS (B) muestra una zona de mala aposición
La inadecuada aposición del stent detectada por OCT podría estar en relación con la endotelización tardía. Así, sería un factor determinante en la trombosis tardía del stent46,47, si bien este hecho no se ha documentado en estudios prospectivos con OCT.
Se ha descrito la utilidad de la OCT para caracterizar la aposición del stent en segmentos en los que se solapan dos stents48. Desde la introducción de los stents farmacoactivos, la longitud de los segmentos tratados ha ido aumentando, lo que ha llevado a que en multitud de intervenciones sea necesario solapar dos stents. La presencia de stents solapados podría condicionar una endotelización más tardía y una expansión subóptima de los stents que favorecería la trombosis. Mediante la OCT se ha comprobado que hasta un 40% de los struts en los segmentos de solapamiento de dos stents se encuentran mal apuestos. Sin embargo, el significado clínico de este hallazgo todavía no ha sido establecido.
Una de las limitaciones de la OCT para el diagnóstico de la mala aposición del stent es su escasa capacidad para evaluar el remodelado del vaso debido a su baja penetración de la OCT. Esta característica de los sistemas de OCT actuales no permite analizar adecuadamente los mecanismos y las consecuencias de la mala aposición43.
Complicaciones del implante: disección
La disección o microdisección, en el mismo trabajo de Kubo et al44, se encontró en el 40% de los pacientes, mientras que la IVUS sólo detectó el 16%. Al igual que ocurre con la mala aposición, se desconoce cuál puede ser el papel de estas complicaciones a largo plazo. Por lo tanto, son necesarios más estudios para conocer si es necesario actuar sobre estas complicaciones una vez detectadas.
Detección neointimal
La OCT permite la detección y la medición del engrosamiento intimal tras el implante19,49,50. Prati et al51 han documentado una adecuada correlación lineal entre las medidas obtenidas por OCT y las medidas histológicas: coeficiente de correlación (R2) = 0,726 (p < 0,0001). Además, la reproducibilidad por un observador y entre observadores fue R2 = 0,9 y R2 = 0,8 respectivamente. La detección intimal postimplante ha sido evaluada comparativamente por OCT e IVUS. En el trabajo de Matsumoto et al52, sobre 57 stents farmacoactivos, tras 6 meses de mediana de seguimiento, se estudió la reacción intimal y se observó que el 64% de los struts estaban cubiertos por una íntima de espesor < 100 mm (por debajo de la resolución de la IVUS). Así, han surgido numerosos trabajos que describen el proceso de endotelización de los distintos stents disponibles53,54. En un estudio reciente realizado por Chen et al55, se objetivó una mayor endotelización tras el implante de stent no recubierto que con stent farmacoactivo. La máxima hiperplasia intimal fue de 0,36 mm para el stent no recubierto evaluado entre los 5 y los 10 meses, mientras que fue de 0,07 mm para el stent farmacoactivo evaluado entre los 6 y los 12 meses. De la misma forma, se ha convertido en el instrumento para evaluar la nueva generación de stents absorbibles56-58.
Sin embargo, con la técnica actual de la OCT no se puede distinguir de forma adecuada el tipo de tejido que cubre el stent (p. ej., endotelio, células musculares lisas, matriz extracelular, trombina)9,43.
Futuros estudios que incluyan correlación histopatológica permitirán distinguir la endotelización «normal». Además, la resolución actual de la OCT es insuficiente para detectar espesores < 20 mm, lo que impide distinguir de forma precisa la ausencia total de endotelización del stent frente a la presencia de 3 a 5 filas celulares9. Se ha señalado que la detección de endotelización de los stents farmacoactivos valorada por OCT podría ayudar a tomar la decisión de suspender la doble antiagregación en algunos pacientes. Sin embargo, las limitaciones comentadas hacen necesario esperar a nuevos estudios clínicos que demuestren la seguridad de este planteamiento.
Estudios clínicos
Dadas las posibles aplicaciones de la OCT, se usa cada vez más en diversos estudios clínicos para la evaluación de resultados y/o complicaciones. Además, recientes estudios han mostrado la seguridad de la realización de estudios de OCT en la práctica clínica habitual59, y se ha descrito una baja tasa de complicaciones mayores como fibrilación ventricular (1,1%), embolia aérea (0,6%) o disección coronaria (0,2%).
La OCT se está usando para la evaluación de pacientes con intervenciones coronarias previas. En pacientes revascularizados mediante stent, la OCT permite obtener información sobre el posible mecanismo de la reestenosis. Como ya se ha comentado, la mala aposición del stent puede detectarse con precisión mediante OCT, aunque el significado clínico de este hallazgo todavía no está claro. Hay datos con IVUS que apuntan a que la aposición incompleta del stent a la pared arterial podría determinar trombosis60. Los datos más precisos aportados por la OCT podrían proporcionar las claves que permitan interpretar correctamente esta complicación. Se ha mostrado que los pacientes a los que se implanta un stent farmacoactivo durante una angioplastia primaria presentan una mayor tasa de mala aposición que los pacientes en quienes la intervención se realiza por angina estable o inestable61. Se ha señalado que la disolución del trombo o el retroceso elástico del stent podrían ser la causa de estos hallazgos. También se han analizado las tasas de aposición incompleta según el tipo de stent implantado (stent farmacoactivo o stent convencional)62 o según el tipo de malla de éste63.
Se han publicado recientemente los datos de diversos estudios clínicos que analizaron el recubrimiento de diversos tipos de stent farmacoactivo. En el subestudio de OCT del estudio LEADERS (Limus Eluted From A Durable Versus Erodable Stent Coating) se ha mostrado un mayor recubrimiento a 9 meses del stent con polímero bioabsorbible frente a un stent farmacoactivo convencional64. En el estudio ODESSA (OTC for DES safety) se incluyó a pacientes con lesiones largas que requerían múltiples stents solapados para su tratamiento y fueron aleatorizados a recibir distintos tipos de stent. Se analizó el recubrimiento del stent a los 6 meses, y los resultados finales todavía no se han publicado, pero los resultados preliminares muestran diferencias en el recubrimiento según el tipo de stent y el segmento analizado (zona solapada frente a zona no solapada)65. Los resultados definitivos del subestudio de OCT del HORIZONS (Harmonizing Outcomes With Revascularization and Stents in AMI), en el que se realiza un estudio de OCT a los 13 ± 1 meses tras el implante para evaluación del recubrimiento, la aposición y las respuestas anormales del tejido a 117 pacientes tratados con angioplastia primaria por SCACEST, están pendientes de publicación66.
También se está comenzando a utilizar la OCT como técnica de evaluación previa a la angioplastia en pacientes intervenidos con puentes de safena. La OCT permite una definición más exacta del tipo de tejido que se genera en la safena y es capaz de detectar elementos móviles en el interior del puente, lo que teóricamente aumentaría el riesgo de embolización65.
COMPARACIÓN CON OTRAS TÉCNICAS DE IMAGEN ENDOVASCULAR
Muchas son las técnicas de imagen, invasivas y no invasivas, que han surgido en los últimos años67-69 (tabla 2). Debido a la facilidad de uso y la seguridad de la IVUS, es la técnica más empleada. La principal ventaja de la IVUS sobre la OCT es su mayor penetración en el tejido, lo que permite medir el tamaño del vaso o el área de la placa26.
Cabe destacar que las nuevas modalidades de IVUS de histología vascular (IVUS-VH) permiten un análisis cuantitativo de los componentes de la placa12.
Sin embargo, la OCT es superior a la hora de medir la cobertura colágena de la placa32,70 y la determinación del contenido en macrófagos y una mayor resolución de imagen respecto a todas las modalidades de IVUS.
La IVUS-VH debido a su poca resolución (> 100 mm) no muestra la capa fibrosa fina. Por otro lado, la OCT tiene gran resolución (10-20 mm), pero con poca penetrancia (< 2 mm). Es decir, la OCT permite ver la capa fibrosa, pero no puede detectar los lípidos profundos. Por lo tanto, el uso combinado de estas técnicas de imagen complementarias podría permitir el diagnóstico preciso de la TCFA, y así se ha demostrado en un estudio reciente71.
De las demás técnicas sólo hay resultados significativos de la angioscopia y la termografía. La angioscopia es una técnica que no ofrece información morfológica de la placa72. Así, en la identificación de la placa vulnerable, la OCT se muestra claramente superior. La angioscopia se ha utilizado para evaluar la endotelización de los diferentes stents. En la literatura revisada, hay dos trabajos con pocos pacientes en los que se evalúa esta característica. Aunque no se ha hecho una comparación directa entre OCT y angioscopia, la primera permite una medición más precisa del grosor intimal, mientras que la angioscopia utiliza como variable resultado el mayor o menor grado de visualización de los struts73,74.
La termografía es una técnica que proporciona información funcional y no morfológica. No hay resultados comparativos entre la termografía y la OCT y quizá, dadas sus características, podrían ser técnicas complementarias.
CONCLUSIONES
La OCT se presenta como la técnica más novedosa que se ha introducido en el laboratorio de hemodinámica en los últimos años. La alta resolución de esta técnica, que inicialmente se centró en la caracterización de la placa aterosclerótica, recientemente se ha dirigido al campo del intervencionismo coronario, donde puede tener un papel en el implante de las endoprótesis coronarias y sus complicaciones. Sin embargo, son los estudios de endotelización de los diferentes stents farmacoactivos donde se puede desarrollar su uso.
Todo ello hace que la OCT se sitúe con ventaja sobre las otras técnicas de diagnóstico intravascular y sea una de las técnicas más atractivas y con más futuro.
Full English text available from: www.revespcardiol.org
El Dr. Jesús Herrero-Garibi agradece a Medtronic Ibérica, S.A. y al Hospital Universitario de Salamanca la financiación para su estancia en el Massachusetts General Hospital de Boston.
ABREVIATURAS
IVUS: ecografía intravascular.
IVUS-VH: ecografía intravascular de histología virtual.
OCT: tomografía de coherencia óptica.
SCACEST: síndrome coronario agudo con elevación del segmento ST.
TCFA: fibroateroma con capa fibrosa fina.
Correspondencia: Dr. I-K. Jang.
Cardiology Division. Massachusetts General Hospital.
Gray/Bigelow 800. 55 Fruit Street. Boston, MA 02114. Estados Unidos.
Correo electrónico: ijang@partners.org