La miocardiopatía hipertrófica es una causa frecuente de muerte súbita. Las guías de práctica clínica recomiendan implantar un desfibrilador como prevención primaria para pacientes con uno o más factores de riesgo, y como prevención secundaria para pacientes con antecedentes de muerte súbita recuperada o arritmias ventriculares sostenidas. El objetivo de este trabajo es analizar el seguimiento de los pacientes a quienes se implantó un desfibrilador siguiendo las guías actuales en centros que no son de referencia para esta afección.
MétodosEstudio observacional retrospectivo de todos los pacientes a quienes se implantó un desfibrilador entre enero de 1996 y diciembre de 2012 en tres centros de la provincia de Barcelona.
ResultadosSe incluyó a 69 pacientes (media de edad, 44,8±17 años; el 79,3% varones), 48 en prevención primaria y 21 en prevención secundaria. La media de factores de riesgo era 1,8 por paciente en el grupo de prevención primaria y 0,5 en el grupo de prevención secundaria (p=0,029). La mediana de seguimiento fue de 40,5 meses. La tasa de terapias apropiadas fue de 32,7/100 pacientes-año en prevención secundaria y 1,7/100 pacientes-año en prevención primaria (p<0,001). La mortalidad total fue del 10,1%. Sufrió complicaciones relacionadas con el implante el 8,7% de los pacientes, y en el 13% hubo descargas inapropiadas del desfibrilador.
ConclusionesEn los pacientes portadores de desfibrilador como prevención primaria, la tasa de terapias apropiadas es excesivamente baja, lo que indica que los criterios actuales de estratificación de riesgo tienen bajo poder predictivo.
Palabras clave
La miocardiopatía hipertrófica (MCH) es una enfermedad genética causada por mutaciones en distintos genes que codifican para las proteínas sarcoméricas. Se caracteriza por una hipertrofia ventricular izquierda no explicada por otras causas, y presenta gran heterogeneidad en cuanto a sus manifestaciones clínicas1. La muerte súbita es la manifestación más grave de la enfermedad, particularmente frecuente y dramática en pacientes jóvenes. La incidencia de muerte súbita en poblaciones no seleccionadas es inferior a la descrita en series iniciales procedentes de centros de referencia, y actualmente se estima que es inferior al 1% anual2–4. La mayoría de las muertes súbitas en esta población se deben a fibrilación ventricular. El tratamiento médico no ha mostrado efecto protector5, por lo que el desfibrilador automático implantable (DAI) es la única terapia considerada efectiva para disminuir el riesgo de muerte súbita, si bien no se han realizado estudios aleatorizados en esta población6. Los pacientes de mayor riesgo son los que ya han presentado episodios de taquicardia ventricular sostenida o fibrilación ventricular, y para ellos el implante de un DAI está indicado como prevención secundaria7. Para el resto de los pacientes, la decisión de implantar un DAI se basa en la estimación individual del riesgo de muerte súbita. Para tratar de identificar a los pacientes con mayor riesgo, se han descrito cinco criterios clínicos, procedentes de estudios de cohortes, que se consideran factores de riesgo mayores8,9: la presencia de síncope no explicado, antecedente de muerte súbita en familiares de primer grado, grosor de pared ventricular ≥ 30 mm, taquicardia ventricular no sostenida en estudio Holter, y respuesta anormal de la presión arterial (respuesta plana o hipotensiva) en la prueba de esfuerzo. Las guías de práctica clínica de la Sociedad Europea de Cardiología sobre MCH (2003)10 y prevención de muerte súbita (2006)11 y las más recientes de American College of Cardiology Foundation/American Heart Association (2011)12 recomiendan considerar el implante de DAI profiláctico para pacientes con uno o más factores de riesgo mayores, aun reconociendo que muchos de ellos no recibirán terapias del desfibrilador durante muchos años. Hay escasos datos publicados sobre el seguimiento de los pacientes que reciben un DAI cumpliendo las indicaciones de estas guías13–15. El objetivo de este trabajo es analizar el seguimiento de los pacientes con MCH que recibieron un DAI en el ámbito de la práctica clínica habitual en tres centros que atienden habitualmente a pacientes con esta afección.
MÉTODOSSe trata de un estudio observacional retrospectivo de todos los pacientes con MCH a los que se implantó un desfibrilador, entre enero de 1996 y diciembre de 2012, en tres centros terciarios de la provincia de Barcelona: Hospital Universitari Vall d’Hebron (Barcelona), Hospital Universitari de Bellvitge (L’Hospitalet de Llobregat) y Hospital Universitari Germans Trias i Pujol (Badalona). El diagnóstico de MCH se realizó mediante ecocardiografía según el grosor de pared ventricular fuera ≥ 15 mm sin causa identificable. Se indicó implante de DAI como prevención secundaria a los pacientes que hubieran sufrido arritmias ventriculares sostenidas espontáneas o muerte súbita recuperada. A los pacientes con uno o más factores de riesgo de muerte súbita, se les indicó el implante de DAI como prevención primaria. Se consideraron fundamentalmente los cinco factores de riesgo mayores enumerados previamente, si bien teniendo en cuenta otros factores modificadores, como la edad, la presencia de obstrucción en el tracto de salida o la presencia de fibrosis importante en la resonancia magnética.
Se obtuvo el consentimiento informado de todos los pacientes antes del implante del desfibrilador.
Se realizó seguimiento clínico junto con interrogación del DAI al menos cada 6 meses. Los dispositivos se programaron según el criterio del médico responsable. Se analizaron los electrogramas del dispositivo para clasificar las terapias en apropiadas o inapropiadas. Se consideró apropiadas las descargas de alta energía o las terapias antitaquicárdicas administradas como respuesta a una taquiarritmia ventricular sostenida. Se consideró inapropiadas las descargas de alta energía administradas en ausencia de arritmia ventricular.
La variable de resultado principal fue la supervivencia libre de terapias apropiadas del DAI. Se analizó también la incidencia de descargas inapropiadas y complicaciones relacionadas con el DAI, así como la mortalidad total.
Análisis estadísticoSe utilizó el software estadístico SPSS v.17.0. Para las variables continuas, se calculó la media±desviación estándar. Las variables categóricas se presentan en forma de porcentajes. El tiempo de seguimiento se calculó desde el momento del implante hasta el último seguimiento (junio de 2013 o la fecha de fallecimiento). Las comparaciones entre grupos se realizaron mediante el test de la χ2 en el caso de variables cualitativas y mediante el test de la U de Mann-Whitney para variables cuantitativas. La incidencia de terapias apropiadas en los grupos de prevención primaria y secundaria se calculó por cada 100 pacientes-año, considerando el tiempo desde el implante hasta la primera terapia apropiada, y se estimaron las tasas acumuladas según el método de Kaplan-Meyer. La comparación entre los grupos se realizó mediante la prueba de los rangos logarítmicos. Se analizó la asociación entre distintas variables clínicas y la incidencia de terapias apropiadas mediante análisis de regresión de Cox, y los resultados se expresan como hazard ratio con sus correspondientes intervalos de confianza del 95%. Se consideró significativo un valor de p<0,05.
RESULTADOSSe incluyó a 69 pacientes, de los que 55 (79,3%) eran varones, con una media de edad en el momento del implante de 44,8±17 (intervalo, 13-73) años. La indicación del DAI fue en prevención secundaria para 21 pacientes (30,4%) y en prevención primaria para 48 (69,6%). De los 21 pacientes en prevención secundaria, 13 habían experimentado muerte súbita recuperada por fibrilación ventricular y 8, taquicardia ventricular sostenida. Desde 1996 hasta 2003, se implantaron 9 desfibriladores, 6 de ellos como prevención secundaria. A partir de 2004 hubo un aumento significativo del número de dispositivos implantados, con mayor porcentaje en prevención primaria: 18 entre 2004 y 2008 (el 72% en prevención primaria) y 42 entre 2009 y 2012 (el 76% en prevención primaria).
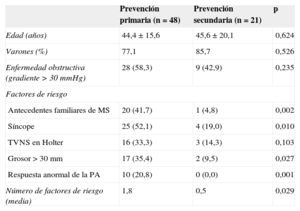
De los 48 pacientes en prevención primaria, la mayoría (64,7%) tenía dos o más factores de riesgo mayores; 14 pacientes (29,2%) tenían un solo factor de riesgo: 6 pacientes con síncope, 4 con antecedentes familiares de muerte súbita, 3 con hipertrofia > 30 mm y 1 con taquicardia ventricular no sostenida en el estudio Holter. En 3 pacientes en prevención primaria (6,3%) se implantó DAI aunque no se diera ninguno de los factores de riesgo clásicos: uno de ellos fue remitido de otro centro, donde se indujo una fibrilación ventricular en estudio electrofisiológico; otro por fibrosis masiva en la resonancia magnética; el último por ser un paciente joven con importante gradiente en el tracto de salida, con síntomas refractarios y limitantes, al que se decidió implantar un desfibrilador para estimulación bicameral secuencial. Se halló obstrucción en el tracto de salida, considerada factor modificador de riesgo, en 28 pacientes (58,3%).
De los 21 pacientes en prevención secundaria, 12 (57,1%) no tenían factores de riesgo conocidos previamente, 8 (38,1%) tenían un factor de riesgo y 1 (4,2%) tenía dos factores de riesgo; 9 de los 21 pacientes tenían obstrucción en el tracto de salida (42,9%).
La media de factores de riesgo por paciente fue de 1,8 en el grupo de prevención primaria y 0,5 en el de prevención secundaria (p=0,029).
La tabla 1 resume los factores de riesgo de los pacientes en prevención primaria y secundaria.
Características clínicas y factores de riesgo previos al implante de los pacientes en prevención primaria y secundaria
| Prevención primaria (n=48) | Prevención secundaria (n=21) | p | |
|---|---|---|---|
| Edad (años) | 44,4±15,6 | 45,6±20,1 | 0,624 |
| Varones (%) | 77,1 | 85,7 | 0,526 |
| Enfermedad obstructiva (gradiente > 30 mmHg) | 28 (58,3) | 9 (42,9) | 0,235 |
| Factores de riesgo | |||
| Antecedentes familiares de MS | 20 (41,7) | 1 (4,8) | 0,002 |
| Síncope | 25 (52,1) | 4 (19,0) | 0,010 |
| TVNS en Holter | 16 (33,3) | 3 (14,3) | 0,103 |
| Grosor > 30 mm | 17 (35,4) | 2 (9,5) | 0,027 |
| Respuesta anormal de la PA | 10 (20,8) | 0 (0,0) | 0,001 |
| Número de factores de riesgo (media) | 1,8 | 0,5 | 0,029 |
MS: muerte súbita; PA: presión arterial; TVNS: taquicardia ventricular no sostenida.
Salvo otra indicación, los valores expresan media±desviación estándar o n (%).
En cuanto al tratamiento médico previo al implante, 37 pacientes (53,6%) recibían bloqueadores beta; 6 (8,7%), amiodarona y 2 (2,9%), antagonistas del calcio.
La mayoría de los desfibriladores (50 pacientes, el 72,5%) fueron bicamerales, aunque solo 19 (27,5%) requerían estimulación para disminuir el gradiente o, menos frecuentemente, por bradicardia sinusal.
La mediana de seguimiento fue de 40,5 meses. A pesar de que en los primeros años de la serie había más pacientes en prevención secundaria, no hubo diferencia estadísticamente significativa en cuanto a los tiempos de seguimiento entre el grupo de prevención primaria y el de prevención secundaria. No hubo pérdidas en el seguimiento.
Terapias apropiadasDe los 21 pacientes en prevención secundaria, 14 (66,7%) tuvieron terapias apropiadas durante el seguimiento. La mayoría (11 pacientes) recibió descargas del DAI, y 3 pacientes recibieron únicamente terapia antitaquicardia.
De los 48 pacientes en prevención primaria, 3 (6,3%) tuvieron terapias apropiadas. De ellos, 1 paciente recibió terapia antitaquicardia y descargas. Los otros 2 pacientes no recibieron descargas, sino solamente terapia antitaquicardia. El único paciente en prevención primaria que recibió descargas de alta energía del DAI era de edad avanzada (73 años) y tenía obstrucción grave en el tracto de salida (120 mmHg), clase funcional III y síncopes de repetición, así como antecedentes familiares de muerte súbita. No se había realizado estudio Holter, pero sí un estudio electrofisiológico en el que se indujo taquicardia ventricular sostenida. Se trataba, pues, de un paciente con enfermedad muy evolucionada, que tuvo su primera terapia apropiada apenas 2 meses después del implante del DAI y falleció 3 años más tarde por insuficiencia cardiaca.
La tasa de incidencia general de terapias apropiadas fue de 7,8/100 pacientes-año. En el grupo de prevención secundaria, la incidencia de terapias apropiadas fue de 32,7/100 pacientes-año, y en el grupo de prevención primaria de, 1,7/100 pacientes-año (p<0,001).
La mayoría de las terapias apropiadas (58,8%) ocurrieron en el primer año tras el implante (4 días-7 años). En los 3 pacientes en prevención primaria que tuvieron terapias apropiadas, estas ocurrieron transcurrida una media de 40,5 meses desde el implante, mientras que para los pacientes en prevención secundaria el tiempo medio fue 18,3 meses (diferencia sin significación estadística).
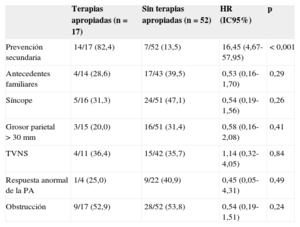
En el análisis univariable mediante regresión de Cox, el único factor que se asoció a la presencia de terapias apropiadas fue el antecedente de arritmias ventriculares sostenidas previas al implante (es decir, implante como prevención secundaria) (tabla 2). Ninguno de los factores de riesgo clásicos por sí solo fue predictor de terapias apropiadas. De los 17 pacientes que recibieron terapias apropiadas (incluidos los de prevención primaria y los de prevención secundaria), 5 no tenían ningún factor de riesgo previo conocido, 9 tenían un factor de riesgo y 3 tenían dos o más factores de riesgo.
Asociación entre factores de riesgo e incidencia de terapias apropiadas. Análisis univariable (regresión de Cox)
| Terapias apropiadas (n=17) | Sin terapias apropiadas (n=52) | HR (IC95%) | p | |
|---|---|---|---|---|
| Prevención secundaria | 14/17 (82,4) | 7/52 (13,5) | 16,45 (4,67-57,95) | < 0,001 |
| Antecedentes familiares | 4/14 (28,6) | 17/43 (39,5) | 0,53 (0,16-1,70) | 0,29 |
| Síncope | 5/16 (31,3) | 24/51 (47,1) | 0,54 (0,19-1,56) | 0,26 |
| Grosor parietal > 30 mm | 3/15 (20,0) | 16/51 (31,4) | 0,58 (0,16-2,08) | 0,41 |
| TVNS | 4/11 (36,4) | 15/42 (35,7) | 1,14 (0,32-4,05) | 0,84 |
| Respuesta anormal de la PA | 1/4 (25,0) | 9/22 (40,9) | 0,45 (0,05-4,31) | 0,49 |
| Obstrucción | 9/17 (52,9) | 28/52 (53,8) | 0,54 (0,19-1,51) | 0,24 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; PA: presión arterial; TVNS: taquicardia ventricular no sostenida.
Los valores expresan n/N (%).
Durante el seguimiento fallecieron 7 pacientes (10,1%), 3 del grupo de prevención primaria (mortalidad del 6,2%) y 4 del grupo de prevención secundaria (mortalidad del 19,0%). Hubo 5 muertes de causa cardiaca (2 por insuficiencia cardiaca, 2 por muerte súbita sin arritmias documentadas en el DAI, 1 por tormenta arrítmica), 1 paciente falleció por ictus y 1 paciente, por shock séptico de origen respiratorio.
Complicaciones del implante y descargas inapropiadasSe observaron complicaciones relacionadas con el implante en 6 pacientes (8,7%), 4 del grupo de prevención primaria y 2 en prevención secundaria. Las complicaciones fueron: 2 neumotórax, 2 infecciones de dispositivo y 2 disfunciones de electrodo que requirieron reintervención.
Durante el seguimiento, 9 pacientes (13%), 4 en prevención primaria y 5 en prevención secundaria, recibieron descargas inapropiadas. En 7 pacientes se debieron a arritmias supraventriculares (fibrilación auricular en 5 pacientes, taquicardia paroxística supraventricular en 2) y en 2 se debieron a sobredetección de señal.
No hubo diferencias significativas en cuanto a las tasas de complicaciones y de descargas inapropiadas entre los grupos de prevención primaria y secundaria.
DISCUSIÓNDe esta serie de tres centros con pacientes no seleccionados cuya indicación de DAI se estableció siguiendo las guías de práctica clínica, se puede obtener las siguientes conclusiones: por una parte, los pacientes en prevención secundaria son un grupo de alto riesgo con elevadas tasas de recurrencias y de terapias apropiadas del DAI; en cambio, entre los 48 pacientes en prevención primaria, con un seguimiento medio de 45 meses, solamente 3 tuvieron terapias apropiadas. Además, solo uno de ellos recibió descargas de alta energía, mientras que los otros dos únicamente recibieron terapia antitaquicardia. En este sentido, cabe preguntarse si las terapias eran realmente necesarias. No siempre una terapia apropiada implica una vida salvada16, y más teniendo en cuenta que los pacientes con MCH tienen frecuentemente taquicardias ventriculares no sostenidas, a menudo asintomáticas17, que pueden ser detectadas por el DAI y desencadenar una terapia antitaquicardia que se podría haber evitado, por ejemplo, alargando los tiempos de detección para permitir que la taquicardia se autolimite18. La programación de los dispositivos no se realizó sistemáticamente, por lo que es posible que se pudiera haber evitado algunas terapias apropiadas.
Con estas consideraciones, y teniendo en cuenta que la incidencia de muerte súbita en la población de MCH está en torno al 1% anual, el hecho de tener entre los pacientes a quienes se indica DAI una tasa de terapias apropiadas parecida a la tasa de muerte súbita observada en pacientes no seleccionados indica que, posiblemente, los criterios actuales de selección no permiten predecir de manera fiable la ocurrencia de muerte súbita o de arritmias ventriculares. Prueba de ello es que más de la mitad de los pacientes incluidos en prevención secundaria por haber tenido arritmias ventriculares sostenidas o muerte súbita no presentaban a priori ninguno de los criterios que hubiesen indicado implantarles un DAI como prevención primaria. La incorporación de nuevas técnicas como el estudio genético19,20 o la cuantificación de fibrosis mediante resonancia magnética21 puede ayudar en el futuro a una mejor selección de pacientes candidatos a DAI como prevención primaria.
Otro aspecto relevante es el de las complicaciones del DAI, que no fueron despreciables en esta serie. Destaca que, en el grupo de prevención primaria, la tasa de complicaciones (incluidas las descargas inapropiadas) fue más del doble que la tasa de terapias apropiadas. Los pacientes con MCH son más susceptibles de presentar complicaciones y descargas inapropiadas, debido a la edad joven y a la mayor prevalencia de fibrilación auricular22. Estos pacientes jóvenes necesitarán, además, múltiples reintervenciones por agotamiento de batería y por posibles disfunciones de electrodo con el paso del tiempo, por lo que la tasa de complicaciones a largo plazo puede ser mayor23.
Dos pacientes presentaron muerte súbita y no tenían arritmias documentadas en el DAI. Los pacientes con MCH, por lo tanto, pueden sufrir muerte súbita por mecanismos no arrítmicos, y el implante de DAI no siempre garantiza una protección absoluta.
LimitacionesEntre las limitaciones del estudio están el pequeño tamaño de la muestra y su carácter retrospectivo. En los tres centros participantes se dispone de bases de datos específicas de pacientes portadores de DAI, por lo que la inclusión de los pacientes y el seguimiento de los dispositivos son exhaustivos. Sin embargo, no se analizaron los datos de pacientes con MCH que no hubieran recibido DAI, ya sea por no tener indicación o por otros motivos, por lo que es posible que exista un sesgo de selección. En los tres centros la decisión de implantar un DAI se consensúa entre distintos miembros del equipo médico, que incluye a cardiólogos clínicos y arritmólogos, teniendo en cuenta el riesgo individual que se estima en cada paciente y las recomendaciones de las guías de práctica clínica. En todo caso, la cohorte de pacientes con DAI en prevención primaria estaría formada por los individuos para quienes se ha predicho un riesgo elevado de muerte súbita, por lo que, de haber un sesgo de selección, el efecto sería una sobrestimación del beneficio del DAI.
El tiempo de seguimiento fue mayor para los pacientes en prevención secundaria, y esto puede aumentar el porcentaje de pacientes con terapias apropiadas tardías. Esta diferencia en el tiempo de seguimiento medio no fue significativa y, además, la mayor parte de las terapias ocurrieron en los primeros años de seguimiento, por lo que es improbable que esta diferencia tenga impacto en los resultados obtenidos.
A pesar de estas limitaciones, los participantes en este estudio consideran que es representativo de los resultados que se puede esperar en la mayoría de los pacientes con MCH en la práctica real de centros que no son de referencia para esta afección.
CONCLUSIONESLos pacientes a los que se implanta un DAI como profilaxis primaria de muerte súbita siguiendo las guías de práctica clínica actuales tienen una tasa de terapias apropiadas excesivamente baja y no muy diferente de la tasa de muerte súbita observada en pacientes no seleccionados con MCH, lo que indica que los criterios actuales de estratificación de riesgo tienen bajo poder predictivo y deberían revisarse. Los pacientes que ya han experimentado arritmias sostenidas son un grupo de alto riesgo, y para ellos el implante de DAI está plenamente justificado.
CONFLICTO DE INTERESESNinguno.