El desfibrilador subcutáneo (S-ICD) surge como alternativa al transvenoso. La incidencia de complicaciones es similar, y los choques inapropiados (CI) son más frecuentes que lo observado con programaciones contemporáneas en los transvenosos. Tras aprobarse en 2009 en Europa, se han implementado diversas mejoras. Se expone el resultado en un centro con el implante de S-ICD, cuya experiencia se inició tardíamente, a finales de 2013.
MétodosEstudio prospectivo observacional con inclusión de pacientes consecutivos con indicación de desfibrilador y sin indicación de estimulación permanente o resincronización cardiaca, a los que se implantó un S-ICD. Se analizaron datos del implante y seguimiento a largo plazo.
ResultadosSe implantó un S-ICD a 50 pacientes que habían superado el cribado electrocardiográfico pertinente. La media de edad era 46,9±15 (15-78) años, y el 72% eran varones. El 38% presentaba una fracción de eyección del ventrículo izquierdo ≤ 35%, y la cardiopatía isquémica fue la más frecuente (34%), seguida de la miocardiopatía hipertrófica (18%). Se usó la técnica intermuscular, con 3 incisiones en el 10% y 2 en el 90%. Se indujo fibrilación ventricular a 49 pacientes, con eficacia del 100% en su conversión. Tras un seguimiento medio de 18,1 (2,3-44,8) meses, no se produjeron complicaciones tardías que requirieran revisión quirúrgica ni CI (0%), y 1 paciente (2%) recibió choques apropiados.
ConclusionesLas mejoras tecnológicas, de implante y programación, junto con una selección adecuada de pacientes, han permitido obtener unos excelentes resultados agudos y a largo plazo, especialmente por la ausencia de CI y complicaciones que requirieran revisión quirúrgica.
Palabras clave
Para minimizar los riesgos para los pacientes de los cables endovasculares con los desfibriladores automáticos implantables (DAI) convencionales, pero sin detrimento de su eficacia, se ha desarrollado un sistema de desfibrilación implantable completamente subcutáneo (S-ICD, Boston Scientific), cuyos resultados iniciales son prometedores, aunque no exentos de complicaciones y con tasas de choques inapropiados (CI) de entre el 5 y el 25% en las primeras experiencias informadas1, sensiblemente superiores a las observadas con programaciones contemporáneas de DAI transvenosos, que pueden llegar a ser<5%2. En nuestro medio, la experiencia con el S-ICD es aún muy escasa, pues los primeros implantes se realizaron en 2013, fecha muy posterior a cuando se inició el implante en otros países europeos3,4. Desde su comercialización, y mayoritariamente debido a la experiencia acumulada, se han implementado diversas mejoras en las técnicas de implante5–8, la programación9 e incluso relacionadas con el dispositivo en sí en cuanto a su tamaño y la adición de nuevo software10,11, que están contribuyendo a reducir la incidencia de problemas relacionados con este nuevo dispositivo.
El presente trabajo describe la experiencia en un centro con el empleo contemporáneo del S-ICD, experiencia que, por tardía, ha permitido incorporar mayoritariamente desde el inicio las mejoras citadas, lo cual permite analizar su papel para reducir la incidencia de complicaciones.
MÉTODOSEstudio prospectivo observacional, realizado en un centro, en el que se detalla la experiencia con el S-ICD en pacientes consecutivos, describiendo datos de los pacientes seleccionados, el cribado electrocardiográfico previo, el implante, las pruebas de inducción de arritmias ventriculares, el seguimiento y las complicaciones acaecidas hasta la última revisión en cada paciente. Se consideraron 2 tipos de complicaciones: periimplante, que engloba las ocurridas durante el implante o en las primeras 24 h tras este, y tardías, las acaecidas más de 24 h tras el implante.
PacientesDesde octubre de 2013 hasta abril de 2017, se seleccionó para implante de S-ICD a pacientes con indicación estándar de DAI, que no tuviesen indicación de terapia de resincronización cardiaca ni de estimulación cardiaca permanente. La elección de este dispositivo en lugar de un DAI transvenoso fue variando a lo largo del periodo de inclusión con la evidencia sobre esta nueva terapia disponible en la bibliografía en cada momento.
A todos los pacientes seleccionados se les explicó el carácter novedoso de esta terapia y la menor evidencia a largo plazo disponible respecto a los DAI transvenosos. Todos los pacientes firmaron un consentimiento informado antes del implante.
DispositivoLa descripción del S-ICD y su funcionamiento se ha detallado previamente12,13. Se han implantado 3 modelos de S-ICD: inicialmente el dispositivo Cameron S-ICD SQ-RX 1010 (con un volumen de 69,9ml y longevidad estimada en 5,1 años), después el Emblem S-ICD A209 y posteriormente el Emblem MRI S-ICD A219 (estos con un volumen de 59,5ml y longevidad estimada en 7,3 años; el Emblem MRI S-ICD A219 tiene un nuevo algoritmo, SMART pass, que activa un filtro de 9Hz diseñado para reducir la amplitud de señales de baja frecuencia manteniendo un margen de detección adecuado, lo que mejora la detección en caso de ondas T o P de gran amplitud10, que también se introdujo a partir de la fecha de comercialización del Emblem MRI S-ICD A219 en todos los dispositivos Emblem S-ICD A209 mediante una actualización de software en abril de 2016). Previamente, en septiembre de 2014, se había añadido, también mediante actualización de software de los dispositivos ya implantados y en todos los nuevos implantados a partir de esa fecha, un algoritmo adicional en la fase de certificación del dispositivo (algoritmo ACWADD) para reducir la posibilidad de sobresensado de onda T11.
Evaluación electrocardiográfica previaSe realizó un cribado electrocardiográfico que determinara la conveniencia de implantar un S-ICD, para minimizar el riesgo de CI por detección inadecuada de señales. Solo en el caso de que el análisis fuera satisfactorio al menos en una derivación o vector tanto en decúbito supino como en bipedestación, se consideró apropiado programar el implante del S-ICD. En todos los casos se evaluó la posición teórica paraesternal izquierda y derecha del cable.
ImplanteLos implantes se realizaron con anestesia local y sedoanalgesia consciente o con anestesia local y general y ventilación mecánica, en función de que se dispusiera de anestesiólogo o no. Se realizó profilaxis antibiótica. No se utilizó radioscopia durante los implantes. Se utilizó inicialmente la técnica de 3 incisiones, y posteriormente, tras su descripción y a la vista de su simplicidad y seguridad, la de 2 incisiones que obvia la incisión más craneal paraesternal7. Se realizó una prueba de inducción de fibrilación ventricular con el propio dispositivo, con una zona de choques exclusiva programada en 170 lpm, y programando un choque inicial con el S-ICD de 65J, y en caso de no que no fuera eficaz, un choque adicional con polaridad invertida de 80J, y finalmente choques de 300J con desfibrilador externo. Se programó el dispositivo con 2 zonas, una condicional con algoritmo de discriminación de arritmias no ventriculares y una exclusiva de choques.
SeguimientoSe realizaron seguimientos presenciales a los 3 meses del implante y luego cada 6-12 meses. Además, mediante el sistema Latitude de Boston Scientific se hizo seguimiento a distancia de los pacientes a los que se implantaron generadores de segunda y tercera generación.
Análisis estadísticoPara el análisis de los datos se utilizó el programa SPSS (versión 20.0, IBM Corp.; Armonk, New York, Estados Unidos). Las variables continuas se expresan como media±desviación típica; las variables categóricas, como valor absoluto y porcentaje.
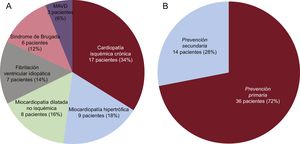
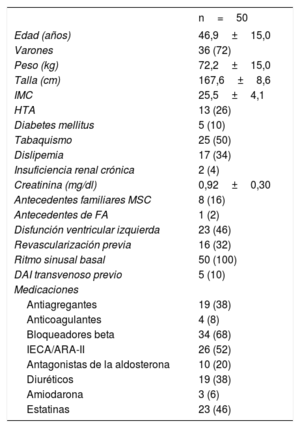
RESULTADOSCaracterísticas de los pacientesSe seleccionó para implante de S-ICD a 56 pacientes; 6 finalmente no recibieron un S-ICD por diversas razones: 3 por no pasar el cribado electrocardiográfico previo, 1 porque el paciente decidió que no se le implantara ningún tipo de dispositivo, 1 porque prefirió que se le implantara un DAI transvenoso y 1 porque necesitaba estimulación permanente. Las características generales de los 50 pacientes a los que finalmente se implantó un S-ICD se detallan en la tabla 1, y el tipo de cardiopatía de los pacientes y el tipo de indicación se refleja en la figura 1. Datos iniciales de los primeros 8 pacientes a los que se implantó un S-ICD en el centro ya se han publicado13. La media de edad era 46,9±15 (15-78) años y la del índice de masa corporal, 25,5±4,1 (16,5-35,0). Algo más de un tercio de los pacientes (el 38%, 19 pacientes) presentaban una fracción de eyección del ventrículo izquierdo ≤ 35%. El 100% de los pacientes estaban en clase funcional de la New York Heart AssociationI o II. Cinco pacientes (10%) ya llevaban un DAI transvenoso, y la razón de implantar un S-ICD fue la disfunción del cable de desfibrilación en 2 y la infección previa del sistema en los 3 restantes.
Características generales de los pacientes
| n=50 | |
|---|---|
| Edad (años) | 46,9±15,0 |
| Varones | 36 (72) |
| Peso (kg) | 72,2±15,0 |
| Talla (cm) | 167,6±8,6 |
| IMC | 25,5±4,1 |
| HTA | 13 (26) |
| Diabetes mellitus | 5 (10) |
| Tabaquismo | 25 (50) |
| Dislipemia | 17 (34) |
| Insuficiencia renal crónica | 2 (4) |
| Creatinina (mg/dl) | 0,92±0,30 |
| Antecedentes familiares MSC | 8 (16) |
| Antecedentes de FA | 1 (2) |
| Disfunción ventricular izquierda | 23 (46) |
| Revascularización previa | 16 (32) |
| Ritmo sinusal basal | 50 (100) |
| DAI transvenoso previo | 5 (10) |
| Medicaciones | |
| Antiagregantes | 19 (38) |
| Anticoagulantes | 4 (8) |
| Bloqueadores beta | 34 (68) |
| IECA/ARA-II | 26 (52) |
| Antagonistas de la aldosterona | 10 (20) |
| Diuréticos | 19 (38) |
| Amiodarona | 3 (6) |
| Estatinas | 23 (46) |
ARA-II: antagonistas del receptor de la angiotensina II; DAI: desfibrilador automático implantable; FA: fibrilación auricular; HTA: hipertensión arterial; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; MSC: muerte súbita cardiaca.
Los valores expresan n (%) o media ± desviación estándar.
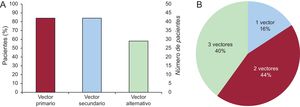
Se realizó el cribado electrocardiográfico en reposo en todos los pacientes. El resultado del cribado electrocardiográfico se refleja en la figura 2.
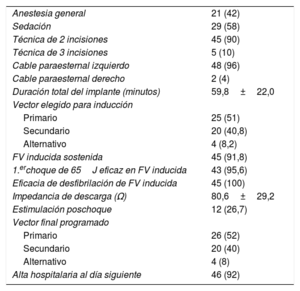
Datos del implante, prueba de inducción y programación finalTodos los implantes se realizaron en la sala de electrofisiología por 4 cardiólogos con amplia experiencia en implantes de todo tipo de dispositivos electrónicos cardiacos. Solo en 1 paciente se realizó el implante con el paciente anticoagulado, ya que era portador de una prótesis mecánica tricúspide14. Se consiguió implantar satisfactoriamente el S-ICD en los 50 pacientes (100%) en los que se intentó, en 2 de ellos con el cable en posición paraesternal derecha (4%) y en los demás, en posición paraesternal izquierda (96%) (figura 3). Recibieron un dispositivo Cameron S-ICD SQ-RX 1010 los primeros 10 pacientes (el 20% del total), un Emblem S-ICD A209 los 18 pacientes siguientes (el 36% del total) y el dispositivo Emblem MRI S-ICD A219 se implantó en los últimos 22 pacientes (44%). Los datos fundamentales de los procedimientos de implante se detallan en la tabla 2. Se realizó una prueba de inducción y detección de fibrilación ventricular (figura 4A) en todos los pacientes excepto 1 (2%) (por un trombo ventricular izquierdo apical), con eficacia del 100% del S-ICD, y solo en 2 pacientes, tras un choque no eficaz de 65J con polaridad estándar, fue necesario un segundo choque de máxima energía (80J) con polaridad invertida. El tiempo medio a terapia de la fibrilación ventricular inducida fue de 16,7±2,8 (13,4-26) s. Solo en 4 pacientes de los 45 en que se intentó (8,8%) no se consiguió inducir una arritmia ventricular sostenida pese a realizar hasta 3 intentos con hasta 5 s de corriente continua con el dispositivo. Se programaron las 2 zonas con las siguientes frecuencias de corte: la zona condicional con límite de 220 lpm en 4 pacientes, de 200 lpm en 37, de 180 lpm en 8 y de 170 lpm en 1, y la zona de choques con límite de 250 lpm en 45 pacientes y de 240 lpm en 5. La programación más habitual fue la de una zona condicional desde 200 lpm y una de choques a partir de 250 lpm (36 pacientes, el 72% del total).
Datos del implante y prueba de inducción
| Anestesia general | 21 (42) |
| Sedación | 29 (58) |
| Técnica de 2 incisiones | 45 (90) |
| Técnica de 3 incisiones | 5 (10) |
| Cable paraesternal izquierdo | 48 (96) |
| Cable paraesternal derecho | 2 (4) |
| Duración total del implante (minutos) | 59,8±22,0 |
| Vector elegido para inducción | |
| Primario | 25 (51) |
| Secundario | 20 (40,8) |
| Alternativo | 4 (8,2) |
| FV inducida sostenida | 45 (91,8) |
| 1.erchoque de 65J eficaz en FV inducida | 43 (95,6) |
| Eficacia de desfibrilación de FV inducida | 45 (100) |
| Impedancia de descarga (Ω) | 80,6±29,2 |
| Estimulación poschoque | 12 (26,7) |
| Vector final programado | |
| Primario | 26 (52) |
| Secundario | 20 (40) |
| Alternativo | 4 (8) |
| Alta hospitalaria al día siguiente | 46 (92) |
FV: fibrilación ventricular.
Los valores expresan n (%) o media±desviación estándar.
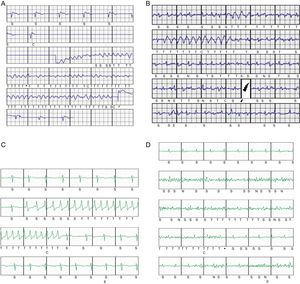
A: episodio de inducción de fibrilación ventricular tras el implante en un paciente, con conversión eficaz a ritmo sinusal con un choque del desfibrilador subcutáneo de 65J. B: choques inapropiados periimplante debido a fibrilación auricular rápida con complejos anchos intermitentes; programadas 2 zonas, condicional 180 lpm, choques a 250 lpm. C: episodio de taquicardia ventricular monomórfica no sostenida que determina el inicio de la carga del dispositivo; programadas 2 zonas, condicional 200 lpm, choques a 250 lpm. D: episodio clasificado como taquicardia ventricular no sostenida debido a sobresensado de señales no fisiológicas generadas por la movilización de la extremidad superior izquierda de una paciente; programadas 2 zonas, condicional 200 lpm, choques a 250 lpm.
La tasa de pacientes libres de complicaciones periimplante fue del 96%. Se produjeron complicaciones periimplante en 2 pacientes (4%). En 1 paciente, tras inducirse una fibrilación ventricular que se detectó correctamente y se trató eficazmente con el primer choque, al despertar de la anestesia y con el dispositivo programado con 2 zonas (180 y 250 lpm), presentó un estado de agitación intensa con caída en fibrilación auricular muy rápida, con complejos anchos intermitentes (complejos aberrados o ventriculares); además, se produjo sobredetección de señales y recibió 2 CI (figura 4B) para después pasar a ritmo sinusal tras la remisión del cuadro de agitación. En otro paciente, minutos después de cerrar la bolsa se apreció hematoma de bolsa de generador que necesitó reapertura inmediata, en la que se documentó un punto interno sangrante activo, que se cauterizó sin incidencias.
En todos los casos, la radiografía de tórax realizada al día siguiente confirmó la normal posición del sistema y no se observaron complicaciones. La mayoría de los pacientes recibieron el alta hospitalaria al día siguiente, y cuando no, fue por motivos no relacionados con el implante y en todos los casos, pacientes cuyo ingreso no se originó por el implante. No se produjo ningún agotamiento prematuro de batería. Recibieron un monitor para control remoto domiciliario por el sistema Latitude todos los pacientes que recibieron un dispositivo de la segunda o la tercera generación (40 pacientes, el 80% del total).
Se siguió más de 1 año tras el implante a un total de 33 pacientes (66%). Tras un seguimiento medio de 18,1 (2,3-44,8) meses, solo 1 paciente (2%) presentó episodios de arritmias ventriculares que precisaran choques apropiados del dispositivo, y en 3 (6%) se registró un episodio asintomático de taquicardia ventricular autolimitada antes de recibir un choque (figura 4C), detectados prematuramente al activarse una alerta en el sistema Latitude. Destaca que, en el periodo de seguimiento de los 50 pacientes, no se produjeron CI en ningún paciente (0%).
Solo en 1 paciente, a los 18 meses tras el implante, se cambió el vector de detección inicialmente programado debido a un episodio de ruido que activó una alerta sin choque, que se reproducía al movilizar la extremidad superior izquierda (figura 4D). Se produjo el fallecimiento de 1 paciente (el 2% de mortalidad) por causa no cardiovascular, neoplasia vesical, a los 10 meses del implante; la tasa de pacientes libres de complicaciones tardías fue del 98%, y no hubo ningún caso que requiriera revisión quirúrgica del sistema. Un paciente (2%) tuvo a los 3 meses del implante una infección de la herida paraesternal tras la técnica de 2 incisiones, con cultivos positivos para Staphylococcus aureus, resuelta mediante tratamiento antibiótico intravenoso.
DISCUSIÓNPrincipales hallazgosEn esta experiencia de inicio tardío con el implante de S-ICD en un centro, se observan unos resultados muy favorables, con una tasa de complicaciones periimplante asumible y con ausencia total de complicaciones tardías que necesitasen revisión quirúrgica del sistema implantado. Aún más destacable es la ausencia de CI en el seguimiento realizado, superior a 1 año en el 60% de los pacientes. La eficacia en el tratamiento de arritmias ventriculares inducidas fue absoluta, en línea con los datos previos de la bibliografía.
Características de los pacientesDe modo similar a lo observado en las principales series publicadas de pacientes con S-ICD15–17, la media de edad de los pacientes (46,9 años) es menor que la habitualmente observada en registros de pacientes que reciben un DAI, incluido el registro español18. En gran medida, se debe a un mayor porcentaje de pacientes con miocardiopatía arritmogénica del ventrículo derecho, síndrome de Brugada o miocardiopatía hipertrófica (el 38% del total), enfermedades sin embargo asociadas a mayor riesgo de que se produzcan terapias inapropiadas en pacientes con DAI, y en relación con el S-ICD específicamente, también asociadas con mayor frecuencia con una peor detección de la señal cardiaca y potenciales cambios dinámicos del QRS-T y, por lo tanto, más propensos a los CI19–22.
La cardiopatía isquémica crónica fue la enfermedad de base más habitual en esta cohorte (34%); el 46% de los pacientes tenían disfunción sistólica ventricular izquierda, y los implantes en prevención primaria fueron más habituales que lo observado en nuestro medio con DAI en general18, pero similar a lo observado en las principales series publicadas con S-ICD15–17. En una cohorte de 856 pacientes con un S-ICD y tras un seguimiento medio de más de 600 días, Boersma et al.23 informaron de que el rendimiento del S-ICD no difirió en función de que la indicación fuera en prevención primaria o secundaria, y en prevención primaria fue independiente de que la función ventricular izquierda estuviera deprimida o no, algo que se corrobora en la cohorte que se presenta.
Implante y complicaciones relacionadasLa técnica quirúrgica de 2 incisiones fue la empleada de manera general desde el sexto paciente de la serie, con colocación intermuscular del generador en todos los casos. Solo se produjeron 1 hematoma periimplante (2%) y 1 (2%) infección en el seguimiento que no requirió revisión quirúrgica. En la mayor serie publicada de pacientes con S-ICD17, con 1.637 pacientes, la tasa de complicaciones en los 30 días tras el implante relacionadas con el dispositivo o el procedimiento fue del 4,7%, y del 4,5% a los 30 días en el análisis combinado de los estudios IDE y EFFORTLESS24 con 882 pacientes, con un 11,1% de pacientes con complicaciones a los 3 años, de las que la infección con necesidad de revisión quirúrgica fue la más frecuente (el 1,7% de los pacientes). Esta nueva técnica de 2 incisiones simplifica el procedimiento al evitar la incisión paraesternal superior, lo que reduce el tiempo de implante. En esta serie, la media del tiempo de implante fue 59,8min con un 90% de los implantes realizados con la técnica de 2 incisiones, mientras que en el estudio S-ICD PAS17, con solo el 52,2% de los implantes con esta técnica, fue 77,3min. Además, supone beneficios estéticos y de comodidad para el paciente, minimiza el riesgo de infecciones y erosiones, y se ha demostrado segura, con mínimo riesgo de dislocaciones a largo plazo5,7,8. Por otra parte, el posicionamiento intermuscular del generador, entre el aspecto anterior del músculo serrato mayor y el posterior del dorsal ancho, presenta ventajas no solo estéticas, sino en términos de reducción de complicaciones de la bolsa y reducción de los CI8. Además, se ha demostrado que la colocación del generador sobre el músculo sin tejido adiposo interpuesto reduciría el umbral de desfibrilación25. En esta serie, el 100% de las fibrilaciones ventriculares inducidas se desfibrilaron con el dispositivo, el 95,6% con el primer choque programado, de 65J. En este sentido, hay controversia sobre si se ha de realizar una prueba de inducción y desfibrilación en pacientes a los que se implanta un S-ICD26,27, especialmente aquellos con implante intermuscular27.
Terapias del dispositivoEl resultado más destacado del presente trabajo es la ausencia de CI en el seguimiento de los pacientes, y la causa puede ser multifactorial.
En las primeras experiencias publicadas con el implante de S-ICD1, una de las principales limitaciones fue una tasa de CI (especialmente por sobresensado de onda T y por arritmias supraventriculares con frecuencias por encima de la zona de detección programada) sustancialmente superior a la observada con DAI transvenosos con programaciones contemporáneas. En el análisis combinado a 2 años de los pacientes de los estudios IDE y EFFORTLESS24, se observó que la programación de 2 zonas, 1 condicional y 1 de choques, en lugar de 1 única zona de choques, se asoció a una muy significativa reducción de la tasa de CI. Es plausible asumir que la programación de 2 zonas en todos los pacientes de la presente serie ha contribuido a la ausencia absoluta de CI en el seguimiento a largo plazo.
Por otro lado, Olde Nordkamp et al.21 analizaron en 581 pacientes la incidencia de CI tras un seguimiento medio de 21 meses, y observaron una tasa del 8,3% y que la miocardiopatía hipertrófica y la historia de fibrilación auricular se asociaron de manera independiente con un mayor riesgo de CI. En el presente trabajo solo 1 paciente presentaba antecedentes de fibrilación auricular y un 18% tenían una miocardiopatía hipertrófica.
Al iniciarse tardíamente la experiencia, la mayor parte del seguimiento de los pacientes se ha realizado beneficiándose de las nuevas actualizaciones de software de los dispositivos, dirigidas a reducir significativamente el sobresensado de señales y, por lo tanto, a reducir los CI. Este hecho ha podido contribuir parcialmente a la tasa de CI observada, hecho diferencial con las series publicadas previamente. Se ha estimado una reducción en la incidencia de sobresensado de onda T del 40% con la introducción del algoritmo ACWADD y una reducción adicional de los CI de un 40% con el algoritmo SMART pass. Los resultados a largo plazo de estudios en marcha con inicio de reclutamiento de pacientes en tiempo similar, como el S-ICD PAS17 (inicio en agosto de 2013), demostrarán en una mayor población de pacientes la tasa real de CI una vez introducidas las actualizaciones del software del dispositivo.
En cuanto a las terapias apropiadas, solo 1 paciente en seguimiento las recibió, y fueron eficaces. La eficacia del S-ICD para terminar episodios de arritmias ventriculares malignas sostenidas inducidas espontáneamente es muy alta y en el mismo nivel que el observado con DAI transvenosos24.
LimitacionesLas principales limitaciones del trabajo son: a) el reducido número de pacientes estudiados y que no fueran pacientes consecutivos con indicación de DAI, lo que incluye un evidente sesgo de selección; b) su carácter unicéntrico, lo que puede hacer que los resultados no sean generalizables a otros centros y operadores, especialmente a aquellos con menos experiencia en implante de dispositivos; c) que no es un estudio aleatorizado, si bien el objetivo del trabajo no era su comparación con el DAI transvenoso, sino mostrar la experiencia con el S-ICD tras las mejoras implementadas desde su distribución comercial, y d) el seguimiento relativamente corto, aunque la mayoría supera los 12 meses y se han mostrado diferencias significativas en cuanto a la tasa de CI y complicaciones con revisión quirúrgica, respecto a cohortes de pacientes con S-ICD previas con seguimientos similares e incluso más reducidos.
CONCLUSIONESLas mejoras tecnológicas, de técnicas de implante y programación, junto con una selección de pacientes adecuada, han permitido obtener unos excelentes resultados agudos y a largo plazo en esta cohorte de pacientes de un centro con implante contemporáneo de S-ICD, especialmente por la ausencia de CI y complicaciones que requirieran revisión quirúrgica.
CONFLICTO DE INTERESESM.A. Arias es proctor de S-ICD (Boston Scientific) y es Editor Asociado de Revista Española de Cardiología.
- –
El S-ICD es una terapia con eficacia equivalente al DAI transvenoso que evita las complicaciones de los cables endovasculares, pero que en las primeras series publicadas se asocia con mayor incidencia de CI.
- –
Se han implementado en los dispositivos mejoras de programación, de técnica de implante y de software dirigidas a reducir la incidencia de complicaciones, cuyo resultado se desconoce aún.
- –
El presente trabajo permite tener una aproximación de las complicaciones con el implante contemporáneo de S-ICD, al haberse realizado incluyendo mayoritariamente todas las mejoras implementadas en la terapia desde su inicio comercial.
- –
En el largo plazo, con un seguimiento medio próximo a los 18 meses, no se han producido CI ni complicaciones que necesitasen revisión quirúrgica, lo que confirma un mejor resultado respecto a los estudios iniciales con esta terapia.