La terapia de resincronización cardiaca (TRC) es beneficiosa para pacientes seleccionados con insuficiencia cardiaca (IC), aunque la ausencia de respuesta a la terapia es aún prevalente. Se investiga un conjunto de nuevos biomarcadores asociados a varias vías fisiopatológicas de la IC. El propósito fue valorar su capacidad para predecir los resultados clínicos con la TRC.
MétodosSe estudió a 136 pacientes con IC crónica y TRC. Se midieron los valores plasmáticos de fractalquina, pentraxina-3, factor de crecimiento hepatocitario (HGF), el antígeno carbohidrato 125 y la metaloproteinasa de matriz 9 tanto antes como 6 meses después del inicio de la TRC. El objetivo primario del estudio fue la mortalidad por todas las causas a 5 años, y se consideró la ausencia de remodelado inverso a los 6 meses (definido como al menos un 15% de descenso del volumen telesistólico) como un objetivo secundario.
ResultadosCincuenta y ocho pacientes fallecieron a lo largo de los 5 años de seguimiento y 66 pacientes se categorizaron como no respondedores. En modelos multivariables, solo un aumento del HGF resultó un predictor independiente, tanto de mortalidad (HR=1,35; IC95%, 1,11-1,64; p=0,003; por cada unidad de incremento de la desviación estándar) como de ausencia de remodelado inverso (OR=1,83; IC95%, 1,10-3,04; p=0,01; por cada unidad de incremento de la desviación estándar). Aplicando el HGF al modelo básico multivariable tanto de mortalidad (mejora neta de reclasificación=0,69; IC95%, 0,39-0,99; p<0,0001; mejora de discriminación integrada=0,06; IC95%, 0,02-0,11) como de remodelado inverso (mejora neta de reclasificación=0,39; IC95%, 0,07-0,71; p=0,01; mejora de discriminación integrada=0,03; IC95%, 0,00-0,06) se obtuvo una mejora estadísticamente significativa de reclasificación y discriminación.
ConclusionesDe los biomarcadores investigados, solo el HGF predijo los resultados clínicos después de la TRC independientemente de otros parámetros. Los análisis de reclasificación mostraron que las mediciones de HGF podrían ser útiles para mejorar la selección de pacientes.
Palabras clave
La terapia de resincronización cardiaca (TRC) es un tratamiento eficaz para pacientes con insuficiencia cardiaca (IC), fracción de eyección muy reducida y complejo QRS ancho1. La terapia de resincronización cardiaca aumenta la fracción de eyección y reduce el volumen del ventrículo izquierdo, y se obtiene un remodelado inverso. La capacidad funcional del paciente mejora al tiempo que la morbimortalidad se reduce. A pesar de que la selección de pacientes sea óptima, entre un 20 y un 40% de los pacientes no responden a la TRC2. Urge, por lo tanto, disponer de nuevos biomarcadores capaces de identificar a estos pacientes. Se ha puesto de manifiesto el posible efecto favorable de numerosos biomarcadores relacionados con la inflamación, la reparación tisular o la activación neurohormonal en la práctica clínica3–8.
El objetivo de este estudio es investigar un conjunto de nuevos biomarcadores de la IC asociados con distintas vías fisiopatológicas de la IC. Hay estudios previos que han demostrado una asociación entre estos biomarcadores y los resultados de la IC, pero hasta la fecha no hay información disponible sobre su función en la predicción de los resultados después del inicio de la TRC. La fractalquina se ha considerado un mediador complejo de la inflamación, que actúa como molécula de adhesión en su forma de ligando y quimiotáctica en su forma soluble7. La pentraxina-3 (PTX–3) funciona como un mediador de la respuesta inmunitaria innata y se genera principalmente en el foco de la inflamación6. El factor de crecimiento hepatocitario (HGF) es un cardioprotector, que desencadena los procesos angiogénico, antifibrótico y antiapoptótico al activar las vías clásicas de la tirosincinasa3. El antígeno carbohidrato 125 (CA–125) es un conocido biomarcador del carcinoma ovárico, pero su papel en la IC aguda y crónica se ha planteado recientemente, ya que refleja la contractilidad cardiaca y la hipervolemia4. La metaloproteinasa de matriz 9 (MMP–9) interviene en la proteolisis de la matriz extracelular miocárdica, de ahí que desempeñe una función clave en la reparación miocárdica5,8.
El propósito del estudio es valorar la capacidad predictora de resultados clínicos de estos biomarcadores después del inicio de la TRC. Se establece la hipótesis de que sus valores iniciales puedan predecir el remodelado inverso a los 6 meses y la mortalidad por cualquier causa a los 5 años entre los pacientes con IC y TRC. Se conjetura además que su predicción sea independiente (y por lo tanto aporte valor añadido) de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), que se considera el biomarcador sanguíneo de referencia en la IC9. Se plantea demostrar esta hipótesis mediante los modelos de reclasificación.
MÉTODOSSe incluyó en este estudio observacional, prospectivo y unicéntrico a 141 pacientes con IC crónica consecutivos. El objetivo es evaluar el efecto pronóstico de los nuevos biomarcadores de laboratorio entre los pacientes con IC crónica y TRC de la citada cohorte10. El presente análisis se centra en el efecto de los nuevos biomarcadores de la IC en la TRC.
Los pacientes se encontraban en tratamiento médico óptimo y recibieron un implante de TRC entre septiembre de 2009 y diciembre de 2010 en el Heart and Vascular Center de la Semmelweis University de Budapest, conforme a las pautas de las guías de práctica clínica vigentes11. Los criterios de inclusión fueron IC crónica estable, tratamiento médico óptimo, clase funcional de la New York Heart Association (NYHA) II-IV ambulatoria, QRS ancho (> 120 ms) en el electrocardiograma, con independiencia de la morfología, y una fracción de eyección del ventrículo izquierdo muy reducida (< 35%). Se consideraron las neoplasias y enfermedades hemáticas e inflamatorias sistémicas graves como criterios de exclusión y se excluyó a 5 pacientes en consonancia con dicho criterio.
El objetivo primario del estudio era la mortalidad por cualquier causa a los 5 años y se consideró el remodelado inverso a los 6 meses, definido comouna reducción de al menos el 15% del volumen telesistólico del ventrículo izquierdo, como un objetivo secundario. Todos los pacientes dieron su consentimiento informado por escrito antes de su inclusión en el estudio. La investigación se atuvo a las normas éticas establecidas en la Declaración de Helsinki. El protocolo de estudio fue aprobado por el comité de ética local.
Se siguió a los pacientes hasta un periodo de 5 años, mediante visitas programadas a los 6 meses y a los 2 y los 5 años tras un implante de TRC. Se realizaron al inicio del estudio exploraciones clínicas, analítica, electrocardiograma y ecocardiografía a 136 pacientes, y sus datos se incluyeron en el análisis final. En cada visita de seguimiento se evaluó el estado funcional de los pacientes mediante la valoración de la clase funcional de la NYHA, su tratamiento médico y las complicaciones médicas oportunas. Se repitieron la analítica, la ecocardiografía y el electrocardiograma a los 6 meses.
Se extrajeron muestras de sangre venosa y después se procesaron las muestras de suero y plasma de ácido etilendiaminotetraacético antes de pasadas 2 h. Las muestras se almacenaron a –80°C para el posterior análisis de biomarcadores. Se midieron los valores de la NT-proBNP mediante la técnica de electroquimioluminiscencia con un analizador Cobas e 411 (Mannheim, Alemania) con los accesorios de prueba Elecsys® NT-proBNP II de Roche Diagnostics (n.o de catálogo: 04842464190; Mannheim, Alemania). Se usaron las técnicas de radioinmunoanálisis (ELISA) disponibles en el mercado para medir los valores plasmáticos de la fractalquina (accesorio de análisis ELISA Quantikine® para fractalquina humana CX3CL1, R&D Systems; Minneapolis, Estados Unidos; n.o de catálogo: RD-DCX310), la pentraxina-3 (accesorio de análisis ELISA TSG-14 ELISA System para pentraxina–3 humana, CosmoBio; Tokyo, Japón; n.o de catálogo: PPX-PP-PD03-E0), del HGF (accesorio de análisis ELISA Quantikine para HGF humano, R&D Systems; Minneapolis, Estados Unidos; n.o de catálogo: RD-DHG00) y de la MMP–9 (accesorio de análisis ELISA Quantikine para MMP–9 humana, R&D Systems; Minneapolis, Estados Unidos; n.o de catálogo: RD-DMP900). Se determinó el CA-125 mediante el inmunoanálisis de quimioluminiscencia LIAISON CA-125 II (n.o de catálogo: 314211) en el equipo LIAISON Analyzer (DiaSorin; Saluggia, Italia).
Un cardiólogo acreditado en ecocardiografía llevó a cabo el estudio ecocardiográfico con un equipo iE 33 de Philips (Royal Philips Electronics; Eindhoven, Países Bajos). Se calcularon la fracción de eyección del ventrículo izquierdo con el método bidimensional de Simpson y los volúmenes telesistólico y telediastólico del ventrículo izquierdo con el método de Teicholz. Para verificar la reproducibilidad de las mediciones ecocardiográficas, se determinó la variabilidad entre observadores y por un mismo observador mediante el coeficiente de correlación de concordancia de Lin al comparar entre sí 2 docenas de pares de datos muestrales, lo que corroboró una asociación significativa (variabilidad entre observadores, ρc= 0,956 [0,89-0,98]; variabilidad en un mismo observador, ρc= 0,96 [0,89-0,97]).
Los datos se presentan como mediana [intervalo intercuartílico] o como número de episodios y su porcentaje. Las comparaciones entre las variables continuas se realizaron con la prueba de Wilcoxon y la prueba de la U de Mann-Whitney, según correspondiera. Se utilizó la prueba de la χ2 para las comparaciones entre variables categóricas. Los análisis univariables de regresión logística y de regresión de Cox se utilizaron para establecer los predictores basales de remodelado inverso y de mortalidad a los 5 años. Las variables continuas se ajustaron por cada unidad de incremento de la desviación estándar. Se aplicó el análisis de receiver operating characteristics (ROC), se dicotomizaron las variables continuas y después se compararon las curvas de Kaplan-Meier mediante log-rank test. En los modelos multivariables de regresión de Cox, el modelo inicial incluía las variables que en el análisis univariable obtuvieron un valor de p < 0,05, y se diseñaron modelos más ajustados de manera secuencial y escalonada. Por último, se realizaron los análisis de reclasificación que incluían el estadístico C, la mejora neta de reclasificación (MNR) y la mejora de discriminación integrada (MDI)12,13.
Se consideró indicativo de significación estadística un valor de p bilateral < 0,05. El análisis estadístico se realizó con los programas informáticos IBM® SPSS® Statistics, versión 22 (IBM Corporation; Armonk, Nueva York, Estados Unidos), GraphPad Prism, versión 6.03 (GraphPad Software, Inc.; La Jolla, California, Estados Unidos), PASS 2008 (NCSS, LLC; Kaysville, Utah, Estados Unidos) y el software de código libre R, versión 3.1.2, con los paquetes PredictABEL y pROC (The R Foundation for Statistical Computing; Viena, Austria).
RESULTADOSPoblación del estudio, efectos de la terapia de resincronización cardiaca en los resultados ecocardiográficos y los biomarcadoresLa mediana de edad de los pacientes era 67 [60-73] años y el 80% eran varones. La mediana de duración del QRS era 163 [141-184] ms y el 82% de los pacientes mostraban morfología de bloqueo de rama izquierda (BRI) en el electrocardiograma (tabla 1). Tras 6 meses de TRC, la fracción de eyección del ventrículo izquierdo aumentó un significativo 28% (23%-33%) frente a un 37% (31%-41%) (p < 0,0001); mientras que disminuyeron el volumen telediastólico del ventrículo izquierdo (303 [251-351] frente a 259 [203-332] ml; p < 0,0001) y el volumen telesistólico del ventrículo izquierdo (303 [154-276] frente a 167 [116-242] ml; p < 0,0001).
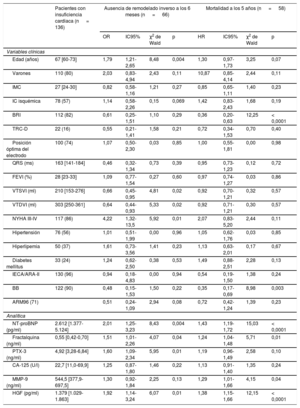
Características basales de los pacientes como predictores de la ausencia de remodelado inverso a los 6 meses y de la mortalidad a los 5 años
| Pacientes con insuficiencia cardiaca (n = 136) | Ausencia de remodelado inverso a los 6 meses (n = 66) | Mortalidad a los 5 años (n = 58) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| OR | IC95% | χ2 de Wald | p | HR | IC95% | χ2 de Wald | p | ||
| Variables clínicas | |||||||||
| Edad (años) | 67 [60-73] | 1,79 | 1,21-2,65 | 8,48 | 0,004 | 1,30 | 0,97-1,73 | 3,25 | 0,07 |
| Varones | 110 (80) | 2,03 | 0,83-4,94 | 2,43 | 0,11 | 10,87 | 0,85-4,14 | 2,44 | 0,11 |
| IMC | 27 [24-30] | 0,82 | 0,58-1,16 | 1,21 | 0,27 | 0,85 | 0,65-1,11 | 1,40 | 0,23 |
| IC isquémica | 78 (57) | 1,14 | 0,58-2,26 | 0,15 | 0,069 | 1,42 | 0,83-2,43 | 1,68 | 0,19 |
| BRI | 112 (82) | 0,61 | 0,25-1,51 | 1,10 | 0,29 | 0,36 | 0,20-0,63 | 12,25 | < 0,0001 |
| TRC-D | 22 (16) | 0,55 | 0,21-1,41 | 1,58 | 0,21 | 0,72 | 0,34-1,53 | 0,70 | 0,40 |
| Posición óptima del electrodo | 100 (74) | 1,07 | 0,50-2,30 | 0,03 | 0,85 | 1,00 | 0,55-1,81 | 0,00 | 0,98 |
| QRS (ms) | 163 [141-184] | 0,46 | 0,32-1,34 | 0,73 | 0,39 | 0,95 | 0,73-1,23 | 0,12 | 0,72 |
| FEVI (%) | 28 [23-33] | 1,09 | 0,77-1,54 | 0,27 | 0,60 | 0,97 | 0,74-1,27 | 0,03 | 0,86 |
| VTSVI (ml) | 210 [153-276] | 0,66 | 0,45-0,95 | 4,81 | 0,02 | 0,92 | 0,70-1,21 | 0,32 | 0,57 |
| VTDVI (ml) | 303 [250-361] | 0,64 | 0,44-0,93 | 5,33 | 0,02 | 0,92 | 0,71-1,21 | 0,30 | 0,57 |
| NYHA III-IV | 117 (86) | 4,22 | 1,32-13,5 | 5,92 | 0,01 | 2,07 | 0,83-5,20 | 2,44 | 0,11 |
| Hipertensión | 76 (56) | 1,01 | 0,51-1,99 | 0,00 | 0,96 | 1,05 | 0,62-1,76 | 0,03 | 0,85 |
| Hiperlipemia | 50 (37) | 1,61 | 0,73-3,56 | 1,41 | 0,23 | 1,13 | 0,63-2,01 | 0,17 | 0,67 |
| Diabetes mellitus | 33 (24) | 1,24 | 0,62-2,50 | 0,38 | 0,53 | 1,49 | 0,88-2,51 | 2,28 | 0,13 |
| IECA/ARA-II | 130 (96) | 0,94 | 0,18-4,83 | 0,00 | 0,94 | 0,54 | 0,19-1,50 | 1,38 | 0,24 |
| BB | 122 (90) | 0,48 | 0,15-1,53 | 1,50 | 0,22 | 0,35 | 0,17-0,69 | 8,98 | 0,003 |
| ARM96 (71) | 0,51 | 0,24-1,09 | 2,94 | 0,08 | 0,72 | 0,42-1,24 | 1,39 | 0,23 | |
| Analítica | |||||||||
| NT-proBNP (pg/ml) | 2.612 [1.377-5.124] | 2,01 | 1,25-3,23 | 8,43 | 0,004 | 1,43 | 1,19-1,72 | 15,03 | < 0,0001 |
| Fractalquina (ng/ml) | 0,55 [0,42-0,70] | 1,51 | 1,01-2,26 | 4,07 | 0,04 | 1,24 | 1,04-1,48 | 5,71 | 0,01 |
| PTX-3 (ng/ml) | 4,92 [3,28-6,84] | 1,60 | 1,09-2,34 | 5,95 | 0,01 | 1,19 | 0,96-1,49 | 2,58 | 0,10 |
| CA-125 (U/l) | 22,7 [11,0-69,9] | 1,25 | 0,87-1,80 | 1,46 | 0,22 | 1,13 | 0,91-1,40 | 1,35 | 0,24 |
| MMP-9 (ng/ml) | 544,5 [377,9-697,5] | 1,30 | 0,92-1,84 | 2,25 | 0,13 | 1,29 | 1,01-1,66 | 4,15 | 0,04 |
| HGF (pg/ml) | 1.379 [1.029-1.863] | 1,92 | 1,14-3,24 | 6,07 | 0,01 | 1,38 | 1,15-1,66 | 12,15 | < 0,0001 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; BRI: bloqueo de rama izquierda; CA-125: antígeno carbohidrato 125; FEVI: fracción de eyección del ventrículo izquierdo; HGF: factor de crecimiento hepatocitario; HR: hazard ratio; IC isquémica: etiología isquémica de la IC; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; MMP-9: metaloproteinasa de matriz 9; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; OR: odds ratio; PTX-3: pentraxina-3; TRC-D: terapia de resincronización cardiaca con desfibrilador automático implantable; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo. Posición óptima del electrodo: electrodo del ventrículo izquierdo lateral o posterolateral.
Los valores expresan mediana [intervalo intercuartílico] para las variables continuas y como número de episodios con su porcentaje para las variables categóricas. Se evaluaron la ausencia de remodelado inverso a los 6 meses (ausencia de una reducción del 15% del VTSVI) mediante el análisis univariable de regresión logística y la mortalidad a los 5 años mediante análisis univariablee de regresión de Cox. Las variables continuas se ajustaron por cada unidad de incremento de la desviación estándar. Las OR y HR se refieren a presencia frente a ausencia en el caso de las variables categóricas y a cada unidad de incremento de la desviación estándar en el de las continuas.
Se investigó el cambio de los biomarcadores analizados durante los 6 meses de seguimiento. Se midieron los valores plasmáticos inferiores al valor de significación estadística de pentraxina-3 (4,92 [3,29-6,84] frente a 3,13 [2,39-4,48] ng/ml; p < 0,0001), NT-proBNP (2.612 [1.377-5.124] frente a 1.626 [725-3.300] pg/ml; p < 0,001), HGF (1.379 [1.029-1.863] frente a 1.083 [862-1.328] pg/ml; p < 0,001) y CA-125 (22,75 [11,05-69,90] frente a 18,30 [9,15-34,35]; p < 0,001) tras 6 meses de seguimiento. Los valores plasmáticos de fractalquina y MMP-9 no registraron variación estadística.
Asociación de los valores de los biomarcadores con la respuesta clínicaSe clasificó a 70 pacientes (51%) como respondedores y a 66 (49%) como no respondedores conforme al criterio establecido (un descenso relativo > 15% del volumen telesistólico del ventrículo izquierdo). Los valores de NT-proBNP fueron significativamente más altos entre los no respondedores tanto al inicio del estudio (p = 0,0002) como a los 6 meses (p < 0,0001). Se observó un descenso significativo de los valores plasmáticos de la NT-proBNP únicamente entre los respondedores (p = 0,0001). Los valores de pentraxina-3 y CA-125 eran considerablemente superiores entre los no respondedores al inicio del estudio (pentraxina-3, p = 0,0005; CA–125, p = 0,001) y a los 6 meses (pentraxina–3, p = 0,02; CA–125, p = 0,002). Después del inicio de la TRC, los valores plasmáticos disminuyeron tanto entre los respondedores (pentraxina–3, p = 0,0001; CA–125, p = 0,01) como entre los no respondedores (pentraxina-3, p < 0,0001; CA–125, p = 0,02). Los pacientes sin respuesta de remodelado inverso a la TRC presentaban valores iniciales significativamente mayores de HGF (p = 0,001) y de fractalquina (p = 0,004). Los valores de HGF se redujeron significativamente después de la TRC en ambos grupos (respondedores, p = 0,003; no respondedores, p = 0,01), mientras que los valores plasmáticos de fractalquina no se alteraron con el paso del tiempo. No se hallaron diferencias significativas en los valores de MMP–9 entre los grupos, aunque se observó un aumento significativo entre los respondedores después de 6 meses (p = 0,003). Un análisis pormenorizado de los citados resultados se muestra en la tabla 2.
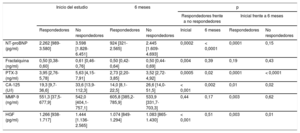
Cambios en los nuevos biomarcadores de insuficiencia cardiaca entre respondedores y no respondedores (respondedores son los pacientes que habían sufrido remodelado inverso a los 6 meses del implante de TRC)
| Inicio del estudio | 6 meses | p | ||||||
|---|---|---|---|---|---|---|---|---|
| Respondedores frente a no respondedores | Inicial frente a 6 meses | |||||||
| Respondedores | No respondedores | Respondedores | No respondedores | Inicial | 6 meses | Respondedores | No respondedores | |
| NT-proBNP (pg/ml) | 2.262 [989-3.580] | 3.598 [1.828-6.451] | 924 [321-2.565] | 2.445 [1.609-4.693] | 0,0002 | < 0,0001 | 0,0001 | 0,15 |
| Fractalquina (ng/ml) | 0,50 [0,38-0,60] | 0,61 [0,46-0,76] | 0,50 [0,42-0,64] | 0,50 [0,44-0,69] | 0,004 | 0,39 | 0,19 | 0,43 |
| PTX-3 (ng/ml) | 3,95 [2,76-5,78] | 5,63 [4,15-7,91] | 2,73 [2,20-3,85] | 3,52 [2,72-4,92] | 0,0005 | 0,02 | 0,0001 | < 0,0001 |
| CA-125 (U/l) | 19,3 [9,7-36,6] | 33,6 [13,9-112,3] | 14,0 [8,1-22,5] | 26,6 [14,0-51,5] | < 0,001 | 0,002 | 0,01 | 0,02 |
| MMP-9 (ng/ml) | 551,3 [37,5-677,9] | 542,0 [404,1-757,1] | 605,8 [385,2-785,9] | 533,9 [331,7-703,3] | 0,44 | 0,17 | 0,003 | 0,62 |
| HGF (pg/ml) | 1.266 [938-1.717] | 1.444 [1.136-2.565] | 1.074 [849-1.294] | 1.083 [865-1.430] | < 0,001 | 0,51 | 0,003 | 0,01 |
CA-125: antígeno carbohidrato 125; HGF: factor de crecimiento hepatocitario; MMP-9: metaloproteinasa de matriz 9; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PTX3: pentraxina-3; TRC: terapia de resincronización cardiaca; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los valores expresan mediana [intervalo intercuartílico].
Se define el remodelado inverso como un 15% de descenso del VTSVI a los 6 meses de un implante de TRC.
Para las comparaciones se utilizaron las pruebas de Mann-Whitney y Wilcoxon.
Respondedores (n = 70), no respondedores (n = 66).
Se investigó la mortalidad por cualquier causa a los 5 años mediante análisis univariable de regresión de Cox y el remodelado inverso a los 6 meses mediante análisis univariable de regresión logística (tabla 1). En el transcurso de los 5 años de seguimiento fallecieron 58 pacientes (43%). La mortalidad por cualquier causa se asoció significativamente con la ausencia de bloqueo de rama izquierda (p < 0,0001), el tratamiento con bloqueadores beta (p = 0,003) y el incremento de los valores de NT-proBNP (p < 0,0001), mientras que el aumento de edad mostró una asociación ligeramente significativa (p = 0,07). De los nuevos biomarcadores, el incremento de los valores de fractalquina (p = 0,01), HGF (p < 0,0001) y MMP-9 (p = 0,04) predijo la mortalidad a los 5 años.
Según la valoración ecocardiográfica de los autores, 70 pacientes (51%) habían sufrido remodelado inverso a los 6 meses. El aumento de edad (p = 0,004), la clase funcional de la NYHA III-IV (p = 0,01) y el incremento de los valores de NT-proBNP (p = 0,004) fueron predictores de la ausencia de remodelado inverso a los 6 meses. Se observó una relación ligeramente significativa entre la etiología isquémica de la IC (p = 0,069), el tratamiento con antagonistas del receptor de mineralocorticoides (p = 0,08) y la ausencia de respuesta. El incremento de los valores plasmáticos de fractalquina (p = 0,04), pentraxina-3 (p = 0,01) y HGF (p = 0,01) predijo la ausencia de respuesta a la TRC.
Modelos multivariables predictivos del riesgo de mortalidad y remodelado inversoPara una valoración más precisa del efecto de los nuevos biomarcadores en la mortalidad, se diseñó un modelo básico multivariable de regresión de Cox a partir de todas las variables que en el análisis univariable previo resultaron significativas. El modelo multivariable inicial incluía las variables edad, bloqueo de rama izquierda, tratamiento con bloqueadores beta y NT-proBNP. En la fase siguiente se añadieron al modelo inicial los nuevos biomarcadores por separado, en secuencia y escalonadamente. El HGF fue el único valor que predijo la mortalidad en el modelo multivariable (por cada unidad de incremento de la desviación estándar, hazard ratio [HR]=1,35; intervalo de confianza del 95% [IC95%], 1,11-1,64; p = 0,003) (tabla 3).
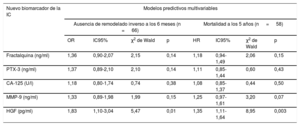
Modelos predictivos multivariables para cada biomarcador, incluidos todos los parámetros iniciales significativos del modelo básico
| Nuevo biomarcador de la IC | Modelos predictivos multivariables | |||||||
|---|---|---|---|---|---|---|---|---|
| Ausencia de remodelado inverso a los 6 meses (n = 66) | Mortalidad a los 5 años (n = 58) | |||||||
| OR | IC95% | χ2 de Wald | p | HR | IC95% | χ2 de Wald | p | |
| Fractalquina (ng/ml) | 1,36 | 0,90-2,07 | 2,15 | 0,14 | 1,18 | 0,94-1,49 | 2,06 | 0,15 |
| PTX-3 (ng/ml) | 1,37 | 0,89-2,10 | 2,10 | 0,14 | 1,11 | 0,85-1,44 | 0,60 | 0,43 |
| CA-125 (U/l) | 1,18 | 0,80-1,74 | 0,74 | 0,38 | 1,08 | 0,85-1,37 | 0,44 | 0,50 |
| MMP-9 (ng/ml) | 1,33 | 0,89-1,98 | 1,99 | 0,15 | 1,25 | 0,97-1,61 | 3,20 | 0,07 |
| HGF (pg/ml) | 1,83 | 1,10-3,04 | 5,47 | 0,01 | 1,35 | 1,11-1,64 | 8,95 | 0,003 |
CA-125: antígeno carbohidrato 125; HGF: factor de crecimiento hepatocitario; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; MMP-9: metaloproteinasa de matriz 9; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; OR: odds ratio; PTX3: pentraxina-3.
Se define el remodelado inverso a los 6 meses (n = 70) como al menos un 15% de descenso del volumen telesistólico. El modelo básico para el análisis de regresión logística multivariable incluía las variables edad, etiología isquémica, clase funcional de la New York Heart Association III-IV, antagonistas del receptor de mineralocorticoides y NT-proBNP. El modelo básico para la mortalidad a los 5 años mediante el análisis multivariable de regresión de Cox incluía las variables edad, bloqueo de rama izquierda, tratamiento con bloqueadores beta y NT-proBNP. De forma secuencial y escalonada, se ajustaron los nuevos nuevos biomarcadores al modelo básico. Las OR y HR se refieren a cada unidad de incremento de la desviación estándar.
Se aplicó el mismo planteamiento al investigar el remodelado inverso. Se incluyeron todos los factores pertinentes en el modelo básico multivariable: edad, etiología isquémica de la IC, NYHA III–IV, tratamiento con antagonistas del receptor de mineralocorticoides y NT-proBNP. Se añadieron al modelo inicial los nuevos biomarcadores por separado, en secuencia y escalonadamente. De igual manera que en la predicción de la mortalidad, el HGF fue el único predictor independiente del remodelado inverso (por cada unidad de incremento de la desviación estándar, odds ratio [OR]=1,83; IC95%, 1,10-3,04; p = 0,01,) (tabla 3).
Evaluación del valor añadido del factor de crecimiento hepatocitario como predictor de resultadosSe evaluó el área bajo la curva mediante análisis ROC para determinar los valores de corte más apropiados. El objetivo era fijar un punto de corte de interés clínico que mostrara una sensibilidad relativamente alta y la máxima especificidad.
De este modo se identificó que los valores plasmáticos de HGF > 1.236 pg/ml representaban un valor de corte óptimo (área bajo la curva = 0,71; IC95%, 0,63-0,80; p < 0,0001; sensibilidad, 81% [69-90]; especificidad, 54% [45-65]) (figura 1). Los valores de HGF > 1.236 pg/ml se asociaron con un incremento del riesgo de muerte a largo plazo (HR = 3,48; IC95%: 1,80-6,73; p < 0,0001) (figura 1).
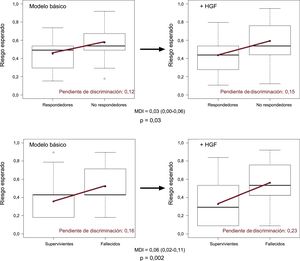
Efecto de los valores iniciales de HGF en la mortalidad a los 5 años. A: comparación de las curvas de supervivencia de Kaplan-Meier mediante log-rank test. Se compara la supervivencia de los pacientes que presentan valores plasmáticos iniciales de HGF inferiores y superiores a 1.236 pg/ml. B: se efectúa el análisis receiver operating characteristics (ROC) al objeto de establecer el punto de corte óptimo para los valores plasmáticos de HGF iniciales. ABC: área bajo la curva; HGF: factor de crecimiento hepatocitario; HR: hazard ratio; NPV: valor predictivo negativo; PPV: valor predictivo positivo.
Al incluir el HGF en el modelo multivariable inicial de mortalidad (MNR = 0,69; IC95%, 0,39-0,99; p < 0,0001; MDI = 0,06; IC95%, 0,02-0,11) y remodelado inverso (MNR = 0,39; IC95%, 0,07-0,71; p = 0,01; MDI = 0,03; IC95%, 0,00-0,06), se observó una mejora significativa de la reclasificación y de la discriminación (figura 2). La inclusión del biomarcador HGF en el modelo inicial aumentó la pendiente de discriminación de los modelos predictivos (de 0,12 a 0,15 en el caso del remodelado inverso y de 0,16 a 0,23 en el de la mortalidad). Los riesgos observados y esperados, que se estimaron mediante la prueba de Hosmer-Lemeshow, no variaron significativamente en el conjunto de los análisis, lo cual indica buena calibración y confirma la validez de los resultados (tabla 4). El descenso en la puntuación de Brier y el incremento de los valores de la R2 de Nagelkerke apuntan a una mejora de la capacidad predictiva.
Mejora de la capacidad de discriminación de los modelos predictivos. La mejora de la capacidad de discriminación se representa visualmente mediante un diagrama de caja con bigotes. La pendiente de discriminación se define como la diferencia en la media de las probabilidades de episodios menos la ausencia de episodios (panel superior: remodelado inverso a los 6 meses; panel inferior: mortalidad a los 5 años). La incorporación del biomarcador HGF al modelo básico incrementa la pendiente de discriminación (línea roja) de los modelos predictivos. La diferencia en la pendiente de discriminación la constituye la propia MDI. HGF: factor de crecimiento hepatocitario; MDI: mejora de discriminación integrada. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
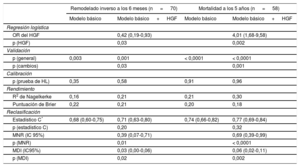
Análisis de validación, calibración y reclasificación
| Remodelado inverso a los 6 meses (n = 70) | Mortalidad a los 5 años (n = 58) | |||
|---|---|---|---|---|
| Modelo básico | Modelo básico + HGF | Modelo básico | Modelo básico + HGF | |
| Regresión logística | ||||
| OR del HGF | 0,42 (0,19-0,93) | 4,01 (1,68-9,58) | ||
| p (HGF) | 0,03 | 0,002 | ||
| Validación | ||||
| p (general) | 0,003 | 0,001 | < 0,0001 | < 0,0001 |
| p (cambios) | 0,03 | 0,001 | ||
| Calibración | ||||
| p (prueba de HL) | 0,35 | 0,58 | 0,91 | 0,96 |
| Rendimiento | ||||
| R2 de Nagelkerke | 0,16 | 0,21 | 0,21 | 0,30 |
| Puntuación de Brier | 0,22 | 0,21 | 0,20 | 0,18 |
| Reclasificación | ||||
| Estadístico C* | 0,68 (0,60-0,75) | 0,71 (0,63-0,80) | 0,74 (0,66-0,82) | 0,77 (0,69-0,84) |
| p (estadístico C) | 0,20 | 0,32 | ||
| MNR (IC 95%) | 0,39 (0,07-0,71) | 0,69 (0,39-0,99) | ||
| p (MNR) | 0,01 | < 0,0001 | ||
| MDI (IC95%) | 0,03 (0,00-0,06) | 0,06 (0,02-0,11) | ||
| p (MDI) | 0,02 | 0,002 | ||
HGF: factor de crecimiento hepatocitario; HL: Hosmer-Lemeshow; IC95%: intervalo de confianza del 95%; MDI: mejora de discriminación integrada; MNR: mejora neta de reclasificación; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; OR: odds ratio.
El modelo básico multivariable de regresión logística para el remodelado inverso incluía las variables edad > 75 años, etiología isquémica, clase funcional de la New York Heart Association III-IV, antagonista del receptor de mineralocorticoides y NT-proBNP > 1.919 ng/ml, mientras que el modelo básico para la mortalidad a los 5 años comprendía edad > 75 años, bloqueo de rama izquierda, bloqueador beta y NT-proBNP > 1.919 ng/ml.
Se ajustaron los valores del HGF > 1.236 ng/ml al modelo básico de forma secuencial y escalonada.
Siguiendo el criterio de la American Heart Association para la evaluación de nuevos marcadores de riesgo cardiovascular, se obtuvieron los medidas tanto de la exactitud de discriminación como de la información incremental. Se evaluó la discriminación con el estadístico C, que mide las diferencias del área total bajo las curvas de los modelos predictivos mediante la prueba de DeLong (es decir, p [estadístico C]). La exactitud se estima mediante la calibración y el rendimiento de los modelos predictivos. La calibración investiga si el riesgo observado (a saber, el número de episodios de muerte por remodelado inverso) difiere del riesgo esperado o estimado. El resultado estadísticamente no significativo (p = 0,05) de la prueba de Hosmer-Lemeshow apunta a que el riesgo observado y el esperado se correlacionan y, por lo tanto, a que el modelo predictivo está bien calibrado. El rendimiento de los modelos predictivos se muestra por medio de los cambios en los valores de la R2 de Nagelkerke y de la puntuación de Brier. El rendimiento mejora si la incorporación del biomarcador al modelo básico redunda en valores incrementados de la R2 de Nagelkerke (de 0,00 a 1,00) y un descenso en paralelo de los valores de la puntuación de Brier (de 0,25 a 0,00). El valor incremental de los nuevos marcadores se muestra por medio de nuevos métodos de reclasificación y discriminación. La MNR indica cómo mejoran el rendimiento general y la fiabilidad del modelo básico con la inclusión del nuevo marcador. La discriminación se estima mediante el estadístico C, aunque se trata de un método más bien conservador, que a menudo subestima el efecto de los factores asociados, por lo que se ha recomendado recientemente la aplicación de la mejora de discriminación integrada. La MDI muestra las diferencias de las pendientes de discriminación entre los modelos (modelo básico frente a modelo básico+HGF). La pendiente de discriminación es la diferencia de la mediana del riesgo resultante de la predicción del biomarcador entre los episodios y la ausencia de episodios (es decir, mortalidad frente a supervivencia; respuesta frente a ausencia de respuesta).
La principal fortaleza de este estudio clínico reside en la investigación de un conjunto de prometedores biomarcadores de la IC que ya habían mostrado información pronóstica en varios grupos de pacientes con IC. Este es el primer estudio que investiga el posible valor predictivo de estos biomarcadores en una cohorte de pacientes con TRC. El seguimiento a largo plazo durante un periodo de 5 años aporta un número suficiente de criterios de valoración para el análisis, a pesar de que el tamaño muestral sea relativamente pequeño. Los análisis de reclasificación permiten explicar que el HGF no solo predice tanto la respuesta a la TRC como la mortalidad a largo plazo, sino que también demuestra un valor pronóstico añadido con respecto a los factores de confusión basales asociados y al criterio de referencia, la NT-proBNP.
Probables mecanismos patogénicos y su explicaciónLa IC crónica es un síndrome clínico complejo inducido por distintos procesos fisiopatológicos. Se está investigando ampliamente sobre la función precisa de la activación neurohormonal, fibrótica e inflamatoria en la evolución y el avance de la IC. No obstante, se están examinando todos estos procesos como elementos participantes en el mecanismo patogénico. En consecuencia, se han estudiado numerosos biomarcadores que son indicadores de la activación de dichos procesos y facilitarían el diagnóstico, la orientación terapéutica y la valoración pronóstica14.
A pesar de los manifiestos progresos de las décadas precedentes en el complicado tratamiento de la IC, la morbimortalidad es todavía alta e impone una pesada carga a la asistencia sanitaria en todo el mundo15. Para atajar estos problemas se exigieron ciertos ajustes en la selección de los pacientes, pero un tercio de ellos, aproximadamente, todavía no responden a la TRC2. De este modo, los biomarcadores predictores de la respuesta o de la mortalidad pueden servir, por lo tanto, para identificar a los pacientes en alto riesgo que requieran atención médica especializada.
En este estudio se investiga un conjunto de nuevos biomarcadores de la IC que se asocian con distintas vías de progresión de esta enfermedad. Se ha demostrado la asociación de estos biomarcadores con el pronóstico y la agudización de la IC en poblaciones sin TRC4–7,16. Los valores de fractalquina, un mediador de la inflamación, se muestran elevados en la IC, hecho que se asocia de manera independiente con el aumento de la mortalidad7. La pentraxina-3 es un importante componente de la respuesta inmunitaria innata humoral, que se ha asociado con los resultados clínicos y la agudización de la enfermedad en pacientes con IC y fracción de eyección conservada y reducida6. El marcador tumoral CA-125 se utiliza para la selección, el diagnóstico y el seguimiento terapéuticos del carcinoma ovárico y se han detectado valores elevados de este indicador en distintas neoplasias, ascitis, derrame pleural y edemas periféricos. Asimismo refleja la situación hemodinámica tanto del corazón derecho como del izquierdo y se asocia con hipervolemia y resultados clínicos en los pacientes con IC4,17. La MMP–9 desempeña una función primordial en la reparación miocárdica al activar la proteolisis de la matriz extracelular. Conjuntamente con otros parámetros, se ha demostrado que aporta valor predictivo en la miocardiopatía isquémica y dilatada5,8.
El HGF, un factor de crecimiento clásico producido por gran variedad de tipos celulares, induce los procesos angiogénico, antifibrótico y antiapoptótico3, por lo que puede considerarse un cardioprotector pluripotente. Esta función protectora se evidenció en una amplia serie de modelos con animales que utilizaban distintas técnicas de transferencia génica3,18. Se detectaron valores elevados de HGF en los pacientes con IC crónica, e insospechadamente resultó ser un predictor de los peores resultados clínicos16,19. Si se tiene en cuenta estos hallazgos, los valores de HGF muy elevados son indicadores del fracaso de las vías protectoras del aparato cardiovascular y, por lo tanto, facilitan la identificación de los pacientes que se encuentran en situación clínica crítica y expuestos a un riesgo extremo.
Se observó un importante efecto favorable de la TRC en los resultados durante el seguimiento, pero los resultados clínicos fueron ligeramente peores que los presentados en las publicaciones médicas. Este hallazgo se explica por el hecho de que, en el conjunto de la población húngara, la mortalidad cardiovascular es mayor y la esperanza de vida, significativamente menor que en los países de rentas altas20.
En el presente estudio, la pentraxina-3 predijo el remodelado inverso y la MMP–9 predijo la mortalidad a largo plazo, mientras que la fractalquina fue predictora de ambos objetivos en los modelos univariables. A pesar de estos prometedores resultados, todos los biomarcadores citados perdieron su valor predictivo en el modelo multivariable. El HGF fue el único marcador capaz de predecir tanto la ausencia de remodelado inverso como la mortalidad a los 5 años con independiencia de las demás covariables clínicas.
Además, se evaluó el valor predictivo del HGF mediante los análisis de reclasificación, que mostraron una mejora de reclasificación y una evolución de la discriminación estadísticamente significativas en ambos objetivos, lo que demuestra que la medición del HGF resulta beneficiosa en la evaluación del riesgo de pacientes con IC y TRC. Este resultado se asemeja a los hallazgos de Richter et al.21, que demostraron que el HGF es el más potente predictor de la mortalidad cardiovascular en pacientes con IC avanzada de entre varios de los nuevos biomarcadores de IC. Una explicación posible reside en el hecho de que el HGF es un factor de crecimiento que actúa directamente sobre los genes y lo activa un trastorno cardiovascular inespecífico. De ahí que el HGF ofrezca una visión más completa de la compleja fisiopatología de la IC que los demás biomarcadores, los cuales, en cambio, reflejan la activación de una vía en particular.
A partir de los resultados de este estudio, el HGF resulta útil en la identificación de pacientes con TRC y altísimo riesgo del peor pronóstico clínico. Los pacientes que no responden adecuadamente a la TRC requieren una atención médica especializada y valoración precoz para trasplante cardiaco o asistencia circulatoria mecánica. Debido a su adecuado valor predictivo, el HGF puede utilizarse para la identificación temprana de posibles no respondedores u orientar el tratamiento posterior con dispositivos en ausencia de respuesta clínica a la TRC.
LimitacionesLas principales limitaciones de nuestro estudio son las inherentes a su diseño unicéntrico y el tamaño muestral relativamente pequeño. Se consideró la mortalidad por cualquier causa como objetivo primario, aunque la muerte cardiovascular no se investigó por separado debido al escaso número de episodios. El análisis sistemático del HGF no está generalizado de momento, lo cual supone una limitación a la hora de aplicar nuestros hallazgos a la práctica clínica diaria. Se midió el volumen telesistólico del ventrículo izquierdo con el método de Teicholz, pero no se hizo con el método de Simpson, lo cual habría aportado mayor exactitud al cálculo de los volúmenes del ventrículo izquierdo en esta cohorte de pacientes en particular. Teniendo en cuenta dichos factores, estos resultados deben interpretarse como hallazgos preliminares de generación de hipótesis. Su validación tendrá que establecerse necesariamente en estudios prospectivos más amplios.
CONCLUSIONESEl incremento de los valores de HGF predice la ausencia de remodelado inverso y la mortalidad a largo plazo entre los pacientes con IC y TRC con independiencia de la NT-proBNP y demás factores asociados. Los análisis de reclasificación mostraron que la inclusión del HGF mejoró el rendimiento, la discriminación y la reclasificación de las predicciones en los modelos predictivos. De este modo, el HGF resulta útil en la selección de pacientes para la TRC y la identificación de los expuestos a un muy alto riesgo de mortalidad o cuya respuesta clínica sea insuficiente.
FINANCIACIÓNEste estudio se ha realizado gracias a los programas de la Fundación Húngara «Semmelweis Egyetem Híd Projekt» (TÁMOP-4.2.2-08/1/KMR-2008-0004) y «Semmelweis Egyetem Magiszter Program» (TÁMOP-4.2.2./B10/1.-210-0013), las becas de investigación János Bolyai de la Academia Húngara de Ciencias (G. Széplaki y L. Gellér) y el Fondo de Investigación Científica de Hungría (OTKA K 105555).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Los nuevos biomarcadores de la IC, fractalquina, pentraxina-3, HGF, CA-125 y MMP-9, se asocian con la respuesta clínica en la IC aguda y crónica, pero no hay evidencia previa de su utilidad en la predicción de los resultados después del inicio de la TRC.
- –
Los resultados del estudio demuestran que el HGF predice la mortalidad a los 5 años y la ausencia de remodelado inverso a los 6 meses en los pacientes con IC y TRC, con independiencia de la NT-proBNP y demás predictores basales de resultados. Los pacientes que presentan valores iniciales del HGF > 1.236 pg/ml triplican ampliamente el riesgo de mortalidad a los 5 años. Los análisis de reclasificación revelaron que la aplicación del HGF al modelo predictivo mejoró significativamente la estratificación del riesgo.
Los autores agradecen la colaboración de Éva Fórizs en los ensayos de laboratorio.