La puntuación CHADS2 es una demostrada herramienta fundamental para identificar el riesgo cardioembólico, fundamentalmente el ictus, de pacientes con fibrilación auricular no valvular, con el propósito de indicar la terapia anticoagulante. El objetivo del presente estudio es analizar la utilidad de dicha puntuación para pacientes hipertensos sin fibrilación auricular conocida en una zona mediterránea.
MétodosSe incluyó a 887 pacientes hipertensos de edad ≥ 65 años, no anticoagulados y sin fibrilación auricular, que acudieron a la consulta médica. Se recogieron los principales factores de riesgo, la historia cardiovascular, el tratamiento farmacológico, una analítica básica y un electrocardiograma y se calculó la puntuación CHADS2 (insuficiencia cardiaca, hipertensión, edad ≥ 75 años, diabetes mellitus e ictus previo o accidente isquémico transitorio). Se realizó un seguimiento clínico con recogida de los ingresos hospitalarios por ictus o accidente isquémico transitorio. La mediana del seguimiento fue 804 días.
ResultadosLa media de edad era 72,5±5,7 años, con el 46,6% de varones, el 27,8% de diabéticos y el 8,6% de fumadores. Durante el seguimiento, 40 pacientes fueron ingresados por ictus o accidente isquémico transitorio (4,5%). El análisis de supervivencia libre de eventos mostró diferencias significativas en función de la puntuación CHADS2 (log rank test, p<0,001). En el análisis multivariable, el tabaquismo y un CHADS2 ≥ 3 fueron predictores independientes de ictus o accidente isquémico transitorio.
ConclusionesLa puntuación CHADS2 puede ser una herramienta útil para identificar el riesgo de ictus o accidente isquémico transitorio de los pacientes hipertensos sin fibrilación auricular conocida.
Palabras clave
La puntuación CHADS2 (insuficiencia cardiaca, hipertensión, edad, diabetes, ictus [doble]) es un predictor clínico del riesgo de ictus en pacientes con fibrilación auricular no valvular utilizado para determinar si la terapia anticoagulante o antiagregante está indicada1. Es un esquema simple, de fácil recuerdo y aplicación en la práctica clínica y que ha sido validado en múltiples estudios2,3. Ello ha facilitado su adopción generalizada y el respaldo de las principales sociedades científicas nacionales e internacionales4–6, si bien las actuales guías europeas han incorporado nuevos factores de riesgo a esta puntuación con el objetivo de mejorar en la identificación de los pacientes «de bajo riesgo» (CHA2DS2-VASc)7.
A pesar de haberse probado la utilidad de la puntuación CHADS2 y otros esquemas de estratificación del riesgo para la población con fibrilación auricular no valvular, la mayor parte de los ictus isquémicos (85%) se producen en pacientes sin fibrilación auricular conocida8. Por otro lado, estudios epidemiológicos han mostrado que la hipertensión arterial es el determinante más importante en el riesgo de ictus y que cada uno de los componentes de la puntuación CHADS2 se han asociado de manera independiente con el accidente cerebrovascular en estudios poblacionales9. Sin embargo, no hemos encontrado en la literatura médica ningún trabajo que haya estudiado la utilidad de esta puntuación en la identificación del riesgo de evento cerebrovascular de pacientes hipertensos y sin fibrilación auricular conocida. El objetivo de este trabajo es analizar el papel de la citada puntuación como marcador de riesgo de ictus en una muestra de pacientes hipertensos de edad ≥ 65 años, en ritmo sinusal y asistidos en consultas de una zona mediterránea.
MÉTODOSEl registro FAPRES es un estudio epidemiológico, observacional y multicéntrico, de ámbito asistencial, diseñado para conocer la prevalencia de fibrilación auricular en pacientes de edad ≥ 65 años con diagnóstico clínico de hipertensión arterial en la Comunidad Valenciana. En él participaron 69 investigadores de atención primaria y unidades hospitalarias de hipertensión arterial de Alicante, Castellón y Valencia, en una proporción en consonancia con el peso poblacional de cada una de las tres provincias. La descripción detallada del estudio y la definición de las variables se han publicado previamente10. Se incluyó a un total de 1.028 pacientes en el estudio basal. Los investigadores fueron invitados a realizar un seguimiento clínico de estos pacientes durante 2 años, con recogida de los principales eventos cardiovasculares. Se recogió el consentimiento informado por escrito de todos los pacientes y el estudio se realizó siguiendo los principios de la Declaración de Helsinki, tras su aprobación por un comité ético hospitalario (Comité Ético de Investigación Clínica del Hospital General Universitario de Castellón).
Población de estudioSe ha incluido en el presente trabajo a todos los pacientes registrados en el estudio FAPRES que no tuvieran antecedentes de fibrilación auricular en la historia clínica, se encontraran en ritmo sinusal en el electrocardiograma realizado en la visita basal y no estuvieran en tratamiento con anticoagulantes. Se recogieron los factores de riesgo y la historia cardiovascular de los pacientes mediante un cuestionario estandarizado. Se consideró fumador a todo paciente que consumiera diariamente algún tipo de tabaco (cigarrillos, pipa, puros o tabaco no inhalado) durante por lo menos el último mes11. Por el contrario, al paciente que hubiera dejado de fumar al menos 1 año antes se lo consideró exfumador. Se consideró que practicaba ejercicio físico quien reconociera que andaba activamente al menos 30 min/día o hacía algún tipo de deporte 3 días/semana12. Se recogió el tratamiento farmacológico que el paciente estaba recibiendo en el momento de la consulta, específicamente los fármacos antihipertensivos y el tratamiento de prevención cardioembólica (anticoagulantes y/o antiagregantes). Asimismo se realizó una exploración física con recogida de datos antropométricos (peso, talla y perímetro abdominal) y se tomó la presión arterial. La toma de la presión arterial clínica se realizó siguiendo las recomendaciones de las guías de práctica clínica13, midiendo la presión arterial al paciente, tras 5 min en reposo, en 2 ocasiones separadas 2 min y en sedestación, para calcular la media aritmética de ambas. Para ello se utilizaron dispositivos automáticos calibrados y validados. Los datos analíticos se recogieron de la historia clínica si estaban disponibles los de los últimos 6 meses o se solicitaron al laboratorio en ese momento. El filtrado glomerular se determinó mediante la fórmula MDRD (Modification of Diet in Renal Disease Study). El cuestionario con la historia clínica se enviaba mediante una CRO (Contract Research Organization) para el procesado automático de los datos. A todos los pacientes se les realizó también un electrocardiograma que se remitía por correo ordinario a un centro de referencia, donde lo analizaban de manera independiente dos cardiólogos expertos que desconocían los datos clínicos de los pacientes. Se valoró la presencia de fibrilación auricular e hipertrofia ventricular izquierda mediante criterios de Sokolov, Cornell o sobrecarga ventricular. Se realizó una auditoria externa aleatoria de un 10% de los cuestionarios registrados, con el fin de comprobar la fiabilidad de los datos incluidos.
Se determinó la puntuación CHADS2 de los pacientes para valorar el riesgo de ictus (insuficiencia cardiaca, hipertensión, edad ≥ 75 años, diabetes mellitus [1 punto cada uno] e ictus previo o accidente isquémico transitorio [AIT] [2 puntos])2 y se los clasificó en 4 grupos en función de su puntuación: 1, 2, 3 y ≥ 4 puntos. Se realizó un seguimiento clínico de los pacientes, con recogida de los ingresos hospitalarios por ictus o AIT.
Análisis estadísticoTodos los datos recogidos en el estudio se describen en términos de tendencia central, medidas de dispersión y frecuencias relativas. Para la comparación de variables cuantitativas entre los grupos, se utilizó el test de la t de Student o el ANOVA y para la comparación de las variables categórica, el test de la χ2. Se calculó la supervivencia libre de enfermedad (ictus/AIT) según la puntuación CHADS2 por el método de Kaplan-Meier. Para determinar las variables relacionadas de manera independiente con la incidencia del evento cerebrovascular en el seguimiento, se realizó un análisis multivariable de regresión logística en el que se incluyeron todas las variables que en el análisis univariable resultaron significativas y aquellas de reconocida relevancia clínica junto con la puntuación CHADS2. Para analizar la validez de la puntuación CHADS2 en el cálculo del riesgo de ictus/AIT, se trazó la curva receiver operating characteristic (ROC) y se calculó el área bajo la curva. Asimismo se creó una puntuación combinada del CHADS2 y las variables que resultaran significativas en el análisis multivariable, con el cálculo de la curva ROC para predecir el riesgo de ictus/AIT. Se consideró significación estadística un valor de p<0,05. Para el análisis se utilizó el programa estadístico SPSS versión 21.
RESULTADOSDe los 1.028 pacientes hipertensos incluidos basalmente en el estudio FAPRES, se seleccionó a 922 pacientes sin fibrilación auricular conocida y sin tratamiento anticoagulante. De ellos, 887 completaron el seguimiento (96,2%), con una mediana de 804 (723-895) días. La media de edad de la población era 72,5±5,7 años, y el 46,6% eran varones. El 47,8% de los pacientes tenía antecedentes de hipercolesterolemia, el 27,8% presentaba diabetes mellitus y el 8,6% eran fumadores activos. Asimismo 62 pacientes tenían antecedentes de ictus previo (7%), 31 casos estaban diagnosticados de insuficiencia cardiaca (3,5%) y 115, de cardiopatía isquémica (13%).
Tras calcular la puntuación CHADS2, se observó que 430 casos (48,5%) tenían un valor de 1; 307 (34,6%), de 2; 111 (12,5%), de 3 y 39 (4,4%), ≥ 4. En la tabla 1 se recogen las características principales de dichas poblaciones. Los pacientes con puntuación más alta eran de más edad y tenían mayor prevalencia de factores de riesgo y enfermedad cardiovascular establecida (especialmente cardiopatía isquémica e hipertrofia ventricular izquierda), así como más tiempo de evolución de la hipertensión arterial. También tenían concentraciones plasmáticas de colesterol unido a lipoproteínas de alta densidad más bajas y peor filtrado glomerular. Respecto al tratamiento, los pacientes con CHADS2 ≥ 4 recibieron más frecuentemente antagonistas de los receptores de la angiotensina II, antagonistas del calcio, estatinas y antiagregantes. No se encontraron diferencias significativas en el uso de inhibidores de la enzima de conversión de la angiotensina, bloqueadores beta o diuréticos entre las 4 poblaciones.
Características basales de la población en función de la puntuación CHADS2
| Variable | CHADS2=1 (n=430) | CHADS2=2 (n=307) | CHADS2=3 (n=111) | CHADS2 ≥ 4 (n=39) | p |
|---|---|---|---|---|---|
| Edad (años) | 69,4±3,3 | 74,8±6,2 | 77,1±5,3 | 75,8±4,1 | < 0,001 |
| Varones | 188 (43,7) | 146 (47,6) | 54 (48,6) | 25 (64,1) | 0,088 |
| Tabaquismo | 40 (9,3) | 25 (8,1) | 9 (8,1) | 2 (5,1) | 0,805 |
| Diabetes mellitus | 0 | 146 (47,6) | 75 (67,6) | 26 (66,7) | < 0,001 |
| Hipercolesterolemia | 187 (43,5) | 150 (48,9) | 58 (52,3) | 29 (74,4) | 0,002 |
| Cardiopatía isquémica | 40 (9,3) | 47 (15,3) | 19 (17,1) | 9 (23,1) | 0,008 |
| Insuficiencia cardiaca | 0 | 10 (3,3) | 13 (11,7) | 8 (20,5) | < 0,001 |
| Ictus previo | 0 | 0 | 27 (24,3) | 35 (89,7) | < 0,001 |
| Ejercicio físico | 186 (43,3) | 104 (33,9) | 32 (28,8) | 16 (41) | 0,010 |
| Evolución HTA (años) | 9,2±7,2 | 11,7±8,6 | 12,8±7,4 | 14,2±10,4 | < 0,001 |
| PAS en consulta (mmHg) | 146,5±18,3 | 147,4±19,5 | 148,9±18,5 | 147,9±20,6 | 0,846 |
| PAD en consulta (mmHg) | 83,1±10,1 | 80,5±11,3 | 77,6±11 | 78,5±13,9 | < 0,001 |
| Perímetro abdominal (cm) | 97,3±11 | 99,2±11,4 | 98,2±11,8 | 101,8±11,7 | 0,031 |
| IMC | 29,1±3,9 | 29,5±4,4 | 28,3±4,4 | 29,3±4 | 0,073 |
| Hemoglobina (g/dl) | 13,7±1,6 | 13,4±1,8 | 13,3±2,1 | 13,2±2,2 | 0,041 |
| Glucosa (mg/dl) | 96,6±18,3 | 116,7±38,3 | 126,6±38,3 | 119,1±31,5 | < 0,001 |
| cLDL (mg/dl) | 124,3±33,2 | 117,8±32,1 | 112,8±37,3 | 105,1±39,1 | < 0,001 |
| cHDL (mg/dl) | 54,3±12,1 | 51,3±12,6 | 52,4±14,5 | 47,2±9,8 | 0,001 |
| Triglicéridos (mg/dl) | 130,3±69,7 | 126,6±66,6 | 120,6±50,2 | 169,6±175,6 | 0,005 |
| Filtrado glomerular (ml/min) | 78,9±21,6 | 72,8±22,5 | 74,4±27,3 | 68,9±17,5 | 0,001 |
| HVI en ECG* | 53 (12,3) | 56 (18,2) | 23 (20,7) | 8 (20,5) | 0,047 |
| Estatinas | 96 (22,3) | 73 (23,8) | 34 (30,6) | 22 (56,4) | < 0,001 |
| Antiagregantes | 41 (9,5) | 69 (22,5) | 40 (36) | 27 (69,2) | < 0,001 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECG: electrocardiograma; HTA: hipertensión arterial; HVI: hipertrofia ventricular izquierda; IMC: índice masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Los datos expresan n (%) o media ± desviación estándar.
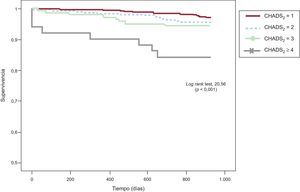
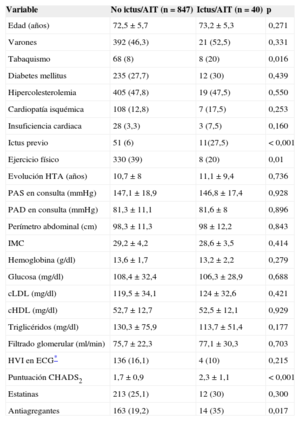
Durante el seguimiento, 40 (4,5%) pacientes sufrieron un ingreso hospitalario por ictus/AIT, con mayor incidencia en los pacientes con puntuaciones CHADS2 más altas: el 2,8% del grupo CHADS2=1, el 4,2% del CHADS2=2, el 7,2% en el CHADS2=3 y el 17,9% del CHADS2 ≥ 4. En la figura 1 se muestra la curva de Kaplan-Meier que refleja la peor evolución de los pacientes con puntuación CHADS2 más alta. Los pacientes que sufrieron un evento cerebrovascular tenían mayores prevalencias de tabaquismo e ictus previo y CHADS2 (2,3±1,1 frente a 1,7±0,9; p<0,001) más alto que los pacientes sin esa complicación, además de menos práctica de ejercicio físico (tabla 2). No hubo diferencias en la edad o en la prevalencia de diabetes mellitus o hipercolesterolemia entre ambas poblaciones. Por el contrario, se observó que los pacientes que sufrieron un ictus/AIT tomaban más antiagregantes (el 35 frente al 19,2%; p<0,05), sin diferencias en el tratamiento antihipertensivo o la utilización de estatinas entre ambas poblaciones.
Estudio comparativo entre los pacientes según sufrieran o no ictus/accidente isquémico transitorio durante el seguimiento
| Variable | No ictus/AIT (n=847) | Ictus/AIT (n=40) | p |
|---|---|---|---|
| Edad (años) | 72,5±5,7 | 73,2±5,3 | 0,271 |
| Varones | 392 (46,3) | 21 (52,5) | 0,331 |
| Tabaquismo | 68 (8) | 8 (20) | 0,016 |
| Diabetes mellitus | 235 (27,7) | 12 (30) | 0,439 |
| Hipercolesterolemia | 405 (47,8) | 19 (47,5) | 0,550 |
| Cardiopatía isquémica | 108 (12,8) | 7 (17,5) | 0,253 |
| Insuficiencia cardiaca | 28 (3,3) | 3 (7,5) | 0,160 |
| Ictus previo | 51 (6) | 11(27,5) | < 0,001 |
| Ejercicio físico | 330 (39) | 8 (20) | 0,01 |
| Evolución HTA (años) | 10,7±8 | 11,1±9,4 | 0,736 |
| PAS en consulta (mmHg) | 147,1±18,9 | 146,8±17,4 | 0,928 |
| PAD en consulta (mmHg) | 81,3±11,1 | 81,6±8 | 0,896 |
| Perímetro abdominal (cm) | 98,3±11,3 | 98±12,2 | 0,843 |
| IMC | 29,2±4,2 | 28,6±3,5 | 0,414 |
| Hemoglobina (g/dl) | 13,6±1,7 | 13,2±2,2 | 0,279 |
| Glucosa (mg/dl) | 108,4±32,4 | 106,3±28,9 | 0,688 |
| cLDL (mg/dl) | 119,5±34,1 | 124±32,6 | 0,421 |
| cHDL (mg/dl) | 52,7±12,7 | 52,5±12,1 | 0,929 |
| Triglicéridos (mg/dl) | 130,3±75,9 | 113,7±51,4 | 0,177 |
| Filtrado glomerular (ml/min) | 75,7±22,3 | 77,1±30,3 | 0,703 |
| HVI en ECG* | 136 (16,1) | 4 (10) | 0,215 |
| Puntuación CHADS2 | 1,7±0,9 | 2,3±1,1 | < 0,001 |
| Estatinas | 213 (25,1) | 12 (30) | 0,300 |
| Antiagregantes | 163 (19,2) | 14 (35) | 0,017 |
AIT: accidente isquémico transitorio; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECG: electrocardiograma; HTA: hipertensión arterial; HVI: hipertrofia ventricular izquierda; IMC: índice masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Los datos expresan n (%) o media ± desviación estándar.
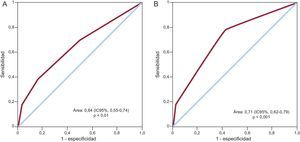
En el análisis multivariable, los factores asociados a la incidencia de ictus/AIT fueron el tabaquismo y la puntuación CHADS2, con mayor riesgo para los pacientes con valores ≥ 3 (tabla 3). Por el contrario, el ejercicio físico se asoció a menos riesgo de ictus/AIT. El área bajo la curva ROC de la puntuación CHADS2 para el riesgo de ictus/AIT fue 0,64 (intervalo de confianza del 95% [IC95%], 0,55-0,74; p<0,01) (figura 2A). Dados estos resultados, se calculó también la curva ROC de la puntuación combinada de las variables significativas del análisis multivariable (CHADS2 + tabaquismo + sedentarismo) para el riesgo de ictus/AIT, con un área bajo la curva de 0,71 (IC95%, 0,62-0,79; p<0,001) (figura 2B).
Análisis multivariable. Factores asociados a la aparición de ictus/accidente isquémico transitorio durante el seguimiento
| Variable | Ictus/AIT, OR (IC95%) | p |
|---|---|---|
| Tabaco | 3,45 (1,50-8,04) | 0,004 |
| Ejercicio físico | 0,39 (0,17-0,88) | 0,023 |
| CHADS2=2* | 1,36 (0,60-3,01) | 0,469 |
| CHADS2=3* | 2,91 (1,12-7,52) | 0,028 |
| CHADS2 ≥ 4* | 9,40 (3,33-26,49) | < 0,001 |
AIT: accidente isquémico transitorio; OR: odds ratio.
Las variables introducidas en el modelo son: sexo, tabaquismo, hipercolesterolemia, cardiopatía isquémica, ejercicio físico, presión arterial sistólica y diastólica, tiempo de evolución de la hipertensión arterial, perímetro abdominal, filtrado glomerular, índice de masa corporal, inhibidores de la enzima de conversión de la angiotensina, antagonistas del receptor de la angiotensina II, bloqueadores beta, diuréticos, antagonistas del calcio, estatinas, antiagregantes y puntuación CHADS2.
El presente estudio es uno de los primeros trabajos que valora el impacto pronóstico de la puntuación CHADS2 para establecer el riesgo de evento cerebrovascular en una cohorte mediterránea de pacientes hipertensos sin fibrilación auricular conocida. Los resultados ponen de manifiesto que el CHADS2 es un buen predictor de ictus/AIT, de tal manera que los pacientes con una puntuación ≥ 3 tienen un riesgo aumentado de padecer un evento cerebrovascular a medio plazo.
La enfermedad cardiovascular aterosclerótica, especialmente la enfermedad cerebrovascular, es una de las principales causas de muerte prematura y discapacidad en los países desarrollados9. El desarrollo y la progresión de la enfermedad aterosclerótica a menudo son insidiosos y pueden aparecer sin síntomas de alarma y en estadios avanzados. Por este motivo, es de gran importancia establecer el riesgo de ictus para proporcionar un adecuado tratamiento médico y reducir la elevada carga económica de los sistemas de salud. En los últimos años, se ha extendido el uso de la puntuación CHADS2 más allá de su escenario original de la fibrilación auricular14,15, y presenta algunas ventajas sobre otras escalas (SCORE o Framinghan), como la inclusión de pacientes de más edad y su menor complejidad en su utilización diaria. Henriksson et al han aplicado esta puntuación a una amplia serie de pacientes supervivientes a un ictus incluidos en el Swedish Stroke Registry, y demuestran que el riesgo de mortalidad a los 5 años del evento cerebral aumenta gradual y linealmente con la puntación del CHADS2, tanto para pacientes con fibrilación auricular como en ritmo sinusal16. Estos datos se han confirmado recientemente en otros estudios, donde se ponen de manifiesto mayor mortalidad y mayor recurrencia de ictus y eventos cardiovasculares en los pacientes con ictus y una puntuación ≥ 2, independientemente de que haya o no fibrilación auricular17,18.
El papel de la puntuación CHADS2 también se ha investigado en el campo de la cardiopatía isquémica. En un estudio realizado en 916 pacientes no anticoagulados con enfermedad coronaria estable y sin fibrilación auricular, se puso de manifiesto que los pacientes con un CHADS2 intermedio (2-3) o alto (4-6) tenían mayor riesgo de ictus/AIT que los pacientes con un CHADS2 bajo (0-1) tras ajustar por otros factores de riesgo19. Además, la incidencia de ictus en los pacientes isquémicos con CHADS2 > 5 era comparable a la publicada sobre pacientes con fibrilación auricular y CHADS2 1-2, una población en la que se conoce los beneficios derivados de las terapias de prevención del ictus como la anticoagulación20. También se ha demostrado su utilidad pronóstica para pacientes con síndrome coronario agudo y sin fibrilación auricular, pues puntuaciones elevadas del CHADS2 en el momento del ingreso se asociaban a mayor riesgo de hospitalización por ictus y mayor mortalidad durante el seguimiento21. Más recientemente, la puntuación CHADS2 también ha mostrado su capacidad predictiva de ictus en pacientes a los que se implantó un marcapasos por enfermedad del nódulo sinusal22.
En el presente estudio ampliamos el escenario de utilización de la citada puntuación al campo de la hipertensión arterial, el factor determinante más importante en el riesgo de ictus, y demostramos la asociación entre CHADS2 y riesgo de sufrir un evento cerebrovascular a medio plazo en una muestra de pacientes hipertensos de edad ≥ 65 años, con un incremento progresivo a medida que aumenta el valor del CHADS2, de tal manera que los pacientes con una puntuación ≥ 4 multiplican por 9 el riesgo de los pacientes con una puntuación de 1. Estos hallazgos no se habían establecido en esta población de alto riesgo, por lo que pensamos que el presente trabajo puede aportar un valioso apoyo a la hora de utilizar este esquema de predicción de riesgo, atractivo y sencillo, en nuestro medio.
Son diversos los mecanismos potenciales que pueden explicar la capacidad del CHADS2 para predecir el riesgo de ictus de los pacientes hipertensos sin fibrilación auricular. Por un lado, los pacientes con mayor puntuación CHADS2 pueden tener mayor riesgo de arritmias auriculares. Un estudio realizado en pacientes que habían sufrido un ictus isquémico y se encontraban monitorizados durante su estancia hospitalaria reveló una mayor incidencia de episodios de fibrilación auricular oculta en los pacientes con mayor puntuación CHADS223. Por otro lado, los diferentes factores de riesgo del CHADS2 pueden por sí solos aumentar el riesgo de ictus, independientemente del ritmo cardiaco. Pacientes con insuficiencia cardiaca24 y diabetes mellitus25 tienen elevados los marcadores plasmáticos de hipercoagubilidad y disfunción endotelial, mecanismos implicados en la formación de trombos e ictus en pacientes con fibrilación auricular26. Finalmente, los distintos componentes del CHADS2 pueden directamente contribuir al remodelado de la aurícula izquierda, un proceso caracterizado por dilatación y disfunción mecánica de la aurícula27. Ello puede conducir a estasis sanguínea y conllevar un incremento en el riesgo tromboembólico, independientemente del ritmo cardiaco28. En este sentido, un estudio reciente realizado en 970 pacientes con enfermedad coronaria ha demostrado asociación entre la puntuación del CHADS2 y un parámetro ecocardiográfico de disfunción de la aurícula izquierda, la puntuación funcional, incluso en pacientes sin fibrilación auricular, lo que abre el debate sobre el papel de la disfunción de la aurícula izquierda en el ictus cardioembólico29.
LimitacionesEl estudio realizado presenta algunas limitaciones. En primer lugar existe un sesgo de selección, ya que los pacientes reclutados en el estudio eran los que acudían espontáneamente al sistema sanitario, por lo que nuestras conclusiones no pueden extrapolarse a otros escenarios. Por otro lado, nuestro trabajo obtiene los eventos a partir del análisis de los ingresos hospitalarios; esto hace que un número indeterminado de AIT que no consultan no se detecten en el análisis. Asimismo, los ictus/AIT se analizaron de manera general, sin diferenciar las distintas etiopatogenias (embólico, aterotrombótico, lacunar, etc.). Finalmente, no existe una segunda cohorte independiente de validación que confirme los resultados de predicción clínica obtenidos en nuestra muestra.
CONCLUSIONESNuestros hallazgos ponen de manifiesto que el CHADS2, una herramienta fácil, rápida y simple, puede tener un papel en la identificación del riesgo de evento cerebrovascular de los pacientes hipertensos sin fibrilación auricular conocida. Además permite plantear la cuestión de si los casos con CHADS2 más altos podrían beneficiarse de terapias preventivas como la anticoagulación, ya sea por un mayor riesgo de fibrilación auricular silente30 o por mecanismos de tromboembolia independientemente del ritmo cardiaco, por lo que sería recomendable la realización de estudios en este sentido.
CONFLICTO DE INTERESESNinguno.
A laboratorios Lácer, por su contribución y ayuda no condicionada a este proyecto. A todos los investigadores participantes, sin cuyo trabajo y esfuerzo diario no habría sido posible el estudio.
Juan Alberola, Vicente Javier; Maestre Amat, Luis; Mateo Limiñana, Jose Manuel; Monleon Gomez, Jose; Montagud Moncho, Miguel; Guinot Martinez, Enrique; Gamon Pastor, Jose Blas; Salanova Penalba, Alejandro; Sanchis Domenech, Carlos; Pallares Carratala, Vicente; Palacios del Cerro, Antonio; Perez Martinez, Rafael; Baudet Dejean, Chantal; Perez Alonso, Manuel; Facila Rubio, Lorenzo; Sipan Sarrion, Yolanda; Saro Perez, Eugenia; Villaro Gumpert, Juan; Cabrera Ferriols, M. Angeles; Fraile Fraile, Belen; Carbonell Franco, Francisco; Cornejo Mari, Francisco Javier; Barbera Comes, Javier; Quiles Añon, Fernando; Llisterri Caro, Jose Luis; Almenar Cubells, Enrique; Casado Gonzalez, Joaquin; Godoy Rocati, Diego; Martinez Guerola, Carmen; Bonet Garcia, Jorge Alejo; Blazquez Encinar, Julio Cesar; Botella Estrada, Carlos; Saen Alcoy, Montepio; Almarcha Perez, Natividad; Salanova Chilet, Lorena; Torres Ferrando, Miquel; Debon Belda, Manuel; Fluixa Carrascosa, Carlos; Aznar Baset, Lucia; Vivancos Aparicio, Diego; Pineda Cuenca, Manuel; Obarrio Moreno, Alicia; Nuñez Jorge, Carlos; Matoses Nacher, Daniel; Baño Aracil, Manuel; Balanza Garzon, Alicia; Garcia Palomar, Carlos; Peña Forcada, Enrique; Raga Casasus, Jose; Martinez Lahuerta, Juan; Mendizabal Nuñez, Andrea; Santos Alonso, Eufrosina; Corbi Pascual, Miguel; Lillo Sanchez, Antonio; Martorell Adsuara, Vicente; Sanchez Ruiz, Tomas; Ortiz Diaz, Francisco; Llinares Orts, Jose Francisco; Lahoz Ferrer, Julio; Morillas Blasco, Pedro; Pertusa Martinez, Salvador; Manclus Montoya, Carlos; Adria Mico, Jose Manuel; Llaudes Soler, Ricardo; Castillo Castillo, Jesus; Llopis Martinez, Francisco; Ruiz de la Prada Abarzuza, Ignacio; Nebot Rico, Lidia.