INTRODUCCIÓN Y OBJETIVOS: El propósito de este estudio ha sido conocer el curso clínico y el pronóstico de los pacientes con endocarditis que desarrollan un seudoaneurisma.
MÉTODOS: Se describen las características clínicas y evolutivas de un grupo de 18 pacientes (11 varones, edad media 55 ± 4 años) con endocarditis infecciosa, en quienes la ecografía transesofágica diagnosticó la presencia de seudoaneurisma.
RESULTADOS: Catorce seudoaneurismas se localizaron en posición aórtica (6 sobre válvula nativa y 8 sobre prótesis), tres en posición mitral (tres prótesis) y uno en posición tricuspídea. En 6 casos apareció bloqueo aurículoventricular que no existía al ingreso, y en todos ellos el seudoaneurisma estaba en posición aórtica. Los microorganismos más frecuentemente aislados fueron los estafilococos (n = 5) y estreptococos (n = 5). Se encontraron abscesos en 5 pacientes. La presencia de seudoaneurisma no fue considerada per se como criterio de cirugía. De los 11 pacientes operados, 5 fallecieron tras la cirugía (45%), uno presentó reinfección y otros 5 están asintomáticos. Los restantes 7 pacientes recibieron exclusivamente tratamiento médico: fallecieron dos (28%), uno presentó reinfección y cuatro están asintomáticos. En el grupo de tratamiento conservador que están asintomáticos (n = 4), el tamaño del seudoaneurisma no se modificó después de 24 meses de seguimiento (diámetro mayor 21 ± 5 frente a 22 ± 5 mm en el seguimiento; p = NS).
CONCLUSIÓN: La presencia de seudoaneurisma identifica a un subgrupo de pacientes con endocarditis que tienen una alta mortalidad. Los seudoaneurismas son más frecuentes en posición aórtica y alrededor de material protésico. El tratamiento médico puede considerarse una alternativa a la cirugía cuando no existan otras indicaciones quirúrgicas. Finalmente, el tamaño del seudoaneurisma en el grupo de pacientes tratados de forma conservadora permanece estable a lo largo del tiempo.
Palabras clave
Endocarditis infecciosa
Ecografía transesofágica
Seudoaneurisma
INTRODUCCIÓN
El desarrollo de complicaciones perianulares (abscesos, seudoaneurismas y fístulas) en un paciente con endocarditis indica que el proceso no se ha limitado a la región valvular y sugiere, por tanto, un pronóstico sombrío 1-6.
La mayoría de los autores consideran el hallazgo de complicaciones perianulares como indicación de cirugía 7, y existe poca información disponible sobre las características clínicas y la evolución de los pacientes con complicaciones perianulares 1-5,8. Más concretamente, no existen series amplias sobre enfermos con endocarditis a quienes se les haya diagnosticado la presencia de un seudoaneurisma durante el curso clínico.
Nuestro objetivo ha sido conocer el perfil clínico y el pronóstico de un grupo de 18 pacientes con endocarditis en quienes un ecocardiograma transesofágico realizado tempranamente, o la visión directa durante el acto quirúrgico, demostró la presencia de un seudo-aneurisma.
MÉTODOS
De 143 episodios consecutivos diagnosticados de endocarditis según los criterios de Durack et al 9, la ecografía transesofágica demostró la presencia de un seudoaneurisma en 18 pacientes (12,5%), que forman nuestro grupo de estudio (seguimiento durante 14 ± 5 meses).
En nuestros centros, un paciente diagnosticado de endocarditis entra a formar parte de un estudio prospectivo en el que se analiza un total de 94 variables (epidemiológicas, clínicas, analíticas, microbiológicas, eocardiográficas y referentes al tratamiento inicial recibido y a su evolución). Nuestro protocolo incluye un seguimiento clínico y una completa evaluación ecocardiográfica (con un estudio transtorácico y transesofágico) en el momento del ingreso, a la semana del inicio del tratamiento antibiótico y antes del alta para evaluar la lesión valvular residual. El ecocardiograma se repite siempre que se sospeche una complicación intracardíaca, si la situación hemodinámica empeora bruscamente, si persiste el síndrome febril a pesar de un tratamiento antibiótico adecuado y si aparece roce pericárdico o alteraciones de la conducción eléctrica. Además, se realiza una evaluación clínica y ecocardiográfica a los 6 meses tras el alta, al año y posteriormente de forma anual.
Ante la sospecha de endocarditis infecciosa, se procede a la extracción de al menos tres hemocultivos (separados por una hora entre sí y obtenidos en diferentes sitios de punción). Si los primeros hemocultivos son negativos, se realiza una nueva serie de ellos a las 48 h. A todos los pacientes se les vuelven a repetir tras dos días de inicio del tratamiento antibiótico. Si los primeros hemocultivos son negativos, se solicitará serología frente a fiebre Q, Chlamydia, Mycoplasma, Brucella y Legionella.
La reaparición de la endocarditis por el mismo patógeno causal que el episodio previo se consideró una recidiva; si era producida por un germen diferente, se consideró reinfección.
La cirugía se indicó de acuerdo con los criterios clínicos establecidos por cada centro. En ningún caso un paciente fue operado por el hallazgo de un seudoaneurisma.
Para la realización de la ecocardiografía transesofágica se usó una sonda multiplano de 5 mHz. Los pacientes permanecían en ayunas durante al menos 4 h antes del estudio. La sonda se introducía en el esófago después de anestesiar la orofaringe con lidocaína tópica y la administración de midazolam o diazepam y meperidina por vía intravenosa. A continuación se siguió la sistemática habitual en la forma de obtención de imágenes para visualizar las cámaras cardíacas y los grandes vasos 10. Se prestó una especial atención a determinadas áreas como los anillos valvulares, vál-vulas protésicas o la continuidad mitroaórtica. El Doppler y el Doppler color se utilizaron en todos los casos tanto para valorar si las válvulas eran funcionalmente normales como para demostrar o descartar la presencia de flujo dentro de las cavidades o la existencia de comunicaciones entre las cámaras cardíacas.
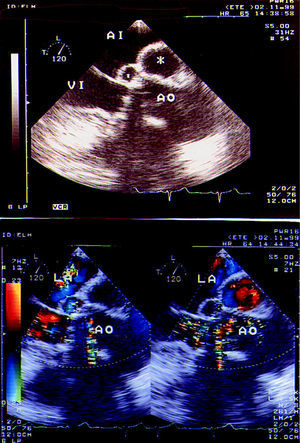
Desde una perspectiva ecocardiográfica, definimos el seudoaneurisma como una cavidad perivalvular, anecoica, con flujo en su interior que comunica con la luz vascular (fig. 1). Un absceso sería una región perivalvular bien delimitada, de baja densidad ecocardiográfica, sin flujo en su interior.
Fig. 1. Estudio transesofágico en modo bidimensional de un paciente con un seudoaneurisma sobre una prótesis aórtica. En la imagen superior se observan dos cavidades (asteriscos) situados en la región posterior del anillo y raíz aórticas. En la imagen inferior, el color demuestra que hay flujo en el interior de las cavidades; corresponden, por tanto, a seudoaneurismas. AI, LA: aurícula izquierda; Ao: aorta; VI: ventrículo izquierdo.
RESULTADOS
Nuestro grupo de estudio está formado por 18 pacientes (11 varones; edad media, 55 ± 4 años; rango, 29-82 años), de un total de 143 episodios consecutivos de endocarditis infecciosa. La cirugía confirmó el diagnóstico ecocardiográfico de seudoaneurisma en 11 pacientes; en los 7 restantes el diagnóstico fue exclusivamente ecocardiográfico. Se llevó a cabo un seguimiento clínico y ecocardiográfico en todos los pacientes, con un tiempo medio de 14 ± 5 meses.
Datos epidemiológicos
Entre los antecedentes personales de interés conviene destacar que un paciente era adicto a drogas por vía intravenosa y dos tenían antecedentes de endocarditis previa. En 7 pacientes los seudoaneurismas se localizaron sobre válvulas nativas: dos en válvulas reumáticas, uno en válvula aórtica bicúspide, uno en válvula mitral mixoide, una cardiopatía isquémica y uno sin cardiopatía previa conocida.
Localización del seudoaneurisma
Catorce seudoaneurismas estaban localizados en posición aórtica (8 sobre prótesis y 6 en válvulas nativas), tres en válvulas protésicas mitrales y uno sobre válvula nativa tricúspide. La ecografía transesofágica demostró abscesos en 5 pacientes con seudoaneurismas.
Alteraciones electrocardiográficas
En 6 casos (42%) se objetivaron trastornos de la conducción que no existían previamente en forma de bloqueo auriculoventricular: 4 de primer grado y dos de segundo grado. En todos ellos el seudoaneurisma estaba ubicado en posición aórtica.
Microbiología(tabla 1)
Desde el punto de vista microbiológico, los agentes etiológicos más comunes fueron el grupo de estafilococos y estreptococos. Los hemocultivos realizados fueron negativos en 4 casos (22%); estos 4 pacientes habían recibido tratamiento antibiótico antes de su ingreso hospitalario.
Evolución de los pacientes que requirieron cirugía
De los 18 pacientes, 11 (61%) recibieron un tratamiento combinado médico y quirúrgico. La cirugía se indicó por los siguientes motivos: insuficiencia cardíaca refractaria al tratamiento médico habitual (7); infección persistente a pesar de tratamiento antibiótico correcto (2); aumento progresivo del tamaño de la vegetación sobre prótesis biológica en posición aórtica (1), y más de un accidente cerebrovascular (1). En este grupo de pacientes operados fallecieron 5 (45%): 4 en el postoperatorio y uno después del alta. Un paciente precisó ingreso por reinfección y, al final del seguimiento, 5 se encontraban asintomáticos.
Evolución de los pacientes que siguieron tratamiento médico
Del grupo de pacientes no intervenidos (7), dos fallecieron (28%), uno ingresó por reinfección y 4 estaban libres de síntomas al final del seguimiento. Ninguno precisó cirugía durante el seguimiento. El seudoaneurisma estaba localizado en tres de ellos en posición mitral, en tres en posición aórtica y en uno en tricúspide; en 5 de ellos asentaba sobre prótesis, y en los dos restantes, sobre válvulas nativas. El tamaño del seudoaneurisma no se modificó con el tiempo en los 4 pacientes que se encontraban asintomáticos. En el momento del diagnóstico el diámetro máximo era de 21 ± 5 mm y no aumentó al final del seguimiento (22 ± 5 mm; p = NS).
DISCUSIÎN
Actualmente la mayoría de los pacientes con endocarditis que desarrollan alguna complicación perianular son remitidos a cirugía debido al previsible tórpido curso clínico 1-6,11. Esta indicación está basada en estudios observacionales de tipo retrospectivo en los que se ha demostrado una asociación entre la presencia de estas complicaciones y una mala evolución clínica. Nuestro estudio confirma esta relación, pues un 61% de los pacientes con seudoaneurismas requirió cirugía. Sin embargo, no sabemos si los enfermos con endocarditis y complicaciones perianulares con buena respuesta al tratamiento médico necesitan ser operados 12-14. Debido a que en nuestros centros la presencia de alguna de estas complicaciones no fue considerada per se como criterio de cirugía, hemos podido seguir a un grupo de pacientes con un seudoaneurisma que no fueron operados. Según nuestros resultados, un paciente con seudoaneurisma que evoluciona de forma favorable no necesariamente debe ser operado.
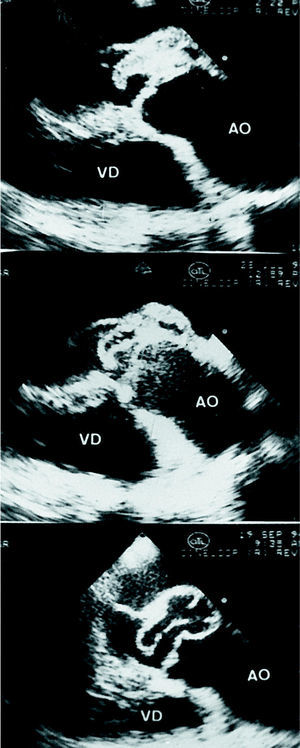
Un absceso, entendido como una cavidad necrótica con material purulento en su interior, puede espontáneamente drenar el contenido infeccioso y transformarse en una cavidad estéril con flujo en su interior, es decir, un seudoaneurisma (fig. 2). Teóricamente, el curso clínico de los pacientes con seudoaneurisma sería más benigno, pues la infección habría desaparecido. Algunos autores 15 discrepan de la patogenia de los seudoaneurismas. La propia infección podría causar un debilitamiento de la pared, seguido de una disección que formaría el seudoaneurisma (fig. 3). Si así fuera, la pared del seudoaneurisma sería muy débil, y dejar que éste evolucionara sobre el plano aórtico podría entrañar un elevado riesgo de rotura. Sin embargo, hemos comprobado que, en los pacientes con seudo-aneurismas tratados de forma conservadora que han evolucionado favorablemente, el tamaño del seudoaneurisma no se modifica y permanece estable a lo largo del tiempo, como ya han observado otros autores 14. Es posible que los pacientes con seudoaneurismas formados por debilitamiento de la pared evolucionaran de forma desfavorable y fueran los que necesitaran cirugía. No obstante, es recomendable efectuar un exhaustivo seguimiento tanto clínico como con una adecuada técnica de imagen a los pacientes con seudoaneurismas que no han sido operados 16, y plantear la cirugía si el tamaño de éste aumenta de forma considerable.
Fig. 2. Evolución de un absceso en un paciente con endocarditis aórtica. La imagen superior corresponde a un absceso, y la inferior, a un seudoaneurisma. AO: aorta; VD: ventrículo derecho.
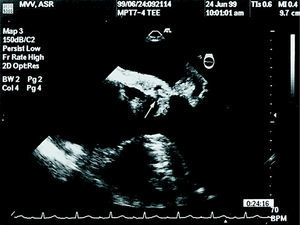
Fig. 3. Ecografía transesofágica en modo bidimensional de un paciente con endocarditis de la válvula mitral anterior. Se observa un seudoaneurisma que parece formado a partir de una disección de la continuidad mitroaórtica (flecha).
La principal limitación de este estudio es el tamaño de la muestra; aunque partimos de un número considerable de episodios de endocarditis, no lo es tanto el grupo de seudoaneurismas, y menos aún el subgrupo de éstos tratados de forma conservadora. Todo ello nos hace ser cautos a la hora de extrapolar conclusiones. Aun así, opinamos que las indicaciones de cirugía en el seno de la endocarditis deben basarse en criterios clínicos, no en hallazgos encontrados por una técnica de imagen; por tanto, el hallazgo ecocardiográfico de un seudoaneurisma no debe ser una indicación de cirugía per se.
Nuestro estudio confirma que los pacientes con endocarditis que desarrollan un seudoaneurisma presentan una alta mortalidad. Éstos se localizan más frecuentemente en posición aórtica y sobre material protésico, como ya se ha observado en otras series 1-4,6,17,18. El tratamiento médico puede considerarse una alternativa a la cirugía cuando no existan otras indicaciones quirúrgicas. Además, el tamaño del seudoaneurisma en pacientes tratados de forma conservadora permanece estable a lo largo del tiempo.
Bibliografía
[1]
Arnett EN, Roberts WC..
Valve ring abscess in active infective endocarditis: frequency, location, and clues to clinical diagnosis from the study of 95 necropsy patients..
Circulation, (1976), 54 pp. 140-155
[2]
Omari B, Shapiro S, Ginzton L, Robertson JM, Ward J, Nelson RJ et al..
Predictive risk factors for periannular extension of native valve endocarditis. Clinical and echocardiographic analyses..
Chest, (1986), 96 pp. 1273-1279
[3]
González Vílchez FJ, Martín Durán R, Delgado Ramis C, Vázquez de Prada JA, Ochoteco Azcárate A, Zarauza Navarro et al..
Endocarditis infecciosa activa complicada con absceso paravalvular: revisión de 40 casos..
Rev Esp Cardiol, (1991), 44 pp. 306-312
[4]
Aguado JM, González Vílchez F, Martín Durán R, Arjona R, Vázquez de Prada JA..
Perivalvular abscesses associated with endocarditis. Clinical features and diagnostic accuracy of two-dimensional echocardiography..
Chest, (1993), 104 pp. 88-93
[5]
Blumberg EA, Karalis DA, Chandrasekaran K, Wahl JM, Vilaro J, Covalesky VA et al..
Endocarditis-associated paravalvular abscesses..
Do clinical parameters predict the presence of abscess? Chest, (1995), 107 pp. 898-903
[6]
San Román JA, Vilacosta I, Sarriá C, De la Fuente L, Sanz O, Vega JL et al..
Clinical course, microbiological profile and diagnosis of periannular complications in prosthetic valve endocarditis..
Am J Cardiol, (1999), 83 pp. 1075-1079
[7]
Bayer AS, Bolger AF, Taubert KA, Wilson W, Stecherbelg J, Karchmer AW et al..
Diagnosis and management of infective endocarditis and its complications..
Circulation, (1998), 98 pp. 2936-2948
[8]
Daniel WG, Mügge A, Martin RP, Lindert O, Hausmann D, Nonnast Daniel B et al..
Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography..
N Engl J Med, (1991), 324 pp. 795-800
[9]
Durack D, Lukes AS, Bright DK..
New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings..
Am J Med, (1994), 96 pp. 200-209
[10]
Seward JB, Khandheria BK, Edwards WD, Oh JK, Freeman WK, Tajik J..
Biplanar transesophageal echocardiography: anatomic correlations, image orientation and clinical applications..
Mayo Clin Proc, (1990), 65 pp. 1193-1213
[11]
Roshmann S, Seifert T, Erbel R, Jakob H, Mohr-Kahaly S, Makowski T et al..
Identification of abscess formation in native valve infective endocarditis using transesophageal echocardiography: implications for surgical treatment..
Thorac Cardiovasc Surg, (1991), 39 pp. 273-280
[12]
Tucker KJ, Johnson JA, Ong T, Mullen WL, Mailhot J..
Medical management of prosthetic aortic valve endocarditis and aortic root abscess..
Am Heart J, (1993), 125 pp. 1195-1197
[13]
Burger AJ, Messiner FC, Schulman P, Geller D..
Mycotic aneurysm of the sinus of Valsalva due to Eikinella corrodens bacterial endocarditis..
Cardiology, (1984), 71 pp. 220-228
[14]
Byrd BF, Shelton ME, Wilson BH, Schillig S..
Infective perivalvular abscess of the aortic ring: echocardiography features and clinical course..
Am J Cardiol, (1990), 66 pp. 102-105
[15]
Tingleff J, Egebland H, Gotzsche CO, Baandrup U, Bent OC, Pilegaard H et al..
Perivalvular cavities in endocarditis: Abscesses versus pseudoaneurysms? A transesophageal Doppler echocardiographic study in 118 patients with endocarditis..
Am Heart J, (1995), 130 pp. 93-100
[16]
Danchin N, Retournary G, Stchepinsky O, Selton-Suty C, Voirot P, Villemot JP et al..
Comparision of long term outcome in patients with or without aortic ring abscess treated surgically for aortic valve infective endocarditis..
Heart, (1999), 81 pp. 177-181
[17]
Castillo Domínguez JC, Anguita Sánchez MP, Ramírez Moreno A, Siles Rubio JR, Torres Calvo F, Mesa Rubio P et al..
Pronóstico de la endocarditis infecciosa sobre prótesis..
Rev Esp Cardiol, (2000), 53 pp. 623-631