Las concentraciones basales de interleucina 6 y proteína C reactiva elevadas comportan un aumento del riesgo de muerte en el síndrome coronario agudo sin elevación del segmento ST. El objetivo del estudio es delucidar si las determinaciones seriadas de interleucina 6 y proteína C reactiva ultrasensible aportan información pronóstica adicional a las determinaciones basales para la estratificación del riesgo a largo plazo de los pacientes con síndrome coronario agudo sin elevación del segmento ST.
MétodosSe incluyó prospectivamente en el estudio a 216 pacientes consecutivos con síndrome coronario agudo sin elevación del segmento ST. Se obtuvieron muestras de sangre en un plazo de 24 h tras el ingreso en el hospital y a los 30 días de seguimiento. La variable de valoración principal fue la combinación de muerte por todas las causas, infarto de miocardio no mortal e insuficiencia cardiaca aguda descompensada.
ResultadosLas concentraciones tanto de interleucina 6 como de proteína C reactiva ultrasensible se redujeron del día 1 al día 30, con independencia de los eventos adversos aparecidos (p < 0,001 en ambos casos). Los valores de interleucina 6 en los dos momentos de valoración (día 1, por pg/ml; hazard ratio = 1,006; intervalo de confianza del 95%, 1,002-1,010; p = 0,002; día 30, por pg/ml; hazard ratio = 1,047; intervalo de confianza del 95%, 1,021-1,075; p < 0,001) fueron predictores independientes de eventos adversos, pero no los de proteína C reactiva ultrasensible del día 1 y el día 30. Los pacientes con interleucina 6 el día 1 ≤ 8,24 pg/ml y el día 30 ≤ 4,45 pg/ml fueron los que presentaron la tasa de eventos adversos más baja (4,7%), mientras que los pacientes con valores superiores a la mediana de ambos parámetros fueron los que tuvieron la tasa de eventos adversos más alta (35%). Después de la adición de la interleucina 6 del día 30 al modelo multivariable, el índice C aumentó de 0,71 (intervalo de confianza del 95%, 0,63-0,78) a 0,80 (intervalo de confianza del 95%, 0,72-0,86, p = 0,042) y la mejora neta de la reclasificación fue de 0,39 (intervalo de confianza del 95%, 0,14-0,64; p = 0,002).
ConclusionesEn esta población, tanto la concentración de interleucina 6 como la de proteína C reactiva ultrasensible se reducen tras la fase aguda. La determinación de las concentraciones de interleucina 6 en muestras seriadas mejora la estratificación pronóstica del riesgo en estos pacientes.
Palabras clave
En estudios previos se ha mostrado que las concentraciones de interleucina 6 (IL-6) y proteína C reactiva elevadas comportan un aumento del riesgo de muerte a largo plazo para los pacientes con síndrome coronario agudo sin elevación del segmento ST (SCASEST)1–6. Además, se ha observado también que las determinaciones seriadas de las concentraciones plasmáticas de estas citocinas proinflamatorias en los síndromes coronarios agudos tienen valor predictivo de resultados adversos7–13 incluso para pacientes con troponina T sérica normal14. Sin embargo, la mayor parte de los estudios consideraron solamente los valores iniciales (24-72 h) de estos biomarcadores, pero continúa sin estar claro el papel pronóstico de las determinaciones seriadas más tardías en la estratificación del riesgo a largo plazo de los pacientes con SCASEST.
El objetivo del estudio es determinar el valor pronóstico de las determinaciones seriadas de IL-6 en comparación con las de proteína C reactiva ultrasensible (PCRus) y aclarar si aportan información adicional a la proporcionada por las determinaciones aisladas para la estratificación del riesgo a largo plazo de los pacientes con SCASEST.
MÉTODOSPoblación en estudio y diseñoEste estudio se diseñó para determinar la utilidad pronóstica de las determinaciones seriadas de IL-6 y PCRus en los pacientes con SCASEST de alto riesgo. Entre el 1 de septiembre de 2006 y el 31 de marzo de 2008, se incluyó de forma prospectiva a un total de 216 pacientes consecutivos con angina inestable de alto riesgo o infarto de miocardio sin elevación del segmento ST. El diagnóstico de SCASEST de alto riesgo se estableció según los criterios de las guías actuales (que lo definen por síntomas isquémicos de duración ≥ 10min que se producen en las 72 h previas a la inclusión o desviación del segmento ST ≥ 1mm, una inversión simétrica profunda de las ondas T en las derivaciones precordiales anteriores o cifras elevadas de un biomarcador de necrosis cardiaca). Se excluyó a los pacientes con signos de disfunción hepática (alaninaminotransferasa en más del doble del límite superior de la normalidad), enfermedades neoplásicas, infecciosas, del tejido conjuntivo o inflamatorias concomitantes, trombosis venosa profunda o embolia pulmonar o antecedentes recientes (< 1 mes) de cirugía o traumatismo, así como a los pacientes tratados con inmunosupresores.
Durante todo el periodo de hospitalización, se registraron de manera prospectiva las características clínicas basales, y todos los pacientes recibieron el tratamiento estándar recomendado para el SCASEST15,16. Tomó las decisiones de tratamiento clínico para cada paciente su cardiólogo responsable, que no conocía las determinaciones de IL-6 o PCRus. Posteriormente, los pacientes dados de alta del hospital fueron objeto de seguimiento clínico durante un mínimo de 12 meses —mediana, 667 [intervalo intercuartílico, 397-944] días— y se registraron los eventos clínicos adversos de todos los pacientes. El objetivo del estudio es la combinación de los episodios de muerte por todas las causas, infarto de miocardio no mortal o insuficiencia cardiaca aguda descompensada durante el periodo de seguimiento. Los casos de muerte se determinaron a partir de las historias clínicas disponibles y los certificados de defunción. El infarto de miocardio se definió por la detección de una elevación de los biomarcadores de necrosis cardiaca (generalmente la troponina T) con al menos un valor situado por encima del límite superior de referencia del percentil 99, junto con signos de isquemia miocárdica con al menos una de las siguientes observaciones: cambios electrocardiográficos que indicaran isquemia de nueva aparición (cambios del ST-T de nueva aparición o bloqueo de rama izquierda de nueva aparición), ondas Q patológicas de nueva aparición en al menos dos derivaciones contiguas, signos de pérdida de miocardio viable en las exploraciones de imagen o anomalías de la contractilidad segmentaria de nueva aparición17,18. El diagnóstico de insuficiencia cardiaca aguda descompensada se estableció mediante los criterios de las guías actuales y se definió como la aparición rápida o gradual de signos y síntomas de insuficiencia cardiaca que motivaran una hospitalización no programada19. El estudio fue aprobado por el comité ético local, y se obtuvo el consentimiento informado de cada paciente en el momento de su inclusión.
Análisis bioquímicoLas muestras de sangre se obtuvieron en un plazo de 24 h tras el ingreso en el hospital y a los 30 días de seguimiento. A los 30 días del síndrome coronario agudo, 146 (68%) de los 216 pacientes reclutados acudieron al examen de seguimiento, en el que se realizó un análisis de sangre. Todas las muestras de sangre se obtuvieron antes de realizarse la angiografía coronaria mediante punción venosa, a las ocho de la mañana, en las 24 h siguientes al ingreso en el hospital y a los 30 días de seguimiento; se guardaron muestras alícuotas de suero a –80°C hasta el momento del análisis. Las concentraciones de IL-6 y PCRus se determinaron mediante un analizador Cobas® 6000 (Roche Diagnostics; Mannheim, Alemania). Los límites de detección fueron de 1,5 pg/ml para la IL-6 y 0,15 mg/dl para la PCRus. Los coeficientes de variación intraanalítica y total de las ensayos analíticos fueron < 2% y el 4,9% respectivamente para la IL-6 y < 2% y el 3,6% respectivamente para la PCRus.
Análisis estadísticoLas diferencias en las características de la población se compararon con un análisis de varianza o con la prueba de Kruskal-Wallis para las variables continuas, y con la prueba de la χ2 para las variables categóricas. Las concentraciones de IL-6 y PCRus se compararon con la prueba de Wilcoxon en dos momentos de valoración durante todo el protocolo del estudio. Las comparaciones de ambos biomarcadores entre los grupos de pacientes con y sin eventos clínicos se realizaron con la prueba de la U de Mann-Whitney. Las correlaciones entre ambos biomarcadores y otros parámetros clínicos y analíticos se evaluaron con la correlación de rangos de Spearman.
Al analizar el valor predictivo de las concentraciones de ambos biomarcadores el día 30, se censuraron los eventos ocurridos antes de los 30 días. Se realizaron análisis de curvas de características operativas del receptor para la predicción de los eventos clínicos adversos con ambos biomarcadores. El mejor valor de corte para el pronóstico se definió como el valor máximo del producto de la sensibilidad por la especificidad. Para la identificación de los factores predictivos de la variable de valoración combinada del estudio durante el periodo de seguimiento, se calcularon las hazard ratio (HR) basadas en el análisis de regresión de Cox. El efecto independiente de las variables en la variable de valoración combinada del estudio se calculó con un análisis de regresión de Cox multivariable (por pasos adelante), que incorporó las covariables con p < 0,05 en el análisis univariable y otras covariables con una asociación conocida con los eventos adversos. Se utilizaron gráficos de log-riesgo acumulado, covariables dependientes del tiempo y residuos de Schoenfeld para evaluar la adherencia a los supuestos de riesgos proporcionales de Cox. Se introdujeron en primer lugar individualmente las concentraciones basales de IL-6 (IL-6día 1) y las concentraciones basales de PCRus (PCRusdía 1) en los modelos multivariables. A continuación, los de IL-6día 1 se ajustaron por las concentraciones de IL-6 el día 30 (IL-6día 30) en un análisis multivariable distinto.
Para evaluar la hipótesis de que la determinación seriada de la IL-6 puede mejorar la estratificación del riesgo, se clasificó a los pacientes según el número de muestras en que había una «elevación de IL-6». Se definió la elevación de IL-6 en una muestra si los valores estaban por encima de la mediana (> 8,24 pg/ml para la IL-6día 1 y > 4,45 pg/ml para la IL-6día 30). Se creó una nueva variable ordinal basada en la combinación de las muestras de IL-6 teniendo en cuenta la presencia de ninguna, 1 o 2 muestras con valores de IL-6 elevados. Se añadieron los valores de IL-6, por separado y también mediante una puntuación de biomarcador combinada, a un modelo que incluía los factores de riesgo clínicos. El rendimiento del modelo se evaluó mediante índices C. Además, se evaluó la mejora de la exactitud predictiva mediante el cálculo del índice de mejora en la reclasificación de riesgo y el índice de mejora integrada, según lo descrito por Pencina et al20. Todos los valores de p < 0,05 se aceptaron como estadísticamente significativos. El análisis estadístico se realizó con el programa SPSS versión 15.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSFormaron la población de estudio 216 pacientes hospitalizados por un SCASEST de alto riesgo (tablas 1 y 2). Se observó una correlación positiva la IL-6día 1 con las concentraciones basales de PCRus (PCRusdía 1) (r = 0,59; p < 0,001). Hubo una correlación débil entre IL-6día 1 e IL-6día 30 (r = 0,25; p = 0,002), la edad (r = 0,24; p < 0,001), la frecuencia cardiaca (r = 0,16; p = 0,022), la fracción de eyección del ventrículo izquierdo (r = –0,16; p = 0,019), la hemoglobina (r = –0,24; p < 0,001), los leucocitos (r = 0,22; p = 0,001), la troponina T (r = 0,30; p < 0,001) y la puntuación GRACE (Global Registry for Acute Coronary Events) (r = 0,26; p < 0,001).
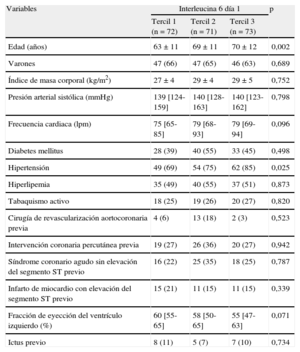
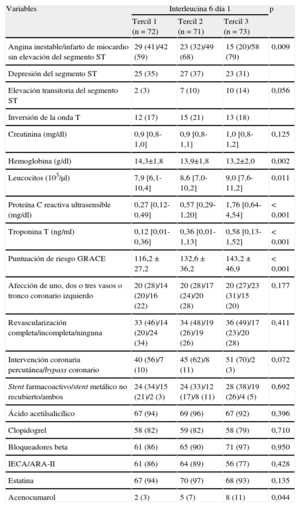
Características clínicas de la población en estudio según las cifras basales de interleucina 6
| Variables | Interleucina 6 día 1 | p | ||
| Tercil 1 (n = 72) | Tercil 2 (n = 71) | Tercil 3 (n = 73) | ||
| Edad (años) | 63 ± 11 | 69 ± 11 | 70 ± 12 | 0,002 |
| Varones | 47 (66) | 47 (65) | 46 (63) | 0,689 |
| Índice de masa corporal (kg/m2) | 27 ± 4 | 29 ± 4 | 29 ± 5 | 0,752 |
| Presión arterial sistólica (mmHg) | 139 [124-159] | 140 [128-163] | 140 [123-162] | 0,798 |
| Frecuencia cardiaca (lpm) | 75 [65-85] | 79 [68-93] | 79 [69-94] | 0,096 |
| Diabetes mellitus | 28 (39) | 40 (55) | 33 (45) | 0,498 |
| Hipertensión | 49 (69) | 54 (75) | 62 (85) | 0,025 |
| Hiperlipemia | 35 (49) | 40 (55) | 37 (51) | 0,873 |
| Tabaquismo activo | 18 (25) | 19 (26) | 20 (27) | 0,820 |
| Cirugía de revascularización aortocoronaria previa | 4 (6) | 13 (18) | 2 (3) | 0,523 |
| Intervención coronaria percutánea previa | 19 (27) | 26 (36) | 20 (27) | 0,942 |
| Síndrome coronario agudo sin elevación del segmento ST previo | 16 (22) | 25 (35) | 18 (25) | 0,787 |
| Infarto de miocardio con elevación del segmento ST previo | 15 (21) | 11 (15) | 11 (15) | 0,339 |
| Fracción de eyección del ventrículo izquierdo (%) | 60 [55-65] | 58 [50-65] | 55 [47-63] | 0,071 |
| Ictus previo | 8 (11) | 5 (7) | 7 (10) | 0,734 |
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Características clínicas y analíticas y parámetros periprocedimentales según las cifras basales de interleucina 6
| Variables | Interleucina 6 día 1 | p | ||
| Tercil 1 (n = 72) | Tercil 2 (n = 71) | Tercil 3 (n = 73) | ||
| Angina inestable/infarto de miocardio sin elevación del segmento ST | 29 (41)/42 (59) | 23 (32)/49 (68) | 15 (20)/58 (79) | 0,009 |
| Depresión del segmento ST | 25 (35) | 27 (37) | 23 (31) | |
| Elevación transitoria del segmento ST | 2 (3) | 7 (10) | 10 (14) | 0,056 |
| Inversión de la onda T | 12 (17) | 15 (21) | 13 (18) | |
| Creatinina (mg/dl) | 0,9 [0,8-1,0] | 0,9 [0,8-1,1] | 1,0 [0,8-1,2] | 0,125 |
| Hemoglobina (g/dl) | 14,3±1,8 | 13,9±1,8 | 13,2±2,0 | 0,002 |
| Leucocitos (103/μl) | 7,9 [6,1-10,4] | 8,6 [7,0-10,2] | 9,0 [7,6-11,2] | 0,011 |
| Proteína C reactiva ultrasensible (mg/dl) | 0,27 [0,12-0,49] | 0,57 [0,29-1,20] | 1,76 [0,64-4,54] | < 0,001 |
| Troponina T (ng/ml) | 0,12 [0,01-0,36] | 0,36 [0,01-1,13] | 0,58 [0,13-1,52] | < 0,001 |
| Puntuación de riesgo GRACE | 116,2 ± 27,2 | 132,6 ± 36,2 | 143,2 ± 46,9 | < 0,001 |
| Afección de uno, dos o tres vasos o tronco coronario izquierdo | 20 (28)/14 (20)/16 (22) | 20 (28)/17 (24)/20 (28) | 20 (27)/23 (31)/15 (20) | 0,177 |
| Revascularización completa/incompleta/ninguna | 33 (46)/14 (20)/24 (34) | 34 (48)/19 (26)/19 (26) | 36 (49)/17 (23)/20 (28) | 0,411 |
| Intervención coronaria percutánea/bypass coronario | 40 (56)/7 (10) | 45 (62)/8 (11) | 51 (70)/2 (3) | 0,072 |
| Stent farmacoactivo/stent metálico no recubierto/ambos | 24 (34)/15 (21)/2 (3) | 24 (33)/12 (17)/8 (11) | 28 (38)/19 (26)/4 (5) | 0,692 |
| Ácido acetilsalicílico | 67 (94) | 69 (96) | 67 (92) | 0,396 |
| Clopidogrel | 58 (82) | 59 (82) | 58 (79) | 0,710 |
| Bloqueadores beta | 61 (86) | 65 (90) | 71 (97) | 0,950 |
| IECA/ARA-II | 61 (86) | 64 (89) | 56 (77) | 0,428 |
| Estatina | 67 (94) | 70 (97) | 68 (93) | 0,135 |
| Acenocumarol | 2 (3) | 5 (7) | 8 (11) | 0,044 |
ARA-II: antagonistas del receptor de la angiotensina II; GRACE: Global Registry for Acute Coronary Events; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Durante el periodo de estudio, 44 (20,3%) pacientes sufrieron episodios del evento combinado (16 muertes, 26 infartos de miocardio no mortales y 15 hospitalizaciones por insuficiencia cardiaca aguda descompensada); 23 (10,6%) de estos pacientes sufrieron eventos adversos después de los primeros 30 días (13 muertes, 21 infartos de miocardio no mortales y 11 insuficiencia cardiaca aguda descompensada). La mediana de IL-6 fue mayor entre los pacientes con eventos adversos que entre los pacientes sin ellos, tanto en el momento de presentación clínica inicial (15,38 [7,38-31,30] frente a 7,13 [4,29-16,35] pg/ml; p < 0,001) como en el día 30 (8,59 [4,40-10,83] frente a 4,12 [2,67-5,80] pg/ml; p = 0,001). En cambio, sólo los valores de PCRusdía 1 (pero no las concentraciones de PCRus el día 30 [PCRusdía 30]) fueron superiores en los pacientes con eventos durante el seguimiento (PCRusdía 1, 1,50 [0,36-3,99] frente a 0,53 [0,23-1,28] mg/dl; p = 0,009; PCRusdía 30, 0,39 [0,10-1,29] frente a 0,27 [0,13-0,44] mg/dl; p = 0,220).
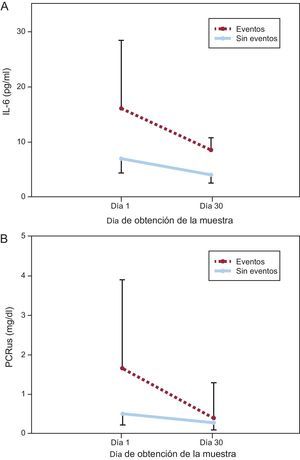
En la figura 1 se muestra una disminución significativa de las concentraciones de ambos biomarcadores desde el momento de la presentación clínica inicial hasta el día 30, con independencia de que se presentaran eventos, aunque los pacientes con eventos clínicos tenían concentraciones de IL-6 más altas en ambos momentos de valoración. Dado que los valores en el momento de la presentación clínica inicial eran más altos, las disminuciones absolutas de IL-6 y PCRus fueron mayores en los pacientes con eventos adversos (IL-6, –5,87 [–0,19 a –19,01] frente a –2,38 [0,58 a –10,81] pg/ml; p = 0,019; PCRus, –0,72 [–0,26 a –1,60] frente a –0,19 [0,04 a –0,90] mg/dl; p = 0,009), mientras que los cambios relativos de ambos biomarcadores fueron similares en los dos grupos (IL-6, –46% [–6 a –65%] frent a –41% [8 a –76%]; p = 0,627; PCRus, –61% [–49 a –87%] frente a –43% [15 a –83%]; p = 0,190).
Cambio en las concentraciones desde el momento de la presentación clínica hasta el día 30 en sujetos con y sin eventos adversos. A: interleucina 6. B: proteína C reactiva ultrasensible. Se representa gráficamente la mediana de valores de interleucina 6 y proteína C reactiva ultrasensible y el intervalo intercuartílico (barras de error) frente al día de obtención de la muestra. IL-6: interleucina 6; PCRus: proteína C reactiva ultrasensible.
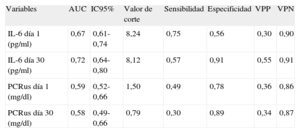
Al realizar los análisis de características operativas del receptor para evaluar la exactitud pronóstica de ambos biomarcadores inflamatorios, las concentraciones de IL-6día 30 fueron las que mostraron mejor capacidad pronóstica para diferenciar a los pacientes con y sin eventos clínicos adversos durante el seguimiento (área bajo la curva [ABC] ROC = 0,72; intervalo de confianza del 95% [IC95%], 0,64-0,80), seguida de la IL-6día 1 (AUC = 0,67; IC95%, 0,61-0,74), mientras que la PCRusdía 1 fue la que tuvo menor exactitud pronóstica general (AUC = 0,59; IC95%, 0,52-0,66) (tabla 3).
Rendimiento de las determinaciones de interleucina 6 para la predicción de eventos adversos (muerte por todas las causas, infarto de miocardio no mortal o insuficiencia cardiaca aguda descompensada)
| Variables | AUC | IC95% | Valor de corte | Sensibilidad | Especificidad | VPP | VPN |
| IL-6 día 1 (pg/ml) | 0,67 | 0,61-0,74 | 8,24 | 0,75 | 0,56 | 0,30 | 0,90 |
| IL-6 día 30 (pg/ml) | 0,72 | 0,64-0,80 | 8,12 | 0,57 | 0,91 | 0,55 | 0,91 |
| PCRus día 1 (mg/dl) | 0,59 | 0,52-0,66 | 1,50 | 0,49 | 0,78 | 0,36 | 0,86 |
| PCRus día 30 (mg/dl) | 0,58 | 0,49-0,66 | 0,79 | 0,30 | 0,89 | 0,34 | 0,87 |
AUC: área bajo la curva; IC95%: intervalo de confianza del 95%; IL: interleucina; PCRus: proteína C reactiva ultrasensible; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
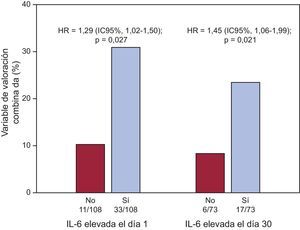
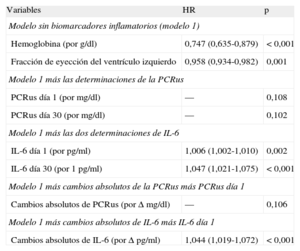
Tras los análisis de regresión de Cox multivariables (tabla 4), los valores de IL-6, como variables cuantitativas, fueron predictores independientes de eventos adversos en los dos momentos de valoración (IL-6día 1, por pg/ml, HR = 1,006; IC95%, 1,002-1,010; p = 0,002; IL-6día 30, por pg/ml, HR = 1,047; IC95%, 1,021-1,075; p < 0,001). Además, los valores de IL-6 superiores a la mediana, tanto en el momento de la presentación inicial (> 8,24 pg/ml; HR = 1,290; IC95%, 1,025-1,502; p = 0,027) como el día 30 (> 4,45 pg/ml; HR = 1,453; IC95%, 1,059-1,994; p = 0,021) fueron predictores independientes de eventos (fig. 2), al igual que ocurrió con sus cambios absolutos (por Δ pg/ml; HR = 1,050; IC95%, 1,024-1,077; p < 0,001). Sin embargo, ni las concentraciones de PCRus ni los cambios absolutos de esta mostraron asociación independiente con los resultados clínicos adversos (tabla 4).
Análisis del riesgo mediante regresión de Cox para la variable de valoración combinada (muerte por todas las causas, infarto de miocardio no mortal o insuficiencia cardiaca aguda descompensada)
| Variables | HR | p |
| Modelo sin biomarcadores inflamatorios (modelo 1) | ||
| Hemoglobina (por g/dl) | 0,747 (0,635-0,879) | < 0,001 |
| Fracción de eyección del ventrículo izquierdo | 0,958 (0,934-0,982) | 0,001 |
| Modelo 1 más las determinaciones de la PCRus | ||
| PCRus día 1 (por mg/dl) | — | 0,108 |
| PCRus día 30 (por mg/dl) | — | 0,102 |
| Modelo 1 más las dos determinaciones de IL-6 | ||
| IL-6 día 1 (por pg/ml) | 1,006 (1,002-1,010) | 0,002 |
| IL-6 día 30 (por 1 pg/ml) | 1,047 (1,021-1,075) | < 0,001 |
| Modelo 1 más cambios absolutos de la PCRus más PCRus día 1 | ||
| Cambios absolutos de PCRus (por Δ mg/dl) | — | 0,106 |
| Modelo 1 más cambios absolutos de IL-6 más IL-6 día 1 | ||
| Cambios absolutos de IL-6 (por Δ pg/ml) | 1,044 (1,019-1,072) | < 0,001 |
HR: hazard ratio;IL-6: interleucina 6; PCRus: proteína C reactiva ultrasensible.
El modelo incluye las variables que muestran significación estadística en el análisis de regresión de Cox multivariable para la variable de valoración combinada. Incluye también un ajuste respecto a la puntuación de riesgo Global Registry for Acute Coronary Events, presión arterial sistólica, frecuencia cardiaca, sexo, diabetes mellitus, hipertensión, creatinina, troponina T y revascularización.
Análisis dicotomizado del riesgo mediante regresión de Cox para la variable de valoración combinada (muerte por todas las causas, infarto de miocardio no mortal o insuficiencia cardiaca aguda descompensada) en función de las concentraciones de interleucina 6 superiores a la mediana (> 8,24 pg/ml para la los valores basales de interleucina 6 y > 4,45 pg/ml para los valores de interleucina 6 el día 30). HR: hazard ratio; IL-6: interleucina 6.
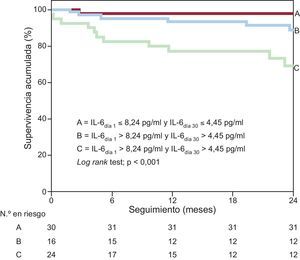
El mayor valor potencial del uso combinado de determinaciones seriadas de IL-6 para la estratificación pronóstica del riesgo se muestra en la figura 3. En dicha figura se aprecia que la tasa de eventos más baja fue la observada entre los pacientes con IL-6 por debajo de la mediana en el momento de la presentación clínica inicial y el día 30 (n = 43; el 4,7%, puntuación = 0), mientras que la tasa de eventos observada en los pacientes con valores de IL-6 superiores a los de corte en ambos momentos de valoración fue considerablemente superior al de cualquier otro grupo (n = 40; el 35%, puntuación = 2; p < 0,001). En el análisis ajustado, por cada determinación de IL-6 con un valor elevado en la puntuación combinada (de 0 a 2), se observó un riesgo de eventos clínicos significativamente superior (por medida elevada, HR = 1,35; IC95%, 1,090-1,670; p = 0,005).
Tasa de eventos adversos según la presencia de ninguno, uno o ambos valores de interleucina 6 superiores a la mediana en el momento de la presentación clínica inicial y el día 30. IL-6día1: concentraciones basales de interleucina 6; IL-6día 30: concentraciones de interleucina 6 el día 30.
Finalmente, la adición al modelo multivariable de la concentración de IL-6día 30 ajustada por otros factores de riesgo (incluidas la IL-6día 1 y la puntuación de riesgo GRACE) se asoció a una mejora significativa del rendimiento y la exactitud predictivos. El índice de mejora en la reclasificación de riesgo con la adición de IL-6día 30, fue de 0,39 (IC95%, 0,14-0,64; p = 0,002), mientras que el índice de mejora integrada fue de 0,49 (IC95%, 0,12-0,66; p = 0,001). La probabilidad de predecir correctamente los eventos o la ausencia de ellos al añadir la IL-6día 30 al modelo multivariable clínico se ponía de relieve especialmente en el porcentaje de sin eventos reclasificados correctamente (48%), mientras que el porcentaje de eventos reclasificados fue del –9%. El índice C aumentó de 0,71 (IC95%, 0,63-0,78) a 0,80 (IC95%, 0,72-0,86; p = 0,042) con la adición de IL-6día 30 al modelo multivariable clínico.
DISCUSIÓNEn el presente estudio se ha examinado el valor pronóstico de las determinaciones seriadas de las concentraciones de IL-6 y PCRus circulantes en una población hospitalizada por SCASEST. Coincidiendo con los resultados de estudios previos2,21,22, se observa que la IL-6día 1 alta se asocia a mala evolución clínica a largo plazo. Pero lo que es más importante, se muestra por primera vez que las determinaciones seriadas de IL-6día 30 de un SCASEST aportan información que complementa la de las concentraciones basales y otras variables clínicas (como la puntuación de riesgo GRACE) para la estratificación del riesgo a largo plazo. Estos resultados son novedosos, así como el uso de los análisis de reclasificación actuales para la valoración del valor pronóstico de las muestras seriadas de IL-6 en este escenario clínico. En consecuencia, nuestros resultados respaldan el uso de determinaciones repetidas de IL-6 en los pacientes con SCASEST una vez que se hayan estabilizado. Uno de los puntos fuertes de nuestro estudio es que las muestras de sangre se obtuvieron en un momento en que los pacientes estaban clínicamente estabilizados (30 días después de la presentación clínica inicial). A pesar de ello, los valores de IL-6 permitieron identificar a los pacientes con menor riesgo de sufrir eventos adversos a largo plazo, con un valor predictivo negativo elevado (> 90%). En este sentido, el seguimiento de las concentraciones de IL-6 puede facilitar la identificación de los pacientes para quienes un tratamiento y un seguimiento más agresivos podrían no aportar beneficio.
La IL-6 es una citocina ubicua, con una función crucial en la activación de los leucocitos y las células endoteliales, que promueve el aumento de la síntesis de una amplia variedad de proteínas reactantes de fase aguda, incluida la proteína C reactiva, y constituye el principal mediador sistémico de la respuesta aguda a la lesión tisular. Además, la IL-6 es una citocina inflamatoria clave en los trastornos aterotrombóticos. La IL-6 se expresa en la placa aterosclerótica y actúa localmente potenciando el reclutamiento de monocitos y células T, con el consiguiente aumento de la inestabilidad de la placa, a la vez que tiene una acción sistémica de inducción de un estado proinflamatorio y protrombótico23–25. En este estudio, observamos que los valores de IL-6día 1 están estrechamente relacionados con el pronóstico a largo plazo de los pacientes con SCASEST, lo cual establece nuevamente la importancia pronóstica que tiene el estado proinflamatorio durante la fase inicial de un síndrome coronario agudo.
Nuestros resultados resaltan también la importancia del seguimiento de los «cambios dinámicos» del estado inflamatorio en los pacientes con SCASEST. En estudios previos se ha demostrado que los pacientes con angina inestable en los que se produjo disminución de la IL-6 en las primeras 48-72 h de hospitalización presentaron un curso hospitalario sin complicaciones, mientras que los pacientes con aumento de IL-6 tuvieron una tasa superior de eventos durante la hospitalización14 o a 30 días10,12. La determinación de los biomarcadores inflamatorios en una fase más tardía para establecer su valor predictivo a largo plazo tiene dos posibles ventajas. La primera es que superamos el «problema» que plantea para el pronóstico el fácil acceso a la revascularización, ya sea durante el ingreso hospitalario (urgente) o poco después del alta (electiva). Este tratamiento invasivo temprano de los pacientes con SCASEST puede modificar la evolución natural de la enfermedad coronaria y, por lo tanto, atenuar el valor pronóstico a largo plazo de un marcador inflamatorio analizado durante la fase aguda. De hecho, Ozer et al26 han demostrado que la angioplastia coronaria temprana (incluso por tipo de stent utilizado) modifica la concentración de los biomarcadores inflamatorios. La segunda ventaja es que, 4 semanas después del evento adverso coronario, el exceso de respuesta inflamatoria causado por dicho evento debe haberse reducido hasta llegar a un nuevo estado estable o «normalizado», y los marcadores inflamatorios pueden reflejar entonces el proceso inflamatorio crónico subyacente y, por lo tanto, ser un mejor indicador de la gravedad de la enfermedad. Por consiguiente, una elevación persistente de los biomarcadores inflamatorios más allá de la fase aguda indica un estado inflamatorio prolongado y podría representar una característica subclínica de inestabilidad recurrente27.
En nuestro estudio, los valores de IL-6 se redujeron significativamente a los 30 días, con independencia de que se produjeran eventos clínicos, y la IL-6día 30 aportó información adicional a la de las determinaciones aisladas en cuanto a la estratificación del riesgo a largo plazo de estos pacientes. Esto respalda la hipótesis de que una activación inflamatoria persistente, indicada por cifras de IL-6 más altas, es un importante factor pronóstico a largo plazo para los pacientes con SCASEST.
Se han publicado resultados contradictorios respecto al valor pronóstico de los marcadores inflamatorios. El estudio SIESTA (Systemic Inflammation Evaluation in patients with non-ST segment Elevation Acute Coronary Syndrome) evaluó el valor pronóstico de las concentraciones de PCRus, IL-6 y otros marcadores de inflamación en pacientes con SCASEST de riesgo de bajo a moderado28. En este estudio, los marcadores inflamatorios no aportaron información pronóstica independiente a los 6 y a los 12 meses de seguimiento. Sin embargo, estos resultados aparentemente discrepantes pueden atribuirse a diferencias en las características de la población, debido al perfil de riesgo superior y la mayor carga inflamatoria de nuestros pacientes (que se refleja principalmente en los valores de IL-6 más altos en nuestra población)29,30. En un artículo de Rallidis et al se estudió también el valor pronóstico del seguimiento de las concentraciones de citocinas 6 semanas después de la presentación clínica en pacientes con angina inestable, pero las de IL-6 a las 6 semanas no fueron predictores independientes del pronóstico a largo plazo13. Una posible explicación podría estar en haber incluido como evento adverso en la variable de valoración combinada la revascularización por síntomas de nueva aparición o empeoramiento de los existentes. En estudios previos no se pudo demostrar asociación entre los marcadores inflamatorios y la angina31 ni entre los marcadores inflamatorios y la reestenosis tardía del stent por angiografía32. De hecho, los biomarcadores inflamatorios circulantes están más relacionados con la rotura aguda y la trombosis de la placa que con la aterosclerosis coronaria oclusiva lentamente progresiva33.
Por otro lado, nuestra variable de valoración combinada incluía también la insuficiencia cardiaca aguda descompensada. En estudios previos se ha demostrado que la elevación de las concentraciones de IL-6 en pacientes con enfermedad coronaria precede a la progresión a una insuficiencia cardiaca clínicamente manifiesta34. Además, la IL-6 puede exacerbar por sí misma el daño debido a necrosis/lesión miocárdica menor o puede estimular la atrofia muscular y la insuficiencia miocárdica durante el síndrome coronario agudo35. Esta puede ser una de las razones que expliquen por qué se ha involucrado a la concentración de IL-6 circulante en el síndrome coronario agudo y la insuficiencia cardiaca, y por qué su aumento se asocia, de manera independiente, con la mortalidad/insuficiencia cardiaca aguda descompensada a largo plazo en la población con síndrome coronario agudo22.
Nuestros resultados pueden indicar que el valor pronóstico de las determinaciones seriadas de la IL-6 puede ser superior al de las de PCRus. La falta de valor predictivo de la PCRus en nuestro estudio contrasta con los datos aportados por trabajos previos3,36,37. Este hallazgo podría explicarse por la baja potencia estadística de nuestro estudio. Sin embargo, nuestros resultados concuerdan con los de otros trabajos que muestran escasa utilidad de la PCRus en cuanto a la predicción del riesgo. Así, en estudios previos se ha puesto de manifiesto que la PCRus aporta poca información adicional en cuanto a la predicción general del riesgo que deriva de la evaluación de los factores de riesgo cardiovascular convencionales30,38. Esto probablemente indique que el valor predictivo de la PCRus podría no ser universal. Serán necesarios nuevos estudios para abordar esta cuestión en diferentes poblaciones.
LimitacionesEl reducido tamaño de la muestra de pacientes de un solo centro de estudio y el número relativamente bajo de eventos, sobre todo después del primer mes, dificultan establecer conclusiones sólidas. Además, es preciso tener precaución al interpretar nuestros resultados, puesto que podrían no ser extrapolables a todos los pacientes con SCASEST, por lo que se debe considerarlos generadores de hipótesis. Además, dado que se censuró para el análisis a los pacientes con eventos clínicos adversos en los primeros 30 días de seguimiento, la presencia de un sesgo de supervivencia en la fase aguda puede limitar la interpretación de los resultados.
Hay razones económicas, biológicas y analíticas que explican en parte las limitaciones del uso de los biomarcadores inflamatorios. La disponibilidad de métodos de alta sensibilidad y coste relativamente bajo para la determinación de la IL-6 podría facilitar su uso ordinario. Además, aunque las muestras de nuestro estudio se conservaron a –80°C, no podemos descartar la posibilidad de una degradación proteica. Sin embargo, un efecto de este tipo es improbable, ya que la distribución de la IL-6 en nuestro estudio fue muy similar a la observada en otros en que se utilizaron muestras de sangre recién extraídas. Otra consideración que tener en cuenta es la falta de métodos estandarizados para la determinación de IL-6, que incluiría el uso de la misma preparación peptídica e iguales unidades, patrones de referencia y valores de corte. No obstante, dado que nuestro límite de detección es 1,5 pg/ml, nuestro sistema automatizado permite la detección dentro de la gama de kits de enzimoinmunoanálisis más sensibles disponibles en el mercado (0,7-5 pg/ml) y evita las variaciones debidas a la manipulación de la muestra en los protocolos manuales. Los índices inflamatorios se determinaron en sangre periférica, y no permiten extraer conclusiones sólidas respecto a la liberación de estos factores a la circulación coronaria. Los medicamentos pueden influir en los valores plasmáticos de los índices inflamatorios medidos39; sin embargo, los pacientes con eventos adversos y sin ellos recibieron un tratamiento farmacológico similar. Otra limitación importante de la determinación de la IL-6 es su baja especificidad, ya que las concentraciones plasmáticas de IL-6 se ven influidas por diversas enfermedades. La concentración de IL-6 circulante puede mostrar también una variabilidad natural durante la evolución de la enfermedad. De hecho, la concentración de IL-6 sigue un ritmo circadiano, con un brusco aumento nocturno40. Para reducir al mínimo este problema, las muestras de sangre se extrajeron siempre a la misma hora (a las ocho de la mañana).
CONCLUSIONESEn los pacientes con SCASEST, las determinaciones seriadas de IL-6 a los 30 días aportan información complementaria para la estratificación del riesgo a largo plazo y pueden ser útiles para identificar a los pacientes que podrían no beneficiarse de un tratamiento y un seguimiento más agresivos.
FINANCIACIÓNEste trabajo se financió en parte por una subvención de investigación FFIS/CM09/016 de Cajamurcia y por una subvención de investigación Abbott/12399 de la Universidad de Murcia.
CONFLICTO DE INTERESESNinguno.