Analizar en un modelo experimental las características de la fibrilación ventricular en situaciones con distintos grados de complejidad y establecer la relación existente entre los datos aportados por distintos métodos de análisis de la arritmia.
MétodosEn 27 preparaciones de corazón aislado de conejo estudiadas bajo la acción de fármacos (propranolol y KB-R7943) o procedimientos físicos (estiramiento) que causan distintos grados de variación de la complejidad de la activación miocárdica durante la arritmia, se han utilizado técnicas espectrales, morfológicas y cartográficas para procesar los registros obtenidos con multielectrodos epicárdicos.
ResultadosLa complejidad de la fibrilación ventricular objetivada mediante procedimientos cartográficos se ha relacionado con la frecuencia dominante, la energía normalizada del espectro, el índice de regularidad de las señales, sus coeficientes de variación y el área de las regiones de interés identificadas a partir de estos parámetros. En el análisis multivariable, se han aceptado como variables independientes el área de las regiones de interés relacionadas con la energía espectral y el coeficiente de variación de la energía (índice de complejidad=–0,005×área de las regiones de la energía espectral – 2,234×coeficiente de variación de la energía + 1,578; p=0,0001; r=0,68).
ConclusionesLos indicadores espectrales, morfológicos y, de manera independiente, los derivados del análisis de las regiones de interés de la energía normalizada permiten aproximarse de manera fiable a la evaluación de la complejidad de la fibrilación ventricular como una alternativa a los complejos procedimientos cartográficos.
Palabras clave
La fibrilación ventricular (FV) es una arritmia letal presente en gran parte de los casos de muerte súbita que ocurren con y sin antecedentes de cardiopatías1. El tratamiento se basa en la cardioversión eléctrica, cuya eficacia se relaciona, entre otros factores, con las características de la activación miocárdica, que cambian en función del tiempo transcurrido desde el inicio de la arritmia, el deterioro metabólico, los fármacos administrados o el sustrato2–6.
El interés de analizar las características de la activación durante la FV y su complejidad es doble. Por una parte, hay interés clínico, ya que puede ayudar a predecir la dificultad para revertir la arritmia y la recuperación de la mecánica cardiaca7,8. Por otra, este tipo de análisis experimental permite describir los efectos de diversos factores sobre los mecanismos de inicio, perpetuación y cese de la FV9–16.
Entre las aproximaciones al análisis de la activación miocárdica durante la FV, se encuentran las basadas en registros obtenidos con derivaciones electrocardiográficas o con técnicas cartográficas utilizando multielectrodos o sistemas ópticos7,8,11,17. Sin embargo, la información disponible sobre la relación existente entre los parámetros obtenidos es escasa.
El objetivo del presente trabajo es analizar, en un modelo experimental, las características de la FV en situaciones con distintos grados de complejidad y establecer, mediante análisis multivariable, la relación existente entre los datos aportados por distintos métodos de análisis de las señales fibrilatorias. Se parte de la hipótesis de que es posible establecer indicadores del grado de complejidad de la activación miocárdica durante la FV distintos de los proporcionados por los complejos procedimientos cartográficos convencionales y de que, por lo tanto, pueden ayudarnos a cuantificar las modificaciones espontáneas o inducidas por fármacos u otras manipulaciones de la FV y caracterizar así la arritmia. La disponibilidad de estos indicadores permitiría utilizar los más adecuados o los menos complejos en función de las características experimentales o de la metodología disponible.
Para ello, se ha utilizado un modelo de corazón aislado y perfundido de conejo sometido a diversas situaciones (estiramiento miocárdico y fármacos) que en estudios previos han mostrado distintos grados de modificación de la complejidad de la activación miocárdica durante la FV16,18. Los registros se han obtenido con un electrodo múltiple epicárdico que han permitido procesar la información utilizando procedimientos basados en el análisis espectral y morfológico de las señales junto con técnicas cartográficas.
MÉTODOSPreparación experimentalLos experimentos se realizaron siguiendo el Real Decreto 1201/2005, de 10 de octubre, sobre utilización de animales. La metodología aplicada ha sido descrita en estudios previos16,18. Se utilizaron preparaciones aisladas y perfundidas de conejo (n=27) según la técnica de Langendorff, en las que se obtuvieron registros epicárdicos unipolares situados en la zona media de la pared libre del ventrículo izquierdo con un multielectrodo compuesto por 121 electrodos unipolares de acero inoxidable (diámetro, 0,125 mm; distancia entre electrodos, 1 mm) dispuesto en una distribución cuadrangular de 11×11 electrodos cubriendo una superficie de 1 cm2 (pared anterolateral).
Los registros se efectuaron utilizando el sistema de cartografía de la actividad epicárdica cardiaca MAPTECH® (Waalre, Países Bajos), que consiste en un sistema multicanal provisto de amplificación con una ganancia de 100 a 300, filtro de banda entre 1 y 400 y multiplexación con una frecuencia de muestreo de cada canal de 1 kHz. Una vez estabilizada la preparación, se indujo la FV mediante estimulación a frecuencias crecientes de 4 a 20 Hz. La perfusión coronaria se mantuvo durante la arritmia. En una de las series, se indujo un estiramiento local de la pared libre del ventrículo izquierdo siguiendo la metodología previa16,18.
Series experimentalesLos registros de FV se obtuvieron en cuatro situaciones: a) en preparaciones no sometidas a modificaciones (n=9); b) en estas mismas preparaciones durante la aplicación de estiramiento agudo en la pared libre del ventrículo izquierdo16,18; c) durante la perfusión de propranolol (1 μM) (n=9)16,19–21, y d) durante la perfusión del inhibidor del intercambiador de sodio y calcio KB-R794322–25 (1 μM) (n=9)16.
Los registros de FV obtenidos sin introducir modificaciones (controles) o bajo los efectos del propranolol o el KB-R7943 se obtuvieron en situación estable a los 5 min de inducir la arritmia. Los correspondientes al estiramiento miocárdico se obtuvieron a los 3 min de iniciar el estiramiento, que se aplicó una vez transcurridos 5 min desde la inducción de la arritmia en la serie control (fig. 1). Se eligió esta ventana temporal porque corresponde al momento de máximo efecto del estiramiento en el patrón de activación durante la FV16,18. Las concentraciones de KB-R7943 y propranolol se encuentran en el rango de las utilizadas para analizar sus efectos16,20,22–25.
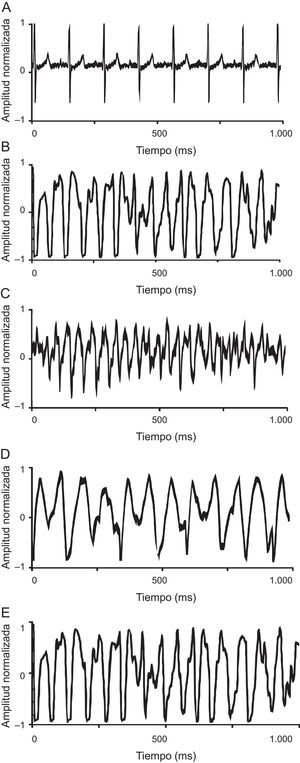
A: ventriculograma en ritmo sinusal registrado en corazón de grupo control. B: trazado fibrilatorio del grupo control. C: trazado fibrilatorio del grupo control durante estiramiento. D: trazado fibrilatorio del grupo tratado con propranolol durante la infusión. E: trazado fibrilatorio del grupo con KB-R7943 durante la infusión. Los trazados en fibrilación ventricular corresponden a 1 s de registro.
Se procesaron segmentos de 4.096 muestras (frecuencia de muestreo, 1 kHz). Se analizó la regularidad morfológica de la señal y sus características en el dominio de la frecuencia, estas mediante la obtención del espectro de frecuencias mediante el periodograma de Welch26. Se identificó la frecuencia dominante del espectro (FD), y la energía normalizada (EN) definida como la energía espectral en una ventana centrada en FD ± 1 Hz, y normalizada por la energía espectral en la banda de interés (5-35 Hz).
La regularidad morfológica se analizó calculando para cada electrodo el índice de regularidad (IR) propuesto por Faes et al27 en la fibrilación auricular y modificado para adaptarlo al modelo utilizado28. Este índice cuantifica (entre 0 y 1) la regularidad de la señal analizando la semejanza de las ondas de activación local en el segmento considerado. El algoritmo comprende: a) filtrado pasabanda para eliminar oscilaciones, actividad auricular y ruido de alta frecuencia (filtro FIR [finite impulse response] de orden 40, banda pasante de 5-40 Hz en ventana de Kaiser); b) detección de las ondas de activación locales (criterio de la máxima pendiente); c) obtención de los tiempos de activación; d) normalización de las ondas de activación local, y e) cálculo de las diferencias entre las ondas de activación para evaluar su similitud.
El utilizado en el presente trabajo es un IR morfológica de las ondas de activación local27,28 y es distinto del utilizado por otros autores con técnicas espectrales para evitar la utilización de valores de FD obtenidos a partir de señales con una relación señal/ruido pobre29.
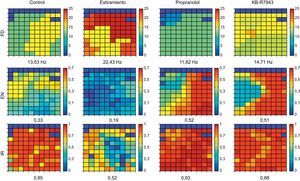
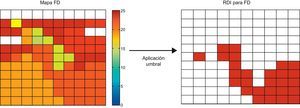
Distribución espacial de los parámetrosPara cada parámetro (FD, EN e IR) se obtuvo un mapa que contiene los valores obtenidos de todos los electrodos (fig. 2). De cada mapa se calcularon el valor medio y el coeficiente de variación (CV). Para analizar la regularidad en la distribución espacial de los parámetros, se calcularon las correspondientes regiones de interés (RDI). Las RDI se utilizaron en el campo del análisis de la FV para extraer información sobre el grado de dispersión en frecuencia y su estabilidad temporal30. En el presente trabajo (fig. 3), la generación de las RDI a partir del mapa de electrodos se realizó en una primera fase determinando cuáles superaban un umbral obtenido experimentalmente sobre el conjunto de registros. A continuación, estos electrodos se agruparon en una misma RDI en función de su vecindad. De este modo, en el caso de IR o EN, un canal pertenecía a una RDI si el valor del parámetro superaba el umbral. En el caso de FD, el criterio utilizado fue considerar si su valor estaba comprendido en el intervalo de la FD media±1 Hz, donde la FD media es el valor medio de la FD en el conjunto de electrodos del mapa. A partir de las RDI, se calcularon dos parámetros adicionales: a) el área de las RDI (ARDI) que corresponde al porcentaje de área del mapa ocupada por las RDI, que indica el grado de regularidad espacial del parámetro, y b) el número de RDI (NRDI) detectadas en el mapa que se ha considerado de manera arbitraria que representa una medida de la fragmentación espacial, ya que su incremento indicaría mayor variabilidad del parámetro considerado.
Representación de las matrices que corresponden al conjunto de electrodos del multielectrodo, en uno de los casos de cada una de las cuatro situaciones consideradas (control, estiramiento, propranolol y KB-R7943) y con tres índices empleados: frecuencia dominante media, energía normalizada e índice de regularidad. En cada caso se indican los valores medios. EN: energía normalizada; FD: frecuencia dominante; IR: índice de regularidad. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Obtención de las regiones de interés a partir del mapa de frecuencia dominante. Se aplica un umbral a los valores de frecuencia dominante de cada canal. Un canal pertenece a una región de interés si su frecuencia dominante está en el intervalo medio de frecuencia dominante±1 Hz, en el conjunto de electrodos del mapa. El umbral cambia según el tipo de parámetro. Para el índice de regularidad y energía normalizada, se aplica un umbral simple, de manera que los canales con valor superior a este pertenecen a la región de interés. FD: frecuencia dominante; RDI: región de interés. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se analizaron los mapas de activación durante la FV segmentando el tiempo de registro en intervalos de 100 ms. De este modo en cada registro se construyeron 20 mapas en los que se consideró como valor cero el inicio de la ventana de tiempo considerada. Tras la determinación de los tiempos de activación local con respecto a dicho valor cero, se construyeron las isocronas, se identificaron los frentes de onda y la presencia de líneas de bloqueo de la conducción siguiendo la metodología utilizada en estudios previos4,16. Según la complejidad de los mapas, se establecieron tres tipos17,31: tipo I, caracterizado por tener frentes de onda simples sin líneas de bloqueo o áreas de conducción lenta; tipo II, con dos frentes de onda o un frente de onda con áreas de bloqueo de la conducción o conducción lenta, y tipo III, de máxima complejidad, con tres o más frentes de onda asociados a áreas de bloqueo y de conducción lenta. Una vez caracterizados los mapas de activación, se utilizó un índice de complejidad (ICM) aplicando la fórmula ICM=[(número de mapas tipo I×0,1)+(número de mapas tipo II×1)+(número de mapas tipo III×2)]/(número de mapas analizados).
Cálculos estadísticosLos datos se presentan como media±desviación estándar. Las diferencias entre variables cuantitativas se analizaron con la prueba de la t de Student para muestras apareadas en el caso de la comparación de situación basal frente a estiramiento, al ser el mismo grupo, y con la t de Student para muestras independientes para comparar tanto el grupo con propranolol frente al grupo control como el grupo de KB-R7943 frente al grupo control. Se considero p<0,05 el límite de significación estadística en todos los casos. El análisis multivariable se efectuó mediante análisis de regresión lineal múltiple por pasos sucesivos.
Se utilizó el paquete estadístico IBM SPSS Statistics® versión 19 para efectuar la totalidad de los cálculos.
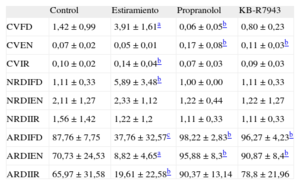
RESULTADOSCoeficientes de variación de los parámetros obtenidos mediante el análisis espectralLa tabla 1 muestra los resultados obtenidos en las distintas series experimentales. Con respecto a la situación control, el CV de la FD fue mayor durante el estiramiento (p<0,0001), menor en el grupo con propranolol (p<0,05), y no se observaron diferencias en el grupo con KB-R7943. El CV de la EN (CVEN) fue mayor en el grupo con propranolol (p<0,05) y con KB-R7943 (p<0,05).
Valores de los coeficientes de variación relacionados con los valores espectrales y con las regiones de interés obtenidos en cada una de las series experimentales
| Control | Estiramiento | Propranolol | KB-R7943 | |
| CVFD | 1,42±0,99 | 3,91±1,61a | 0,06±0,05b | 0,80±0,23 |
| CVEN | 0,07±0,02 | 0,05±0,01 | 0,17±0,08b | 0,11±0,03b |
| CVIR | 0,10±0,02 | 0,14±0,04b | 0,07±0,03 | 0,09±0,03 |
| NRDIFD | 1,11±0,33 | 5,89±3,48b | 1,00±0,00 | 1,11±0,33 |
| NRDIEN | 2,11±1,27 | 2,33±1,12 | 1,22±0,44 | 1,22±1,27 |
| NRDIIR | 1,56±1,42 | 1,22±1,2 | 1,11±0,33 | 1,11±0,33 |
| ARDIFD | 87,76±7,75 | 37,76±32,57c | 98,22±2,83b | 96,27±4,23b |
| ARDIEN | 70,73±24,53 | 8,82±4,65a | 95,88±8,3b | 90,87±8,4b |
| ARDIIR | 65,97±31,58 | 19,61±22,58b | 90,37±13,14 | 78,8±21,96 |
ARDIEN: área de regiones de interés de la energía normalizada; ARDIFD: área de regiones de interés de la frecuencia dominante; ARDIIR: área de regiones de interés del índice de regularidad; CVEN: coeficiente de variación de la energía normalizada; CVFD: coeficiente de variación de la frecuencia dominante; CVIR: coeficiente de variación del índice de regularidad; NRDIEN: número de regiones de interés de la energía normalizada; NRDIFD: número de regiones de interés de la frecuencia dominante; NRDIIR: número de regiones de interés del índice de regularidad. El área de las regiones de interés se expresa en unidades arbitrarias.
El IR fue menor durante el estiramiento miocárdico, y mayor bajo la acción del propranolol y el KB-R7943 (control, 0,80±0,04; estiramiento, 0,64±0,11; p<0,0001; propranolol, 0,92±0,04; p<0,0001; KB-R7943, 0,87±0,02; p<0,001). El coeficiente de variación del IR fue mayor durante el estiramiento y no se observaron diferencias significativas en las otras situaciones (tabla 1).
Distribución espacial de los parámetros. Regiones de interésNúmero de regiones de interésLa tabla 1 muestra el NRDI en relación con los parámetros FD, EN e IR. Durante el estiramiento miocárdico, el NRDI generadas al representar la FD fue mayor (p<0,05) y no hubo diferencias en las otras situaciones. El NRDI relacionadas con la EN no mostró diferencias y tampoco se encontraron diferencias en el NRDI construidas al considerar el parámetro IR.
Área de las regiones de interésDurante el estiramiento el ARDI relacionada con FD fue menor (p<0,001), mientras que fue mayor (p=0,05) en las otras dos situaciones. El ARDI relacionada con la EN (ARDIEN) disminuyó durante el estiramiento (p<0,0001), y fue mayor tanto con propranolol (p<0,05) como con KB-R7943 (p<0,05). La de las relacionadas con IR fue menor durante el estiramiento miocárdico (p<0,05) (tabla 1).
Índice de complejidad derivado del análisis de los mapas de activaciónEl ICM fue mayor durante el estiramiento (basal, 1,09±0,26; estiramiento, 1,48±0,21; p<0,05) y menor en el grupo perfundido con propranolol (0,57±0,23; p<0,0001). No hubo diferencias frente al grupo perfundido con KB-R7943 (1,00±0,25).
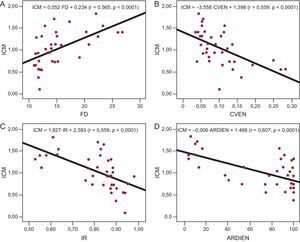
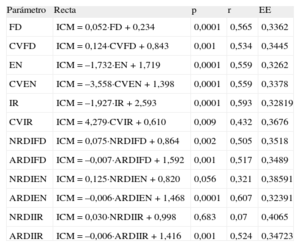
Análisis multivariableLos coeficientes de correlación obtenidos al relacionar ICM con las demás variables (fig. 4) consideradas individualmente fueron significativos en todos los casos, excepto al considerar el NRDI de la EN (p=0,056) y el NRDI del IR (p=0,68). La tabla 2 muestra las rectas de regresión obtenidas en cada caso.
Rectas de regresión obtenidas al relacionar el índice de complejidad con la frecuencia dominante en la gráfica A, el coeficiente de variación de la energía normalizada en la gráfica B, el índice de regularidad en la gráfica C y el área de las regiones de interés de la energía normalizada en la gráfica D. ARDIEN: área de las regiones de interés de la energía normalizada; CVEN: coeficiente de variación de la energía normalizada; FD: frecuencia dominante; ICM: índice de complejidad; IR: índice de regularidad.
Rectas de regresión obtenidas al relacionar el índice de complejidad de los mapas de activación con el resto de los parámetros considerados
| Parámetro | Recta | p | r | EE |
| FD | ICM=0,052·FD+0,234 | 0,0001 | 0,565 | 0,3362 |
| CVFD | ICM=0,124·CVFD+0,843 | 0,001 | 0,534 | 0,3445 |
| EN | ICM=–1,732·EN+1,719 | 0,0001 | 0,559 | 0,3262 |
| CVEN | ICM=–3,558·CVEN+1,398 | 0,0001 | 0,559 | 0,3378 |
| IR | ICM=–1,927·IR+2,593 | 0,0001 | 0,593 | 0,32819 |
| CVIR | ICM=4,279·CVIR+0,610 | 0,009 | 0,432 | 0,3676 |
| NRDIFD | ICM=0,075·NRDIFD+0,864 | 0,002 | 0,505 | 0,3518 |
| ARDIFD | ICM=–0,007·ARDIFD+1,592 | 0,001 | 0,517 | 0,3489 |
| NRDIEN | ICM=0,125·NRDIEN+0,820 | 0,056 | 0,321 | 0,38591 |
| ARDIEN | ICM=–0,006·ARDIEN+1,468 | 0,0001 | 0,607 | 0,32391 |
| NRDIIR | ICM=0,030·NRDIIR+0,998 | 0,683 | 0,07 | 0,4065 |
| ARDIIR | ICM=–0,006·ARDIIR+1,416 | 0,001 | 0,524 | 0,34723 |
ARDIEN: área de regiones de interés de la energía normalizada; ARDIFD: área de regiones de interés de la frecuencia dominante; ARDIIR: área de regiones de interés del índice de regularidad; CVEN: coeficiente de variación de la energía normalizada; CVFD: coeficiente de variación de la frecuencia dominante; CVIR: coeficiente de variación del índice de regularidad; EE: error estándar; EN: energía normalizada; FD: frecuencia dominante; ICM: índice de complejidad; IR: índice de regularidad; NRDIEN: número de regiones de interés de la energía normalizada; NRDIFD: número de regiones de interés de la frecuencia dominante; NRDIIR: número de regiones de interés del índice de regularidad.
Unidades empleadas: el área de las regiones de interés se expresa en unidades arbitrarias. Frecuencia dominante en hercios.
Se consideraron tres modelos al efectuar el análisis multivariable utilizando como variable dependiente el ICM obtenido a partir del análisis cartográfico. En un primer modelo se consideraron como variables independientes todas las que alcanzaron p<0,1 en las regresiones simples. En dicho modelo entraron las variables ARDIEN y CVEN. La ecuación obtenida fue: ICM=–0,005·ARDIEN – 2,234·CVEN+1,578 (p<0,0001; r=0,681; error típico de la estimación=0,30).
En un segundo modelo se incluyeron como variables independientes las obtenidas del análisis espectral y morfológico, excluyendo las relacionadas con las RDI. En dicho modelo se aceptaron las variables EN y CVEN. La ecuación obtenida fue: ICM=–1,265·EN – 2,331·CVEN+1,773 (p<0,0001; r=0,680; error típico de la estimación=0,30).
En un tercer modelo se consideraron las del modelo anterior menos las relacionadas con la EN. En dicho modelo se aceptó únicamente la variable IR. La ecuación obtenida fue: ICM=–1,927·IR+2,593 (p<0,0001; r=0,593; error típico de la estimación=0,33).
DISCUSIÓNLos principales resultados de este trabajo son: a) la complejidad de la FV evaluada mediante el análisis de las características de los mapas de activación epicárdicos se correlaciona con los parámetros derivados del análisis espectral y morfológico de las señales y con sus CV; b) el ARDI construidas a partir de los parámetros derivados del análisis espectral y morfológico de las señales también se correlaciona con dicha complejidad, y c) el análisis multivariable muestra que la asociación es independiente al considerar el ARDI construidas a partir de la EN y el CV de esta.
Análisis espectral y complejidad de la fibrilación ventricularEl análisis espectral de las señales fibrilatorias ha facilitado el estudio de diversos aspectos de la activación miocárdica durante la fibrilación tanto auricular como ventricular3,4,16,30,32–38. La determinación de la FD aporta información directamente relacionada con los ciclos de activación y permite obtener de manera rápida información sobre los cambios locales y temporales en los procesos de activación durante este tipo de arritmias. Por otra parte, el análisis de la dispersión de la energía del espectro de frecuencias mediante parámetros como la concentración espectral alrededor de la FD aporta información sobre la regularidad de la arritmia e incluso permite establecer correlaciones entre el grado de fraccionamiento de las señales y su FD39. Entre las limitaciones de estas técnicas se encuentran diversos aspectos relacionados con el tipo de registros, la presencia de artefactos, la estabilidad de las señales o la rapidez de los cambios temporales33,34,40. En el presente trabajo se han utilizado registros unipolares, y al considerar aisladamente los parámetros derivados directamente del análisis espectral (FD, EN y sus CV), se ha observado que se relacionan con la complejidad de la FV objetivada mediante el análisis de los mapas de activación. Tanto el aumento de FD —es decir, la aceleración de la arritmia— como el de su CV se han asociado a mayores complejidad y desorganización de la activación durante la FV. Por otra parte, la disminución de EN —es decir, la menor concentración del espectro de frecuencias alrededor de la FD— y su CV también se ha asociado a mapas de activación más complejos, con mayor número de frentes de activación y áreas de bloqueo de la conducción. El resultado del análisis univariable ha mostrado correlación inversa con estos últimos parámetros, hecho que iría unido a menor presencia de valores elevados de concentración espectral en los casos con mayor complejidad de la activación miocárdica y, por lo tanto, menor variabilidad de este parámetro.
Análisis morfológico de las señalesEl análisis morfológico de los electrogramas se ha utilizado para definir patrones de organización de la activación miocárdica en el contexto de diversas arritmias tanto auriculares como ventriculares. Entre las características analizadas se encuentran aspectos relacionados con la regularidad de las señales, la presencia de alternancia, el fraccionamiento de los electrogramas y la asociación de determinados tipos de señales con la existencia de zonas de giro, de conducción enlentecida, de bloqueo o de colisión de los frentes de activación17,27,28,31,40–43. En la fibrilación auricular se ha utilizado este tipo de análisis para establecer asociaciones entre la complejidad de la activación eléctrica y las regiones anatómicas en las que se obtienen los registros42. De los métodos propuestos, el IR cuantifica la repetitividad de los electrogramas registrados. En estudios sobre la activación miocárdica durante la fibrilación auricular, se ha demostrado la disminución de este índice al aumentar su complejidad27. En el presente trabajo se ha utilizado este índice en la FV y se ha evaluado su relación con la complejidad. El análisis univariable ha mostrado buena correlación entre los parámetros obtenidos a partir de la aproximación morfológica al análisis de las señales y la aproximación cartográfica basada en el análisis de los mapas de activación. En el análisis multivariable, la información proporcionada por el IR no ha sido independiente de la obtenida con los parámetros derivados del análisis de las RDI o de la energía del espectro, de tal modo que solamente se ha considerado el IR tras excluir los parámetros anteriormente mencionados.
Regiones de interés obtenidas a partir del análisis espectral y morfológicoChoi et al30 aplicaron el análisis de las variaciones regionales y temporales de la frecuencia de activación durante la FV para estudiar las características de la FV. Utilizaron procedimientos de análisis basados en la identificación de agrupaciones de frecuencias en torno a los valores predominantes, que constituye la base del procedimiento utilizado en el presente trabajo para caracterizar las denominadas RDI a partir de las cuales se han obtenido variables relacionadas con su extensión y su número. Mientras que estas no han aportado información relevante, el ARDI construidas a partir de la EN del espectro es una de las variables aceptadas en el modelo multivariable cuando se han considerado todas las variables empleadas en el presente estudio. Así pues, los valores elevados del ARDI obtenidas utilizando la información proporcionada por el análisis de la concentración de la energía espectral se relacionan con una menor complejidad de la activación miocárdica durante la FV. Esta relación es independiente de la proporcionada por las otras variables.
Utilidad clínicaDisponer de indicadores del grado de complejidad de la FV podría ser útil en circunstancias en que se necesita caracterizar los efectos de diversos factores en los procesos fibrilatorios, entre los que se encuentran el deterioro metabólico, la isquemia y la reperfusión3,6, los fármacos4,16 y la hipotermia10, y en determinadas ocasiones para ayudar a establecer situaciones más apropiadas para conseguir una desfibrilación efectiva7.
LimitacionesLa extrapolación de los resultados obtenidos a la clínica ha de tener presentes las características del modelo experimental utilizado, en el que las diferencias entre especies y las relacionadas con las técnicas de registro influyen en los resultados. Asimismo, en el estudio no se ha considerado otras situaciones de cambios en las características de la FV, como las observadas durante el deterioro metabólico inducido por la ausencia de perfusión miocárdica, tal como sucede cuando se desencadena la FV en el corazón in situ.
CONCLUSIONESLos indicadores espectrales, morfológicos y, de manera independiente, los derivados del análisis de las RDI de la EN permiten aproximarse de manera fiable a la evaluación de la complejidad de la FV como una alternativa a los complejos procedimientos cartográficos.
FINANCIACIÓNEstudio realizado con las ayudas a la investigación del Instituto de Salud Carlos III (FIS PS09/02417 y RETIC REDINSCOR RD06/0003/0010), y de la Generalitat Valenciana (PROMETEO 2010/093).
CONFLICTO DE INTERESESNinguno.