La obstrucción microvascular produce efectos nocivos después del infarto de miocardio. Con objeto de esclarecer el papel de la lesión por isquemia-reperfusión en la aparición y la dinámica de la obstrucción microvascular, se llevó a cabo un estudio metodológico preliminar para definir con exactitud este proceso en un modelo in vivo.
MétodosSe indujo un infarto de miocardio en cerdos mediante una oclusión de 90min en la parte media de la arteria coronaria descendente anterior izquierda empleando balones de angioplastia. Se aplicó una infusión intracoronaria de tioflavina-S y se comparó con la instilación tradicional intraaórtica o intraventricular. Se cuantificó el área perfundida por la arteria coronaria coronaria descendente anterior izquierda y la obstrucción microvascular en los grupos sin reperfusión (administración de tioflavina-S a través de la luz de un balón hinchado montado sobre la guía) y con reperfusión de 1min, 1 semana y 1 mes (administración de tioflavina-S mediante el catéter intracoronario después de deshinchar el balón).
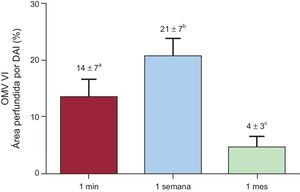
ResultadosEn comparación con la administración intraaórtica e intraventricular, la infusión intracoronaria de tioflavina-S permitió una evaluación mucho más clara del área perfundida por la arteria coronaria descendente anterior izquierda y de la obstrucción microvascular. La lesión por isquemia-reperfusión tuvo un papel decisivo en la aparición y la dinámica de la obstrucción microvascular. El grupo sin reperfusión presentó una perfusión completamente preservada. Con la misma duración de la oclusión coronaria, la obstrucción microvascular se detectó ya en el grupo de reperfusión de 1min (14±7%), alcanzó un máximo en el grupo de reperfusión de 1 semana (21±7%) y se redujo significativamente en el grupo de reperfusión de 1 mes (4±3%; p<0,001).
ConclusionesSe presenta una prueba de concepto del papel crucial que desempeña la lesión por isquemia-reperfusión en la aparición y la dinámica de la obstrucción microvascular. El modelo de cerdo descrito, que emplea inyección intracoronaria de tioflavina-S, permite una caracterización exacta de la obstrucción microvascular después del infarto de miocardio.
Palabras clave
El restablecimiento rápido y completo de la permeabilidad del vaso del infarto es el objetivo principal en los pacientes con infarto agudo de miocardio (IAM)1. No obstante, este enfoque no asegura una reperfusión adecuada a nivel microvascular, y el deterioro de la perfusión persiste en un número considerable de pacientes2. Este fenómeno se denomina obstrucción microvascular (OMV) y tiene una profunda repercusión negativa después de un IAM3–5.
La lesión por isquemia-reperfusión se ha estudiado ampliamente en el IAM6,7 y podría producir efectos nocivos para la integridad microvascular2,3. No obstante, no hay evidencia definitiva de una asociación directa entre la lesión por reperfusión y la aparición de una OMV en muestras de miocardio obtenidas inmediatamente después del restablecimiento del flujo coronario. Hay una urgente necesidad de modelos animales in vivo y exactos que simulen la dinámica de la OMV existente en el ser humano. Tales modelos permitirían conocer mejor la fisiopatología y la evolución temporal de este proceso y, a su vez, la exploración de nuevas posibilidades terapéuticas en unas condiciones controladas.
El presente estudio tiene como objetivo aportar evidencia como prueba de concepto del papel crucial que desempeña la lesión por isquemia-reperfusión en la aparición de la OMV y la dinámica de este proceso. Hasta el momento, los medios de contraste utilizados para el estudio de la perfusión en muestras miocárdicas obtenidas en modelos animales in vivo se han infundido en la aurícula izquierda8, el ventrículo izquierdo (VI)9 o por vía intravenosa10. Con objeto de estudiar de manera efectiva la OMV, se llevó a cabo un estudio metodológico preliminar, que consistió en investigar la mejor vía para la administración de tioflavina-S (T-S) para definir con exactitud la OMV.
MÉTODOSEstudio experimentalSe utilizaron 31 cerdos domésticos de corta edad, que pesaban entre 25 y 30kg. El protocolo del estudio fue aprobado por el comité de ética de experimentación animal y se atiene a lo establecido en la reglamentación actual de España (Real Decreto 53/2013 de 1 de febrero) y en la Directiva Europea 2010/63/EC.
Puede consultarse información adicional detallada respecto al protocolo de estudio en otras publicaciones11,12. De forma resumida, los cerdos recibieron un tratamiento previo por vía intravenosa con amiodarona (300mg) y lidocaína (30mg) con objeto de reducir las arritmias que pudieran comportar un peligro para la vida. Se introdujo una vaina de calibre 7 Fr en la arteria femoral derecha para el registro de la presión arterial y el acceso a la arteria coronaria descendente anterior izquierda (DAI). Se utilizó un catéter Amplatz Izquierdo 0,75 de 7 Fr para colocarlo selectivamente en la parte proximal de la DAI, y se introdujo una guía de angioplastia hidrófila estándar que se colocó en la parte distal de la DAI. Se hinchó un balón de angioplastia de 2,5×15mm a una presión de 6 atm en la parte media de la DAI, distal a la primera rama diagonal. Se confirmó la oclusión de la arteria coronaria mediante la inyección de medio de contraste y por la elevación del segmento ST en el electrocardiograma.
Se llevaron a cabo tres grupos de experimentos con reperfusión. Se deshinchó el balón después de 90min de oclusión coronaria y se documentó mediante angiografía el restablecimiento de un flujo coronario normal. En el grupo de reperfusión durante 1min (n=5), se realizó una infusión selectiva de 20ml de una solución de T-S al 4% en la parte proximal de la DAI a través del catéter Amplatz Izquierdo 0,75 1min después de deshinchar el balón, y se provocó una parada cardiaca con cloruro potásico, tras lo cual se extrajo el corazón (figura 1). En los animales de los grupos de reperfusión durante 1 semana y durante 1 mes, se permitió la recuperación y, al cabo de 1 semana (n=5) o de 1 mes (n=5) respectivamente, se siguió el mismo protocolo de estudio y se infundieron selectivamente 20ml de solución de T-S al 4% en la parte proximal de la DAI a través del catéter Amplatz Izquierdo 0,75. Se provocó la parada cardiaca con cloruro potásico y se extrajo el corazón.
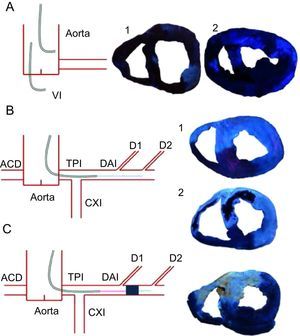
Metodología utilizada para la infusión de tioflavina-S. Izquierda: los diagramas resumen los diferentes métodos utilizados para la infusión de tioflavina-S. Derecha: imágenes obtenidas bajo iluminación con azul ultravioleta. A: la infusión en la aorta (1) o en el ventrículo izquierdo (2) produjo una mala definición del área perfundida por la arteria coronaria descendente anterior izquierda y de la obstrucción microvascular. B: la infusión a través del catéter introducido en la parte proximal de la arteria coronaria descendente anterior izquierda proporcionó una definición perfecta del área perfundida por la arteria descendente anterior izquierda y de la obstrucción microvascular; este método se utilizó en el grupo de control (1) y en los grupos de reperfusión de 1min, 1 semana (2) y 1 mes; los puntos azul claro corresponden al lugar de infusión de tioflavina-S. C: la infusión en la parte media de la arteria coronaria descendente anterior izquierda a través de la luz del balón de angioplastia montado sobre la guía, que se mantuvo hinchado durante todo el experimento, produjo una definición perfecta del área perfundida por la arteria coronaria descendente anterior izquierda; este método se utilizó en el grupo sin reperfusión. ACD: arteria coronaria derecha; CXI: arteria circunfleja izquierda; D: diagonal; DAI: arteria coronaria descendente anterior izquierda; TPI: tronco principal izquierdo; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Posteriormente, con objeto de evaluar el papel que desempeña la lesión por reperfusión en la aparición de la OMV, se comparó el grupo de reperfusión durante 1min con un grupo sin reperfusión (n=5) al que se aplicó un periodo de isquemia idéntico de 90min, pero sin reperfusión posterior. En este grupo de experimentación, no se deshinchó el balón y los 20ml de solución de T-S al 4% se infundieron selectivamente en la parte media de la DAI después de la primera rama diagonal a través de la luz de un balón montado sobre la guía (figura 1). Inmediatamente después de la administración de T-S, se provocó la parada cardiaca con cloruro potásico y se extrajo el corazón.
Formaron el grupo de control cinco experimentos. En ese grupo se utilizó el mismo protocolo de estudio descrito, pero no se hinchó el balón de angioplastia y, por lo tanto, no se provocó isquemia e infarto. Se realizó una infusión de 20ml de la solución de T-S al 4% selectivamente en la parte proximal de la DAI, a través del catéter Amplatz Izquierdo 0,75. Se provocó la parada cardiaca con cloruro potásico y se extrajo el corazón.
Se llevó a cabo una serie preliminar de experimentos para comparar la instilación intraventricular e intraaórtica transcatéter con la metodología utilizada en el presente estudio (infusión intracoronaria de T-S). Se utilizó el protocolo ya descrito para la inducción del IAM en 6 cerdos. A continuación, se retiró el balón de angioplastia y se dejó que los cerdos se recuperaran. Una semana después del infarto, se colocó el catéter Amplatz Izquierdo 0,75 en el VI (n=3) o en la aorta (n=3), y se perfundieron allí 20ml de la solución de T-S al 4%. Se provocó la parada cardiaca con cloruro potásico y se extrajo el corazón. Se comparó la precisión de la infusión intraaórtica e intraventricular de T-S con la de la infusión intracoronaria para evaluar el área perfundida por la DAI y la OMV (figura 1).
Además, con objeto de determinar cuál era el mejor método de administración de T-S para diferenciar el área de OMV y el área perfundida por la DAI, se cuantificó el cociente de intensidad de señal del área de OMV respecto al área perfundida por la DAI que era negativa para OMV, en muestras obtenidas tras las infusiones intraventricular, intraaórtica e intracoronaria, mediante el programa informático MATLAB 6.5 (The Mathworks, Inc.; Natick, Massachusetts, Estados Unidos). Este parámetro se definió como el cociente entre la señal obtenida en las áreas perfundidas por la DAI que eran negativas para OMV y la señal obtenida en las áreas que presentaban OMV. Los valores más altos indicaban una mejor diferenciación entre esas regiones y, por lo tanto, mejor capacidad de distinguir y cuantificar el área de OMV.
Estudio macroscópico de muestras de miocardioInmediatamente después de la extirpación, se examinó el corazón completo bajo luz ultravioleta y se fotografió. A continuación, se realizaron cortes de 5mm de grosor siguiendo el eje corto. Para evaluar la perfusión miocárdica en el VI, cada corte se examinó bajo luz ultravioleta y se fotografió (figura 1). El área perfundida por la DAI se definió como el porcentaje de volumen del miocardio que mostraba tinción con T-S. Las zonas azul oscuro eran las no perfundidas por la DAI, mientras que las zonas de azul claro eran las perfundidas por la DAI. Se interpretó como OMV la falta de tinción de T-S en la parte central del área perfundida por la DAI (figura 2), y ello se expresa como porcentaje del área perfundida por la DAI.
Efecto de la lesión por isquemia-reperfusión en la aparición de la obstrucción microvascular. Las imágenes muestran que, en iguales condiciones y duración de la oclusión coronaria, la perfusión se preservó en el grupo sin reperfusión, mientras que se detectó obstrucción microvascular después de tan solo 1min de reperfusión. Los asteriscos indican el área de obstrucción microvascular. Los puntos delimitan el área perfundida por la arteria coronaria descendente anterior izquierda. A: un ejemplo del corazón completo y los cortes en el grupo sin reperfusión. B: un ejemplo del corazón completo y los cortes en el grupo de reperfusión de 1min. DAI: arteria coronaria descendente anterior izquierda; OMV: obstrucción microvascular.
A continuación, los cortes se incubaron en una solución de cloruro de 2,3,5-trifeniltetrazolio al 2% durante 20min a 37°C. Por último, se examinaron bajo luz ambiental y se fotografiaron. Se definió como tejido infartado el área del miocardio que no se teñía con el cloruro de 2,3,5-trifeniltetrazolio y se expresó como porcentaje del área de perfusión de la DAI.
Se cuantificó el grosor de la pared del miocardio de las zonas de OMV, infarto, área adyacente y área remota en las imágenes obtenidas con luz ultravioleta. Se definió como área de infarto el área que no se teñía con el cloruro de 2,3,5-trifeniltetrazolio y era negativa para OMV; se definió como área adyacente el área perfundida por la DAI no infartada (con tinción de T-S y de cloruro de 2,3,5-trifeniltetrazolio), y se definió el área remota como el miocardio no perfundido por la DAI (sin tinción de T-S).
Se llevó a cabo un subanálisis por separado del área perfundida por la DAI, la OMV, el tejido infartado y el grosor de la pared del ventrículo derecho (VD) utilizando la misma metodología que se empleó para esos parámetros en el VI.
Se digitalizaron las imágenes y más tarde un evaluador experimentado que no conocía el protocolo aplicado en cada experimento realizó una cuantificación manual de todos los cortes obtenidos en el eje corto en un laboratorio especializado (Unidad de Técnicas de Imagen Cardiaca, INCLIVA, Valencia, España). Se utilizó el programa informático MATLAB 6.5. En todas las imágenes se fotografió junto a los cortes de miocardio una regla de medición, que se utilizó como referencia para todas las mediciones. Esto, junto con el grosor de corte predefinido (5mm), permitió el cálculo de los volúmenes de miocardio del VI y el VD.
Análisis estadísticoLos datos de variables continuas se expresan mediante la media±desviación estándar y se compararon con pruebas de la t de Student para datos no apareados. Los porcentajes se compararon con la prueba de la χ2; se utilizó la prueba exacta de Fisher cuando resultó apropiado. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. En todos los análisis se utilizó el programa SPSS 22.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSTres de los experimentos no se completaron: dos de ellos a causa de una fibrilación ventricular refractaria y uno por problemas técnicos en el equipo de radiología. Fue necesaria la desfibrilación ventricular eléctrica en 7 cerdos durante la oclusión de la DAI y en 8 durante la reperfusión. No se registraron complicaciones significativas a lo largo del periodo de reperfusión.
Metodología utilizada para la infusión de tioflavina-SLa infusión intracoronaria de T-S, ya fuera mediante el catéter colocado en la parte proximal de la DAI (en los grupos de reperfusión), ya por la luz del balón montado sobre la guía y colocado en la parte media de la DAI (en el grupo sin reperfusión), produjo una definición mucho más clara del área perfundida por la DAI y de la OMV que la obtenida con la inyección intraventricular o intraaórtica (figura 1). Según lo indicado por estas observaciones, el cociente de intensidad de señal (que comparaba la intensidad del área de OMV y la del área perfundida por la DAI que era negativa para OMV) mostró unos valores más altos en las muestras obtenidas después de la infusión intracoronaria de T-S (5±1,9) que en las obtenidas después de la infusión intraaórtica (1±0,5) o intraventricular (1±0,3) de T-S.
Dinámica de la obstrucción microvascularSe detectó una OMV en las muestras de miocardio del VI de todos los experimentos en los que se utilizó reperfusión. La obstrucción microvascular se detectó ya 1min después del inicio de la reperfusión, alcanzó un máximo al cabo de 1 semana y se redujo al llegar a 1 mes. El grado de OMV detectado en el grupo de reperfusión de 1 mes fue significativamente inferior al observado en el grupo de reperfusión de 1 semana (figura 3 y tabla). Se obtuvieron resultados similares por lo que respecta a la dinámica de la OMV en el VD (figura 1 y tabla 1 del material suplementario).
Dinámica de la obstrucción microvascular en el ventrículo izquierdo. El grado de obstrucción microvascular se expresa mediante el porcentaje del área perfundida por la arteria coronaria descendente anterior izquierda. La obstrucción microvascular se detectó ya en el grupo de 1min de reperfusión, alcanzó un máximo en el grupo de 1 semana y se resolvió en parte en el grupo de 1 mes de reperfusión. DAI: arteria coronaria descendente anterior izquierda; OMV: obstrucción microvascular; VI: ventrículo izquierdo.
ap < 0,01 frente al grupo de control.
bp < 0,001 frente al grupo de control.
cp < 0,001 frente al grupo de 1 semana de reperfusión.
Área perfundida por la arteria coronaria descendente anterior izquierda, obstrucción microvascular, área de infarto y grosor de la pared miocárdica en el ventrículo izquierdo en las tres series de experimentos
| VI | 1 min | 1 semana | 1 mes |
|---|---|---|---|
| Área perfundida por la DAI (% del VI) | 65±6 | 76±8 | 66±13 |
| OMV (% del área perfundida por la DAI) | 14±7a | 21±7b | 4±3c |
| Área de infarto (% del área perfundida por la DAI) | 0±0 | 34±13b | 26±11b |
| Grosor de la pared del miocardio (mm) | |||
| Área de OMV | 10±2,3 | 9±2,7 | 7±2,7 |
| Área de infarto | 10±2,8 | 10±2,7d | |
| Área adyacente | 11±2,4 | 11±2,7 | 11±3,8d |
| Área remota | 12±2,6 | 11±3,0 | 13±4,2d |
DAI: arteria coronaria descendente anterior izquierda; OMV: obstrucción microvascular; VI: ventrículo izquierdo.
En los experimentos realizados en las mismas condiciones controladas y con la misma duración de la oclusión coronaria, la OMV se produjo tan solo en las muestras de miocardio obtenidas de animales a los que se aplicó reperfusión. En la figura 2 se muestra el papel crucial de la lesión por reperfusión en la aparición de la OMV. Mientras que la perfusión miocárdica se preservó por completo en las muestras de miocardio obtenidas en todos los experimentos del grupo sin reperfusión, se detectó OMV en todos los experimentos del grupo de reperfusión de 1min.
Consecuencias estructurales de la obstrucción microvascularSe detectó tejido infartado (según lo indicado por la tinción de cloruro de 2,3,5-trifeniltetrazolio) en todos los casos de los grupos de reperfusión de 1 semana y de 1 mes (tabla).
La pared del miocardio del VI tenía menor grosor en el área de OMV en el grupo de reperfusión de 1 mes, en comparación con las áreas de infarto, adyacente y remota en el mismo momento de valoración (tabla) y en comparación con el área de OMV del grupo de reperfusión de 1 semana (figura 4).
Consecuencias de la obstrucción microvascular en el grosor de la pared del miocardio del ventrículo izquierdo. Cortes de los grupos sin perfusión y con perfusión de 1min, 1 semana y 1 mes, teñidos con cloruro de 2,3,5-trifeniltetrazolio (paneles izquierdos) y con tioflavina-S (paneles derechos). Los asteriscos indican el área de obstrucción microvascular en los grupos con reperfusión. Los puntos delimitan el grosor de la pared del ventrículo izquierdo en el área de obstrucción microvascular. Se produjo un adelgazamiento significativo de la pared del ventrículo izquierdo en el área de obstrucción microvascular 1 mes después del inicio de la reperfusión.
Se observó una tendencia similar por lo que respecta a la extensión del área de infarto y hubo asociación de la OMV con adelgazamiento progresivo de la pared del VD (figura 2 y tabla 1 del material suplementario).
DISCUSIÓNLa principal aportación de este estudio es la descripción del efecto crucial que ejerce la lesión por isquemia-reperfusión en la aparición y la dinámica de la OMV. Con objeto de realizar una caracterización precisa de la OMV en muestras de miocardio, se definió un modelo experimental del IAM de cara anterior basado en la infusión intracoronaria de T-S.
Metodología utilizada para la infusión de tioflavina-SLos modelos animales permiten recrear la enfermedad humana y son una herramienta esencial para comprender mejor los mecanismos que subyacen a ella. En la actualidad, debido a los similares tamaño y fisiología cardiaca de los corazones porcino y humano, el cerdo es la especie preferida para los estudios experimentales, no solo para la lesión por isquemia-reperfusión, sino también en otras enfermedades cardiovasculares como la aterosclerosis13–15. Aunque los modelos porcinos de IAM están bien definidos y se han utilizado ampliamente, no se ha desarrollado una metodología dirigida específicamente a la caracterización de la OMV después de un IAM.
Se utilizó T-S, un colorante que tiñe el endotelio perfundido, para realizar mediciones cuantitativas de la OMV. Anteriormente se había descrito la infusión intraauricular8, intraventricular9 e intravenosa10 de diversos medios de contraste para distintos fines, como el análisis de la perfusión, el área en riesgo o la OMV (tabla 2 del material suplementario). Sin embargo, hasta donde se sabe, no se ha explorado con una descripción metodológica específica la administración intracoronaria del colorante. En una experiencia previa con el empleo de ecocardiografía con contraste intracoronario, se averiguó que esta vía es la que aporta la máxima definición de la perfusión miocárdica16. Estas observaciones previas sirvieron de inspiración para emprender el presente estudio. En el modelo porcino descrito para el IAM de cara anterior, la infusión intracoronaria de T-S permitió una excelente delimitación del área perfundida por la DAI y de la OMV en las muestras de miocardio obtenidas inmediatamente después de haber sacrificado a los animales. Por el contrario, la infusión de T-S por vía intraaórtica o intraventricular produjo una definición mucho peor de la perfusión miocárdica. Esta observación fue evidente tanto en el análisis visual de las imágenes como tras la cuantificación del cociente de intensidad.
La infusión intracoronaria de T-S se llevó a cabo mediante el catéter introducido en la DAI proximal (una vez deshinchado y retirado el balón de angioplastia) o a través de la luz de un balón montado sobre la guía y colocado en la parte media de la DAI (que se mantuvo hinchado durante todo el experimento). La primera de estas estrategias resultó útil para evaluar la dinámica de la OMV en diferentes momentos de valoración del proceso de isquemia-reperfusión. El segundo modelo permitió la exploración del estado de la microcirculación después de un largo periodo de isquemia, pero inmediatamente antes de los posibles efectos nocivos de la lesión por reperfusión.
Así pues, esta estrategia novedosa que utiliza una infusión intracoronaria de T-S parece ser un abordaje sencillo y fiable que permite la caracterización exacta de la perfusión miocárdica y la OMV en muestras de miocardio obtenidas en un modelo porcino in vivo del IAM de cara anterior. Es posible que esta metodología resulte útil en el futuro para alcanzar nuevos avances en el conocimiento de los mecanismos que subyacen en la OMV y para explorar los efectos de nuevas posibilidades terapéuticas dirigidas a prevenir o revertir este proceso.
Dinámica de la obstrucción microvascularEn las primeras horas y días siguientes a la reperfusión, se producen cambios en el estado de la microcirculación bajo la influencia de múltiples elementos patogénicos2,3. Además de los autores del presente estudio, otros autores han puesto de manifiesto, empleando técnicas de imagen en los pacientes, que hay una tendencia a la resolución espontánea de la OMV durante las semanas y los meses que siguen a la reperfusión en el IAM2,3,17,18.
El modelo in vivo que se presenta aquí es una plataforma ideal para la caracterización de la dinámica de este proceso. Para este fin, se llevaron a cabo experimentos tras distintos periodos de reperfusión: 1min, 1 semana y 1 mes después del inicio de la reperfusión. Se observaron cambios importantes en la OMV: se detectó ya inmediatamente después de la reperfusión, alcanzó su grado máximo al cabo de 1 semana y se había resuelto casi por completo al llegar a 1 mes. En estudios recientes llevados a cabo en un modelo porcino, se han evidenciado otros aspectos del daño estructural del miocardio. En ellos se ha observado que el edema sigue un patrón bimodal durante la primera semana tras un IAM19. Los resultados del presente estudio revelan que la OMV tiene también un comportamiento dinámico que se caracteriza por un incremento durante la primera semana tras el IAM y una disminución al llegar a 1 mes. Estos resultados pueden tener consecuencias por lo que respecta al diagnóstico y el tratamiento.
En primer lugar, no hay acuerdo respecto a cuál es el momento más apropiado para evaluar la OMV en los pacientes con IAM. Según lo indicado por los resultados obtenidos, podría decirse que el análisis mediante técnicas de imagen antes del alta (aproximadamente 1 semana después del IAM) puede aportar una estimación aproximada del conjunto de todo el daño microvascular. En segundo lugar, el comportamiento dinámico de la OMV proporciona un objetivo terapéutico que va más allá de la salvación del miocardio. Hasta la fecha, aparte de una reperfusión temprana en las primeras pocas horas siguientes a la oclusión coronaria, los enfoques evaluados para reducir el tamaño del infarto no han tenido éxito20. En consecuencia, la actuación sobre el miocardio dañado continúa resultando difícil. Sin embargo, aunque se han documentado claramente los efectos nocivos de una mayor OMV en la evolución clínica del paciente y el remodelado del VI, hasta el momento los tratamientos dirigidos a reducir la OMV no han sido eficaces, y en futuros estudios deberá demostrarse su utilidad adicional respecto a una reperfusión coronaria temprana mediante ensayos aleatorizados rigurosos21–23.
Tal como se preveía, no se detectó tejido infartado en los animales de control ni en los grupos sin perfusión o con perfusión de 1min. El área de infarto máxima se produjo 1 semana después de iniciada la reperfusión. Al llegar a 1 mes, como consecuencia del proceso de encogimiento, hubo una disminución del tamaño del infarto.
El equipo de investigación ha puesto de manifiesto en estudios previos que el daño estructural del VD no es exclusivo del IAM de cara inferior. En el IAM de cara anterior, tanto el tejido infartado como la OMV pueden detectarse en el territorio anterior del VD11. El presente estudio confirma las consecuencias estructurales de un IAM de cara anterior en el VD. El curso de la OMV en el VD fue paralelo al observado en el VI. Esta observación aporta una información relevante sobre la naturaleza de la OMV y el daño por reperfusión, pero no están claras las consecuencias clínicas de estas observaciones.
Prueba de concepto del efecto de la reperfusión en la obstrucción microvascularEl papel de la lesión por isquemia-reperfusión en el daño miocárdico ha sido objeto de un amplio debate. La patogenia de la OMV es multifactorial e incluye la combinación de diversos elementos2,3. No se ha esclarecido por completo el papel de la lesión por isquemia-reperfusión, en caso de que lo tenga, en este rompecabezas. La controversia respecto al papel que desempeña la lesión por isquemia-reperfusión ha existido durante años6,7, pero se ha señalado que este mecanismo interviene de algún modo en la aparición de la OMV2,3.
En este estudio, más allá de las afirmaciones teóricas, se pretendió aportar datos que constituyeran una prueba de concepto de la influencia decisiva que tiene la lesión por isquemia-reperfusión en la OMV. Con objeto de abordar específicamente esta cuestión, se diseñaron dos series de experimentos en los que se provocó un IAM de cara anterior en condiciones idénticas. El único factor que difería es la reperfusión. En la primera serie, al final del periodo de 90min de oclusión de la DAI, se inyectó T-S a través de la luz del balón, que se mantuvo hinchado; así pues, no se permitió que se produjera reperfusión. En el segundo grupo, al final de los 90min de oclusión de la DAI, se deshinchó el balón y se retiró, y la infusión de T-S se realizó a través del catéter colocado en la parte proximal de la DAI después de un periodo de reperfusión de 1min. Se observaron diferencias notables en lo relativo a la OMV al comparar las muestras de miocardio de ambas series. Mientras que la perfusión miocárdica se preservó por completo en el grupo sin reperfusión, se observó OMV en todos los casos en que se aplicó una reperfusión de tan solo 1min.
En opinión del presente equipo de investigación, los datos presentados aportan una evidencia convincente respecto al papel decisivo de la lesión por isquemia-reperfusión en la OMV. En la actualidad existen tratamientos prometedores para la lesión por reperfusión, pero se encuentran todavía en fase experimental24. Además, diversos enfoques médicos o invasivos destinados a reducir la OMV en el IAM reperfundido han dado resultados controvertidos o han sido ineficaces21,22. En consecuencia, más allá de la efectividad bien establecida de la intervención percutánea primaria temprana, continúan siendo necesarios grandes esfuerzos por comprender mejor y tratar de manera más apropiada los minutos del periodo perirreperfusión.
Limitaciones del estudioEn primer lugar, la limitación principal del presente estudio es la ausencia de una técnica de comparación que permita evaluar la OMV in vivo, como la resonancia magnética cardiaca; una segunda técnica que confirmara los resultados habría reforzado las conclusiones alcanzadas. En segundo lugar, las técnicas funcionales para evaluar la influencia de la OMV en la función cardiaca (como la ecocardiografía de strain —deformación— o los cristales intramiocárdicos) podrían haber aportado cierta perspectiva respecto a las consecuencias funcionales de la OMV, pero no se dispone de esas técnicas en el laboratorio.
Como siempre ocurre en la investigación básica, la traslación a la práctica clínica exige precaución. Los datos obtenidos en el presente estudio podrían inspirar la realización de estudios en el ser humano con objeto de replicar estos resultados empleando técnicas de imagen y fomentar el diseño de ensayos destinados a obtener nuevos instrumentos terapéuticos capaces de reducir al mínimo el efecto nocivo de la lesión por reperfusión en la perfusión microvascular.
CONCLUSIONESEl inicio inmediato de la OMV tras deshinchar el balón pone de manifiesto el papel decisivo de la lesión por isquemia-reperfusión en la aparición de este proceso y obliga a tener presente el manejo de este periodo, corto pero crítico, en la revascularización de pacientes con IAM. El modelo experimental in vivo presentado podría ser útil como plataforma para nuevos estudios traslacionales centrados en un mejor conocimiento de la OMV y en explorar posibilidades terapéuticas alternativas en unas condiciones muy controladas.
FINANCIACIÓNEl presente estudio fue financiado por el Instituto de Salud Carlos III III, el Fondo Europeo de Desarrollo Regional (subvención PI1400271) y la Generalitat Valenciana (subvención PROMETEO/2013/007), y fue premiado por la Reial Academia de Medicina de la Comunitat Valenciana.
CONFLICTO DE INTERESESNinguno.