INTRODUCCION
La fibrilación auricular (FA) se inicia, en la mayoría de los casos, por ectopias originadas en las venas pulmonares (VP) y, con menor frecuencia, en otras estructuras auriculares1-7. La identificación y la localización de los focos ectópicos es un procedimiento complejo que, en pacientes sin actividad ectópica espontánea y abundante, requiere el empleo de diversas maniobras con la finalidad de desenmascarar y permitir la cartografía de los focos causantes. Aunque estos procedimientos constituyeron inicialmente la base de la ablación de la FA4,5, con posterioridad han quedado relegados a un segundo término debido, en gran parte, al desconocimiento del rendimiento de las maniobras de inducción y del significado clínico de las arritmias inducidas, fruto de la falta de estudios sistematizados.
El propósito de nuestro estudio fue analizar: a) la inducibilidad de arritmias auriculares mediante la infusión de adenosina e isoproterenol en pacientes con FA; b) la reproducibilidad de la inducción; c) la localización de los focos ectópicos causantes, y d) el significado clínico de la arritmia inducida.
MÉTODOS
Se realizó un análisis retrospectivo de los resultados obtenidos con el protocolo de inducción farmacológica empleado en nuestro centro para desenmascarar focos ectópicos en pacientes con FA referidos para ablación. Todos estos pacientes tenían FA paroxística o persistente refractaria al menos a un fármaco antiarrítmico de clase I o III. Según nuestro protocolo asistencial, empleamos la inducción farmacológica en pacientes con FA que presentaban una alta densidad de extrasístoles auriculares (> 10/h) y/o paroxismos de taquicardia auricular (TA) o FA en los registros Holter obtenidos antes de la ablación, pero sin suficiente ectopia espontánea en el momento de la ablación como para poder establecer su procedencia.
Estudio electrofisiológico y maniobras farmacológicas
En todos los pacientes se introdujo un catéter de 24 electrodos (Orbiter®, Bard Electrophysiology) en el seno coronario haciendo un bucle en la aurícula derecha, de tal manera que permitiera registrar amplias zonas de aurícula izquierda y derecha con los electrodos distales y proximales, respectivamente. Mediante la técnica de doble guía a través de una única punción transeptal guiada por ecografía intracardiaca8, se colocó un catéter circular decapolar (Lasso®, Biosense Webster) y un catéter de ablación con punta de 4 mm (Navistar®, Biosense Webster) en el segmento proximal de las VP superiores. Previamente, las VP se visualizaron mediante angiografía selectiva y se hizo una reconstrucción anatómica con sistema CARTO® (Biosense Webster). Los pacientes con FA en el momento del estudio fueron cardiovertidos una vez colocados los catéteres en la aurícula izquierda.
Nuestro protocolo de inducción farmacológica utiliza en primer lugar la adenosina, por la comodidad de su uso y la rapidez del efecto, y en segundo lugar, el isoproterenol. En determinadas circunstancias (contraindicaciones para el empleo de adenosina, inducción de ectopia repetitiva, inducción de FA, FA de presunto predominio simpático, etc.), y según el criterio del médico responsable del caso, puede haberse invertido el orden de ambos fármacos o prescindido de alguno de ellos.
La adenosina se administró en bolo intravenoso ultrarrápido por vía periférica en una dosis inicial de 6 mg, con incrementos de 6 mg en los bolos sucesivos hasta alcanzar una dosis máxima de 18 mg o la inducción de ectopia auricular. Los pacientes con asma bronquial o enfermedad pulmonar obstructiva crónica no recibieron adenosina. El isoproterenol se administró en infusión continua comenzando con una dosis de 1 µg/min, que se incrementó a razón de 1 µg/min cada 5 min hasta alcanzar una dosis máxima de 4 µg/min, un aumento de la frecuencia sinusal basal superior al 30%, la inducción de ectopia o la aparición de efectos secundarios. El estudio electrofisiológico se realizó sin sedación ni anestesia general, excepto en los pacientes que requirieron cardioversión eléctrica, en los que se indujo un breve período de sedación profunda con propofol (1-2 mg/kg).
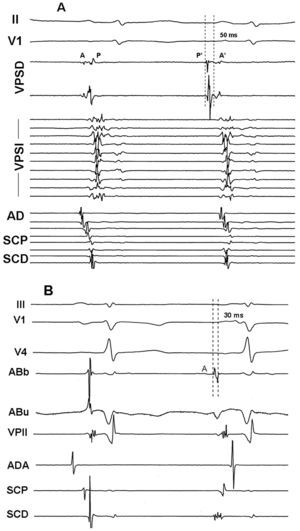
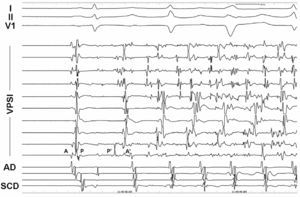
Se distinguieron 3 tipos de respuesta farmacológica: ectopia auricular aislada, TA y FA. La localización del foco se estableció según la procedencia de los latidos ectópicos, estimada mediante una precocidad de activación auricular local superior a 30 ms con respecto al inicio de la onda P, el análisis de la secuencia de activación auricular en el seno coronario y la aurícula derecha, los electrogramas unipolares y la cartografía electroanatómica cuando fue posible9,10. Cuando la arritmia inducida fue FA, la localización del foco se estimó mediante la cartografía del primer latido ectópico que iniciaba la FA (figs. 1 y 2).
Fig. 1. Registro intracavitario de ectopia inducida en 2 pacientes distintos tras la administración de adenosina. A: ectopia aislada procedente de la VPSD: el primer latido corresponde a ritmo sinusal y el segundo, a la ectopia. Nótese la inversión de los electrogramas en el canal correspondiente a la VPSD, la precocidad del potencial de vena pulmonar (P') con respecto a la onda P del electrocardiograma de superficie, y el cambio de secuencia en los registros de AD, SCP y SCD. B: ectopia procedente de la región de la vena de Marshall. El intervalo entre el electrograma del catéter de ablación bipolar (ABb) y la onda P es de 30 ms. Nótese la morfología tipo QS en ablación unipolar (ABu). II y V1: derivaciones del ECG; AD: aurícula derecha; SCD: seno coronario distal; SCP: seno coronario proximal; VPSD: vena pulmonar superior derecha; VPSI: vena pulmonar superior izquierda; A: electrograma auricular en ritmo sinusal; P: electrograma de vena pulmonar en ritmo sinusal; A': electrograma auricular de la ectopia; P': electrograma de vena pulmonar de la ectopia.
Fig. 2. Inicio de fibrilación auricular desde la VPSI. Después del primer latido (sinusal) se producen ectopias de la VPSI que inician la fibrilación auricular. Nótese la inversión de los electrogramas y la precocidad de éstos en los canales correspondientes a la VPSI durante el primer latido ectópico. I, II, V1: derivaciones del ECG; AD: aurícula derecha; SCD: seno coronario distal; VPSI: vena pulmonar superior izquierda; A: electrograma auricular en ritmo sinusal; P: electrograma de vena pulmonar en ritmo sinusal; A': electrograma auricular de la ectopia; P': electrograma de vena pulmonar de la ectopia.
Ablación
Una vez realizadas las maniobras de provocación se procedió a la ablación con radiofrecuencia apoyada con sistema CARTO®. En los casos en que se indujo ectopia o FA de forma consistente y reproducible, se ablacionó únicamente dicho foco, de forma directa en caso de focos extrapulmonares, o mediante aislamiento eléctrico ostial en caso de focos de VP. En los casos en que no se indujo ectopia reproducible se hizo un aislamiento empírico de las VP. El éxito inmediato de la ablación fue definido por la desaparición de la ectopia en caso de focos extrapulmonares o el bloqueo bidireccional de la conducción venoatrial cuando se realizó un aislamiento eléctrico de VP. El éxito a largo plazo fue definido por la ausencia de recurrencia de FA en un plazo de 6 meses desde el momento de la ablación, evaluado clínicamente y con Holter seriados en el primer, tercer y sexto mes.
Análisis estadístico
Las variables cuantitativas se ajustan a una distribución normal según la prueba de Shapiro-Wilk, por lo que se expresan como media ± desviación estándar (DE), y se analizan mediante pruebas paramétricas (t de Student). Las variables cualitativas se expresan como número (porcentaje) de observaciones y se analizan con la prueba de la χ², o la prueba exacta de Fisher si los valores esperados son < 5. Se consideraron estadísticamente significativas las pruebas de significación con valores de p ≤ 0,05.
RESULTADOS
Se incluyó en el presente análisis a un total de 53 pacientes. El promedio de edad de la población estudiada fue de 50 ± 13 años, con predominio de varones (37 pacientes, 70%). El 94% de los pacientes no tenía cardiopatía estructural. El tamaño medio de la aurícula izquierda fue de 42 ± 6 mm. En total, 46 pacientes tenían historia de FA paroxística (87%) y 7 (13%) tenían FA persistente. El número medio de fármacos antiarrítmicos utilizados antes de la ablación fue de 2,5 ± 0,8.
De los 53 pacientes incluidos en el estudio, 43 (81%) no presentaron ectopia espontánea basal y 10 (19%) presentaron ectopia en cantidad insuficiente como para establecer su procedencia (media de 12 ± 4 extrasístoles/h), por lo que se indicó el protocolo de inducción farmacológica. El tiempo de monitorización previa a la administración de los fármacos inductores fue de 122 ± 24 min (tiempo comprendido entre el inicio del registro electrocardiográfico basal y la administración del primer fármaco).
En el protocolo de inducción farmacológica se utilizó adenosina en 21 pacientes, isoproterenol en 17 pacientes, y ambos fármacos en 15 pacientes. No se observaron diferencias significativas en las características basales de los pacientes de cada grupo. Durante la infusión de adenosina, los pacientes refirieron malestar general, sofocos o disnea de segundos de duración, produciéndose bloqueo auriculoventricular de alto grado en el 50, el 86 y el 100% de los casos al recibir dosis de 6, 12 y 18 mg, respectivamente. Durante la administración de isoproterenol en dosis ≥ 2 µg/min, los pacientes refirieron palpitaciones, en ocasiones asociadas con sudación. No se produjeron otros efectos adversos relacionados con la administración de adenosina e isoproterenol.
En 46 pacientes (88%) se indujo alguna arritmia auricular tras la administración de adenosina y/o isoproterenol. La tasa de inducibilidad en pacientes con FA paroxística fue del 87% (40 de 46 pacientes) y en pacientes con FA persistente fue del 86% (6 de 7 pacientes; p = NS). Se indujo ectopia aislada en 31 pacientes (65%), TA en 4 pacientes (8%) y FA en 13 pacientes (27%). Esta última fue sostenida y requirió cardioversión eléctrica en 10 de los 13 pacientes (77%). En los pacientes que basalmente presentaban alguna ectopia, la morfología de la onda P de los extrasístoles inducidos fue similar a la de los espontáneos. En las tablas 1 y 2 se muestran la procedencia y los intervalos de acoplamiento, respectivamente, del primer latido ectópico de las arritmias inducidas. En 10 pacientes (19%), la ectopia inducida tuvo una localización extrapulmonar.
Adenosina
Treinta y seis pacientes recibieron 54 inyecciones de adenosina. En total, 46 bolos de adenosina (85%) indujeron alguna arritmia en 31 de los 36 pacientes (86%), que consistió en ectopias aisladas en 26 pacientes (84%), TA en un paciente (3%) y FA en 4 pacientes (13%). En 21 bolos de adenosina (46%), la inducción de la arritmia precedió o no se asoció con cambios en la frecuencia cardiaca, en 8 bolos (17%) la arritmia apareció en el momento de la bradicardia y en 17 bolos (37%) la arritmia apareció tras la bradicardia (media, 15 ± 25 s después). La probabilidad de inducción aumentó de forma directamente proporcional con la dosis de adenosina utilizada. Con dosis de 6, 12 y 18 mg se obtuvo una respuesta positiva en 4 de 8 inyecciones (50%), en 33 de 37 inyecciones (89%) y en 9 de 9 inyecciones (100%), respectivamente (p = 0,02). No se observó ninguna relación significativa entre la dosis de adenosina y el tipo de efecto, ectopia aislada, TA o FA. En 14 pacientes se administraron 18 bolos adicionales de adenosina (máximo 3 por paciente) para valorar la reproducibilidad de la ectopia inducida, induciéndose alguna ectopia en todos los casos (en 10 pacientes del mismo tipo, y en 8 pacientes de iguales tipo y localización que la ectopia inicial).
Isoproterenol
Treinta y dos pacientes recibieron infusión de isoproterenol. La administración de isoproterenol indujo alguna arritmia en 27 pacientes (82%), que consistió en ectopias aisladas en 14 pacientes (52%), TA en 3 pacientes (11%) y FA en 10 pacientes (37%). En el momento de la inducción, la frecuencia sinusal no se había modificado en 3 pacientes (11%), 7 pacientes (26%) habían experimentado un incremento en la frecuencia sinusal < 30% de la basal, y los restantes 17 pacientes (63%) habían experimentado un incremento > 30%. Globalmente, el incremento medio de la frecuencia sinusal en el momento de la inducción fue del 27 ± 18%.
Ablación guiada por inducibilidad
En 32 de los 46 pacientes inducibles (70%) se ablacionó exclusivamente la ectopia inducida (1,4 ± 0,6 sustratos por paciente), obteniéndose un éxito a largo plazo en 21 pacientes (66%). No hubo diferencias significativas en el resultado de la ablación dependiendo del tipo de arritmia inducida. Nueve de los 11 pacientes con recurrencias de FA tras la primera ablación recibieron un segundo procedimiento. En 4 de ellos solamente se ablacionó el sustrato previamente tratado por encontrarse recurrencia del foco inicial, o conducción venoatrial y reproducibilidad de la inducibilidad previa. En todos estos pacientes se consiguió éxito a largo plazo. En un paciente se realizó ablación de otro sustrato, con persistencia de la FA durante el seguimiento. En 4 pacientes se realizó un aislamiento empírico de las 4 VP, persistiendo la FA en 3 pacientes.
El resto de los pacientes inducibles (14 pacientes) fue tratado mediante ablación de la ectopia inducida y las VP restantes (4,2 ± 0,7 sustratos por paciente), lográndose éxito a largo plazo en 13 pacientes (93%). Globalmente, la duración de estos procedimientos fue de 339 ± 55 min.
En la figura 3 se presentan los resultados de la ablación según la estrategia seguida y la inducibilidad de arritmias auriculares.
Fig. 3. Resultados de la ablación de fibrilación auricular según la inducibilidad farmacológica de arritmias auriculares y la estrategia de ablación. En el grupo de pacientes inducibles, la ablación de la ectopia se refiere a la ablación directa del foco o al aislamiento de una vena pulmonar en el caso de focos de esta procedencia. En el grupo de pacientes no inducibles, cuando se hizo ablación dirigida por la ectopia se utilizaron para ello los extrasístoles espontáneos de baja densidad que tuvieron los pacientes durante el estudio electrofisiológico. VP: vena pulmonar.
DISCUSION
El presente estudio muestra el resultado del empleo de 2 maniobras farmacológicas, la infusión de adenosina e isoproterenol, en pacientes con FA refractaria a fármacos antiarrítmicos referidos para ablación, que tenían ectopia abundante en los Holter realizados previamente, pero que en el momento del procedimiento carecían de suficiente densidad de ectopia para localizar los focos causantes de la FA. En términos generales, la adenosina y el isoproterenol mostraron una alta tasa de inducibilidad de arritmias auriculares en estos pacientes (el 86 y el 82%, respectivamente).
La adenosina es un fármaco ampliamente utilizado para el tratamiento de taquicardias supraventriculares. Su mecanismo de acción lo ejerce principalmente sobre los nódulos sinusal y auriculoventricular al estimular la corriente de potasio IK, Ado, Ach, lo que provoca una hiperpolarización celular y la consiguiente interrupción de taquicardias dependientes del nódulo auriculoventricular11. La importancia de la adenosina como inductor de ectopia y/o FA radica en sus efectos proarrítmicos12,13. La frecuencia publicada de inducción de FA por adenosina es de hasta un 12%14, lo que concuerda con lo observado en nuestro estudio. En la aurícula, la adenosina acorta el potencial de acción y los períodos refractarios. Además, aumenta el tono simpático reflejo debido a la hipotensión arterial que ocasiona15,16. La adenosina, al modificar los períodos refractarios, favorece el desarrollo de reentradas funcionales en pacientes susceptibles17. Estas reentradas tienen especial predilección por las VP, en virtud de la conducción anisotrópica y la repolarización heterogénea de éstas17. Aunque la adenosina disminuye directamente el automatismo y la actividad desencadenada, el aumento reflejo en el tono simpático que se produce tras la administración de adenosina puede favorecer los automatismos anormales y la actividad desencadenada, una vez pasada la fase bradicardizante, situación que observamos en el 35% de nuestra serie. La inducción de arritmias auriculares con la adenosina presentó en nuestro estudio un comportamiento dosis dependiente, y la inducibilidad era más frecuente cuanto mayor era la dosis administrada.
El isoproterenol es un fármaco agonista adrenérgico que, mediante una acumulación de calcio intracelular, promueve un aumento de la actividad desencadenada y del automatismo anormal18,19. Al igual que la adenosina, el isoproterenol se ha utilizado como inductor de ectopia y/o FA3,5,20. En nuestro trabajo, la tasa de inducibilidad de arritmias auriculares con isoproterenol fue comparable a la observada con adenosina, aunque hubo diferencias en el tipo de arritmia inducida, ya que el isoproterenol indujo FA con más frecuencia que la adenosina. La mayoría de los pacientes que presentaron una respuesta positiva al isoproterenol lo hicieron tras un aumento de la frecuencia sinusal, requiriendo en el 63% de los casos aumentos > 30% de la frecuencia sinusal basal.
La desaparición de las recurrencias de FA tras la ablación única y exclusiva de la ectopia inducida apoya la relevancia patogénica y clínica de ésta. En la serie de Marchlinski et al6, la ablación guiada exclusivamente por la ectopia inducida produjo una tasa de éxito a largo plazo en torno al 80%, con una media de 3 sustratos tratados por paciente. En nuestra serie, el éxito de la ablación guiada exclusivamente por ectopia inducida fue del 66% tras abordar una media de 1,4 sustratos por paciente, y aumentó al 78% tras realizar un segundo procedimiento de ablación sobre el mismo sustrato.
Cabría pensar que una utilidad práctica del uso de maniobras de inducción farmacológica podría ser reducir el número de sustratos ablacionados al identificar el/los focos causantes de la FA en cada paciente. Sin embargo, a pesar de que la ectopia inducida tiene un carácter específico, dirigir la ablación exclusivamente hacia los focos identificados podría dejar sin tratar otros focos ectópicos no desenmascarados por estos fármacos o estructuras importantes para el mantenimiento de la FA, como se puso de manifiesto en las primeras series publicadas de ablación de FA2-5. En nuestra serie, los pacientes en los que se trató la ectopia inducida y, además, las VP restantes tuvieron una mayor tasa de éxito a largo plazo (93%). Por ello, creemos que la principal utilidad de las maniobras de inducción farmacológica podría ser identificar focos ectópicos no abordados mediante la ablación empírica de las 4 VP. Nuestro estudio pone de manifiesto que, en cerca del 20% de los pacientes con ablación de FA que presentaban ectopia abundante previa, el foco causante de la arritmia tenía una localización extrapulmonar. Marchlinski et al6 observaron un origen extrapulmonar en el 16% de los pacientes con FA que recibieron ablación guiada por la ectopia inducida con fármacos. Más recientemente, Lee et al7 analizaron una serie de 293 pacientes con latidos ectópicos espontáneos que inducían FA durante el estudio electrofisiológico y observaron que en el 20% de los pacientes la ectopia procedía tanto de VP como de focos extrapulmonares, y que en el 12% procedía sólo de focos extrapulmonares.
CONCLUSIONES
La infusión de adenosina e isoproterenol durante ritmo sinusal frecuentemente induce ectopia auricular en pacientes con FA refractaria a fármacos y evidencia de ectopia previa abundante. La ablación selectiva de la ectopia inducida previene las recurrencias de FA en una proporción significativa de pacientes, lo que apoya su relevancia clínica. El uso sistemático de maniobras de inducción farmacológica podría aumentar el éxito de la ablación de FA, al permitir identificar focos no abordados mediante el abordaje empírico de las 4 VP.
Limitaciones
A pesar de que en el momento del estudio electrofisiológico los pacientes se encontraban en ritmo sinusal sin ectopia espontánea significativa, éstos presentaron una alta densidad de ectopia y/o episodios frecuentes de FA en los Holter realizados previamente. Esto indica una importante participación de focos ectópicos en la fisiopatología de la FA de estos pacientes. Por ello, los resultados de este estudio podrían no ser extrapolables a pacientes con FA dependiente de otros mecanismos. Otra limitación es la naturaleza retrospectiva del análisis. Obviamente, el reducido número de pacientes y la ausencia de aleatorización de la estrategia de ablación impiden extraer conclusiones sobre el valor relativo de la ablación guiada, empírica, o mixta.
Correspondencia: Dr. N. Pérez-Castellano.
Hospital Clínico San Carlos. Unidad de Arritmias. Instituto Cardiovascular.
Prof. Martín Lagos, s/n. 28040 Madrid. España.
Correo electrónico: nperez.hcsc@salud.madrid.org
Recibido el 5 de septiembre de 2005.
Aceptado para su publicación el 9 de marzo de 2006.