La hiperglucemia al ingreso se asocia a mal pronóstico en pacientes con infarto agudo de miocardio. El objetivo es evaluar la asociación independiente entre la hiperglucemia de estrés y la mortalidad hospitalaria en pacientes con infarto agudo de miocardio con elevación del ST (IAMCEST).
MétodosAnalizamos a 834 pacientes ingresados de forma consecutiva por IAMCEST en la Unidad Coronaria. La asociación entre la glucemia al ingreso y la mortalidad hospitalaria se evaluó mediante regresión de Cox. La capacidad discriminatoria del modelo multivariable se evaluó mediante el estadístico C de Harrell.
ResultadosLa mortalidad fue del 10,7% (89/834 pacientes). Mediante las curvas ROC se determinó como punto de corte óptimo para la mortalidad una glucemia ≥ 140mg/dl. La incidencia de arritmias fue más frecuente en pacientes con glucemias ≥ 140mg/dl, tanto para las arritmias ventriculares malignas (el 28 frente al 18%; p=0,001) como para los trastornos de conducción intraventricular (el 5 frente al 2%; p=0,005) y auriculoventricular (el 9 frente al 5%; p=0,05), al igual que ocurrió con la incidencia de muerte intrahospitalaria (el 15 frente al 5%; p<0,001). En el análisis multivariable, los pacientes con glucemia ≥ 140mg/dl presentaron el doble de mortalidad intrahospitalaria (intervalo de confianza del 95%, 1,2-3,5; p=0,008). El valor pronóstico de la glucemia (como variable continua y como variable dicotomizada) no varió significativamente según hubiera diabetes o no (para la interacción, p=0,487 y p=0,653 respectivamente).
ConclusionesLa hiperglucemia de estrés al ingreso es un predictor de mortalidad y arritmias en pacientes con IAMCEST y se podría usar en la estratificación de riesgo de estos pacientes.
Palabras clave
En muchos estudios se ha puesto de relieve que un nivel de glucosa en plasma elevado al ingreso es un importante factor predictivo independiente respecto a la evolución clínica intrahospitalaria y a largo plazo en pacientes con infarto agudo de miocardio (IAM), independientemente de que sean diabéticos1,2,3,4,5. En un estudio retrospectivo, Stranders et al6 observaron que se producía un aumento del 4% en la mortalidad de los individuos no diabéticos por cada 18 mg/dl de aumento de la glucosa. El Cooperative Cardiovascular Project, que es el estudio retrospectivo más amplio realizado hasta la fecha en pacientes ancianos hospitalizados con IAM, demostró un aumento relativo significativo, del 13 al 77% en la mortalidad a 30 días, y un aumento relativo del 7 al 46% en la mortalidad a 1 año, en función del grado de hiperglucemia7. En el ensayo aleatorizado CREATE-ECLA, en el que se evaluó a pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST), la tasa de mortalidad a 30 días fue del 6,6% en los pacientes con una glucosa basal situada en el tercil inferior, mientras que en el tercil de glucosa más alta se produjo una tasa de mortalidad del 14%8.
No obstante, existen algunas lagunas y ciertas discrepancias en los estudios. Estas divergencias pueden deberse a la heterogeneidad del grupo de pacientes, con diferentes tipos de IAMCEST frente a IAM sin elevación del ST, diferentes valores de corte para la definición de la hiperglucemia de estrés o diferentes estrategias de tratamiento, con terapia fibrinolítica frente a intervención coronaria percutánea (ICP). Las elevadas glucemias al ingreso en el IAMCEST afectan al pronóstico de los pacientes sin diabetes mellitus (DM); sin embargo, no se trata de un factor independiente de riesgo de mortalidad para los pacientes con DM tratados con una ICP9. Además, en la actualidad no hay consenso acerca del valor preciso de la glucosa que debe considerarse anormal al ingreso en esos pacientes. Por consiguiente, los valores de corte para la glucosa de estrés han variado de un estudio a otro, y la proporción de pacientes con glucemia de estrés ha oscilado entre el 31 y el 71% en los pacientes no diabéticos y entre el 46 y el 84% en los pacientes diabéticos4. Además, el hecho de que el pronóstico de pacientes sin un diagnóstico previo de DM pero con un aumento de la glucemia en el IAM sea similar o incluso peor que el de los pacientes con DM resulta de interés7,9.
Por otro lado, el mecanismo fisiopatológico que subyace en la asociación de hiperglucemia con la mortalidad en pacientes con IAMCEST no se conoce por completo. Cuando el sistema nervioso simpático es estimulado durante el inicio de un IAM, se produce una lipolisis tisular inducida por catecolaminas, con liberación de ácidos grasos libres, que puede hacer que el miocardio deje de recibir el balance óptimo de energía. La combinación de liberación de catecolaminas, lipolisis y miocardio isquémico puede dar lugar a arritmias malignas y muerte10.
El objetivo de este estudio ha sido determinar si la glucemia de estrés en pacientes con IAMCEST tiene valor pronóstico y si es posible utilizar ese valor en la estratificación del riesgo a corto plazo de los pacientes con o sin DM conocida. Además, intentamos investigar el impacto que la glucemia al ingreso asociada a arritmias malignas pudiera tener sobre la mortalidad.
Material y métodosSelección de los pacientesAnalizamos prospectivamente una cohorte de 834 pacientes consecutivos ingresados por un IAMCEST en la unidad coronaria (UC) entre enero de 2004 y diciembre de 2008. Se excluyó a los pacientes con neoplasias (2 pacientes), infecciones activas (20) o enfermedades inflamatorias (2). Todos los pacientes incluidos dieron su consentimiento informado para participar en el estudio.
El IAMCEST se definió según los criterios establecidos en las guías actuales11,12 como un dolor retroesternal persistente (≥ 30 min) asociado a una elevación del segmento ST ≥ 0,1 mV en dos o más derivaciones de extremidades o ≥ 0,2 mV en dos o más derivaciones precordiales o un bloqueo de rama (BR) agudo.
Se obtuvieron los datos demográficos de todos los pacientes. Ello incluía la edad, el sexo, el índice de masa corporal y la prevalencia de factores de riesgo cardiovascular, DM, hipertensión, hábito tabáquico y dislipemia. Otros datos clínicos adicionales eran los antecedentes previos de ICP o de cirugía de revascularización coronaria. Se registró la aparición de las siguientes complicaciones durante la hospitalización: taquiarritmias ventriculares sostenidas que requirieran intervención (taquicardia ventricular y/o fibrilación ventricular), insuficiencia cardiaca aguda, recurrencia de angina o infarto de miocardio y muerte. La insuficiencia cardiaca se definió como una disnea en reposo progresiva asociada a signos clínicos de congestión pulmonar, según los criterios de Killip.
Todos los pacientes recibieron el tratamiento estándar recomendado para el IAMCEST. Los pacientes con una contraindicación para el tratamiento trombolítico fueron remitidos a una angiografía invasiva urgente con la intención de practicar una ICP primaria. Además, los pacientes en los que el tratamiento fibrinolítico no dio resultado fueron tratados luego con una ICP de rescate.
Todos los pacientes diabéticos y no diabéticos con hiperglucemia en la fase aguda del IAMCEST fueron tratados con insulina de acción corta subcutánea, según los resultados de una test de glucemia digital. Tras el alta de la UC, la glucemia elevada se trató con insulina de acción prolongada dos veces al día.
Definición de diabetes e hiperglucemia. Análisis de laboratorioLa DM se definió por los antecedentes previos obtenidos de la historia clínica hospitalaria, cuando el paciente confirmaba estar informado de este diagnóstico o cuando se iniciaba un tratamiento farmacológico (hipoglucemiantes orales o insulina). Dado que los valores de corte de la glucosa de estrés están mal definidos, el umbral que propusimos para la glucosa al ingreso se basó en la optimización de la suma de sensibilidad y especificidad, establecida mediante curvas de características operativas del receptor (ROC), que predecían la aparición de la variable de valoración principal (mortalidad hospitalaria).
Todas las determinaciones analíticas se realizaron con métodos de laboratorio convencionales. Se obtuvieron muestras de sangre de todos los pacientes en el servicio de urgencias. Además, se extrajeron también muestras de sangre a las 24-48 h del ingreso para la determinación de colesterol total, triglicéridos, colesterol unido a lipoproteínas de alta densidad (cHDL) y colesterol unido a lipoproteínas de baja densidad (cLDL).
Se efectuó una monitorización continua de todos los pacientes durante su estancia en la UC, con objeto de determinar la aparición de cualquier tipo de arritmia significativa, taquiarritmias ventriculares malignas (TVM) (taquicardia ventricular o fibrilación ventricular), fibrilación auricular paroxística o no, defectos de conducción intraventricular complicativos (BR izquierdo o derecho) y bloqueo auriculoventricular (BAV) de grado alto (de segundo grado o superior). Durante la hospitalización, se realizó un electrocardiograma cada día y cuando los pacientes presentaban síntomas.
Análisis estadísticoLas variables continuas con una distribución no normal (prueba de Kolmogorov-Smirnov) se transformaron mediante logaritmos neperianos antes del uso de los datos. Las variables continuas se expresaron en forma de media±desviación estándar o error estándar de la media, y las diferencias entre los grupos se observaron mediante la prueba de la t de Student. Las variables discretas se compararon con el análisis de la χ2. La relación entre las variables continuas se examinó con el coeficiente de correlación de Pearson. Se utilizó un análisis de curva ROC para valorar la capacidad de diversas concentraciones de glucosa al ingreso para predecir la mortalidad.
Las variables significativas en el análisis univariable se introdujeron en un modelo de regresión logística multivariable para obtener las variables predictivas de los episodios clínicos adversos. Los indicadores se introdujeron en el modelo multivariable completo si para la asociación univariable el valor de p<0,25. El modelo multivariable final se elaboró mediante una eliminación escalonada anterógrada de los factores menos significativos en el análisis univariable. El supuesto de proporcionalidad para la función del riesgo con el paso del tiempo se verificó mediante los residuos de Schoenfeld. La capacidad discriminatoria del modelo se evaluó mediante el estadístico C de Harrell, mientras que su calibrado se valoró con la prueba de Gronnesby y Borgan13.
Las tasas de episodios de las variables de valoración clínicas se determinaron con el método de Kaplan-Meier y se compararon con el log-rank test. En todos los análisis se consideró estadísticamente significativo un valor de p<0,05. Los datos se analizaron con el programa SPSS versión 9.0 (SPSS Inc., Chicago, Illinois, Estados Unidos).
ResultadosCaracterísticas basalesLa Tabla 1 describe las características basales de la población. La media de edad de nuestra muestra fue de 64±13 años y un 74% de los pacientes eran varones. En total, 505 (61%) pacientes presentaban IAMCEST de cara anterior y 274 (33%) pacientes tenían antecedentes de DM como factor de riesgo cardiovascular. La mediana de tiempo transcurrido desde el inicio del dolor hasta el ingreso fue de 3 (intervalo, 1-48) h, y los pacientes fueron dados de alta del hospital tras una media de 7 (1-11) días. De los 280 pacientes a los que se practicó una ICP en el hospital, en 79 (28%) se realizó una ICP primaria y en 50 (18%), una ICP de rescate tras el fallo del tratamiento fibrinolítico.
Tabla 1. Características clínicas de los pacientes con infarto de miocardio con elevación del segmento ST a
| Variable | Características basales |
| Pacientes | 834 |
| Edad (años) | 64±13 (25-94) |
| Varones | 619 (74) |
| IMC | 27±5 |
| NYHA>II | 21 (2,5) |
| IAMCEST de cara anterior | 505 (61) |
| Dolor en servicio de urgencias (h) | 3 (1-48) |
| Clase de Killip al ingreso>I | 222 (26) |
| PAS (mmHg) (ingreso) | 130±31 |
| PAD (mmHg) (ingreso) | 78±18 |
| Frecuencia cardiaca (lat/min) (ingreso) | 79±22 |
| Factores de riesgo cardiovascular | |
| Diabetes mellitus | 274 (33) |
| Hipertensión (≥ 140/90 mmHg) | 443 (53) |
| Tabaquismo | 352 (42) |
| Dislipemia | 349 (41) |
| Infarto de miocardio previo | 183 (22) |
| Antecedentes familiares | 72 (9) |
| ICP previa | 39 (5) |
| CABG previa | 19 (2) |
| Glucemia al ingreso (mg/dl) | |
| Diabetes mellitus (274 pacientes) | 226±108 |
| No diabéticos (560 pacientes) | 149±57 |
| Glucemia al ingreso ≥ 140 mg/dl | 455 (54) |
| Biomarcadores séricos máximos | |
| Recuento leucocitario (109/l) | 11.390±4,111 |
| Tn I (ng/ml) | 59±54 |
| CK-MB (ng/ml) | 195±201 |
| PCR (mg/l) | 52±60 |
| Creatinina al ingreso (mg/dl) | 1,16±0,9 |
| FG (MDRD) al ingreso | 64±28 |
| Medicación previa | |
| AAS | 22 (9) |
| IECA | 356 (43) |
| Estatina | 337 (40) |
| Fármacos antidiabéticos | 210 (25) |
| Insulina | 66 (8) |
| Medicación hospitalaria concomitante | |
| Heparina de bajo peso molecular | 508 (61) |
| AAS | 802 (96) |
| Clopidogrel | 340 (43) |
| IECA | 460 (55) |
| Bloqueadores beta | 393 (47) |
| Diuréticos | 258 (31) |
| Inotrópicos y vasopresores b | 50 (6) |
| Estatinas | 482 (58) |
| Insulina | 310 (37) |
| Terapia de reperfusión | |
| Fibrinolíticos | 435 (52) |
| ICP primaria | 79 (9,5) |
| Angioplastia de rescate | 50 (6) |
| FEVI (447 pacientes) | 51±14 |
| Mortalidad hospitalaria por todas las causas | 89 (10,7) |
| Duración de la hospitalización (días) | 7 (1-18) |
AAS: ácido acetilsalicílico; CABG: cirugía de revascularización coronaria; CK-MB: fracción MB de la creatincinasa; FEVI: fracción de eyección ventricular izquierda; FG: filtración glomerular; IAMCEST: infarto agudo de miocardio con elevación del ST; ICP: intervención coronaria percutánea; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; NYHA: New York Heart Association; PCR: proteína C reactiva; PAD: presión arterial diastólica; PAS: presión arterial sistólica; Tn I: troponina I.
a Los datos expresan n (%), media±desviación estándar o mediana (intervalo).
b Inotrópicos y vasopresores: dopamina, dobutamina, levosimendán.
Los pacientes con DM conocida tenían con mayor frecuencia antecedentes de hipertensión (el 39 frente al 26%; p=0,001) y de dislipemia (el 46,7 frente al 39,5%; p=0,046). El valor de glucemia al ingreso fue más alto en los pacientes con DM (226±108 frente a 149±57mg; p=0,001). La glucemia ≥ 140 mg/dl se observó en el 79,8% de los pacientes diabéticos y en el 42,8% de los no diabéticos (p<0,001). La mortalidad hospitalaria fue similar entre los pacientes con y sin DM (el 11,7 frente al 10,2%; p=0,51).
Episodios durante la hospitalizaciónEn total, 89 pacientes fallecieron antes del alta hospitalaria (10,7%). Se produjeron episodios de TVM en 197 pacientes (24%), BAV de segundo grado o superior en 59 (7%), BR de nueva aparición en 30 (4%) y fibrilación auricular en 61 (7%).
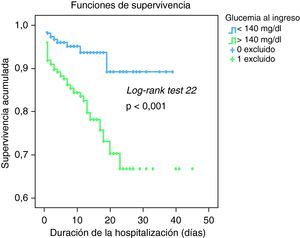
El mejor punto de corte de la glucemia al ingreso fue el de 140 mg/dl, con un 80% de sensibilidad, aunque la especificidad no superaba el 50% (área bajo la curva=0,697; p<0,001). La mortalidad en los pacientes con una glucemia al ingreso ≥ 140 mg/dl fue del 15%, frente al 5% en los pacientes con glucemia<140 mg/dl (p<0,001). En la Figura 1 se muestra la curva de Kaplan-Meier correspondiente al punto de corte de la glucemia de 140 mg para la totalidad de los pacientes con IAMCEST. La diferencia entre ambas curvas fue estadísticamente significativas (log-rank test=22,3; p<0,001).
Figura 1. Supervivencia acumulada en pacientes con infarto agudo de miocardio con elevación del ST según la glucemia al ingreso.
El riesgo relativo sin ajustar de mortalidad hospitalaria se muestra en la Tabla 2. Es importante observar que ni la terapia de reperfusión mediante intervenciones percutáneas primarias ni el tratamiento trombolítico se asociaron a una disminución de la mortalidad.
Tabla 2. Riesgo relativo de mortalidad hospitalaria, sin ajustar, en pacientes con infarto de miocardio con elevación del ST
| Variables al ingreso | OR (IC del 95%) | p |
| IAMCEST de cara anterior | 1,45 (1,03-2) | 0,021 |
| Mujeres | 1,9 (1,46-2,5) | 0,0001 |
| Edad ≥ 70 años | 2 (1,76-2,4) | 0,0001 |
| Diabetes mellitus | 1 (0,8-1,2) | 0,5 |
| Hipertensión | 1,28 (1,09-1,5) | 0,008 |
| Tabaquismo | 0,39 (0,25-0,62) | 0,001 |
| Killip>1 | 3 (2,5-3,8) | 0,001 |
| PAS ≥ 60 mmHg | 3,6 (2,5-5) | 0,001 |
| Tratamiento trombolítico | 1 (0,8-1,2) | 0,9 |
| ICP primaria | 0,56 (0,23-1,3) | 0,1 |
| Creatinina ≥ 1,4 mg/dl | 3,6 (2,6-5) | 0,001 |
| FEVI ≤ 40% (124/447 pacientes) | 3,5 (2,8-4) | 0,001 |
| Glucemia ≥ 140 mg/dl | 1,5 (1,34-1,7) | 0,001 |
| Recuento leucocitario>10.000 células/ml | 1,7 (1,1-2,4) | 0,001 |
FEVI: fracción de eyección ventricular izquierda; IAMCEST: infarto de miocardio con elevación del ST; IC: intervalo de confianza; ICP: intervención coronaria percutánea; PAS: presión arterial sistólica; OR: odds ratio.
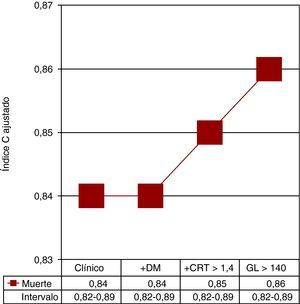
El análisis multivariable se muestra en la Tabla 3. Las covariables basales incluidas en el modelo final fueron la clase de Killip>I, la edad ≥ 70 años y la creatinina sérica ≥ 1,4 mg/dl. Las interacciones entre la glucemia, tanto continua como dicotomizada, y la DM no fueron significativas (p=0,487 y p=0,653 respectivamente), lo cual indica ausencia de efecto pronóstico diferencial atribuible a la glucemia según el antecedente DM. En la Figura 2 se muestra la contribución estimada de cada uno de los marcadores clínicos y los biomarcadores independientes en el modelo de predicción de la mortalidad tras el ajuste para posibles factores de confusión.
Tabla 3. Factores predictivos de mortalidad de los pacientes con infarto de miocardio con elevación del ST en la regresión logística multivariable
| Variable | HR (IC del 95%) | p |
| Killip>1 | 3,5 (2,18-5) | 0,0001 |
| Edad ≥ 70 años | 1,8 (1,1-3,2) | 0,02 |
| Creatinina ≥ 1,4 mg/dl | 2,2 (1,4-3,4) | 0,005 |
| Glucemia ≥ 140 mg/dl | 2 (1,2-3,5) | 0,008 |
HR: hazard ratio; IC: intervalo de confianza.
Figura 2. Modelo de regresión logística en la estratificación de todos los pacientes con infarto agudo de miocardio con elevación del ST. Se calculó el estadístico C de Harrell para la mortalidad introduciendo los parámetros clínicos y analíticos al ingreso sin ajustar que eran significativos. Obsérvese que tras añadir al modelo la diabetes mellitus (DM), el estadístico C de Harrell no se modifica. CRT: creatinina; GL: glucemia.
Los estadísticos C de Harrell de los modelos multivariables que incluían la glucemia en forma de variable binaria o continua mostraron una alta capacidad de discriminación (0,825 y 0,828). La prueba de Gronnesby y Borgan de la bondad de ajuste mostró la buena calibración del modelo (p=0,46).
La incidencia de arritmias fue mayor en los pacientes con glucemia ≥ 140 mg/dl que en los que tenían una glucemia<140 mg/dl. La incidencia de TVM fue del 28 frente al 18% de los pacientes (p=0,001), la de BAV de nueva aparición fue del 9 frente al 5% (p=0,05) y la de un BR complicativo fue del 5 frente al 2% (p=0,005). La fibrilación auricular se produjo en mayor medida en los pacientes con hiperglucemia, aunque no alcanzó significación estadística (el 8 frente al 6%; p=0,2).
Tal como se preveía, los pacientes con taquiarritmias ventriculares, BAV de nueva aparición, fibrilación auricular y BR aparecido como complicación sufrieron después una mortalidad más alta que los pacientes sin trastornos del ritmo. Así pues, estas arritmias se asociaron a la mortalidad, independientemente de la unidad de hospitalización. En total, 89 pacientes fallecieron antes del alta hospitalaria (10,7%) y previamente se había producido una TVM en 48 (54%) frente a 149 pacientes (20%) (p=0,001), un BAV en 17 (19%) frente a 42 (6%) (p=0,001), una fibrilación auricular en 21 (23%) frente a 40 (5%) (p<0,001) y un BR de nueva aparición en 14 (16%) frente a 16 (2%) (p=0,001). Además, los pacientes con TVM y con fibrilación auricular tenían unas concentraciones máximas de troponina I más altas (77±45 frente a 57±54 ng/ml; p=0,001 y 76±46 frente a 58±54 ng/ml; p=0,012 respectivamente) durante la hospitalización.
DiscusiónEl presente estudio, basado en una cohorte no seleccionada de pacientes con IAMCEST, resalta la relevancia de la hiperglucemia de estrés al ingreso para identificar con exactitud a un grupo de pacientes con un alto riesgo de sufrir episodios clínicos a corto plazo. Esta relación no se veía afectada por el antecedente de DM.
El estudio multinacional Euro Heart Survey señaló que la regulación normal de la glucosa es menos frecuente que la regulación anormal en los pacientes con enfermedad coronaria inestable14. La proporción de pacientes con hiperglucemia de estrés osciló entre el 31 y el 71% de los no diabéticos y entre el 46 y el 84% de los diabéticos15, resultados similares a los observados en nuestro estudio. La hiperglucemia se encuentra presente hasta en un 50% del total de pacientes con IAMCEST, mientras que se observa un diagnóstico previo de DM en tan sólo un 20-25% de los pacientes con IAMCEST. Cuando se realiza una prueba de tolerancia a la glucosa oral, la prevalencia de DM tipo 2 o de intolerancia a la glucosa puede ser de hasta un 65% de los pacientes con infarto de miocardio sin diagnóstico previo de DM16.
A diferencia de lo que ocurre con la glucemia en ayunas17, que está bien definida, los valores de corte de las concentraciones de glucosa de estrés en las primeras horas siguientes al ingreso no ha sido definida a consecuencia de la falta de consenso al respecto. En una revisión sistemática de 11 estudios en los que se presentaron datos de evolución clínica, Capes et al4 observaron que el umbral de concentración de glucosa utilizado para definir la hiperglucemia de estrés oscilaba de 6,7 a 11 mmol/l (118 a 198 mg/dl) o de 6,1 a 8 mmol/l (110 a 145 mg/dl) la mañana siguiente al ingreso. Pertursson et al18 estratificaron a los pacientes en grupos de cuartiles definidos mediante la glucosa plasmática al ingreso, y la hiperglucemia se definió como una glucosa plasmática>9,4 mmol/l, que fue el valor de corte para el cuarto cuartil en los pacientes con síndrome coronario agudo. Timmer et al19 clasificaron a los pacientes en función de la glucemia al ingreso basándose en los valores descritos por la American Diabetes Association para el diagnóstico de la intolerancia a la glucosa20. Foo et al21, en un amplio estudio de cohorte de pacientes con síndrome coronario agudo, observaron un mayor riesgo con una concentración de glucosa al ingreso>10 mmol/l (180 mg/dl). En nuestra experiencia, el punto de corte óptimo de la glucosa de estrés, con máxima sensibilidad y especificidad, fue de 140 mg/dl para predecir la mortalidad hospitalaria.
La relación entre la hiperglucemia al ingreso y la mortalidad a corto plazo en los pacientes sin una DM conocida tras un IAM está bien documentada3,6,13,21,22. El aumento de las concentraciones de glucosa al ingreso (con valores de entre 110 y 144mg/dl [6,1-8 mmol/l]) comporta un riesgo de mortalidad casi 4 veces mayor en los pacientes sin DM conocida tras un IAM4. Un aumento de 18 mg/dl (1 mmol/l) en las concentraciones de glucosa se asoció a un aumento del 4% en el riesgo de mortalidad en los pacientes diabéticos de un estudio retrospectivo6. En el presente estudio, nuestros resultados subrayan el doble de mortalidad con la hiperglucemia tras un IAMCEST, de manera aditiva a los parámetros clínicos (Figura 2). Además, es muy interesante observar que la probabilidad de mortalidad cuando se añade la DM a nuestro modelo no se modifica, lo cual indica que la influencia predictiva de la DM fue marginal. Pinto et al23 observaron resultados similares en un subgrupo de pacientes del ensayo CLARITY-TIMI 28. Gasior et al9, en 1.027 pacientes con IAMCEST tratados con ICP, con una incidencia de DM del 26%, observaron que un aumento de 18mg/dl en la glucemia basal al ingreso era un factor pronóstico de mortalidad independiente.
Por qué la DM tiene sólo un mero papel testimonial en la evolución de estos pacientes resulta difícil de explicar. La definición de la hiperglucemia de estrés tiene una dificultad intrínseca en los pacientes con DM, ya que en ellos es más probable que se utilice antes del IAM insulina o antidiabéticos orales para la hiperglucemia. Este tratamiento puede reducir la liberación de ácidos grasos libres durante un IAM, fomentar la captación miocárdica de glucosa para el metabolismo anaerobio y reducir la coagulabilidad a causa de una reducción de la producción de tromboxano A24. Un tratamiento correcto en estos pacientes explicaría la menor frecuencia de episodios cardiovasculares y el mejor pronóstico en comparación con los pacientes con una DM no conocida e hiperglucemia no controlada25,26.
El mecanismo fisiopatológico que subyace en la asociación entre la hiperglucemia y la mortalidad en los pacientes con IAMCEST no se conoce por completo. Hace 25 años, Oswald et al22 observaron que las concentraciones de cortisol, adrenalina y noradrenalina eran los principales factores determinantes de la concentración plasmática de glucosa en los pacientes no diabéticos con IAM. Recientemente, Kadry et al27 han observado una interacción intensa entre la glucemia y la insuficiencia ventricular izquierda detectada al ingreso. Sin embargo, el hecho de que la hiperglucemia fuera un indicador pronóstico en nuestros pacientes, que se sumaba al de la insuficiencia cardiaca inicial, indica la posibilidad de que fuera un factor importante para la evolución clínica, más que una simple consecuencia de un tamaño de infarto mayor o menor. Se ha incriminado en ello varios mecanismos. Hay firme evidencia experimental y clínica de que la hiperglucemia puede tener efectos nocivos por sí sola. La hiperglucemia aguda atenúa la vasodilatación dependiente del endotelio en el ser humano in vivo y produce además una abolición del efecto del precondicionamiento isquémico, al tiempo que induce un estrés oxidativo que afecta a la función plaquetaria, la coagulación y la fibrinólisis23,28,29. Aunque este aumento de la mortalidad probablemente se deba en parte a la resistencia a la fibrinolisis, se ha descrito un aumento de la mortalidad en los pacientes hiperglucémicos a los que se practica una ICP primaria, en la que la permeabilidad de los vasos es casi universal9,23,30. Timmer et al31 observaron que, en el estadio agudo del infarto de miocardio, la hiperglucemia predice un deterioro del flujo coronario antes del tratamiento de reperfusión. Iwakura et al32 señalaron una intensa asociación entre las concentraciones séricas de glucosa al ingreso y la aparición de un fenómeno de ausencia de restablecimiento del flujo (non-reflow) tras la angioplastia. Fefer et al33 exploraron las posibles razones de esta asociación mediante la integración de los datos clínicos y angiográficos en un grupo relativamente homogéneo de pacientes con IAMCEST a los que se practicó una ICP primaria, y observaron que el aumento de la glucosa en ayunas y el diagnóstico previo de DM se asociaban a menor reperfusión espontánea y tras la ICP primaria, lo cual producía un peor resultado en las variables de valoración clínicas.
Un hecho interesante observado en nuestro estudio es la asociación entre las TVM y la hiperglucemia al ingreso. Los mecanismos que llevan a la fibrilación ventricular y se producen durante la isquemia miocárdica aguda no se conocen bien. Una respuesta inmediata a los síntomas iniciales de un síndrome coronario agudo es un aumento rápido e intenso de la liberación de catecolaminas, que conduce a una lipolisis del tejido adiposo, con aumento agudo de las concentraciones plasmáticas de ácidos grasos libres, supresión de la actividad de la insulina y reducción de la captación de glucosa por el miocardio. Que el miocardio isquémico utilice ácidos grasos libres en vez de glucosa podría desencadenar un déficit regional de oxígeno o energía y conducir a una lesión de las membranas de las células cardiacas, sobrecarga de calcio y arritmias34, que podrían preceder a la mortalidad en muchos pacientes. Hay ya evidencia experimental y clínica que respalda la conclusión de que los fármacos antilipolíticos reducen la incidencia de la fibrilación ventricular, aunque no ha sido ampliamente estudiado35.
Por último, muchos de los pacientes no diabéticos que sufren una hiperglucemia de estrés probablemente tengan una disglucemia cuando no están en situación de estrés. Norhammar et al15 observaron que el 65% de los pacientes no diabéticos con una glucemia>11 mmol/l tenían DM o intolerancia a la glucosa no diagnosticadas. Recientemente Meisinger et al36 han realizado una observación similar en un periodo de seguimiento medio de 4,7 años. Sin embargo, no puede confirmarse el diagnóstico de DM en más del 50% de los pacientes que inicialmente presentan un aumento importante de la glucemia (> 200mg/dl) en el momento de sufrir un IAM, lo cual refuerza el concepto de que el IAMCEST induce cambios per se que conllevan una intolerancia a la glucosa transitoria37. Menos del 20% de los pacientes con IAMCEST incluidos en el ensayo CLARITY-TIMI 28 tenían diagnóstico previo de DM, pero más del 65% de los pacientes tenían glucemias anormales que se asociaron a una evolución clínica adversa23.
LimitacionesEn primer lugar, dado el carácter observacional de este estudio, no puede descartarse la posibilidad de un sesgo de selección y/o de un efecto de confusión residual derivado de covariables desconocidas o no evaluadas. En segundo lugar, se trata de un estudio observacional de un solo centro, por lo que debemos tener precaución al plantear hipótesis respecto a los mecanismos involucrados, y la posibilidad de extrapolar nuestras conclusiones a otras poblaciones puede ser limitada.
ConclusionesLa hiperglucemia al ingreso es un potente factor predictivo de la mortalidad de los pacientes con IAMCEST y en ellos podría usarse para la estratificación del riesgo. Además, se ha observado asociación entre glucemia elevada al ingreso y arritmias durante la hospitalización.
Conflicto de interesesNinguno.
Agradecimientos
Deseamos agradecer a la Srta. Chris Guevara (Mercé V. Electromedicina S.L.) su apoyo en la traducción de este artículo al inglés.
Recibido 18 Mayo 2010
Aceptado 25 Agosto 2010
Autor para correspondencia: Unidad Coronaria, Hospital Clínico Universitario, Avda. Blasco Ibáñez 17. 46010 Valencia, España. sanjuan_raf@gva.es