Analizar el valor pronóstico de la escala INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) en pacientes tratados con trasplante cardiaco urgente.
MétodosAnálisis retrospectivo de 111 pacientes tratados con trasplante cardiaco urgente en nuestro centro entre abril de 1991 y octubre de 2009. Se asignó retrospectivamente a los pacientes a tres niveles de la escala INTERMACS en función de su situación clínica previa al trasplante cardiaco.
ResultadosLos pacientes del grupo INTERMACS 1 (n=31) presentaban mayor frecuencia de cardiopatía isquémica (p=0,03) y shock tras cardiotomía (p=0,02) que los pacientes del grupo INTERMACS 2 (n=55) y los pacientes del grupo INTERMACS 3–4 (n=25), así como mayores dosis de catecolaminas (p=0,001), mayor empleo de ventilación mecánica (p<0,001), balón de contrapulsación (p=0,002) y dispositivos de asistencia ventricular (p=0,002) y mayores tasas de infección preoperatoria (p=0,015). El grupo INTERMACS 1 también mostraba mayores cifras de presión venosa central (p=0,02), GOT (p=0,002), GPT (p=0,006) y creatinina (p<0,001) y menores cifras de hemoglobina (p=0,008) y aclaramiento de creatinina (p=0,001). Tras el trasplante cardiaco, los pacientes del grupo INTERMACS 1 presentaron mayores incidencias de fracaso primario del injerto (p=0,03) y necesidad de terapia de sustitución renal (p=0,004), y su supervivencia a largo plazo fue menor que la de los pacientes de los grupos INTERMACS 2 (log rank=5,1; p=0,023; razón de riesgos [HR]=3,1; intervalo de confianza [IC] del 95%, 1,4-6,8) e INTERMACS 3-4 (log rank=6,1; p=0,013; HR=4; IC del 95%, 1,3-12,3).
ConclusionesNuestros resultados indican que la escala INTERMACS resulta útil para estratificar el pronóstico postoperatorio tras el trasplante cardiaco urgente.
Palabras clave
El trasplante cardiaco (TrC) mejora la supervivencia y la calidad de vida de pacientes seleccionados con cardiopatías avanzadas sin posibilidad de respuesta a otros tratamientos1. Dado que el pronóstico de los candidatos para esta terapia puede verse limitado por el tiempo en espera del órgano, la Organización Nacional de Trasplantes (ONT) reserva la posibilidad de incluir en lista de espera para TrC con prioridad urgente a los pacientes entre los que se prevé una elevada mortalidad a corto plazo sin TrC.
En nuestro país, la creciente escasez de donantes óptimos ha conllevado en los últimos años un incremento progresivo del número de TrC que se realizan en situación urgente, pese a que su mortalidad postoperatoria es significativamente superior a la del TrC electivo2. Los criterios actuales de la ONT para la inclusión de pacientes en lista de espera para TrC urgente establecen varios niveles de prioridad únicamente en función de la necesidad de diferentes dispositivos de soporte vital3, de modo que en cada nivel coexisten pacientes muy heterogéneos en cuanto a situación clínica, grado de deterioro hemodinámico y extensión de la afección de órganos diana. Con estos condicionantes, la clasificación actual no es una herramienta óptima para la toma de decisiones terapéuticas, la comparación de resultados entre grupos ni la predicción de la supervivencia tras el TrC.
La escala INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) permite la estratificación de los pacientes con insuficiencia cardiaca (IC) avanzada en siete niveles en función de su perfil hemodinámico y el grado de daño de órganos diana (Tabla 1)4. Esta clasificación se definió en el marco de un registro multicéntrico de dispositivos de asistencia ventricular4,5 con el objetivo de unificar criterios en la descripción del estado clínico de los pacientes con IC avanzada, optimizar la predicción de su riesgo perioperatorio y clarificar las indicaciones de cada una de las alternativas terapéuticas disponibles. La escala INTERMACS ha demostrado su valor para predecir mortalidad4,5 y complicaciones postoperatorias6 tras el implante de dispositivos de asistencia ventricular, pero hasta el momento su valor pronóstico en el contexto del TrC no ha sido establecido. El objetivo del presente estudio es analizar la utilidad de la escala INTERMACS para estratificar el pronóstico postoperatorio de los pacientes con IC avanzada que reciben un TrC urgente.
Tabla 1. Escala INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) para la clasificación de los pacientes con insuficiencia cardiaca avanzada.
| Perfiles | Definición | Descripción |
| INTERMACS 1 | «Crash and burn» | Inestabilidad hemodinámica pese a dosis crecientes de catecolaminas y/o soporte circulatorio mecánico con hipoperfusión crítica de órganos diana (shock cardiogénico crítico) |
| INTERMACS 2 | «Sliding on inotropes» | Soporte inotrópico intravenoso con cifras aceptables de presión arterial y deterioro rápido de la función renal, el estado nutricional o los signos de congestión |
| INTERMACS 3 | «Dependent stability» | Estabilidad hemodinámica con dosis bajas o intermedias de inotrópicos e imposibilidad para su retirada por hipotensión, empeoramiento sintomático o insuficiencia renal progresiva |
| INTERMACS 4 | «Frequent flyer» | Es posible retirar transitoriamente el tratamiento inotrópico, pero el paciente presenta recaídas sintomáticas frecuentes, habitualmente con sobrecarga hídrica |
| INTERMACS 5 | «Housebond» | Limitación absoluta de la actividad física, con estabilidad en reposo, aunque habitualmente con retención hídrica moderada y un cierto grado de disfunción renal |
| INTERMACS 6 | «Walking wounded» | Menor limitación de la actividad física y ausencia de congestión en reposo. Fatiga fácil con actividad ligera |
| INTERMACS 7 | «Placeholder» | Paciente en clase funcional NYHA II-III sin balance hídrico inestable actual ni reciente |
NYHA: New York Heart Association.
Hemos realizado un análisis retrospectivo de la cohorte histórica de pacientes adultos tratados con TrC urgente en nuestro hospital entre abril de 1991 y octubre de 2009. En el estudio se incluyó a todos los pacientes cuya indicación de TrC urgente había sido motivada por una cardiopatía en situación de IC avanzada con inestabilidad hemodinámica dependiente de aminas vasoactivas y/o dispositivos de soporte circulatorio mecánico o con arritmias ventriculares malignas recurrentes y refractarias a tratamiento convencional. La decisión de incluir a un paciente en lista de espera para TrC urgente fue tomada en todos los casos por un equipo multidisciplinario integrado por cardiólogos, cirujanos cardiacos e intensivistas, según los criterios establecidos por la ONT en cada etapa histórica.
Hasta el año 2001, nuestro protocolo recomendaba la terapia inmunosupresora de inducción con anticuerpos OKT-3 durante los primeros 7 días tras el TrC. Desde esa fecha, nuestro grupo utiliza la terapia de inducción con basiliximab los días 0 y 4 tras el TrC. Salvo contraindicaciones, todos los pacientes recibieron triple terapia inmunosupresora con prednisona, un inhibidor de la proliferación celular (micofenolato mofetilo o azatioprina) y un fármaco anticalcineurínico (tacrolimus o ciclosporina) o un inhibidor de mTOR (mammalian target of rapamycin) (everolimus o sirolimus).
Recogida de variablesLa información para el estudio se obtuvo de la revisión individualizada de historias clínicas. Los pacientes vivos fueron informados acerca de la intención del estudio y de participar en el análisis de su información clínica y todos ellos dieron su consentimiento verbal ante testigos. Se diseñó un cuaderno de recogida de datos en el que se incluyeron variables epidemiológicas, clínicas y relativas a tratamiento y pruebas complementarias de donante y receptor, así como relativas al propio acto quirúrgico. Se definieron los siguientes eventos adversos durante la hospitalización postoperatoria tras el TrC:
– Muerte postoperatoria: fallecimiento por cualquier causa durante el periodo de hospitalización postoperatoria.
– Sangrado mayor: sangrado que precisa transfusión de 4 o más concentrados de hematíes y/o causa inestabilidad hemodinámica que requiere infusión de inotrópicos y/o reintervención quirúrgica.
– Reintervención quirúrgica: intervención quirúrgica cardiaca por cualquier causa.
– Terapia de sustitución renal: necesidad de hemodiálisis convencional y/o hemo(dia)filtración venovenosa continua.
– Fracaso primario del injerto: disfunción sistólica del ventrículo izquierdo o biventricular del injerto cardiaco acompañada de inestabilidad hemodinámica que precisa soporte circulatorio mecánico y/o infusión de fármacos vasoactivos.
– Fracaso agudo del ventrículo derecho: disfunción sistólica aislada del ventrículo derecho del injerto cardiaco acompañada de inestabilidad hemodinámica que precisa soporte circulatorio mecánico y/o infusión de fármacos vasoactivos.
– Rechazo agudo: rechazo agudo celular de grado 2R o superior de la clasificación de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar, rechazo agudo celular de grado<2R con deterioro hemodinámico, tratamiento empírico por sospecha de rechazo agudo celular no probado por biopsia o rechazo humoral, definido como disfunción del injerto no explicada por otra causa asociada a la detección de depósitos de C4d con patrón pericapilar en la biopsia endomiocárdica mediante inmunofluorescencia.
– Infección: cualquier infección demostrada por cultivos y/o necesidad de tratamiento antibiótico empírico por sospecha de infección. Para los pacientes que presentaban un proceso infeccioso durante la hospitalización previa a la cirugía de TrC urgente, sólo se consideró este evento en caso de aislamiento de un nuevo germen en los estudios microbiológicos o cambio de la pauta antibiótica previa por sospecha de nueva infección.
La información relativa al seguimiento a largo plazo se obtuvo del registro prospectivo de la Unidad de Trasplante Cardiaco de nuestro centro. Los autores dispusieron de datos fiables acerca del estado vital de todos los pacientes con fecha 19 de noviembre de 2009.
Perfiles INTERMACSLa asignación del nivel INTERMACS que presentaban los pacientes inmediatamente antes de la cirugía de TrC urgente fue realizada de modo retrospectivo e independiente por dos cardiólogos (EBC, MCL) tras la revisión pormenorizada de su historia clínica y resolviendo por consenso las discrepancias de criterio existentes. Dado que el reducido número de pacientes asignados a los perfiles 3 y 4 y que la alternancia entre ellos es frecuente en la práctica clínica, ambos fueron incluidos en un único grupo. Ningún paciente fue asignado a los perfiles 5, 6 o 7.
Análisis estadísticoLas variables categóricas se presentan como frecuencias absolutas (porcentajes) y las variables continuas se presentan como media±desviación estándar. Hemos empleado el test χ2 para la comparación de variables categóricas y el test de análisis de la varianza (ANOVA) para la comparación de variables continuas. El test de Scheffé se empleó para las comparaciones entre pares a posteriori en el caso de las variables en las que el test ANOVA mostró una diferencia estadísticamente significativa. Las curvas de supervivencia se construyeron con el método de Kaplan-Meier y se compararon con el log rank test. Finalmente, se construyó un modelo multivariable de riesgos proporcionales de Cox, en el que se forzó la inclusión de las variables asociadas de modo independiente con la supervivencia tras el TrC en nuestra muestra (año de TrC, diabetes mellitus, edad del receptor, sexo del receptor) y otras variables que, en virtud de la literatura previa, la experiencia clínica y/o su distribución asimétrica entre los grupos, se consideraron potenciales factores de confusión (tipo de cardiopatía, cirugía cardiaca previa, tiempo de isquemia, edad del donante, sexo del donante, soporte vasoactivo del donante). Todos los análisis se realizaron con SPSS 13.0. El nivel de significación se fijó en p<0,05.
ResultadosPoblación del estudioEntre abril de 1991 y octubre de 2009, 112 pacientes recibieron un TrC urgente en nuestro centro. Todos cumplían los criterios de inclusión en el estudio, excepto uno cuya indicación de TrC urgente había sido motivada por patología aórtica no susceptible de reparación quirúrgica y que no fue considerado. La población del estudio, por lo tanto, quedó configurada por 111 pacientes (18 mujeres) con una media de edad de 50,2±12,9 años. En el grupo INTERMACS 1 se incluyó a 31 pacientes (27,9%), de los que 3 eran mujeres (9,7%), con una media de edad de 50,9±10,3 años. El grupo INTERMACS 2 incluyó a 55 pacientes (49,6%), 8 mujeres (14,5%), con media de edad de 51,1±12,6 años. Por último, el grupo INTERMACS 3-4 estaba constituido por 25 pacientes (22,5%), 7 (28%) mujeres, con media de edad de 48,9±16,2 años.
Características clínicas preoperatoriasLa Tabla 2 muestra las características clínicas preoperatorias de los pacientes del estudio. Los pacientes del grupo INTERMACS 1 presentaban una mayor frecuencia de cardiopatía isquémica (p=0,03) y shock post-cardiotomía (p=0,02) que los pacientes de los grupos INTERMACS 2 e INTERMACS 3-4, pero la proporción de pacientes con clase funcional de la New York Heart Association (NYHA) III-IV antes del ingreso que motivó el TrC urgente era significativamente mayor en el grupo INTERMACS 3-4 (p<0,001). Los pacientes del grupo INTERMACS 1 requerían mayores dosis de aminas vasoactivas y recibían más frecuentemente soporte con ventilación mecánica, balón de contrapulsación o dispositivos de asistencia ventricular. De igual modo, la prevalencia de infección preoperatoria era mayor en el grupo INTERMACS 1.
Tabla 2. Características clínicas basales de los pacientes del estudio antes de la cirugía de trasplante cardiaco urgente.
| INTERMACS 1 (n=31) | INTERMACS 2 (n=55) | INTERMACS 3-4 (n=25) | p | |
| Edad (años) | 50,9±10,3 | 51,1±12,6 | 48,9±16,2 | 0,77 |
| IMC (Kg, m2) | 25,2±3,0 | 25,5±4,6 | 25,1±3,5 | 0,91 |
| Mujeres | 3 (9,7) | 8 (14,5) | 7 (28,0) | 0,16 |
| Clase NYHA III-IV basala | 9 (29,0) | 32 (58,2) | 22 (88,0) | <,001 |
| Inclusión previa en lista de espera con prioridad ordinaria | 7 (22,6) | 18 (32,7) | 18 (72,0) | <,001 |
| Cardiopatía de base | 0,03 | |||
| Cardiopatía isquémica | 21 (67,7) | 28 (50,9) | 7 (28,0) | |
| Miocardiopatía dilatada | 6 (19,4) | 18 (32,7) | 15 (60,0) | |
| Otras | 4 (12,9) | 9 (16,4) | 3 (12,0) | |
| Shock tras cardiotomía | 5 (16,1) | 2 (3,6) | 0 (0,0) | 0,02 |
| Hipertensión arterial | 12 (38,7) | 15 (27,3) | 7 (28,0) | 0,52 |
| Hipercolesterolemia | 13 (41,9) | 16 (29,1) | 5 (20,0) | 0,20 |
| Diabetes mellitus | 9 (29,0) | 6 (10,9) | 6 (24,0) | 0,09 |
| Tabaquismo | 10 (32,3) | 25 (45,5) | 6 (24,0) | 0,15 |
| Cirugía cardiaca previa | 7 (22,6) | 17 (30,9) | 6 (24,0) | 0,65 |
| Fibrilación auricular | 7 (22,6) | 18 (32,7) | 11 (44,0) | 0,23 |
| Arritmias ventriculares | 15 (48,4) | 17 (30,9) | 13 (52,0) | 0,12 |
| Parada cardiorrespiratoriab | 10 (32,3) | 13 (23,6) | 10 (40,0) | 0,31 |
| Infección preoperatoriac | 16 (51,6) | 20 (36,4) | 5 (20,0) | 0,015 |
| DAI | 3 (9,7) | 8 (14,5) | 4 (12,0) | 0,80 |
| TRC | 1 (3,2) | 3 (5,5) | 2 (8,0) | 0,73 |
| Anticoagulación | 18 (58,2) | 39 (70,9) | 16 (64,0) | 0,47 |
| Heparina | 14 (45,2) | 34 (61,8) | 10 (40,0) | |
| Anticoagulantes orales | 4 (13,0) | 5 (9,1) | 6 (24,0) | |
| Antiagregación | 14 (45,2) | 25 (44,4) | 6 (24,0) | 0,32 |
| Aspirina | 11 (35,5) | 25 (37,1) | 6 (24,0) | |
| Aspirina+clopidogrel | 3 (9,7) | 4 (7,3) | 0 (0,0) | |
| Catecolaminas | 31 (100) | 55 (100) | 20 (80,0) | <,001 |
| Índice inotrópico d | 87,1±86,1 | 22,3±12,1 | 6,3±4,7 | <,001 |
| Balón de contrapulsación | 27 (87,1) | 39 (70,9) | 11 (44,0) | 0,002 |
| Asistencia ventricular | 8 (25,8) | 3 (5,5) | 0 (0,0) | 0,002 |
| Extracorpórea | 7 (22,6) | 2 (3,6) | 0 (0,0) | |
| Percutánea | 1 (3,2) | 1 (1,9) | 0 (0,0) | |
| Ventilación mecánica invasiva | 26 (83,9) | 28 (50,9) | 6 (24,0) | <,001 |
| Terapia de sustitución renal e | 3 (9,7) | 1 (1,9) | 0 (0,0) | 0,09 |
DAI: desfibrilador automático implantable; IMC: índice de masa corporal; NYHA: New York Heart Association; TRC: terapia de resincronización cardiaca.
Los datos expresan media±desviación estándar o n (%).
a Clase funcional del paciente 1 mes antes del ingreso que motivó la inclusión en lista de espera para trasplante cardiaco con prioridad urgente.
b Episodio de fibrilación ventricular, taquicardia ventricular sin pulso, asistolia o disociación electromecánica.
c Sospecha clínica de infección y aislamiento de germen causal o necesidad de tratamiento antibiótico empírico con anterioridad a la cirugía durante el ingreso que motivó la inclusión en lista de espera para trasplante cardiaco con prioridad urgente.
d Índice inotrópico de Wernovsky: dosis de dobutamina+dosis de dopamina+dosis de adrenalina×100+dosis de noradrenalina×100+dosis milrinona×15μg/kg/min. Adaptado de Wernovsky et al. A comparison of low-flow cardiopulmonary bypass and circulatory arrest. Circulation. 1995;92:2226–35.
e Hemodiálisis convencional o hemodiafiltración venovenosa continua.
Los parámetros hemodinámicos preoperatorios de los pacientes del estudio se muestran en la Tabla 3. Los tres grupos únicamente diferían en cuanto a las cifras de presión venosa central (p=0,02), que se encontraba significativamente más elevada en los pacientes INTERMACS 1 (17,8±3,1 mmHg) que en los pacientes INTERMACS 2 (10,4±5,5 mmHg; p=0,03) e INTERMACS 3-4 (9,8±6,3 mmHg; p=0,04).
Tabla 3. Situación hemodinámica de los pacientes del estudio antes de la cirugía de trasplante cardiaco urgente.
| INTERMACS 1 (n=31) | INTERMACS 2 (n=55) | INTERMACS 3-4 (n=25) | p | |
| Gasto cardiaco (l/min) | 3,3±0,5 | 3,7±0,9 | 3,6±0,7 | 0,22 |
| Índice cardiaco (l/min/m2) | 1,8±0,3 | 2,1±0,5 | 2±0,4 | 0,25 |
| Presión sistólica AP (mmHg) | 51,3±15,0 | 50,4±13,6 | 49,4±13,6 | 0,91 |
| Presión media AP (mmHg) | 38,1±12,7 | 34,7±8,9 | 33±9,1 | 0,15 |
| Presión capilar pulmonar (mmHg) | 26,9±10,0 | 24,5±7,7 | 24,9±7,3 | 0,64 |
| Gradiente transpulmonar (mmHg) | 12,9±8,1 | 11,4±4,9 | 7,8±5,0 | 0,07 |
| Resistencia vascular pulmonar (UW) | 3,7±2,2 | 2,8±1,7 | 2,5±1,9 | 0,1 |
| Resistencia pulmonar total (UW) | 12±4,5 | 9,9±3,6 | 9,8±3,4 | 0,25 |
| Presión venosa central (mmHg) | 17,8±3,1 | 10,4±5,5 | 9,8±6,3 | 0,02 |
| FEVI % | 0,21±0,6 | 0,23±0,7 | 0,19±0,7 | 0,09 |
AP: arteria pulmonar; FEVI: fracción de eyección del ventrículo izquierdo: UW: unidades Wood.
Los datos expresan media±desviación estándar o n (%).
Los pacientes del grupo INTERMACS 3-4 presentaban cifras significativamente mayores de hemoglobina y de hematocrito que los pacientes de los grupos INTERMACS 1 e INTERMACS 2 (Tabla 4). Por su parte, el grupo INTERMACS 1 presentaba cifras significativamente mayores de glutamato oxalatotransaminasa, glutamato piruvatotransaminasa y lactato deshidrogenasa, así como cifras más altas de creatinina plasmática y un menor aclaramiento de creatinina que los grupos INTERMACS 2 e INTERMACS 3-4.
Tabla 4. Datos analíticos en los pacientes del estudio antes de la cirugía de trasplante cardiaco urgente.
| INTERMACS 1 (n=31) | INTERMACS 2 (n=55) | INTERMACS 3-4 (n=25) | p | |
| Hemoglobina (g/dl) | 10,8±2,4 | 11,3±2,3 | 12,7±1,7 | 0,008 |
| Hematocrito (%) | 31,6±6,9 | 34,1±6,8 | 37,9±5,1 | 0,004 |
| Bilirrubina total (mg/dl) | 2,2±2,1 | 1,8±1,7 | 2,4±1,7 | 0,45 |
| GOT (UI/l) | 1.337±1,993 | 317±1.011 | 165±297 | 0,002 |
| GPT (UI/l) | 1.220±2,403 | 205±403 | 238±558 | 0,006 |
| GGT (UI/l) | 238±487 | 141±172 | 93±66 | 0,2 |
| LDH (UI/l) | 2.494±1.968 | 1.209±1.822 | 806±550 | 0,002 |
| Creatinina (mg/dl) | 2,3±1,2 | 1,4±0,5 | 1,3±0,5 | <0,001 |
| Aclaramiento de creatinina (ml/min/m2) * | 49,1±25,4 | 74,3±31,8 | 77,7±37,2 | 0,001 |
GGT: gammaglutamil transpeptidasa; GOT: glutamato oxalacetato transpeptidasa; GPT: glutamato piruvato transpeptidasa; LDH: lactato deshidrogenasa.
Los datos expresan media±desviación estándar.
* Calculado con la fórmula de Cockoft-Gault: [(140 – edad)×peso en kg / (72×creatinina plasmática en mg/dl]×0,85 (en mujeres).
Como se muestra en la Tabla 5, los tres grupos del estudio no difirieron significativamente en cuanto al tiempo en lista de espera para TrC urgente, el tiempo de isquemia o el sexo o la edad de los donantes. Sin embargo, el empleo de donantes que habían precisado aminas vasoactivas fue mayor en el grupo INTERMACS 1 (p=0,047). El tiempo de circulación extracorpórea fue ligeramente superior entre los pacientes del grupo INTERMACS 1, sin que la diferencia alcanzara la significación estadística (p=0,06).
Tabla 5. Características de la cirugía de trasplante cardiaco (TrC) urgente en los pacientes incluidos en el estudio.
| INTERMACS 1 (n=31) | INTERMACS 2 (n=55) | INTERMACS 3-4 (n=25) | p | |
| Tiempo en lista de espera de TrC urgente (días) | 3,1±2,3 | 3±2,4 | 3,1±2,5 | 0,96 |
| Técnica biaauricular | 2 (6,5) | 3 (5,5) | 2 (8,0) | 0,9 |
| Edad del donante (años) | 36,8±13,6 | 34,9±13,8 | 37,4±13,0 | 0,7 |
| Donante mujer | 7 (22,6) | 15 (27,3) | 6 (24,0) | 0,88 |
| Donante con fármacos vasoactivos | 24 (77,4) | 36 (65,5) | 13 (52,0) | 0,047 |
| RCP donante | 0 (0,0) | 3 (5,5) | 1 (4,0) | 0,42 |
| Tiempo de isquemia (min) | 213,2±76,6 | 192,4±78,0 | 218±82,6 | 0,31 |
| Tiempo de CEC (min) | 143,4±80,2 | 126,9±33,7 | 116,8±24,1 | 0,06 |
| Uso de óxido nítrico | 9 (29,0) | 18 (32,7) | 9 (36,0) | 0,86 |
CEC: circulación extracorpórea; IMC: índice de masa corporal; RCP: reanimación cardiopulmonar.
Los datos expresan media±desviación estándar o n (%).
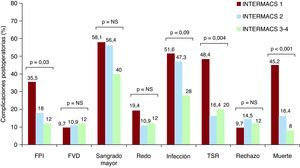
La incidencia de complicaciones durante la hospitalización postoperatoria se muestra en la Figura 1. La incidencia de fracaso primario del injerto fue del 35,8% en el grupo INTERMACS 1, el 18% en el grupo INTERMACS 2 y el 12,0% en el grupo INTERMACS 3-4 (p=0,03). La necesidad de terapia de sustitución renal fue del 48,4% en el grupo INTERMACS 1, el 16,4% en el grupo INTERMACS 2 y el 20,0% en el grupo INTERMACS 3 (p=0,004). La incidencia de infecciones postoperatorias fue del 51,6% en el grupo INTERMACS 1, el 47,3% en el grupo INTERMACS 2 y el 28% en el grupo INTERMACS 3, pero esta diferencia no alcanzó la significación estadística (p=0,09). Las infecciones postoperatorias más frecuentes fueron la infección respiratoria (9 pacientes en el grupo INTERMACS 1; 12 en INTERMACS 2, y 4 en INTERMACS 3-4), la bacteriemia (7 pacientes en el grupo INTERMACS 1; 5 en INTERMACS 2, y 2 en INTERMACS 3-4) y la infección del tracto urinario (1 paciente en el grupo INTERMACS 1 y 3 en el grupo INTERMACS 2). Durante el periodo postoperatorio no se observaron diferencias estadísticamente significativas entre los tres grupos en cuanto a la incidencia de fracaso aislado del ventrículo derecho, sangrado mayor, reintervención quirúrgica o rechazo agudo. La mortalidad intrahospitalaria tras el TrC fue significativamente mayor (p<0,001) en el grupo INTERMACS 1 (45,2%) que en el INTERMACS 2 (16,4%) y el INTERMACS 3-4 (8%).
Figura 1. Incidencia de complicaciones postoperatorias de los pacientes incluidos en el estudio. FPI: fracaso primario del injerto; FVD: fracaso aislado del ventrículo derecho; NS: diferencias no significativas; Redo: reintervención quirúrgica; TSR: terapia de sustitución renal.
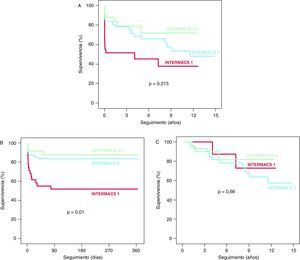
Supervivencia tras el trasplanteTras un seguimiento medio de 4,5±4,3 años (máximo 14,9 años), se observó una diferencia estadísticamente significativa entre las curvas de supervivencia tras el TrC de los tres grupos del estudio (log rank=8,4; p=0,015) (Figura 2A). La mortalidad cruda y la mortalidad ajustada de los pacientes del grupo INTERMACS 1 fueron significativamente mayores que las de los pacientes del grupo INTERMACS 2 (log rank=5,1; p=0,023; hazard ratio [HR]=3,1; intervalo de confianza [IC] del 95%, 1,4-6,8) y el grupo INTERMACS 3-4 (log rank=6,1; p=0,013; HR=4; IC del 95%, 1,3-12,3). No se observaron diferencias significativas en cuanto a mortalidad cruda y ajustada entre los pacientes del grupo INTERMACS 2 y el grupo INTERMACS 3-4 (log rank=0,79; p=0,37; HR=1,3; IC del 95%, 0,4-4). La mayor mortalidad de los pacientes del grupo INTERMACS 1 se concentró en el primer año de seguimiento tras el TrC (log rank=14,3; p=0,01) (Figura 2B). No se observaron diferencias significativas entre los grupos en cuanto al pronóstico a largo plazo de los pacientes que sobrevivieron al primer año tras el trasplante (log rank=0,83; p=0,66) (Figura 2C). Las causas de muerte se muestran en la Tabla 6.
Figura 2. Supervivencia tras el trasplante cardiaco de los pacientes incluidos en el estudio. A. Seguimiento a largo plazo. B. Seguimiento durante el primer año tras el trasplante. C. Seguimiento a largo plazo de los pacientes que sobrevivieron al primer año tras el trasplante.
Tabla 6. Causas de muerte de los pacientes del estudio en función del nivel INTERMACS en el que se encontraban antes del trasplante cardiaco urgente.
| Causas de muerte antes de 1 año tras el trasplante | Causas de muerte más de 1 año tras el trasplante | |
| INTERMACS 1 (n=31) | Fracaso multisistémico (n=6) | Rechazo agudo (n=1) |
| Fracaso primario del injerto (n=5) | Coronariopatía del injerto (n=1) | |
| Infección (n=2) | ||
| Otras (n=2) | ||
| INTERMACS 2 (n=55) | Fracaso primario del injerto (n=4) | Neoplasia (n=9) |
| Fracaso multisistémico (n=2) | Infección (n=2) | |
| Infección (n=2) | Coronariopatía del injerto (n=1) | |
| Otras (n=1) | ||
| INTERMACS 3 (n=25) | Infección (n=2) | Infección (n=1) |
| Fracaso multisistémico (n=1) | Otras (n=2) |
Los resultados de nuestro estudio indican que la escala INTERMACS es una herramienta útil para estratificar el pronóstico postoperatorio de los pacientes con IC avanzada que reciben un TrC en situación urgente. Tras el ajuste por potenciales factores de confusión, la mortalidad tras el TrC de los pacientes en situación preoperatoria INTERMACS 1 (shock cardiogénico crítico) fue unas 3 veces superior que la de los pacientes en situación INTERMACS 2 (deterioro clínico rápido pese a inotrópicos) y unas 4 veces superior que la de los pacientes en situación INTERMACS 3-4 (NYHA IV estable con o sin inotrópicos). Este resultado se obtuvo a expensas de una mayor mortalidad por fracaso multiorgánico y por fracaso primario del injerto durante el periodo postoperatorio inmediato, sin que se observasen diferencias significativas entre los grupos con respecto a la supervivencia a largo plazo de los pacientes que sobrevivieron al primer año tras el TrC. Nuestro estudio no mostró diferencias significativas en la supervivencia tras el TrC entre los pacientes en situación preoperatoria INTERMACS 2 e INTERMACS 3-4.
La principal razón que explica el valor pronóstico de la clasificación INTERMACS en los pacientes tratados con TrC urgente radica en su capacidad para estratificar de modo preciso la situación clínica y hemodinámica del receptor antes de la intervención quirúrgica. En nuestra serie, los pacientes que llegaron al TrC en situación INTERMACS 1 presentaban un mayor grado de deterioro hemodinámico que los pacientes en situación INTERMACS 2 o 3-4 y requirieron más frecuentemente soporte circulatorio mecánico preoperatorio y mayores dosis de aminas vasoactivas. Los pacientes en situación INTERMACS 1 también presentaban un mayor grado de disfunción de órganos diana, reflejado en una mayor necesidad de soporte ventilatorio invasivo y peores parámetros analíticos de función hepática y función renal. En nuestro estudio, el perfil clínico típico de un paciente en situación INTERMACS 1 es el de un individuo afecto de cardiopatía isquémica, con buena clase funcional previa o incluso sin historia previa de IC, que presenta un evento coronario agudo con evolución rápida a shock cardiogénico profundo con daño severo de órganos diana pese a fármacos vasoactivos a altas dosis y soporte circulatorio mecánico, mientras que el perfil INTERMACS 3-4 corresponde típicamente a un paciente con una miocardiopatía dilatada idiopática ya conocida, con historia de IC avanzada, en la mayoría de los casos ya incluido en lista de espera de TrC electivo, que presenta un episodio de descompensación con preservación de la función de órganos diana y requiere un menor grado de soporte hemodinámico. El perfil INTERMACS 2 representa una situación clínica intermedia entre esos extremos. Este escenario resulta similar al descrito en varios estudios previos en los que se ha empleado la escala INTERMACS para clasificar a los pacientes con IC avanzada que reciben un dispositivo de asistencia ventricular4,5,6,7. Un dato interesante de nuestra serie es la mayor frecuencia de infección preoperatoria en pacientes del grupo INTERMACS 1, que consideramos en relación con la mayor frecuencia de empleo de dispositivos invasivos. Cabe recordar que, si bien la infección controlada no se considera en el momento actual una contraindicación absoluta para el TrC8, esta comorbilidad puede comprometer seriamente la evolución postoperatoria en algunos casos.
La mayor mortalidad precoz tras el TrC de los pacientes en situación preoperatoria INTERMACS 1 se justifica en gran medida por una elevada incidencia de fracaso primario del injerto. Esta condición, que conlleva un pésimo pronóstico vital a corto plazo, se ha considerado clásicamente en relación con factores dependientes del donante como la edad, la necesidad de soporte inotrópico o el tiempo de isquemia9. En nuestra serie no hemos observado diferencias significativas en cuanto a edad, tiempo de isquemia o sexo de los donantes empleados en función de la situación INTERMACS preoperatoria del receptor. Además, si bien la mayor frecuencia de empleo de donantes dependientes de fármacos vasoactivos en el grupo INTERMACS 1 puede haber contribuido a la alta incidencia de fracaso primario del injerto observada en este grupo, no parece que este sea el único motivo. En los últimos años, la constatación de los buenos resultados del TrC con donantes subóptimos en receptores seleccionados10 ha contribuido a resaltar la condición hemodinámica preoperatoria del receptor como un factor determinante del riesgo de aparición de fracaso primario del injerto. Así, Segovia et al11 han observado una asociación significativa entre cuatro variables dependientes del receptor (diabetes mellitus, edad>60 años, necesidad de soporte inotrópico y presión venosa central>10 mmHg) y el riesgo de que se presente esta complicación. Los últimos dos factores hacen referencia a una mala condición hemodinámica preoperatoria del receptor, por lo que sus conclusiones resultan congruentes con nuestra observación de una alta incidencia de fracaso primario del injerto en los pacientes que llegan al TrC en situación de shock cadiogénico crítico. Los pacientes INTERMACS 1 también presentaron durante el periodo postoperatorio una mayor necesidad de terapia de sustitución renal, hallazgo que se justifica por su peor función renal preoperatoria y la peor evolución de su situación hemodinámica tras la intervención quirúrgica.
La constatación de los malos resultados del TrC urgente en los pacientes en situación preoperatoria INTERMACS 1 apunta a la necesidad de reconsiderar su manejo clínico. En algunos casos, una actitud razonable podría ser el implante de un dispositivo de asistencia ventricular de corta duración como puente a la toma de una decisión definitiva sobre la idoneidad de la inclusión del paciente en lista de espera de TrC urgente. En estas condiciones, la asistencia ventricular podría facilitar la recuperación de la función de los órganos diana y contribuir a optimizar la condición preoperatoria del receptor. Si bien un análisis reciente ha mostrado un incremento significativo de la mortalidad postoperatoria en pacientes que llegan al TrC con un dispositivo de asistencia ventricular12, otros grupos han obtenido buenos resultados con esta estrategia13,14. Pese a que la rápida disponibilidad de órganos ha conllevado históricamente un reducido empleo de los dispositivos de asistencia ventricular en España15, cabe esperar que la creciente reducción del número de donantes suponga un impulso importante para este tipo de programas en los próximos años. En todo caso, es importante recordar que la toma de decisiones terapéuticas en los pacientes en shock cardiogénico profundo ha de estar presidida en todo momento por una cuidadosa evaluación de la potencial reversibilidad del daño de los órganos diana, ya que cuando este se establece de modo irreversible es probable que cualquier esfuerzo terapéutico resulte inútil (situación que algunos autores denominan nivel INTERMACS 0). Es posible, de hecho, que la realización de TrC urgente en algunos pacientes en situación de fallo multiorgánico irreversible haya condicionado la alta mortalidad observada en el grupo INTERMACS 1 de nuestro estudio. Para una óptima distribución de los donantes, sería interesante disponer de marcadores clínicos que identifiquen en esta población en alto riesgo el «punto de no retorno» a partir del cual el TrC conlleva una mortalidad perioperatoria inasumible y, por lo tanto, debe estar contraindicado. Por motivos de tamaño muestral, este cometido excede el propósito de nuestra investigación, pero puede constituir un campo de trabajo interesante para futuros estudios multicéntricos.
La limitación más importante de nuestro estudio es su diseño retrospectivo, que puede haber condicionado algunos errores en la asignación del nivel INTERMACS preoperatorio. Para la correcta interpretación de los resultados, es necesario tener en cuenta la heterogeneidad de la muestra y la variación de los criterios de selección de candidatos para TrC urgente con el paso de los años. Por otra parte, el reducido tamaño muestral no ha permitido detectar como estadísticamente significativas algunas diferencias entre grupos que podrían ser clínicamente relevantes, como se ha expuesto en el apartado «Discusión». Por último, el diseño de nuestro análisis no permite asegurar la validez externa de sus conclusiones, que deben ser confirmadas en futuros registros multicéntricos de mayor tamaño muestral.
ConclusionesCon las limitaciones expuestas, nuestro trabajo indica que la escala INTERMACS resulta de utilidad para estratificar el pronóstico postoperatorio de los pacientes con IC avanzada que reciben un TrC en situación urgente. En nuestra opinión, la elevada mortalidad postoperatoria observada entre los pacientes que llegan al TrC urgente en situación de shock cardiogénico crítico apunta a la necesidad de replantear la estrategia terapéutica en estos casos e impulsar el desarrollo de programas de asistencia ventricular. A falta de que estos resultados se confirmen en futuros registros multicéntricos, la escala INTERMACS se postula como una herramienta útil para optimizar la selección de candidatos para TrC urgente y la distribución de donantes cardiacos en nuestro medio y, por lo tanto, susceptible de ser incorporada en un futuro próximo a la práctica clínica habitual de los profesionales con responsabilidad en este campo.
Conflicto de interesesNinguno.
FinanciaciónEste trabajo ha sido financiado parcialmente por el Instituto Nacional de Salud Carlos III a través de la Red Nacional de Investigación Cardiovascular (RECAVA).
Agradecimientos
A todos los profesionales de la Oficina de Coordinación de Trasplantes y del programa de Trasplante Cardiaco del Hospital Universitario de A Coruña a lo largo de sus 19 años de historia (1991-2010).
Recibido 14 Abril 2010
Aceptado 24 Agosto 2010
Autor para correspondencia: Unidad de Trasplante Cardiaco, Hospital Universitario de A Coruña. As Xubias 84. 15006 A Coruña, España. blargesbueno@hotmail.com