Existe escasa información sobre el efecto de la fibrilación ventricular que complica un síndrome coronario agudo en la incidencia a largo plazo de muerte súbita cardiaca. Se analiza dicho efecto en una cohorte contemporánea de pacientes con síndrome coronario agudo.
MétodosEntre diciembre de 2003 y diciembre de 2012, se estudió a 5.302 pacientes consecutivos con síndrome coronario agudo. Se comparó la mortalidad hospitalaria y tras el alta por grupos según la presencia o ausencia de fibrilación ventricular.
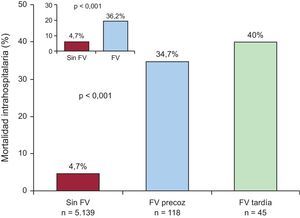
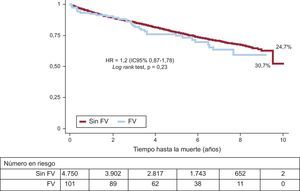
ResultadosTenían fibrilación ventricular 163 (3,1%) pacientes; en el 72,4% se trataba de fibrilación ventricular precoz. La mortalidad hospitalaria fue el 36,2% del grupo con fibrilación ventricular y el 4,7% del grupo sin fibrilación ventricular (p<0,001). La mortalidad tras 4,7±2,6 años del alta fue el 30,7% del grupo con fibrilación ventricular y el 24,7% del otro grupo (p=0,23). La presencia de fibrilación ventricular no se asoció, tras ajustar por varias variables confusoras, a un incremento del riesgo de muerte (hazard ratio=1,29; intervalo de confianza del 95%, 0,90-1,87). Se pudo determinar la causa de la muerte del 72% de los pacientes: la incidencia de muerte súbita fue del 12,9% del grupo de fibrilación ventricular y el 11,9% del otro grupo (p=0,71); la mortalidad por causa cardiovascular fue similar: el 35,5 y el 34,4% respectivamente.
ConclusionesSuperada la fase de hospitalización, no parece que haya un aumento del riesgo de muerte súbita cardiaca o de otra causa cardiovascular en los pacientes cuyo síndrome coronario agudo se complica con fibrilación ventricular.
Palabras clave
La muerte súbita de origen cardiaco es una de las principales causas de muerte en los países occidentales1,2, y probablemente representa el desafío más importante de la cardiología moderna.
El reconocimiento de sus posibles causas y mecanismos3 está dirigido a conseguir una estratificación del riesgo más eficaz. La principal causa de muerte súbita es la fibrilación ventricular (FV) que puede complicar el curso agudo de un síndrome coronario agudo (SCA)2. Aunque se ha reducido su frecuencia en los últimos años2, la FV continúa siendo un indicador de mal pronóstico a corto plazo4,5. En cambio, la influencia pronóstica a medio y largo plazo de la FV que complica un SCA, especialmente en lo concerniente a un posible incremento del riesgo de muerte súbita cardiaca, está peor caracterizada4–10. A pesar de ello, en las vigentes directrices de prevención secundaria de muerte súbita no se recomienda implante precoz de un desfibrilador automático implantable (DAI) para pacientes cuyo SCA se complica con FV11. Dichas recomendaciones se sustentan en que, una vez corregida la isquemia aguda con revascularización y usando las terapias farmacológicas de demostrada eficacia pronóstica, se reduce el riesgo de FV recurrente. Sin embargo, en los últimos años se ha cuestionado esa base argumental y se ha señalado que las terapias de revascularización y farmacológica no son completamente capaces de abolir el riesgo de futuros eventos arrítmicos fatales12–14.
En este trabajo se describe el pronóstico a largo plazo de pacientes con SCA complicado con FV y se proporcionan datos sobre la incidencia de muerte súbita cardiaca en esos pacientes.
MÉTODOSPoblación de estudioEstudio de cohortes retrospectivo basado en el registro CardioCHUS, que incluyó a todos los pacientes ingresados consecutivamente en el Servicio de Cardiología del Complejo Hospitalario Universitario de Santiago de Compostela (Unidad Coronaria, Unidad de Intermedios y planta de hospitalización), desde diciembre de 2003 a diciembre de 2012, con el diagnóstico de SCA (n=5.640).
Excluimos a los pacientes con SCA no confirmado (n=114), además de aquellos (n=224) cuyo SCA fue precipitado en los siguientes contextos: cirugía reciente, pancreatitis, colecistitis, consumo de tóxicos, anemia grave (hemoglobina<7 g/dl) o sepsis. Así, la cohorte final del presente estudio se compone de 5.302 pacientes con el diagnóstico principal y definitivo de SCA.
Se revisó la historia clínica de los pacientes con diagnóstico de parada cardiaca en el contexto de SCA para identificar e incluir a los pacientes con diagnóstico de FV. El diagnóstico de parada cardiaca por FV se confirmó en presencia de trazados compatibles (arritmia rápida desorganizada con ondas irregulares de morfología inconsistente en la que los complejos QRS son indistinguibles de las ondas T), además del contexto clínico. Se clasificó a los pacientes en dos grupos según si sufrieran FV o no. Dentro del subgrupo de FV, distinguimos entre FV precoz (≤ 48 h) y FV tardía (> 48 h). Los episodios de FV periprocedimiento invasivo no se consideraron como eventos de FV en nuestro estudio.
Los SCA se clasificaron en infarto agudo de miocardio (IAM) con elevación del segmento ST (IAMCEST) (elevación del segmento ST ≥ 1mm en al menos dos derivaciones contiguas, bloqueo de rama izquierda nuevo o presumiblemente nuevo) y SCA sin elevación del segmento ST (SCASEST) (IAM sin elevación del ST y angina inestable). A los pacientes con ritmo de marcapasos y ausencia de elevación persistente del ST o bloqueo de rama izquierda conocido, se los clasificó como SCASEST.
La cuantificación de la fracción de eyección del ventrículo izquierdo (FEVI) se realizó por ecocardiografía durante la hospitalización, según el método de Simpson.
El estudio se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki.
Objetivo y seguimientoEl objetivo del estudio es analizar el efecto pronóstico de la FV en la mortalidad intrahospitalaria, la mortalidad total y la causa de muerte a largo plazo.
Tras el alta, se siguió a los pacientes en una consulta monográfica de cardiopatía isquémica y por atención primaria. El seguimiento estructurado se realizó a través de la historia electrónica (única en la Comunidad Autónoma de Galicia, programa IANUS), en la que se revisaron todas las asistencias médicas y los registros hospitalarios; en determinados casos se recurrió al contacto telefónico. La media de seguimiento fue 4,7±2,6 años; no había datos disponibles sobre el estado vital de 150 (3%) pacientes supervivientes al ingreso (el 3,8% del grupo de FV frente al 3,0% del otro grupo; p=0,83), por lo que se los excluyó del análisis de supervivencia.
Para la clasificación de las causas de muertes, se ha empleado la clasificación de las causas de muerte que nuestro grupo había usado previamente15. Se definió muerte súbita como la muerte inesperada de un paciente que hasta entonces había estado estable; puede ser en presencia (con o sin la documentación de la arritmia) o ausencia de testigos (si el paciente había sido visto en las 24 h anteriores a la muerte, pero no había mostrado datos premonitorios de insuficiencia cardiaca, infarto de miocardio u otra causa clara de la muerte). En este estudio, se consideró descarga apropiada de un DAI por FV como un evento de muerte súbita. Se definió muerte de origen cardiovascular (cardiaca y vascular no cardiaca) como la debida a insuficiencia cardiaca refractaria, evento coronario agudo, síndrome aórtico agudo, tromboembolia pulmonar, sistémica o cerebral o enfermedad vasculorrenal (insuficiencia renal en ausencia de glomerulopatías u otras alteraciones parenquimatosas). Las demás causas de muerte disponibles se consideraron de origen no cardiovascular.
Dos cardiólogos (N. Bouzas-Cruz y E. Abu-Assi) establecieron las causas de muerte de manera independiente, y en caso de discrepancia, se recurría a un tercer cardiólogo (J.M. García-Acuña). Cuando no se disponía de información o no había consenso, se incluía al paciente en el grupo de «causa desconocida o inclasificable».
Análisis estadísticoLas variables cuantitativas se expresan como media±desviación estándar y las cualitativas, como frecuencias y porcentajes. Las variables cualitativas fueron comparadas mediante el test de la χ2 o el test exacto de Fisher.
Se utilizó un modelo de regresión logística binaria para la identificación de predictores de sufrir FV en el transcurso de las primeras 48 h del ingreso. Se incluyeron en el modelo las variables que mostraron en el análisis univariable una asociación con p<0,10 y aquellas que en estudios previos, con independencia de su significación estadística en nuestra serie, se demostraron asociadas al desarrollo de FV en las 48 h desde el inicio del evento coronario. En el modelo final de regresión logística para identificar los predictores de FV precoz, se incluyeron las siguientes variables: edad<65 años, sexo, año de ingreso, diabetes mellitus, hipertensión arterial, antecedentes personales de cardiopatía isquémica, antecedentes familiares de cardiopatía isquémica precoz, enfermedad vascular previa (arteriopatía periférica y/o ictus o accidente isquémico transitorio), enfermedad pulmonar obstructiva crónica, tratamiento previo con un bloqueador beta, inhibidor de la enzima de conversión de la angiotensina (IECA) o antagonistas del receptor de la angiotensina II (ARA-II), estatina, IAMCEST frente a SCASEST e IAMCEST de localización anterior.
El efecto de los factores que se mostraron asociados significativamente en el análisis previo con FV precoz se informa como odds ratio (OR) e intervalo de confianza del 95% (IC95%).
Posteriormente, se trazaron las curvas de supervivencia con el método de Kaplan-Meier, y se compararon mediante log-rank test. A continuación, se construyó un modelo de regresión de Cox para identificar los factores asociados a la mortalidad a lo largo del seguimiento. Se incluyeron en el modelo multivariable de Cox las variables que mostraron en el análisis univariable de Cox una asociación con p<0,10. El modelo final incluyó las siguientes variables: edad, sexo, antecedentes de insuficiencia cardiaca, enfermedad vascular previa, diabetes mellitus, hipertensión arterial, dislipemia, bloqueo basal de rama izquierda o ritmo de marcapasos, fibrilación auricular, IAM previo, antecedentes de cáncer, enfermedad pulmonar obstructiva crónica, hemoglobina y creatinina sérica al ingreso, clase Killip al ingreso > 1, tipo de SCA, revascularización coronaria y tipo (intervencionismo percutáneo o cirugía) durante el ingreso, enfermedad coronaria significativa (≥ 70%) multivaso (≥ 2 vasos), tratamiento farmacológico al alta (ácido acetilsalicílico, clopidogrel, bloqueadores beta, estatina, IECA/ARA-II, diuréticos del asa, antialdosterónico y digoxina).
Debido a que no se disponía de la cuantificación de la FEVI de todos los pacientes (disponible en el 91,8% de los casos), no se incluyó inicialmente la FEVI como covariable en el modelo multivariable de Cox, pero posteriormente se evaluó si tras añadir FEVI se habían producido cambios en las estimaciones del modelo previo respecto al efecto pronóstico de FV.
El análisis previo se repitió considerando solo a los pacientes con FV precoz, para probar su influencia en el pronóstico a lo largo del seguimiento.
Los valores p de significación estadística y de hazard ratio (HR), con sus respectivos IC95%, han sido calculados y estimados respectivamente mediante 500 replicaciones bootstrap.
Los análisis estadísticos se realizaron mediante el programa SPSS 21 y STATA 13. Se consideró un resultado estadísticamente significativo si p<0,05.
RESULTADOSSufrieron FV 163 pacientes (3,1%); 118 (72,4%) de ellos presentaron FV precoz. Se observó una tendencia no significativa a la baja en el porcentaje anual de FV desde 2004 a 2012: el 3,9, el 3,3, el 3,1, el 3,5, el 3,3, el 2,2, el 2,6, 2,4 y el 2,9% (test de Cochran-Armitage; p=0,10). La distribución porcentual de FV desde 2004 a 2012 en el SCASEST fue del 1,3, el 1,1, el 2,3, el 1,0, el 1, el 2,8, el 0,6, el 1,2 y el 0,7% respetivamente (p=0,56). En el IAMCEST, la distribución porcentual de FV de 2004 a 2012 fue el 5,0, el 6,9, el 6,3, el 8,0, el 7,4, el 6,6, el 6,8, el 5,8 y el 6,1% (p=0,84).
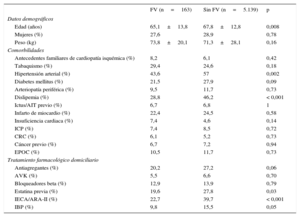
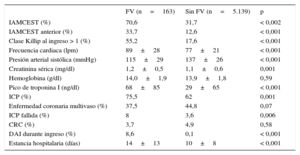
La tabla 1 muestra las características basales de los pacientes por subgrupos según tuvieran FV o no. Lo pacientes que sufrieron FV eran significativamente más jóvenes y con menor prevalencia de comorbilidades.
Características basales según la presencia o ausencia de fibrilación ventricular en el total de los pacientes del estudio
| FV (n=163) | Sin FV (n=5.139) | p | |
|---|---|---|---|
| Datos demográficos | |||
| Edad (años) | 65,1±13,8 | 67,8±12,8 | 0,008 |
| Mujeres (%) | 27,6 | 28,9 | 0,78 |
| Peso (kg) | 73,8±20,1 | 71,3±28,1 | 0,16 |
| Comorbilidades | |||
| Antecedentes familiares de cardiopatía isquémica (%) | 8,2 | 6,1 | 0,42 |
| Tabaquismo (%) | 29,4 | 24,6 | 0,18 |
| Hipertensión arterial (%) | 43,6 | 57 | 0,002 |
| Diabetes mellitus (%) | 21,5 | 27,9 | 0,09 |
| Arteriopatía periférica (%) | 9,5 | 11,7 | 0,73 |
| Dislipemia (%) | 28,8 | 46,2 | < 0,001 |
| Ictus/AIT previo (%) | 6,7 | 6,8 | 1 |
| Infarto de miocardio (%) | 22,4 | 24,5 | 0,58 |
| Insuficiencia cardiaca (%) | 7,4 | 4,6 | 0,14 |
| ICP (%) | 7,4 | 8,5 | 0,72 |
| CRC (%) | 6,1 | 5,2 | 0,73 |
| Cáncer previo (%) | 6,7 | 7,2 | 0,94 |
| EPOC (%) | 10,5 | 11,7 | 0,73 |
| Tratamiento farmacológico domiciliario | |||
| Antiagregantes (%) | 20,2 | 27,2 | 0,06 |
| AVK (%) | 5,5 | 6,6 | 0,70 |
| Bloqueadores beta (%) | 12,9 | 13,9 | 0,79 |
| Estatina previa (%) | 19,6 | 27,8 | 0,03 |
| IECA/ARA-II (%) | 22,7 | 39,7 | < 0,001 |
| IBP (%) | 9,8 | 15,5 | 0,05 |
AIT: accidente isquémico transitorio; ARA-II: antagonista del receptor de la angiotensina II; AVK: antagonistas de la vitamina K; CRC: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FV: fibrilación ventricular; IBP: inhibidor de la bomba de protones; ICP: intervencionismo coronario percutáneo; IECA: inhibidor de la enzima de conversión de la angiotensina.
La tasa de tratamiento previo al ingreso con antiagregantes, así como de IECA/ARA-II y estatina, era más baja entre los pacientes que sufrieron FV. No hubo diferencias significativas en el tratamiento previo al ingreso con bloqueadores beta.
La mayoría de los que sufrieron FV se presentaron con IAMCEST, sobre todo de localización anterior. La proporción de insuficiencia cardiaca al ingreso era significativamente mayor entre los que presentaron FV (el 55,2 frente al 17,6%; p<0,001). Se realizaron más procedimientos de intervencionismo coronario percutáneo en los pacientes con FV, con mayor porcentaje de procedimientos fallidos entre esos pacientes que entre los que no sufrieron FV (el 8 frente al 3,6%; p=0,006). La estancia hospitalaria fue más larga entre los pacientes con FV (14±13 frente a 10±8 días; p<0,001) (tabla 2).
Datos al ingreso y manejo intrahospitalario por subgrupos según presencia o ausencia de fibrilación ventricular
| FV (n=163) | Sin FV (n=5.139) | p | |
|---|---|---|---|
| IAMCEST (%) | 70,6 | 31,7 | < 0,002 |
| IAMCEST anterior (%) | 33,7 | 12,6 | < 0,001 |
| Clase Killip al ingreso > 1 (%) | 55,2 | 17,6 | < 0,001 |
| Frecuencia cardiaca (lpm) | 89±28 | 77±21 | < 0,001 |
| Presión arterial sistólica (mmHg) | 115±29 | 137±26 | < 0,001 |
| Creatinina sérica (mg/dl) | 1,2±0,5 | 1,1±0,6 | 0,001 |
| Hemoglobina (g/dl) | 14,0±1,9 | 13,9±1,8 | 0,59 |
| Pico de troponina I (ng/dl) | 68±85 | 29±65 | < 0,001 |
| ICP (%) | 75,5 | 62 | 0,001 |
| Enfermedad coronaria multivaso (%) | 37,5 | 44,8 | 0,07 |
| ICP fallida (%) | 8 | 3,6 | 0,006 |
| CRC (%) | 3,7 | 4,9 | 0,58 |
| DAI durante ingreso (%) | 8,6 | 0,1 | < 0,001 |
| Estancia hospitalaria (días) | 14±13 | 10±8 | < 0,001 |
CRC: cirugía de revascularización coronaria; DAI: desfibrilador automático implantable; FV: fibrilación ventricular; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervencionismo coronario percutáneo; lpm: latidos por minuto.
En el análisis multivariable, los factores que mostraron asociación independiente con la aparición precoz de FV fueron edad<65 años (OR=1,7; IC95%, 1,10-2,68), IAMCEST (OR=6,0; IC95%, 3,60-9,80), IAMCEST de localización anterior (OR=1,6; IC95%, 1,07-2,52) y ausencia de antecedentes personales de cardiopatía isquémica (OR=2,4; IC95%, 1,33-4,26).
Los índices de discriminación (estadístico c=0,79; IC95%, 0,74-0,83) y calibración del modelo, fueron buenos (test de Hosmer-Lemeshow, p=0,93).
La mortalidad hospitalaria fue del 5,7% (n=301), que en el 82,4% (n=248) de los casos fue de origen cardiovascular.
En la figura 1 se ilustra el porcentaje de mortalidad hospitalaria según la presencia de FV precoz, FV tardía o ausencia de FV. En el grupo de FV, se registraron 59 (36,2%) muertes: 41/118 (34,7%) murieron en el grupo de FV precoz, en comparación con 18/45 (40%) en FV tardía.
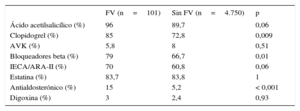
Al alta, la prescripción de antiagregantes, bloqueadores beta, IECA/ARA-II y antialdosterónicos fue significativamente mayor entre los pacientes que sufrieron FV (tabla 3). Durante el seguimiento (4,7±2,6 años), 1.203 (24,8%) pacientes fallecieron. La figura 2 muestra las curvas de supervivencia por subgrupos según la presencia o ausencia de FV durante la fase aguda. No hubo diferencias significativas entre ambos grupos, aunque la mortalidad total no ajustada fue numéricamente mayor entre los pacientes que presentaron FV (el 30,7 frente al 24,7%; p=0,23).
Tratamiento al alta
| FV (n=101) | Sin FV (n=4.750) | p | |
|---|---|---|---|
| Ácido acetilsalicílico (%) | 96 | 89,7 | 0,06 |
| Clopidogrel (%) | 85 | 72,8 | 0,009 |
| AVK (%) | 5,8 | 8 | 0,51 |
| Bloqueadores beta (%) | 79 | 66,7 | 0,01 |
| IECA/ARA-II (%) | 70 | 60,8 | 0,06 |
| Estatina (%) | 83,7 | 83,8 | 1 |
| Antialdosterónico (%) | 15 | 5,2 | < 0,001 |
| Digoxina (%) | 3 | 2,4 | 0,93 |
ARA-II: antagonista del receptor de la angiotensina II; AVK: antagonistas de la vitamina K; FV: fibrilación ventricular; IECA: inhibidor de la enzima de conversión de la angiotensina.
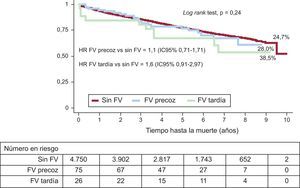
En la figura 3 se comparan las curvas de supervivencia de los pacientes sin FV, con FV precoz y con FV tardía: las tasas de muerte en los subgrupos mencionados fueron del 24,7, el 28,0 y el 38,5% respectivamente.
Durante el seguimiento, se implantó DAI en el 0,9% (42/4.851): el 5% (5/101) de los pacientes del grupo de FV y el 0,8% (37/4.750) del otro grupo (p<0,001).
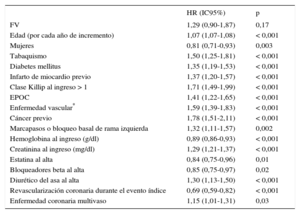
En la tabla 4 se representan los resultados del análisis ajustado de Cox. La FV no se asoció de manera significativa a mayor riesgo de muerte por cualquier causa (HR=1,29; IC95%, 0,90-1,87; p=0,17). Tras considerar la FEVI en el análisis multivariable de supervivencia, la FV tampoco mostró asociación significativa con mayor riesgo de muerte (HR=1,21; IC95%, 0,82-1,76; p=0,35).
Efecto de la fibrilación ventricular en la mortalidad por cualquier causa a largo plazo en los supervivientes al evento índice
| HR (IC95%) | p | |
|---|---|---|
| FV | 1,29 (0,90-1,87) | 0,17 |
| Edad (por cada año de incremento) | 1,07 (1,07-1,08) | < 0,001 |
| Mujeres | 0,81 (0,71-0,93) | 0,003 |
| Tabaquismo | 1,50 (1,25-1,81) | < 0,001 |
| Diabetes mellitus | 1,35 (1,19-1,53) | < 0,001 |
| Infarto de miocardio previo | 1,37 (1,20-1,57) | < 0,001 |
| Clase Killip al ingreso > 1 | 1,71 (1,49-1,99) | < 0,001 |
| EPOC | 1,41 (1,22-1,65) | < 0,001 |
| Enfermedad vascular* | 1,59 (1,39-1,83) | < 0,001 |
| Cáncer previo | 1,78 (1,51-2,11) | < 0,001 |
| Marcapasos o bloqueo basal de rama izquierda | 1,32 (1,11-1,57) | 0,002 |
| Hemoglobina al ingreso (g/dl) | 0,89 (0,86-0,93) | < 0,001 |
| Creatinina al ingreso (mg/dl) | 1,29 (1,21-1,37) | < 0,001 |
| Estatina al alta | 0,84 (0,75-0,96) | 0,01 |
| Bloqueadores beta al alta | 0,85 (0,75-0,97) | 0,02 |
| Diurético del asa al alta | 1,30 (1,13-1,50) | < 0,001 |
| Revascularización coronaria durante el evento índice | 0,69 (0,59-0,82) | < 0,001 |
| Enfermedad coronaria multivaso | 1,15 (1,01-1,31) | 0,03 |
EPOC: enfermedad pulmonar obstructiva crónica; FV: fibrilación ventricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Cuando se consideró en el análisis previo solo a los pacientes que sufrieron FV precoz (n=75), los resultados tampoco variaron con respecto a los observados en el conjunto de la muestra (HR=1,20; IC95%, 0,77-1,93; p=0,39).
Se pudo determinar la causa de muerte de 866 (72%) de los 1.203 pacientes fallecidos. No hubo diferencias significativas en la causa específica de muerte por grupos según la presencia o ausencia de FV (tabla 5). Fallecieron de causa cardiovascular el 35,5% de los pacientes con FV, frente al 34,4% de los pacientes sin FV.
Causa de muerte por subgrupo según presencia o ausencia de fibrilación ventricular entre los supervivientes al evento índice
| FV (n=31/101) | Sin FV (n=1.172/4.750) | p | |
|---|---|---|---|
| Muerte cardiovascular (n=414) | 11 (35,5) | 403 (34,4) | 0,71 |
| Súbita (n=144) | 4 (12,9) | 140 (11,9) | |
| No súbita (n=270) | 7 (22,6) | 263 (22,4) | |
| Muerte no cardiovascular (n=452) | 10 (32,3) | 442 (37,7) | |
| Desconocida o no clasificable (n=337) | 10 (32,3) | 327 (27,9) |
FV: fibrilación ventricular.
Los valores expresan n (%).
Se registraron 3 pacientes con FV durante el seguimiento entre los pacientes con DAI (2 de los pacientes sin FV y 1 de los que sufrieron en el contexto de su SCA un episodio de FV).
Aunque la tasa de muerte súbita fue numéricamente más elevada entre los pacientes con FV (12,9%), no hubo diferencias significativas con el otro grupo (11,9%; p=0,71). La distribución de causas desconocidas o no clasificables no fue significativamente diferente entre los 2 grupos (el 32,3 frente al 27,9%; p=0,74).
DISCUSIÓNEn esta cohorte contemporánea de pacientes con SCA, la incidencia de FV que complica el curso de un evento coronario agudo es relativamente baja y muestra una tendencia no significativa hacia una ligera reducción a lo largo de los años del estudio.
Por otro lado, nuestros resultados señalan que a pesar de la relativamente baja frecuencia de FV, su letalidad en la fase aguda de un SCA es muy alta, especialmente si ocurre tras las primeras 48 h del diagnóstico de un evento coronario agudo. En contraste, una vez superada la fase hospitalaria, no existe un aumento de la mortalidad total atribuible a haber sufrido FV en la fase aguda. Tampoco en el seguimiento a largo plazo de esos pacientes se detectó un incremento en el riesgo de muerte súbita cardiaca ni el riesgo de muerte por otra causa cardiovascular.
La cardiopatía isquémica representa la principal causa de muerte súbita en los países occidentales, el 75% del total de los casos1. La isquemia miocárdica aguda es la causa principal de FV2; el mayor riesgo de eventos arrítmicos fatales se concentra en las primeras semanas tras el evento agudo y disminuye posteriormente de forma sustancial hasta alcanzar la estabilidad aproximadamente al año del evento agudo9.
A pesar de que la FV es una complicación del 2-8% de los SCA2,4–10, y aunque se pueda considerar a los pacientes con SCA complicado con FV como en alto riesgo de FV recurrente en el contexto de un nuevo episodio isquémico o en el curso evolutivo de la enfermedad, no existen ensayos clínicos aleatorizados respecto a un eventual beneficio del implante de DAI en esos pacientes. Además, en los estudios que investigaron esta área de incertidumbre, el pronóstico de FV que complica un SCA no es constante y varía de pobre en algunas series4,5 a excelente en otras6–8.
Las vigentes guías de práctica clínica no recomiendan implantar un DAI como medida de prevención secundaria en los pacientes con FV que complica el curso de un IAM en las primeras 48 h en ausencia de isquemia residual o disfunción ventricular grave11. Es necesario destacar que las recomendaciones previas (clase C) se basan en 2 estudios muy antiguos16,17. De este modo, la vigencia de las conclusiones extraídas de esos estudios puede ser motivo de controversia. Por otro lado, estudios clínicos, epidemiológicos y genéticos señalan que determinados individuos están en alto riesgo de recurrencia de FV12–14, por lo que podría esperarse un episodio recurrente de FV en el contexto de un nuevo evento isquémico, que habitualmente es el desencadenante principal de FV2.
Por lo tanto, y teniendo en cuenta el conjunto de las consideraciones previas, los estudios que caracterizan la influencia en el pronóstico a largo plazo de FV que complica un SCA pueden resultar de especial relevancia clínica.
Nuestro estudio representa la serie más grande de pacientes con FV en el contexto de un SCA. Además, junto con los realizados por Piccini et al5, Bougouin et al10 y de Jong et al8, es la serie más contemporánea. No obstante, nuestra serie es la más reciente, por lo que es más probable que refleje más fehacientemente los vigentes patrones de manejo y tratamiento del SCA, que han demostrado mejoras considerables del pronóstico en ese escenario clínico. Nuestra serie incluye a pacientes con IAM con y sin elevación del ST, a diferencia de los trabajos de Piccini et al y de Jong et al, que incluyeron solo a pacientes con IAM sin elevación del ST e IAMCEST respectivamente.
Por otro lado, los resultados del trabajo de Piccini et al se basan en pacientes cuidadosamente seleccionados del ensayo clínico EARLY ACS5. En ese subestudio se investigó el efecto pronóstico de FV o taquicardia ventricular sostenida en 228 pacientes con IAM sin elevación del segmento ST. La mortalidad a 30 días fue casi 6 veces mayor en los que presentaron FV o taquicardia ventricular sostenida; la mortalidad hospitalaria fue especialmente más alta entre los que presentaron el evento arrítmico tardíamente (≥ 48 h). Los autores del estudio previo también encontraron que el riesgo de muerte de esos pacientes persistía a 1 año de seguimiento. Sin embargo, el estudio previo no proporcionó información sobre el riesgo de muerte súbita más allá de la fase de hospitalización.
En contraste, Bougouin et al10 observaron, tras estudiar a 116 pacientes con FV e IAM (con y sin elevación del ST), que la mortalidad total y por causa cardiaca, fuera súbita o no (4,3±0,17 años tras el alta), no difieren significativamente entre enfermos con y sin FV.
En el último de los estudios previos, de Jong et al8 estudiaron a 341 pacientes con un primer IAMCEST y FV primaria. Los autores encontraron que la mortalidad total fue del 6,6% del grupo de FV frente al 9% del otro grupo (p=0,106). No se determinaron las causas específicas de muerte en el estudio de de Jong et al.
Así, nuestros hallazgos sobre la influencia en el pronóstico a largo plazo de la FV que complica el curso de un SCA confirman los de Bougouin et al y de Jong et al en cuanto a ausencia de incremento del riesgo de mortalidad total8,10.
Los datos de nuestro trabajo confirman los predictores de ocurrencia de FV precoz en un SCA que se han identificado previamente, como la edad más joven10,17 y el IAMCEST4. En contraste con otros trabajos que encontraron que el IAMCEST inferior predispone al desarrollo de FV precoz6, en nuestra serie se ha identificado el IAMCEST anterior. Cabe destacar que, en un estudio de más de 9.000 pacientes con IAM, solo el IAM posterior fue protector contra la aparición de FV, en comparación con otras localizaciones.
La elevada mortalidad hospitalaria de los pacientes que sufrieron FV concuerda con las observaciones de otros estudios4,5,10.
Nuestros hallazgos pueden tener implicaciones clínicas relevantes, ya que se trata de pacientes no seleccionados tratados conforme a las directrices contemporáneas que dan legitimidad a las vigentes recomendaciones de las guías de práctica clínica en cuanto a que no es necesario implantar DAI al conjunto de pacientes con FV en el contexto de un SCA para prevenir un eventual riesgo de futura muerte súbita cardiaca11. Por otro lado, nuestro hallazgo con respecto al mayor riesgo de FV precoz en el IAMCEST anterior enfatiza la importancia de la monitorización electrocardiográfica durante la fase hospitalaria en el subgrupo de alto riesgo de FV precoz. Las directrices actuales dictan monitorizar a los pacientes con IAM al menos durante las primeras 24 h, con extensión de ese periodo hasta 72 h para los pacientes en alto riesgo de arritmias complejas18,19.
LimitacionesNuestro estudio es retrospectivo, con las limitaciones inherentes a este tipo de trabajos. Aunque se incluyó únicamente a pacientes dados de alta de nuestro servicio, tenida en cuenta la política local de atención al SCA en nuestro centro, es de esperar que muy pocos pacientes hubiesen ingresado en otros servicios, por lo que es poco probable que este hecho tenga repercusión relevante en los resultados. A pesar de que el diagnóstico de FV se realizó en presencia de trazados y contextos clínicos compatibles, debido al carácter retrospectivo del estudio, pudo haber casos diagnosticados incorrectamente, aunque esta posibilidad resulta muy remota debido a que los diagnósticos los hicieron cardiólogos y que eran diagnósticos definitivos que se pudo someter incluso al criterio de más de un cardiólogo (a lo largo de la hospitalización), y dicho diagnóstico se mantuvo al alta. Además, en un 28% de los pacientes, no se ha podido concretar las causas de muerte. Tampoco se pudo recolectar la información sobre el estado vital de un 3%. Por otra parte, la ausencia de información sobre la FEVI de algunos pacientes es otra limitación de nuestro estudio. Destaca, sin embargo, que la estimación de la FEVI en nuestro estudio se realizó precozmente (durante la hospitalización), por lo que su efecto en las evaluaciones realizadas puede ser engañoso. Debido al muy bajo número de muertes súbitas entre los pacientes con FV, no se ha podido realizar un análisis estratificado por subgrupos de FV precoz frente a tardía.
Por último, por desgracia, no fue posible el análisis individualizado de las taquicardias ventriculares sostenidas, por lo que nuestros hallazgos deben interpretarse con ese contexto y ser confirmados en otros estudios que consideren preferiblemente el análisis diferencial e individualizado de ambas arritmias (FV y taquicardia ventricular sostenida). Recientemente se ha observado que, en pacientes con IAM, la taquicardia ventricular sola o taquicardia ventricular/FV no se asoció a mayor riesgo de muerte durante 5 años de seguimiento10. Además, hay que resaltar que la FV se desencadena más frecuentemente por isquemia miocárdica aguda20, mientras que la taquicardia ventricular, por lo general, implica un sustrato estructural21,22. El hecho de haber tenido en cuenta en el análisis mutivariable de supervivencia varios factores asociados habitualmente a sustrato estructural reduce, al menos parcialmente, el efecto de la limitación previa de nuestro estudio.
CONCLUSIONESEn esta cohorte contemporánea de pacientes con SCA, la FV en la fase aguda es relativamente infrecuente, se presenta sobre todo en las primeras horas del evento y se asocia a una mortalidad hospitalaria muy elevada. Sin embargo, la FV en esos pacientes no supone un aumento de riesgo de muerte total o muerte súbita cardiaca más allá de la fase hospitalaria. Este hallazgo refuerza las vigentes indicaciones y recomendaciones de las guías de práctica clínica con respecto a la necesidad de recomendar implante de DAI en esos pacientes para prevenir un riesgo eventual de FV recurrente, ya sea en el escenario de un nuevo SCA o en el curso crónico evolutivo de la enfermedad coronaria.
CONFLICTO DE INTERESESNinguno.
A todo el personal sanitario y no sanitario del Servicio de Cardiología del Hospital Clínico Universitario de Santiago de Compostela, por su sensacional trabajo clínico y su implicación en la búsqueda de la excelencia asistencial. Queremos expresar nuestro especial agradecimiento a Isabel Arufe y Belén Outes, enfermeras de la UCC que participaron en el presente trabajo.