TBX1 es un factor de transcripción importante en el desarrollo embrionario del corazón. Se desconoce su implicación en el remodelado miocárdico tras infarto agudo de miocardio (IAM) y si es modulable por una terapia con beneficio demostrado como es el bloqueo del receptor mineralocorticoideo.
MétodosSe sometió a IAM a 60 ratas mediante ligadura de la coronaria izquierda: 50 animales fueron aleatorizados a ser sacrificados pasadas 1, 2, 4, 12 o 24 semanas; 10 animales se trataron con eplerenona (100 mg/kg/día) 7 días antes del IAM, hasta su sacrificio (4 semanas después); 8 animales se sometieron a cirugía sin ligadura (control). Se analizó la expresión cardiaca de TBX1, genes fetales y marcadores de fibrosis.
ResultadosLa expresión génica y proteica de TBX1 se incrementó en el miocardio infartado, con pico de expresión 1 semana tras el IAM (p < 0,01), sin variar en el miocardio no infartado. Los genes fetales y los marcadores de fibrosis también aumentaron, con expresión máxima 4 semanas (p < 0,001) y 1 semana (p < 0,01) tras el IAM respectivamente. La expresión de TBX1 se correlacionó con la de los marcadores de fibrosis (p < 0,01), pero no con los genes fetales. La eplerenona redujo el incremento de TBX1 y la fibrosis inducida tras IAM, que se asociaron con una mejora de función y remodelado ventricular por ecocardiografía.
ConclusionesEstos resultados muestran la reactivación de la expresión de TBX1 e indican su implicación en la fibrosis y el remodelado cardiacos tras el IAM y que puede participar en el beneficio del bloqueo mineralocorticoideo.
Palabras clave
La proteína T-box 1 (TBX1) pertenece a la familia de factores de transcripción cuyos miembros comparten un dominio de unión al ADN conocido como caja T1. Su principal función es regular la proliferación y la diferenciación celular durante la organogénesis de varios tejidos, incluido el corazón. En humanos actúa activando la proliferación de las células precursoras mesenquimales que contribuyen a la formación del tracto de salida del miocardio y la elongación del tubo cardiaco en el polo anterior2,3. Estudios experimentales en ratones han demostrado asociación entre la depleción del gen Tbx1 y un incremento de susceptibilidad a enfermedad cardiaca congénita4. Aparte de su importancia en el desarrollo embrionario, a día de hoy no se ha descrito ninguna función de TBX1 en el corazón adulto.
Durante el desarrollo embrionario, el corazón está expuesto a un entorno pobre en oxígeno que hace del metabolismo anaeróbico y los hidratos de carbono la principal fuente energética. Tras el nacimiento se produce un cambio a la oxidación de los ácidos grasos, que es posible gracias a un cambio en la expresión de los genes encargados5. En el infarto agudo de miocardio (IAM), el corazón es sometido a hipoxia, estrés metabólico y hemodinámico, a lo que responde con la reactivación del programa de genes fetales que conducen a la reactivación de la expresión de las isoformas encargadas del metabolismo anaerobio, así como de la hipertrofia y el remodelado cardiaco, cuyo objetivo es mantener la capacidad contráctil del corazón infartado. Tras el infarto, el remodelado adverso tisular se manifiesta morfológicamente por dilatación progresiva del ventrículo izquierdo y reducción de la fracción de eyección del ventrículo izquierdo (FEVI), factores asociados a un peor pronóstico clínico. Dadas las similitudes del metabolismo embrionario y tras el infarto, el TBX1 podría tener un papel en la respuesta miocárdica al infarto y participar en los fenómenos de reparación, remodelado y pérdida de contractilidad, lo que a su vez puede tener implicaciones terapéuticas.
A lo largo de estos años, diversos fármacos han mostrado beneficio clínico en pacientes infartados, entre los cuales los bloqueadores del receptor mineralocorticoideo se ha asociado no solo a menor mortalidad, sino también a menos fibrosis y remodelado ventricular adverso6,7. La posible modulación del TBX1 por fármacos representa una cuestión de interés por cuanto apoyaría su implicación en el remodelado tras el IAM y su uso como diana terapéutica.
El presente estudio evalúa la expresión del gen fetal Tbx1 en corazones adultos sometidos a IAM y su relación con la fibrosis, proceso implicado en el remodelado cardiaco tras el IAM, así como su posible modulación por eplerenona, un fármaco que ha demostrado beneficio clínico tras infarto y menor fibrosis miocárdica8.
MÉTODOSEl estudio fue aprobado por el Comité Ético de la Universidad de Murcia (código A13150105). La descripción detallada de los materiales y métodos se puede consultar en el material suplementario.
Diseño experimentalEl IAM se realizó en ratas Wistar. Sesenta animales fueron sometidos a ligación permanente de la arteria coronaria descendente anterior izquierda; 50 animales (10 ratas por grupo) se asignaron aleatoriamente a los siguientes grupos según la fecha de sacrificio: 1, 2, 4, 12 o 24 semanas tras el IAM. Diez animales se trataron por vía oral (mezclado en la comida) con un antagonista de aldosterona (eplerenona, 100 mg/kg/día). El tratamiento con eplerenona se inició 7 días antes del IAM para asegurar su efecto en el periodo inmediato tras el IAM y se mantuvo hasta el sacrificio de los animales (4 semanas tras el IAM). La dosis se ajustó semanalmente según el peso de cada animal. Además, 8 animales se sometieron al mismo procedimiento experimental sin ligar la coronaria (grupo control), a los que se sacrificó a las 4 semanas tras el IAM. La mortalidad en las 24 h posteriores a la inducción del infarto fue del 29% de los animales no tratados y el 25% de los pretratados con eplerenona. No hubo mortalidad en el grupo control y ningún animal murió pasadas 24 h del IAM. En todos los animales, el remodelado adverso se evaluó en términos de dimensiones y contractilidad mediante un estudio ecocardiográfico completo basal, 24 h antes de la cirugía y en el seguimiento el día previo al sacrificio, como se describe en el material suplementario. Realizó dicho estudio un operador cualificado y experimentado (M.J. Fernández-Del Palacio), que tenía enmascarado el grupo de tratamiento con eplerenona. Al sacrificio, se separaron las áreas infartada y no infartada del miocardio del ventrículo izquierdo y se almacenaron a –80°C para su posterior análisis. Un fragmento de miocardio infartado se fijó en formalina tamponada al 10% y se incluyó en bloques de parafina para posteriores estudios histológicos.
Extracción de ácido ribonucleico y reacción en cadena de la polimerasa en tiempo real cuantitativaPara el aislamiento del ARN, la retrotranscripción a ADN complementario y la reacción en cadena de la polimerasa en tiempo real, se emplearon kits comerciales (material suplementario). Los cebadores se describen en la tabla S1 del material suplementario.
Análisis por transferencia WesternLa expresión proteica de TBX1 se evaluó mediante análisis por transferencia Western: se separaron 40 μg de extracto proteico mediante electroforesis SDS-PAGE y se transfirieron a membranas de PVDF. Se empleó el anticuerpo primario anti-TBX1 (ab109313, Abcam; Cambridge, Massachusetts, Estados Unidos) y el secundario, contra inmunoglobulina G de conejo conjugado con peroxidada (W4011; Promega, Madison, Wisconsin, Estados Unidos). Los resultados de expresión de TBX1 se normalizaron respecto a proteína total de carga y se expresaron referidos al grupo control.
Análisis histológicoSe realizaron cuatro cortes de 5 μm de cada bloque de parafina, que se tiñeron con tricrómico de Masson siguiendo el protocolo estándar. Se obtuvieron imágenes de alta resolución de los cortes teñidos mediante el escáner Leica SN400F (Leica Microsystems Inc.; Buffalo Grove, Illinois, Estados Unidos). La fracción del volumen de colágeno se calculó con el programa Leica Qwin Pro V3.4.0 (Leica Microsystems, Ltd.; Suiza) en imágenes a 40 aumentos como la media aritmética de todos los cortes y se expresó como la relación entre el área de colágeno teñida por el tricrómico de Masson y el área total del miocardio.
Análisis estadísticoLos datos se expresan como media ± error estándar o media ± desviación estándar y se analizaron estadísticamente mediante el programa SPSS 19 (SPSS, Inc.; Estados Unidos). Según el tipo de variable, se realizaron pruebas de la t de Student o de la U de Mann-Whitney. El análisis de correlación se realizó excluyendo los animales pertenecientes al grupo control. Las gráficas se realizaron mediante el programa SigmaPlot 11.0. Se ha asumido significación estadística con valores de p < 0,05.
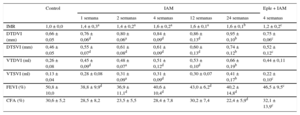
RESULTADOSAnálisis ecocardiográfico de la evolución del infarto agudo de miocardioLos resultados del análisis ecocardiográfico realizado se muestran en la tabla 1. Los animales sometidos a IAM mostraron, desde la semana 1 tras el IAM, disminución de la función sistólica e incremento de remodelado estructural adverso con el tiempo: valores menores de la FEVI e incremento del índice de motilidad, así como de los volúmenes y diámetros telediastólicos y telesistólicos.
Análisis descriptivo de las características ecocardiográficas de los diferentes grupos de animales
| Control | IAM | Eple + IAM | |||||
|---|---|---|---|---|---|---|---|
| 1 semana | 2 semanas | 4 semanas | 12 semanas | 24 semanas | 4 semanas | ||
| IMR | 1,0 ± 0,0 | 1,4 ± 0,3a | 1,4 ± 0,2a | 1,6 ± 0,2a | 1,6 ± 0,1a | 1,6 ± 0,1b | 1,2 ± 0,2c |
| DTDVI (mm) | 0,66 ± 0,05 | 0,76 ± 0,06d | 0,80 ± 0,06a | 0,84 ± 0,09d | 0,86 ± 0,13d | 0,95 ± 0,10b | 0,75 ± 0,06c |
| DTSVI (mm) | 0,46 ± 0,05 | 0,55 ± 0,07d | 0,61 ± 0,08d | 0,61 ± 0,09d | 0,60 ± 0,13d | 0,74 ± 0,12b | 0,52 ± 0,12c |
| VTDVI (ml) | 0,26 ± 0,08 | 0,45 ± 0,09d | 0,48 ± 0,07a | 0,51 ± 0,12d | 0,53 ± 0,10d | 0,66 ± 0,19b | 0,44 ± 0,11 |
| VTSVI (ml) | 0,13 ± 0,04 | 0,28 ± 0,08 | 0,31 ± 0,09a | 0,31 ± 0,09d | 0,30 ± 0,07 | 0,41 ± 0,17b | 0,22 ± 0,10c |
| FEVI (%) | 50,8 ± 10,0 | 38,8 ± 9,9d | 36,9 ± 11,1d | 40,6 ± 10,4d | 43,0 ± 6,2d | 40,2 ± 14,8d | 46,5 ± 9,5c |
| CFA (%) | 30,6 ± 5,2 | 28,5 ± 8,2 | 23,5 ± 5,5 | 28,4 ± 7,8 | 30,2 ± 7,4 | 22,4 ± 5,9d | 32,1 ± 13,9c |
CFA: cambio fraccional del área; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; Eple: eplerenona; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IMR: índice de motilidad regional; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los valores expresan media ± desviación estándar.
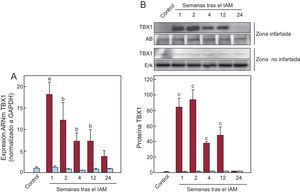
La medida de la expresión de Tbx1 en el tejido cardiaco (figura 1), mediante la reacción en cadena de la polimerasa a tiempo real cuantitativa y transferencia Western, mostró que la concentración de ARNm de TBX1 en la zona infartada se incrementó significativamente desde la primera semana tras el IAM y se mantuvo elevada respecto al grupo control hasta las 24 semanas tras el IAM (figura 1A). La expresión máxima se obtuvo 1 semana tras el IAM. El incremento de la expresión génica de Tbx1 se correspondió con un incremento de la concentración proteica de TBX1 en la zona infartada respecto al grupo control (figura 1B). El análisis de la expresión de TBX1 en la zona no infartada no mostró cambios significativos en ninguno de los grupos de animales infartados respecto al control, ni en la expresión génica ni en la expresión proteica.
Expresión cardiaca de TBX1 tras IAM. A: expresión de ARNm de TBX1 en el miocardio infartado (barras granates) y no infartado (barras azules); datos normalizados respecto a GAPDH y referidos al control. B: imágenes representativas de transferencia Western y análisis densitométrico de la expresión proteica de TBX1 en el miocardio infartado (barras granates) y no infartado (barras azules); datos referidos al control y normalizados respecto a proteína total de carga: tinción con AB para área infartada y Erk para área no infartada. AB: amido black; ARNm: ácido ribonucleico mensajero; Erk: cinasa regulada por señales extracelulares; GAPDH: gliceraldehído 3 fosfato deshidrogenasa; IAM: infarto agudo de miocardio; TBX1: proteína T-box 1. ap < 0,01 frente a control. bp < 0,05 frente a control. cp < 0,001 frente a control. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
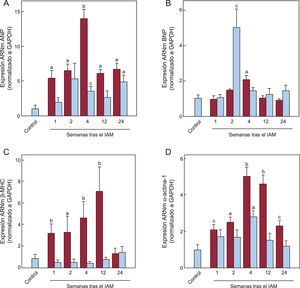
La figura 2 muestra el estudio de expresión de genes fetales en el miocardio infartado y no infartado, determinando las concentraciones de ARNm del péptido natriurético auricular (ANP), el péptido natriurético cerebral (BNP), la isoforma beta de la cadena pesada de miosina (β-MHC) y α-actina 1. Las cinéticas de ANP, β-MHC y alfaactina 1 en el miocardio infartado mostraron un comportamiento similar, con incrementos significativos desde la primera semana tras el IAM y expresión máxima observada 4 o 12 semanas tras el IAM. La expresión de BNP solo se vio incrementada significativamente respecto al grupo control a las 4 semanas del IAM. En el miocardio no infartado se produjo incremento significativo de ANP y alfaactina 1 a las 4 semanas del IAM, mientras que el BNP se incrementó a las 2 semanas. No hubo incremento de expresión de ARNm de β-MHC. El análisis de correlación no mostró ningún tipo de asociación entre la expresión de TBX1 y los demás genes fetales analizados, ni en el miocardio infartado (tabla 2) ni en el no infartado (tabla S2 del material suplementario). Sin embargo, la expresión de ANP, BNP, β-MHC y alfaactina 1 mostró correlación significativa entre sí en el miocardio infartado (ANP frente a BNP, r = 0,642; p < 0,001; ANP frente a alfaactina 1, r = 0,634; p < 0,001; BNP frente a alfaactina 1, r = 0,392; p = 0,012; β-MHC frente a alfaactina 1, r = 0,483; p = 0,001) y cierta correlación en el miocardio no infartado (ANP frente a BNP, r = 0,49; p = 0,002; ANP frente a β-MHC, r = 0,333; p = 0,04).
Expresión cardiaca de genes fetales tras IAM. Expresión de ARNm de ANP (A), BNP (B), β-MHC (C) y α-actina 1 (D) en el miocardio infartado (barras granates) y no infartado (barras azules). Datos normalizados respecto a GAPDH y referidos al control. ANP: péptido natriurético auricular; ARNm: ácido ribonucleico mensajero; β-MHC: cadena pesada de la miosina isoforma beta; BNP: péptido natriurético cerebral; GAPDH: gliceraldehído 3 fosfato deshidrogenasa; IAM: infarto agudo de miocardio. ap < 0,01 frente a control. bp < 0,001 frente a control. cp < 0,05 frente a control. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
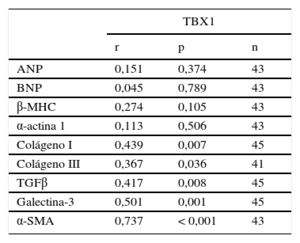
Análisis de correlación entre los niveles de expresión de ARNm de TBX1 y la expresión de genes fetales y marcadores de fibrosis en el miocardio infartado
| TBX1 | |||
|---|---|---|---|
| r | p | n | |
| ANP | 0,151 | 0,374 | 43 |
| BNP | 0,045 | 0,789 | 43 |
| β-MHC | 0,274 | 0,105 | 43 |
| α-actina 1 | 0,113 | 0,506 | 43 |
| Colágeno I | 0,439 | 0,007 | 45 |
| Colágeno III | 0,367 | 0,036 | 41 |
| TGFβ | 0,417 | 0,008 | 45 |
| Galectina-3 | 0,501 | 0,001 | 45 |
| α-SMA | 0,737 | < 0,001 | 43 |
α-SMA: actina alfa de músculo liso; ANP: péptido natriurético auricular; β-MHC: cadena pesada de la miosina isoforma beta; BNP: péptido natriurético cerebral; TBX1: proteína T-box 1; TGFβ: factor de crecimiento transformador beta.
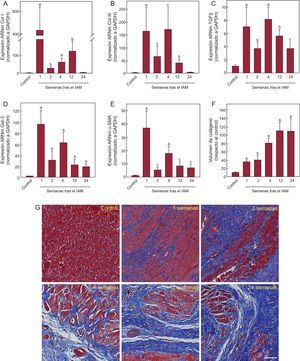
Los marcadores de fibrosis analizados mostraron niveles de expresión significativamente incrementados respecto al grupo control (figura 3). Todos los marcadores mostraron un incremento de expresión significativo desde la semana 1 tras el IAM, con máximos entre las semanas 1 y 4 y una reducción progresiva en las semanas 12 y 24. El incremento de la expresión génica de marcadores de fibrosis derivó en el incremento progresivo de fibrosis intersticial en el miocardio infartado, como muestra el análisis histológico (figura 3F). El depósito de colágeno fue evidente desde la primera semana tras el IAM y se fue acumulando hasta reemplazar por completo el músculo cardiaco. El análisis mostró correlación significativa entre la expresión de TBX1 en el miocardio infartado y la de cada uno de los marcadores de fibrosis analizados (tabla 2). Los marcadores de fibrosis mostraron correlación significativa entre ellos (tabla S3 del material suplementario).
Análisis de la fibrosis cardiaca tras IAM. Expresión de ARNm de colágeno I (A), colágeno III (B), TGFβ (C), Gal-3 (D) y α-SMA (E). Datos normalizados respecto a GAPDH y referidos al control. Mediante tinción por tricrómico de Masson, se determinó el volumen de colágeno en el miocardio infartado (F). Fotomicrografías (40×) representativas y análisis cuantitativo de la fibrosis intersticial expresada como fracción de volumen de colágeno (G). α-SMA: actina alfa de músculo liso; ARNm: ácido ribonucleico mensajero; Col I: colágeno I; Col III: colágeno III; Gal-3: galectina-3; GAPDH: gliceraldehído 3 fosfato deshidrogenasa; IAM: infarto agudo de miocardio; TGFβ: factor de crecimiento transformador beta. ap < 0,001 frente a control. bp < 0,01 frente a control. cp < 0,05 frente a control.
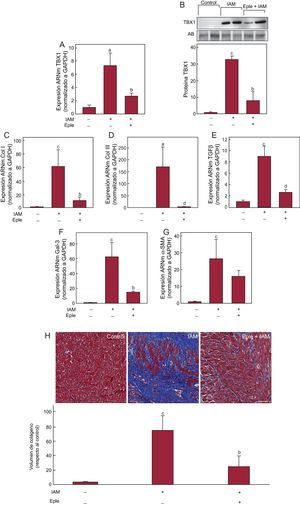
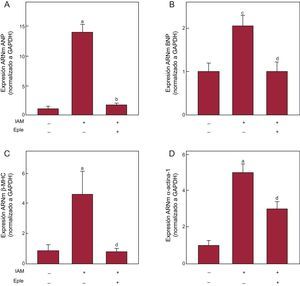
El análisis ecocardiográfico mostró menor remodelado adverso tras el IAM en los animales infartados y tratados con eplerenona respecto a los infartados que no recibieron tratamiento, sin alcanzar los valores característicos del grupo control (tabla 1). La administración de eplerenona bloqueó significativamente el incremento de expresión de TBX1 inducido por el IAM (figura 4), tanto de ARNm (figura 4A) como proteica (figura 4B). El tratamiento con eplerenona redujo la expresión de los marcadores de fibrosis en el miocardio infartado respecto a los animales infartados que no recibieron este tratamiento (figuras 4C-G). Esta reducción de la expresión de marcadores de fibrosis se reflejó en una disminución significativa del depósito de colágeno en los animales tratados con eplerenona en comparación con los animales sin tratamiento (figura 4H). Del mismo modo, el tratamiento con eplerenona bloqueó el incremento de expresión de los genes fetales inducido tras el infarto (figura 5).
Efecto de eplerenona en la expresión de TBX1 y fibrosis cardiaca inducida tras IAM. A: expresión de ARNm de TBX1 en el miocardio infartado de ratas sometidas a IAM durante 4 semanas, con o sin tratamiento previo con eplerenona. B: imágenes representativas de la transferencia Western y análisis densitométrico de la expresión proteica de TBX1 en el miocardio infartado. C-G: análisis de la expresión de ARNm de colágeno I, colágeno III, TGFβ, Gal-3 y α-SMA. H: fotomicrografías (40×) representativas y análisis cuantitativo de la fibrosis intersticial expresada como fracción de volumen de colágeno. α-SMA: actina alfa de músculo liso; AB: amido black; ARNm: ácido ribonucleico mensajero; Col I: colágeno I; Col III: colágeno III; Eple: eplerenona; Gal-3, galectina-3; GAPDH: gliceraldehído 3 fosfato deshidrogenasa; IAM: infarto agudo de miocardio; TBX1: proteína T-box 1; TGFβ: factor de crecimiento transformador beta. Datos de expresión de ARN normalizados respecto a GAPDH y los de expresión proteica normalizados respecto a proteína total de carga mediante tinción con AB. Datos referidos al control. ap < 0,05 frente a grupo control. bp < 0,05 frente a grupo IAM. cp < 0,001 frente a grupo control. dp < 0,01 frente a grupo IAM.
Efecto de eplerenona en la expresión de genes fetales tras IAM. Análisis de ARNm de ANP (A), BNP (B), β-MHC (C) y α-actina 1 (D) en el miocardio infartado de ratas sometidas a IAM durante 4 semanas, con o sin tratamiento previo con eplerenona. ANP: péptido natriurético auricular; ARNm: ARNm: ácido ribonucleico mensajero; β-MHC: cadena pesada de la misosina isoforma beta; BNP: péptido natriurético cerebral; Eple: eplerenona; GAPDH: gliceraldehído 3 fosfato deshidrogenasa; IAM: infarto agudo de miocardio. Datos normalizados respecto a GAPDH y referidos al control. ap < 0,001 frente a control. bp < 0,001 frente a grupo IAM. cp < 0,01 frente a control. dp < 0,01 frente a grupo IAM.
Los hallazgos de este estudio han demostrado que TBX1, un factor de trascripción que participa en el desarrollo embrionario del corazón, reactiva su expresión cardiaca ante una situación de estrés como es el IAM. Esta reactivación parece estar asociada a su participación en el remodelado cardiaco, ya que su expresión en el tejido infartado se correlacionó positivamente con la de marcadores de fibrosis en las semanas posteriores al infarto. Además, los resultados indican cierto valor del TBX1 como diana terapéutica, dado que el tratamiento con eplerenona se asoció a menor expresión tanto de TBX1 como de fibrosis asociados al IAM. Desde nuestro conocimiento, es la primera vez que un estudio asocia el factor de transcripción TBX1 con una función en corazón adulto y con la fisiopatología del IAM.
TBX1 y la reactivación de genes fetales tras el infarto agudo de miocardioTras el IAM, el corazón sufre una serie de respuestas celulares y moleculares que, en conjunto, se denominan remodelado cardiaco, con efectos compensatorios iniciales pero que en su evolución puede derivar a un corazón insuficiente. Un sello distintivo del remodelado posterior al IAM es la reactivación del programa de genes fetales, como consecuencia de una respuesta neurohormonal alterada y del estrés hemodinámico y metabólico al cual es sometido el corazón infartado9. Entre los cambios característicos están el remodelado de la maquinaria contráctil del cardiomiocito, con incremento de expresión de proteínas sarcoméricas (miosinas de cadena pesada y alfaactinas), cambios en el metabolismo energético y la producción incrementada de péptidos natriuréticos (ANP y BNP)10,11. Estos cambios tienen como objetivo inicial mantener la capacidad contráctil y la eficiencia del tejido cardiaco, pero al prolongarse originan un remodelado patológico con dilatación ventricular e insuficiencia cardiaca.
Tal y como muestra el presente estudio, tras el IAM se produjo la reactivación de la expresión de genes fetales evidenciada por el incremento del ARNm de β-MHC, alfaactina 1, ANP y BNP en el miocardio infartado. Esta modulación fue menos evidente en el miocardio no infartado. Actualmente se conocen algunos factores de transcripción implicados en la reactivación de estos genes fetales ante una situación de estrés en el corazón adulto, como Nkx2.5, MEF2, GATA4 y SRF5,12,13. Estos factores de transcripción participan en el desarrollo embrionario del corazón y reactivan su expresión en el corazón infartado para desencadenar la remodelación estructural del miocardio. Nuestros resultados muestran por primera vez que el factor de transcripción TBX1 incrementa su expresión en el corazón adulto desde una fase inicial tras el IAM. En nuestro estudio, el incremento de TBX1 no se correlacionó con la expresión de ninguno de los genes fetales evaluados y ya conocidos, lo que indica que TBX1 no tiene una implicación directa en la expresión de los genes encargados de la sarcomerogénesis (β-MHC y alfaactina 1) y los péptidos natriuréticos (ANP, BNP).
TBX1 y su relación con la fibrosis inducida tras el infarto agudo de miocardioEl remodelado cardiaco tras el IAM está mediado por un gran número de citocinas liberadas por cardiomiocitos, fibroblastos, células endoteliales y células inflamatorias14. El factor de crecimiento transformador beta (TGFβ) y la lectina galectina-3 son 2 moléculas esenciales en la inducción de la fibrosis cardiaca tras el IAM15,16. Ambas son capaces de unirse a receptores presentes en los fibroblastos cardiacos y, a través de la señalización mediada por p-Smad2/3, convertir los fibroblastos intersticiales en miofibroblastos, encargados de la síntesis de colágeno y de su depósito extracelular para la formación de la cicatriz miocárdica y la extensión del IAM. Nuestros resultados muestran que el incremento de ARNm de colágenos I y III se produce desde la primera semana tras el IAM y que su depósito valorado por volumen aumenta progresivamente, lo que facilita la formación de la cicatriz. Como era de esperar, el incremento de ARNm de colágenos I y III se correlacionó con la expresión de TGFβ y galectina-3, moléculas implicadas en la activación de los fibroblastos, y con la expresión de alfaactina de músculo liso, un marcador molecular de miofibroblastos activados (tabla S3 del material suplementario). Lo que resulta interesante es comprobar que la expresión de TBX1 se correlacionó positivamente con la expresión de colágeno y de las moléculas encargadas de activar la respuesta fibrótica. Esta correlación positiva indica un efecto modulador del factor de transcripción TBX1 en los genes implicados en activar la fibrosis tras el IAM. Esta hipótesis se ve reforzada por un estudio reciente en el que las ratas sometidas a daño agudo renal inducido por gentamicina mostraron aumento de TBX1 y activación de la señalización Smad2/3 por TGFβ17. Por el contrario, células renales NRK deficientes en TBX1 mostraron valores de TGFβ disminuidos y menor activación de la señalización Smad2/3. La señalización TGFβ/Smad tiene un papel principal en la inducción de la fibrosis tras el IAM18. En conjunto con estos hallazgos, nuestros resultados concuerdan en indicar que el incremento de TBX1 en el área infartada podría tener un papel en la activación del fibroblasto cardiaco y la activación transcripcional de los genes encargados de la fibrosis cardiaca tras el IAM.
TBX1: potencial diana terapéutica en el infarto agudo de miocardioEl remodelado tras el IAM contribuye significativamente a la insuficiencia cardiaca y la muerte, a través de la dilatación y la disfunción sistólica del ventrículo izquierdo y la arritmogénesis ventricular. La fibrosis cardiaca se reconoce como parte importante de la patogenia de este remodelado desfavorable y su inhibición se traduce en una mejora de la función cardiaca19. Se ha demostrado que el bloqueo del receptor mineralocorticoideo (espironolactona y eplerenona) mejora el pronóstico de los pacientes con insuficiencia cardiaca sistólica6,20,21. En pacientes con IAM asociado a FEVI < 35%, la administración de eplerenona mejora la supervivencia y reduce la muerte súbita y la progresión a insuficiencia cardiaca6,22. En concordancia, el beneficio de estos fármacos se ha puesto en relación con su capacidad para reducir la fibrosis miocárdica, al ser capaces de bloquear el incremento de colágeno inducido por aldosterona7,8,23. Numerosos estudios experimentales han demostrado el beneficio a largo plazo de las terapias antifibróticas, al disminuir la dilatación y la disfunción sistólica7,24,25. En nuestro estudio, el tratamiento con eplerenona atenuó el incremento de TBX1 inducido tras el IAM, disminuyó la expresión de marcadores de fibrosis y mostró recuperación de la función cardiaca en ecocardiografía. Los mecanismos moleculares que explican este efecto antifibrótico de los antagonistas de aldosterona no son bien conocidos. Se ha apuntado que este efecto puede estar mediado por diferentes sistemas de respuesta intracelular como la señalización vía galectina-3, el sistema IL-33/ST2, la señalización TGF/Smad o la respuesta inflamatoria. Actualmente no hay evidencia que relacione TBX1 con el receptor mineralocorticoideo. Sin embargo, nuestro estudio indica que la inhibición de la expresión del factor de transcripción TBX1 es un mecanismo implicado en el efecto antifibrótico de eplerenona en el tratamiento del IAM. Por lo tanto, TBX1 podría ser una diana terapéutica para evitar el remodelado cardiaco adverso tras el IAM.
LimitacionesLa observación del papel mediador del factor de transcripción TBX1 en la fibrosis tras el IAM se sustenta en resultados obtenidos del análisis de correlación de valores de niveles de expresión de ARNm, sin evaluar la asociación de expresión proteica. Para confirmar la implicación de TBX1 en la fibrosis posterior al IAM y descartar su participación en la reactivación de los genes fetales encargados de la síntesis de proteínas sarcoméricas y péptidos natriuréticos, son necesarios nuevos estudios experimentales que evalúen los efectos de la intervención génica de TBX1 (silenciamiento o sobrexpresión del gen Tbx1) en el proceso de fibrosis y remodelado. La dosis de eplerenona (100 mg/kg/día), habitual en estudios experimentales con animales, es superior a la empleada en clínica, lo que podría suponer una limitación a la hora de trasladar los resultados obtenidos.
CONCLUSIONESEste estudio ha permitido caracterizar la modulación espaciotemporal de TBX1 en el tejido cardiaco tras un IAM. TBX1 incrementa su expresión en el miocardio infartado desde la fase inicial tras el IAM y se mantiene elevado. Esta modulación se correlaciona con la cinética de activación génica de los diferentes marcadores de fibrosis analizados, lo que propone al factor de transcripción TBX1 como una nueva diana terapéutica para proteger al corazón infartado y disminuir la fibrosis y el remodelado adverso. En este sentido, el antagonista de aldosterona eplerenona bloqueó la reactivación de la expresión de TBX1 a la vez que redujo la respuesta profibrótica, lo que se asoció a una mejor función cardiaca. La reactivación de TBX1 en el infarto y su regulación por eplerenona indican la necesidad de nuevos estudios dirigidos a identificar el mecanismo de reactivación de TBX1 tras el infarto y su importancia como diana terapéutica en los procesos de remodelado.
FINANCIACIÓNEste trabajo ha sido financiado por la Fundación Séneca-Agencia de Ciencia y Tecnología de la Región de Murcia (19334/PI/14), el Instituto de Salud Carlos III, Madrid (PI14/01637), y la Red de Investigación Cardiovascular (RIC), Ministerio de Sanidad y Consumo, Madrid, España (RD12/0042/0049).
CONFLICTO DE INTERESESNinguno.
- –
El factor de transcripción TBX1 participa en el desarrollo embrionario del corazón y su expresión deja de producirse en el corazón adulto. Aunque no se ha descrito ninguna función en corazones adultos, recientemente se ha asociado un papel fibrótico de TBX1 en modelos animales de daño renal. Al igual que otros genes fetales, TBX1 podría reactivar su expresión tras el infarto de miocardio y ejercer un papel en la fisiopatología del infarto.
- –
Nuestro estudio ha evaluado por primera vez la modulación de TBX1 en corazones de animales adultos sometidos a infarto de miocardio. Tras el infarto, se produce una reactivación de la expresión de TBX1 en la zona infartada, la cual parece estar asociada a la respuesta fibrótica tras el infarto. El tratamiento con eplerenona, un antagonista de aldosterona, bloqueó la reactivación de la expresión de TBX1, a la vez que redujo la respuesta profibrótica y mejoró la función cardiaca. Estos resultados proponen al TBX1 como una nueva diana terapéutica para proteger al corazón infartado.