La distensión de la región isquémica se ha relacionado con una mayor incidencia de arritmias ventriculares espontáneas tras la oclusión coronaria. Analizamos si la distensión isquémica regional predice una mayor inducibilidad de fibrilación ventricular tras la oclusión coronaria en cerdos.
MétodosEn 18 cerdos anestesiados con tórax abierto, se ocluyó la descendente anterior durante 60 min. Se monitorizó la longitud segmentaria en la región isquémica mediante cristales ultrasónicos. Se realizó estimulación programada basal, y después continuamente entre 10 y 60 min tras la oclusión.
ResultadosLa oclusión coronaria indujo un rápido aumento en la longitud telediastólica en la región isquémica, que alcanzó el 109,4±0,9% de los valores basales a los 10 min (p<0,001). Se completaron 6,6±0,5 protocolos de estimulación, que indujeron 5,4±0,6 episodios de fibrilación ventricular entre 10 y 60 min tras la oclusión. Ni los valores séricos de potasio ni el tamaño del área isquémica se asociaron significativamente con la inducibilidad de fibrilación ventricular. Por el contrario, el aumento en la longitud telediastólica 10 min tras la oclusión coronaria se asoció directamente (r=0,67; p=0,002) con el número de episodios inducidos de fibrilación ventricular e inversamente (r=–0,55; p=0,018) con el número de extraestímulos necesarios para inducir la arritmia.
ConclusionesLa distensión regional isquémica predice una mayor inducibilidad de fibrilación ventricular tras la oclusión coronaria. Estos resultados subrayan la influencia potencial de los factores mecánicos, que actúan no sólo sobre los desencadenantes, sino también sobre el sustrato, en la génesis de las arritmias ventriculares malignas durante la isquemia aguda.
Palabras clave
Las arritmias ventriculares malignas en el contexto de la isquemia miocárdica aguda constituyen una causa frecuente de muerte súbita y representan una importante carga para la salud pública1–4. Sin embargo, los mecanismos que subyacen a estas arritmias son complejos y no se conocen por completo1,2,5. En cambio, es bien sabido que la distensión del tejido miocárdico induce cambios electrofisiológicos y es un desencadenante de arritmias6–9. Dado que la oclusión coronaria aumenta rápidamente la tensión mecánica en la región isquémica y en la zona de frontera10–12, no resulta extraño que la posible influencia de las alteraciones mecánicas en la génesis de las arritmias ventriculares isquémicas haya atraído el interés de la investigación.
A este respecto, se ha descrito un aumento de la arritmogenicidad en la zona de frontera13,14, una región que está sometida a tensión mecánica durante la isquemia regional y también de forma asociada a la distensión ventricular izquierda espontánea15–17 o inducida13,18 tras una oclusión coronaria.
Los resultados de todos estos estudios respaldan la intervención de factores mecánicos en la génesis de las arritmias malignas isquémicas. Sin embargo, no está claro en qué medida estos factores podrían ejercer su posible influencia desencadenando extrasístoles ventriculares que inicien la arritmia, elevando la vulnerabilidad del sustrato o a través de ambos mecanismos. Para ayudar a esclarecer esta cuestión, el presente estudio tiene por objetivo determinar si la distensión de la región isquémica predice la inducibilidad de la fibrilación ventricular (FV) mediante la estimulación programada durante la isquemia regional en cerdos.
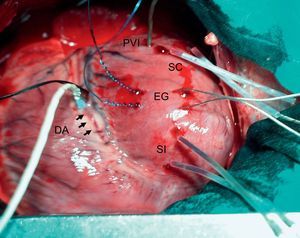
MÉTODOSPreparación de los animalesTras obtener la aprobación de la comisión de investigación del centro, y ateniéndonos a las recomendaciones de la American Physiological Society para la investigación de laboratorio con animales, se utilizaron 19 cerdos de granja de ambos sexos (40±1kg) que fueron premedicados con 10 mg/kg de azaperona por vía intramuscular y anestesiados con 30 mg/kg de tiopental sódico por vía intravenosa. Los animales fueron intubados y ventilados mecánicamente (respirador MA-1B, Bennett; Santa Monica, Californis, Estados Unidos) con aire ambiental. La anestesia se mantuvo con una infusión continua de tiopental. Se cateterizó percutáneamente una arteria femoral y una vena femoral, se practicó una esternotomía media y se abrió el pericardio. Se disecó la arteria descendente anterior izquierda (DA) en su segmento medio y se rodeó con una cinta elástica. Se colocó una sonda de flujo Doppler de 2 mm de anchura (Transonic Systems; Ithaca, Nueva York, Estados Unidos) adyacente a la cinta. Se introdujeron dos pares de cristales ultrasónicos de 1 mm de diámetro en el tercio interno de la pared ventricular izquierda. Los cristales se colocaron con una separación de aproximadamente 1 cm a lo largo de un plano perpendicular al eje longitudinal del ventrículo, un par en el miocardio en el que se iba a provocar la isquemia y el otro en la pared lateral. Se introdujo un catéter equipado con micromanómetro en la punta (Mikro-tip, Millar; Houston, Texas, Estados Unidos) en el ventrículo izquierdo a través de una pequeña incisión en su pared lateral. Con una separación de 5-10 mm, se implantaron dos electrodos de gancho en el miocardio a ambos lados de la zona de frontera prevista. En la figura 1 se presenta un ejemplo de la preparación experimental.
Preparación experimental. DA (y flechas): arteria coronaria descendente anterior izquierda, rodeada en su segmento medio por una cinta y un medidor de flujo; EG: electrodos de gancho utilizados para la estimulación ventricular; PVI: catéter equipado con un micromanómetro en la punta para las determinaciones de la presión ventricular izquierda; SC y SI: pares de cristales ultrasónicos introducidos en el miocardio en el segmento control y el segmento isquémico respectivamente.
Se aplicó una estimulación bipolar programada, tras alcanzar estabilidad hemodinámica mediante un estimulador UHS 20 (Biotronik; Berlín, Alemania) conectado a los electrodos de la zona de frontera. Tras una salva de estimulación de 8 × 600 ms, se aplicaron hasta tres extraestímulos con un intervalo S1-S2 inicial de 400 ms, que se redujo en pasos de 10 ms hasta la aparición de una FV o hasta alcanzar el periodo refractario efectivo. En este caso el intervalo S1-S2 se fijó en 30 ms por encima del periodo refractario efectivo, y el segundo y el tercer extraestímulo se aplicaron según el mismo procedimiento. Si se producía una FV, se desfibrilaba el corazón con descargas de 10-20 J. Después de completado este protocolo, se ocluyó la DA y se reinició la estimulación programada 10 min después de la oclusión coronaria, que se continuó durante todo el periodo isquémico dejando 3 min de recuperación tras cada desfibrilación. Si no se producía una FV, el intervalo hasta el siguiente intento se reducía a 2 min19. El intervalo de 10 min antes de iniciar la estimulación programada durante la isquemia se eligió para asegurar la máxima calidad de las determinaciones de la longitud segmentaria, puesto que permitía que se produjera una expansión telediastólica isquémica máxima10,11,15–17 y reducía al mínimo el riesgo de desplazamiento de los cristales ultrasónicos con las descargas de desfibrilación. Se excluyó del análisis a uno de los animales debido a una FV incesante inmediatamente después de la oclusión coronaria. Así pues, la serie constó de 18 experimentos válidos.
Monitorización del estudioSe obtuvieron determinaciones seriadas de la gasometría arterial con objeto de adaptar los parámetros del respirador. Se determinaron las concentraciones séricas de potasio en la situación basal. Se mantuvo monitorización continua de la presión aórtica. Las señales del segmento ultrasónico se analizaron con un sistema de dimensión ultrasónica (System 6/200, Triton Technology; San Diego, California, Estados Unidos) y se monitorizó con un osciloscopio (HM 205-3, Hameg; Frankfurt, Alemania). Estas señales, junto con la derivación II del electrocardiograma, la presión aórtica, el flujo sanguíneo de la DA y la presión ventricular izquierda y su primera derivada (dP/dt), se registraron de manera continua, se digitalizaron (ML795 PowerLab System, AD Instruments; Mountain View, California, Estados Unidos) y se almacenaron en el disco duro.
Se contó el número de extrasístoles ventriculares durante todo el periodo isquémico y se registró la aparición de una FV espontánea, así como el número total de episodios de FV inducidos y el número medio de extraestímulos aplicados para la inducción de la FV. Esta última variable se definió como la suma de los extraestímulos (1-3 por protocolo) aplicados en todos los protocolos de estimulación administrados a un animal durante la isquemia dividida por el número de episodios de FV inducidos en ese periodo.
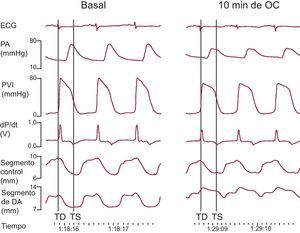
Determinaciones de longitud segmentaria y estudios post mortemSe realizaron determinaciones de la longitud segmentaria en los registros digitales de la forma descrita con anterioridad11,15–17. La telediástole se definió como el punto de inicio de la pendiente de ascenso rápido del trazado de dP/dt, y la telesístole se definió como el punto mínimo de la dP/dt (fig. 2). Las longitudes segmentarias telediastólica y telesistólica (LTD, LTS) —es decir, la distancia entre los dos cristales ultrasónicos de cada par en la telediástole y la telesístole respectivamente— y la longitud máxima del segmento se midieron en la situación basal y a los 5, 10, 15, 30, 45 y 60 min de la oclusión coronaria. El acortamiento sistólico (%) se calculó de la siguiente forma: (LTD – LTS) × 100/LTD. La LTD se expresó como porcentaje de los valores previos a la oclusión coronaria. El abombamiento sistólico durante el periodo isquémico (%) se calculó de la siguiente forma: (longitud máxima del segmento durante la sístole – LTD) × 100/LTD.
Ejemplo de monitorización electrocardiográfica, hemodinámica y de la longitud segmentaria en situación basal y 10 min después de la oclusión coronaria. DA: arteria coronaria descendente anterior izquierda; dP/dt: primera derivada de PVI; ECG: electrocardiograma; OC: oclusión coronaria; PA: presión arterial; PVI: presión ventricular izquierda; TD: telediástole; TS: telesístole.
A los 60 min tras la oclusión coronaria, se inyectaron 5 ml de fluoresceína al 10% en la aurícula izquierda y se extrajo el corazón para realizar cortes, que se pesaron y se fotografiaron bajo luz ultravioleta. Se midió el área en riesgo de forma semiautomática en las imágenes digitalizadas, utilizando un programa informático comercial (Microimage 3.0, Olympus Optical; Hamburgo, Alemania) y se calculó la masa de la región isquémica a partir de esas medidas y el peso de los cortes11,15–17.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS. Los datos se expresaron en forma de media±error estándar. Se utilizaron pruebas de la t de Student para datos apareados o análisis de la varianza para medidas repetidas en la evaluación de los cambios de las variables fisiológicas a lo largo de todo el experimento. La asociación entre LTD e inducibilidad de la FV se evaluó con un análisis de regresión simple. Los valores de p<0,05 se consideraron significativos.
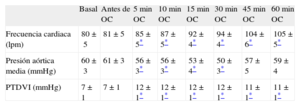
RESULTADOSDatos hemodinámicosLos datos hemodinámicos se resumen en la tabla 1. Los parámetros basales estaban dentro de los límites normales y no se modificaron con la estimulación ventricular antes de la isquemia (p=NS). La frecuencia cardiaca aumentó tras la oclusión coronaria (p=0,03) y se incrementó de manera progresiva durante el periodo isquémico (p=0,001). La presión aórtica media se redujo ligeramente tras la ligadura de la DA (p=0,003) y luego presentó modificaciones de carácter menor (p=0,04). La presión telediastólica ventricular izquierda aumentó tras la oclusión coronaria (p<0,001) y luego se mantuvo estable (p=NS). El flujo en la DA en la situación basal fue de 12±1 ml/min.
Datos hemodinámicos
| Basal | Antes de OC | 5min OC | 10min OC | 15min OC | 30min OC | 45min OC | 60min OC | |
| Frecuencia cardiaca (lpm) | 80±5 | 81±5 | 85±5* | 87±5* | 92±4* | 94±4* | 104±6* | 105±5* |
| Presión aórtica media (mmHg) | 60±3 | 61±3 | 56±3* | 56±3* | 53±4* | 50±3* | 57±5 | 59±4 |
| PTDVI (mmHg) | 7±1 | 7±1 | 12±1* | 12±1* | 12±1* | 12±1* | 11±1* | 11±1* |
OC: oclusión coronaria; PTDVI: presión telediastólica ventricular izquierda.
Los datos expresan media±error estándar.
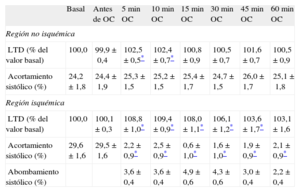
En la situación basal, el valor absoluto de la LTD fue en promedio 11,5±0,5 mm en la zona control y 13,4±0,8 mm en la región de la DA. Las determinaciones de la longitud segmentaria se resumen en la tabla 2. La LTD y el acortamiento sistólico no se modificaron con la estimulación ventricular antes de la isquemia (p=NS). En la zona control, la LTD presentó cambios ligeros, aunque significativos (p=0,02), durante todo el experimento, mientras que el acortamiento sistólico se mantuvo constante (p=NS). En la región de la DA, la LTD sufrió cambios significativos (p<0,001) consistentes en un aumento rápido (fig. 2) tras la ligadura coronaria (que a los 10 min era en promedio un 109,4±0,9% del valor previo a la isquemia; p<0,001) con cierta atenuación de este aumento al final del experimento. La oclusión coronaria produjo también la abolición inmediata del acortamiento sistólico (p<0,001) y la aparición de un abombamiento sistólico en la región de la DA.
Mediciones de longitud segmentaria
| Basal | Antes de OC | 5min OC | 10min OC | 15min OC | 30min OC | 45min OC | 60min OC | |
| Región no isquémica | ||||||||
| LTD (% del valor basal) | 100,0 | 99,9±0,4 | 102,5±0,5* | 102,4±0,7* | 100,8±0,9 | 100,5±0,7 | 101,6±0,7 | 100,5±0,9 |
| Acortamiento sistólico (%) | 24,2±1,8 | 24,4±1,9 | 25,3±1,5 | 25,2±1,5 | 25,4±1,7 | 24,7±1,5 | 26,0±1,7 | 25,1±1,8 |
| Región isquémica | ||||||||
| LTD (% del valor basal) | 100,0 | 100,1±0,3 | 108,8±1,0* | 109,4±0,9* | 108,0±1,1* | 106,1±1,2* | 103,6±1,7* | 103,1±1,6 |
| Acortamiento sistólico (%) | 29,6±1,6 | 29,5±1,6 | 2,2±0,9* | 2,5±0,9* | 0,6±1,0* | 1,6±1,0* | 1,9±0,9* | 2,1±0,9* |
| Abombamiento sistólico (%) | 3,6±0,4 | 3,6±0,4 | 4,9±0,6 | 4,3±0,6 | 3,0±0,4 | 2,2±0,4 | ||
LTD: longitud segmentaria telediastólica; OC: oclusión coronaria.
Los datos expresan media±error estándar.
La concentración basal de potasio en suero fue en promedio de 3,18±0,12 mmol/l y la media del área en riesgo fue el 13,2±0,3% de la masa ventricular.
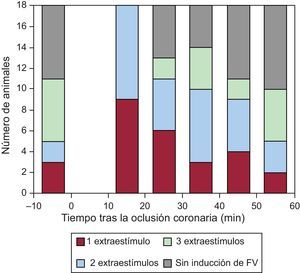
Inducibilidad de la fibrilación ventricular y su asociación con la distensión del área en riesgoLos animales presentaron 100±15 extrasístoles ventriculares durante la isquemia (11±6 en los primeros 10 min y 90±16 entre los 10 y los 60 min después de la oclusión coronaria). Antes de la oclusión coronaria, la FV fue inducida por la estimulación programada en 11 animales (61%), aunque a menudo fueron necesarios dos o tres extraestímulos para inducir la arritmia (fig. 3). Entre 10 y 60min después de la oclusión coronaria, se completó un total de 6,6±0,5 protocolos de estimulación por animal, que comportaron inducción de FV en todos los animales, con una media de 5,4±0,6 episodios de FV por animal. Además, 12 animales (67%) presentaron 1,3±0,5 episodios de FV espontánea —no inducida por la estimulación programada— durante el periodo de oclusión; el primer episodio apareció en cada animal a los 26±4 (13-46) min de la oclusión coronaria.
Tal como se muestra en la figura 3, la distribución de los episodios de FV inducida a lo largo de todo el periodo isquémico no fue homogénea. La máxima vulnerabilidad se observó entre 10 y 20 min después de la oclusión coronaria, tras lo cual la frecuencia de los episodios tendió a disminuir y el número de extraestímulos necesarios para inducir la arritmia tendió a aumentar.
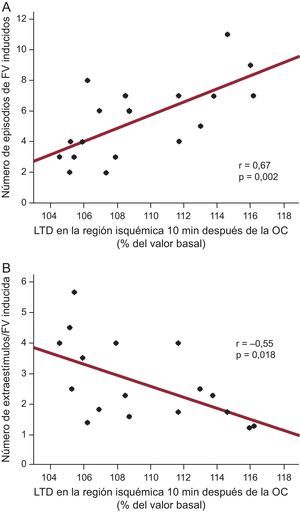
La vulnerabilidad a la FV no se asoció de manera significativa a las concentraciones basales de potasio (r=–0,22; p=NS) ni al tamaño del área en riesgo (r=0,30; p=NS). En cambio, sí se observó una relación con la magnitud de la distensión de la región isquémica poco después de la oclusión coronaria. El aumento de la LTD en la región isquémica 10 min después de la oclusión coronaria mostró una asociación directa (r=0,67; p=0,002) con el número de episodios de FV inducida y una relación inversa (r=–0,55; p=0,018) con el número de extraestímulos necesarios para la inducción de la FV (fig. 4). Ni el acortamiento sistólico ni el abombamiento sistólico en el mismo momento se relacionaron con la inducibilidad de FV.
Asociación entre la longitud segmentaria telediastólica, expresada como porcentaje del valor basal y medida 10 min después de la oclusión coronaria, y el número de episodios de fibrilación ventricular inducidos (A) o el número total de extraestímulos (incluidos los aplicados en los protocolos que no comportaron la inducción de una fibrilación ventricular) necesarios para cada episodio de fibrilación ventricular inducido (B) entre los 10 y los 60 min de oclusión coronaria. FV: fibrilación ventricular; LTD: longitud segmentaria telediastólica; OC: oclusión coronaria.
El aumento de la LTD no se asoció al número de extrasístoles ventriculares durante todo el periodo isquémico (r=–0,23; p=NS) ni con las aparecidas durante los primeros 10 min (r=0,11; p=NS) o entre los 10 y los 60 min después de la oclusión coronaria (r=–0,26; p=NS). Por lo que respecta a la FV espontánea, no se observó una relación con las variables hemodinámicas basales ni con las concentraciones de potasio, pero sí estaba asociada al tamaño del área en riesgo (el 14,8±7,1% frente al 7,9±0,9% de la masa ventricular en los animales con y sin FV espontánea respectivamente; p=0,013).
DISCUSIÓNEste estudio pone de manifiesto que la distensión de la región isquémica poco después de la oclusión coronaria se asocia a un aumento de la susceptibilidad a la FV mediante la estimulación programada en el modelo del cerdo. Los resultados obtenidos resaltan el posible papel de los factores mecánicos en la FV isquémica e apuntan a una contribución directa de dichos factores al sustrato de esta arritmia, de manera independiente de cualquier otra posible influencia en los desencadenantes.
Influencias mecánicas en las arritmias ventriculares sostenidas y no sostenidas durante la isquemia regional agudaAunque el efecto arritmógeno de la distensión miocárdica y la distensión ventricular se demostró hace mucho tiempo en diferentes preparaciones experimentales6–8, la información disponible en el contexto de una isquemia regional aguda es más escasa. En estudios anteriores se han descrito cambios de la duración del potencial de acción inducido por el aumento de las condiciones de carga mecánica18. En estudios previos de nuestro laboratorio, la magnitud de la distensión aguda de la región isquémica se ha asociado de manera uniforme a la posterior aparición de una FV espontánea tras la oclusión coronaria en cerdos anestesiados15–17. Coronel et al13 describieron que, en corazones de cerdo aislados y perfundidos a los que se aplicaba una oclusión coronaria, tanto la frecuencia y gravedad de las arritmias ventriculares espontáneas aumentaban si se elevaba la presión intraventricular con un balón. Por último, la cartografía de esos corazones13 y los estudios de modelización de ventrículos de conejo14 han permitido identificar la zona de frontera como un origen frecuente de las extrasístoles ventriculares durante la isquemia regional.
La distensión puede aumentar la arritmogenicidad ventricular tras la oclusión coronaria desencadenando extrasístoles, aumentando la vulnerabilidad del miocardio a las arritmias sostenidas o a través de ambos mecanismos. Sin embargo, y debido tal vez al uso de metodologías heterogéneas, estos estudios previos han diferido en los resultados obtenidos en cuanto a la contribución relativa atribuida a cada uno de estos mecanismos. Los resultados del presente estudio concuerdan con el hecho de que ninguno de nuestros estudios previos observara una correlación entre el aumento inicial de la LTD tras la oclusión coronaria y el número de extrasístoles ventriculares durante la fase Ib de las arritmias, a pesar de mostrar una intensa asociación con la FV espontánea15–17. En el estudio de Coronel et al13, el aumento de la carga de trabajo ventricular facilitó la aparición de extrasístoles y de arritmias malignas, aunque el incremento fue comparativamente superior en estas. Finalmente, el estudio de modelización de Jie et al14 indicó que la actividad mecánica influye tanto en los desencadenantes como en el sustrato de las arritmias isquémicas en el ventrículo del conejo. Sea cual sea la influencia que tenga la distensión regional en el desencadenamiento de las extrasístoles ventriculares tras la oclusión coronaria, la asociación con la inducibilidad de la FV observada aquí indica claramente un efecto independiente en el sustrato de esta arritmia.
Hay varios mecanismos que podrían explicar esta posible influencia. En primer lugar, podría producirse en parte a través de canales activados por la distensión20,21. A este respecto, en estudios previos realizados con este modelo animal en nuestro laboratorio no se ha podido reducir el número de extrasístoles ni la incidencia de arritmias sostenidas (aunque no tuvieron la potencia estadística necesaria para este aspecto) con la administración intravenosa16 o intracoronaria17 de gadolinio, un bloqueador de los canales activados por la distensión20. Sin embargo, estos estudios tenían la limitación de la dificultad de garantizar un aporte adecuado del fármaco a la zona de frontera. En segundo lugar, la distensión mecánica puede desencadenar reflejos del sistema autónomo aumentando la actividad simpática22,23, la cual reduce de por sí el umbral para la fibrilación24,25. Por último, podría actuar a través de otros mecanismos alternativos, como la activación de receptores betaadrenérgicos26 o afectando a la concentración de calcio citosólico o a su efecto sobre las proteínas contráctiles27,28.
Comparación con estudios previosAnteriormente se ha descrito un aumento de la inducibilidad de la FV durante la isquemia en diferentes especies y preparaciones experimentales19,29–31. En un estudio que tiene especial interés en relación con el nuestro, dada la semejanza de especie animal y del protocolo de estimulación, De Groot et al19 observaron que la inducibilidad máxima de la FV tras la oclusión coronaria en corazones de cerdo aislados y perfundidos con sangre coincidió en el tiempo con el aumento de la resistividad del tejido indicativa de un desacoplamiento celular. Estos resultados contrastan con la observación de nuestro estudio, en el que la máxima vulnerabilidad se observó antes, entre los 10 y los 20 min de isquemia, un intervalo que en su mayor parte es previo a la aparición esperada del desacoplamiento celular en este modelo animal32–34. La aparición frecuente en intervalos posteriores de FV espontánea que interfirió en la estimulación programada y redujo el número total de protocolos que se pudo completar podría explicar esta aparente discrepancia. Cabe plantear la hipótesis de que el aumento de la LTD observado en las fases finales de la oclusión coronaria (y que, tal vez por la intervención aplicada, fue más manifiesta en el presente estudio que en los estudios anteriores realizados con el mismo modelo10,11,15–17,34) pudiera haber contribuido también a producir estos resultados.
Consideraciones metodológicas y limitacionesEn el presente estudio, las concentraciones séricas de potasio y el tamaño del área en riesgo, dos factores predictivos bien conocidos de la FV tras la oclusión coronaria1 (el segundo de los cuales se asoció a la FV espontánea en este estudio), no mostraron asociación significativa con la inducibilidad de la FV. Posiblemente esto se deba en parte a la homogeneidad existente en cuanto a los animales y las condiciones experimentales, y ello concuerda con lo observado anteriormente en relación con la FV espontánea en el mismo modelo15–17. La falta de determinaciones seriadas de las concentraciones de potasio a lo largo de todo el experimento es una limitación, aunque en estudios previos de este modelo se han observado sólo variaciones mínimas de las concentraciones de potasio tras la oclusión coronaria34. La reducción de carácter menor, aunque significativa, a lo largo del experimento del ligero aumento de la LTD observado en el miocardio distal inmediatamente después de la oclusión coronaria concuerda también con observaciones previas realizadas en el mismo modelo35.
Para el análisis de la asociación entre LTD e inducibilidad de la arritmia, se tuvo en cuenta un único momento de determinación de la LTD. Hubiera sido preferible considerar múltiples determinaciones de la LTD a lo largo del periodo de isquemia, pero ello habría complicado notablemente el análisis y la interpretación de los resultados. Además, una vez iniciada la estimulación continua, la aparición de múltiples episodios de FV con posteriores descargas de desfibrilación a veces dificultó la monitorización de los cambios de la LTD. Sin embargo, la estabilidad de la LTD en la región isquémica observada en estudios previos10,11,16,17,34 va en contra de una dispersión significativa de esta variable con consecuencias en la arritmogenicidad en el presente estudio. La falta de un grupo control sin oclusión coronaria, que no se determinara directamente la tensión mecánica en la frontera isquémica y la susceptibilidad intrínseca de los animales a la FV (como evidencia el elevado porcentaje de casos en que esta arritmia fue inducida antes de la oclusión coronaria) son otras limitaciones adicionales.
Dado su carácter observacional, nuestro estudio no permite establecer una relación de causa-efecto en la asociación entre la distensión ventricular regional y la inducibilidad de la FV. Sin embargo, la existencia de una influencia real de estos cambios mecánicos en la susceptibilidad a la FV está respaldada por el hecho de que esta asociación coincide con una mayor frecuencia de FV espontánea asociada a la distensión regional en el mismo modelo15–17 y con lo indicado por otros estudios en los que se han usado enfoques diferentes13,14.
CONCLUSIONESLos resultados del presente estudio indican que los factores mecánicos potencian la vulnerabilidad del miocardio frente a las arritmias ventriculares malignas tras la oclusión coronaria. Vale la pena investigar los posibles mecanismos de esta asociación, dada la elevada prevalencia y letalidad de estas arritmias en los pacientes con síndromes coronarios agudos.
FINANCIACIÓNEste trabajo fue financiado por el Ministerio de Sanidad de España (FIS PI051745 y SAF 2008-3067), la Sociedad Española de Cardiología (Beca 2006 para Investigación Básica) y Redes Temáticas de Investigación Cardiovascular (RECAVA).
CONFLICTO DE INTERESESNinguno.