Palabras clave
INTRODUCCIÓN
En España existe una tradición de registros de síndrome coronario agudo (SCA)1-3, lo que ha permitido conocer el perfil de los pacientes, los patrones de manejo y su evolución. El registro MASCARA representa una continuación de registros previos (PRIAMHO II1 y el DESCARTES2), pero tiene dos características particulares: a) engloba la totalidad de los SCA: con elevación del ST (SCACEST), sin elevación del ST (SCASEST) y aquellos en que esta característica no es verificable (SCA inclasificable), y b) su desarrollo, que tuvo lugar poco después de la publicación de las Guías de Práctica Clínica sobre SCASEST de la Sociedad Española de Cardiología4, permite una evaluación del impacto de su difusión. Sus objetivos fueron: determinar el perfil clínico, los patrones de manejo y el pronóstico del SCA en España y comparar, respectivamente, el efecto —bruto y ajustado por los principales factores pronósticos basales— del intervencionismo coronario percutáneo (ICP) primario con el de la trombolisis en los pacientes con SCACEST y el de la estrategia intervencionista precoz (EIP) con el de la no intervencionista precoz en los pacientes con SCASEST.
MÉTODOS
La metodología del estudio ha sido ya expuesta5. Se trata de un estudio prospectivo con: a) selección aleatoria de centros según niveles asistenciales; b) inclusión consecutiva de los pacientes que cumplían criterios de inclusión y ninguno de exclusión, y c) seguimiento telefónico centralizado a los 6 meses. Los criterios de inclusión comprendían tres condiciones: clínica compatible con SCA en las 24 h previas; haber ingresado directamente o por traslado en uno de los hospitales del estudio (en cualquier área hospitalaria), y que se hubiera confirmado el diagnóstico de SCA durante su ingreso. Se consideraba confirmado el diagnóstico de SCA en alguna de las tres circunstancias siguientes: a) ingreso por dolor torácico anginoso (o equivalente anginoso) sin cambios significativos en el electrocardiograma (ECG) o no valorables pero con elevación de marcadores de necrosis miocárdica o una prueba de detección de isquemia positiva durante su ingreso o antecedentes de enfermedad coronaria conocida; b) ingreso por dolor torácico o equivalente anginoso y cambios en el ECG compatibles con isquemia miocárdica; c) ausencia de dolor torácico, pero elevación de marcadores y cambios en el ECG compatibles con isquemia o prueba de detección de isquemia positiva durante su ingreso. Como criterios de exclusión se consideraron: imposibilidad de seguimiento; isquemia miocárdica claramente desencadenada por una causa extracardiaca; enfermedades extracardiacas concomitantes con pronóstico vital de menos de 12 meses; ausencia de consentimiento informado. Excepto el segundo, estos criterios de exclusión hacen referencia al seguimiento telefónico, no a los datos basales.
Se definió SCACEST como la elevación del segmento ST 3 1 mm en por lo menos dos derivaciones durante más de 20 min; SCA inclasificable, como ritmo de marcapasos, bloqueo de rama izquierda avanzado o síndrome de Wolff-Parkinson-White en el ECG; se diagnosticó SCASEST a los pacientes que cumplían criterios diagnósticos de SCA sin pertenecer a las otras dos categorías.
Se definió EIP, de acuerdo con las últimas recomendaciones de la Sociedad Europea de Cardiología, como la realización de coronariografía en las primeras 72 h del episodio índice en paciente ingresado por SCASEST6; ICP primario, como la realización de coronariografía durante las primeras 12 h del ingreso hospitalario en ausencia de trombolisis previa en paciente diagnosticado de SCACEST.
Investigadores de cada centro identificaban a los pacientes, solicitaban su consentimiento informado e incluían un ECG. Posteriormente, monitores entrenados visitaban periódicamente el hospital y cumplimentaban un extenso cuestionario sobre las características basales y la evolución hospitalaria. Los cuestionarios utilizados en el estudio, junto con las definiciones de variables, pueden consultarse en: http://www.uesca.net/
Las principales variables de resultado del estudio fueron: a) mortalidad hospitalaria; b) mortalidad por cualquier causa a los 6 meses, y c) mortalidad o reingreso por SCA a los 6 meses del episodio índice.
El período de reclutamiento fue de septiembre de 2004 a junio de 2005.
Control de calidad
Entre 2005 y 2006 se realizó un control de calidad de la exhaustividad en la inclusión mediante el proceso siguiente:
1. Se solicitó a todos los hospitales, salvo a 7 centros cuya inclusión fue ya ostensiblemente defectuosa, que aportaran sus listados de alta (códigos 410, 411, 413 y 414 del CMBD).
2. En el centro de datos y el centro coordinador (Instituto Municipal de Investigaciones Médicas de Barcelona y Unidad de Epidemiología del Servicio de Cardiología del Hospital Vall d'Hebron), se excluyeron las codificaciones erróneas y se cruzaron los listados de alta con las bases de datos de los pacientes incluidos hasta entonces en el estudio. Eso aportó una lista de posibles pacientes aptos durante el período de estudio que no habían sido incluidos.
3. A continuación se procedió a identificar los auténticos candidatos a ser incluidos que no lo habían sido, verificándolo en cada centro historia por historia (o informe de alta). Esta labor la realizaron un equipo de enfermeras entrenado al efecto o los investigadores locales que aceptaron hacerlo. Los pacientes así localizados se incluyeron retrospectivamente. Aunque en dichos pacientes no se pudo realizar seguimiento telefónico ante la falta de consentimiento informado, se realizó un seguimiento a través de los registros informáticos de cada centro con objeto de detectar nuevos ingresos y sus causas a partir de la historia clínica. Se obtuvo con ello una cohorte con alta garantía de inclusión exhaustiva y no sesgada (patrón de referencia) en 18 centros que aceptaron dicho control de calidad (4.889 registros).
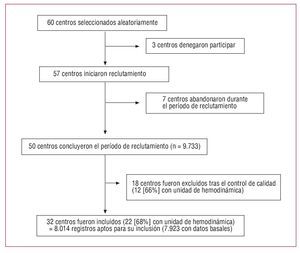
En una segunda fase del control de calidad, se procedió a la comparación de esta cohorte de referencia con los pacientes incluidos en cada uno de los centros que no habían seguido el control de calidad (33 centros; 4.219 registros). En este subanálisis se identificaron centros cuyos pacientes presentaban menor mortalidad y, en ocasiones, una distribución de factores de riesgo bastante diferente de la del grupo de referencia. Por ejemplo, la tasa de mortalidad hospitalaria de SCACEST en uno de los centros de tercer nivel fue del 2% (intervalo de confianza [IC] del 95%, 0,2%-4,3%), mientras que la del grupo de referencia fue un 7,5% (IC del 95%, 6,1%-8,6%), lo que indicaba un sesgo de inclusión por falta de inclusión de los pacientes más graves. En un intento de minimizar dicho sesgo, el comité científico definió unos criterios para excluir del análisis los centros en que la sospecha de inclusión sesgada era alta. En concreto, se decidió excluir del presente análisis los centros en que constara la declaración expresa del investigador de una inclusión manifiestamente incorrecta o cuya tasa de inclusión fuera inferior al 50% de lo esperable según el nivel asistencial del centro y, además, el IC del 95% de su tasa de mortalidad para cada uno de los tipos de SCA no incluyera el valor medio de los centros patrón. Así se excluyó del presente análisis a 18 de los 50 centros que habían concluido el reclutamiento y en los que, según los criterios citados, la inclusión había sido manifiestamente incorrecta (fig. 1). En la inclusión de datos y la depuración de bases se llevó a cabo una minuciosa revisión de cada registro, con consultas al investigador o la historia clínica en caso de incongruencia.
Fig. 1. Selección de centros incluidos en el estudio.
Análisis estadístico
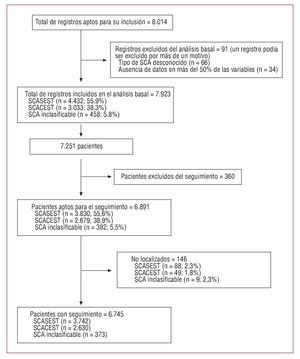
Los análisis de las características basales y el manejo hospitalario se realizaron sobre 7.923 registros, correspondientes a 7.251 pacientes (varios ingresaron más de una vez). Los análisis de mortalidad bruta y ajustada, así como los análisis de supervivencia en los que se valoran las variables de resultado «muerte» y «muerte o reingreso» a los 6 meses, se realizaron sobre los 7.251 pacientes.
Las variables categóricas se expresan en porcentaje, calculadas del total de datos válidos. Se estimó el IC del 95%. Las variables cuantitativas se expresan en media ± desviación estándar o en mediana (rango intercuartílico) según la distribución subyacente fuera normal o no.
Las comparaciones entre los datos basales de los distintos tipos de SCA se realizaron mediante la prueba de la c2 para las variables categóricas y la de Kruskal-Wallis para las continuas (dada la desviación de los supuestos de normalidad de la distribución subyacente).
Los análisis de supervivencia se realizaron mediante el método de Kaplan-Meier. Las curvas de supervivencia y de supervivencia libre de ingresos a los 6 meses se compararon mediante el log-rank test.
Se analizó el efecto ajustado de la EIP en el SCASEST y del tipo de reperfusión en el SCACEST mediante el modelo de riesgos proporcionales de Cox, sobre la mortalidad y la mortalidad o reingreso por SCA a los 6 meses en dos poblaciones: en el total de pacientes y en los que fueron dados de alta vivos en el episodio índice. Primero se construyó un modelo predictivo a partir de las variables que tenían una asociación significativa con la mortalidad en el análisis bivariable y todas las que se consideró clínicamente relevantes. En concreto, para el SCASEST se introdujeron en el modelo inicial las variables: edad, sexo, hipertensión, diabetes, dislipemia, hábito tabáquico, arteriopatía periférica, antecedentes de infarto, elevación de marcadores de necrosis, desviación del ST en el ECG basal > 0,5 mm, presión arterial sistólica inicial, frecuencia cardiaca inicial, creatinina > 1,4 mg/dl, tratamiento con bloqueadores beta en las primeras 24 h, administración de antagonistas de la glucoproteína IIb/IIIa y clase Killip. Para el caso del SCACEST se introdujo, además, la variable localización del infarto (anterior frente a otras), pero no la elevación de marcadores de necrosis ni la desviación del ST. Se analizaron, mediante el procedimiento de eliminación progresiva paso a paso (con un valor de p de entrada < 0,05 y un valor de p de salida > 0,1), los predictores de la mortalidad a 6 meses. A partir del modelo resultante se introdujo la variable «estrategia de reperfusión» en el SCASEST y «tipo de reperfusión» en el SCACEST. Posteriormente se valoró el resto de las variables que no habían pasado los criterios automáticos del sistema de modelización y se las introdujo en caso de que indujeran una modificación clínicamente relevante en el efecto ajustado de la variable principal. En los modelos realizados en los pacientes que sobrevivieron al episodio índice, tanto en el caso del SCASEST como el del SCACEST, se valoraron además los tratamientos al alta. Se comprobó la presunta proporcionalidad de los riesgos proporcionales en las categorías de las variables introducidas en los modelos.
Los análisis se llevaron a cabo con los paquetes estadísticos SPSS 13.0 y SAS 9.
RESULTADOS
Se invitó a participar a 60 centros que fueron seleccionados aleatoriamente, de los cuales 3 declinaron participar. De los 57 centros seleccionados, 50 reclutaron 9.733 casos; se excluyó a 18 centros tras el control de calidad (1.719 casos) al comprobar que la exhaustividad de su reclutamiento estaba por debajo de los requisitos del estudio. Quedaron finalmente 32 centros que incluyeron 8.014 registros, de los que finalmente 7.923, correspondientes a 7.251 pacientes, fueron válidos y en ellos se basa el análisis de los resultados hospitalarios (figs. 1 y 2).
Fig. 2. Pacientes incluidos.
En la tabla 1 se presentan los datos basales de los pacientes según tipo de SCA. En el grupo de SCA inclasificable los pacientes fueron de mayor edad, con mayor predominio femenino y con características generales de mayor gravedad clínica. Destaca la elevada frecuencia de diabetes y la de aterosclerosis de otras localizaciones. Los pacientes con SCACEST mostraron menos antecedentes de enfermedad coronaria y menores tasas de tratamientos previos.
La tabla 2 ilustra las características clínicas, el manejo y los resultados en las primeras 48 h tras el episodio índice. Destacan: la mediana del tiempo transcurrido entre el inicio de los síntomas y la llegada a urgencias de casi 2 h, y en consonancia con los datos de la tabla 1, la mayor proporción entre los pacientes con SCA inclasificable de clase Killip > I y creatinina > 1,4 mg/dl. Aproximadamente un 68% de los pacientes con SCACEST recibieron tratamiento de reperfusión en el momento agudo, y la trombolisis (con o sin ICP de rescate) fue el más frecuente. El ICP primario se realizó en un 24,7% (IC del 95%, 23,2%-26,3%) de los ingresos y el de rescate en un 10,7% (IC del 95%, 9,8%-12%). La mediana de tiempo puerta-aguja fue de 45 (rango intercuartílico, 25-75) min, y la del tiempo puerta-balón, 97 (60-203) min.
En la tabla 3 se recogen datos angiográficos, de manejo y de resultado correspondientes a la totalidad del período de ingreso. En dos tercios de los pacientes se practicó un estudio ecocardiográfico, mientras que el uso de pruebas de detección de isquemia fue escaso. La mayor proporción de enfermedad de tronco común y lesión significativa de 3 vasos se observó en el SCA inclasificable. Destaca la diferente utilización de revascularización coronaria percutánea entre los tipos de SCA, relativamente alta en el SCACEST y baja (19,4%) en los pacientes con peor pronóstico (SCA indeterminado), mientras que el uso de cirugía durante el ingreso o programada para después fue del 5%. La tasa de accidentes hemorrágicos no cerebrales fue baja pero no trivial, especialmente en mayores de 75 años (4%; IC del 95%, 3,3%-5,1%).
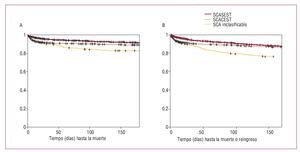
La media de la mortalidad total hospitalaria fue del 5,7% (SCASEST, 3,9%; SCACEST, 7,6%, y SCA indeterminado, 8,8%). Se dispone de datos de seguimiento tras el alta de 6.745 pacientes (el 90% de los válidos). En la figura 3 se representan las curvas de supervivencia total y de supervivencia libre de reingreso por SCA a los 6 meses. Mientras las supervivencias a los 6 meses del SCASEST y el SCACEST fueron semejantes, el 90,3% (IC del 95%, 89,4%-91,3%) y el 88,2% (IC del 95%, 87%-89,5%) respectivamente, la del SCA inclasificable fue claramente inferior: el 83,9% (IC del 95%, 86%-87,9%) (p < 0,0001). Con respecto a la supervivencia libre de reingresos por SCA, en el SCASEST y el SCACEST se alcanzaron tasas del 87,2% (IC del 95%, 86%-88,3%) y el 86,4% (IC del 95%, 85,1%-87,8%) respectivamente, mientras que en el SCA inclasificable fue del 75,2% (IC del 95%, 70,5%-80%) (p < 0,0001).
Fig. 3. Curvas de supervivencia a 6 meses del episodio índice según tipo de SCA. A: supervivencia total. B: supervivencia libre de ingreso.
Las tasas de tratamientos al alta (tabla 4) reflejan un importante incremento en el uso de fármacos con respecto a anteriores registros que ya se observó en los fármacos y procedimientos usados en la fase inicial (tabla 5).
Estrategia intervencionista precoz en el SCASEST
Hay datos sobre el tipo de estrategia (EIP frente a no-EIP) en 4.046 registros (91%). La EIP se realizó en 795 (19,6%) de estos episodios. La tabla 6 muestra las características basales de los episodios de SCASEST que fueron sometidos a EIP frente al resto de los pacientes. Aquellos en que se realizó EIP fueron, en general, de riesgo más bajo que los no sometidos a dicha estrategia: más jóvenes, con menor prevalencia de insuficiencia renal y diabetes, y con grado Killip inicial más bajo. Sin embargo, ingresaron de forma más frecuente en centros con disponibilidad de hemodinámica y la elevación de marcadores de necrosis fue mayor que en los no sometidos a EIP.
La mortalidad hospitalaria bruta, calculada sobre 3.473 pacientes con datos válidos, fue algo mayor en el grupo de la EIP, aunque la diferencia no fue significativa. Sin embargo, dicha tendencia fue invirtiéndose con el tiempo, de manera que a los 6 meses la mortalidad de la EIP (calculada sobre 3.211 pacientes con datos válidos y seguimiento completo) fue significativamente menor que en el resto de los pacientes.
La tabla 7 muestra el efecto de la EIP en la mortalidad a los 6 meses ajustado por las variables predictoras más relevantes, tanto en el total de la población como en los pacientes que sobrevivieron al episodio índice. No se observó una asociación de la EIP con el resultado en el total de la población. Sin embargo, en los pacientes que sobrevivieron al episodio índice, se observó una asociación clínicamente relevante de la EIP, aunque no llegó a alcanzar significación estadística. Se obtuvieron resultados similares con la variable «muerte o reingreso por SCA» a los 6 meses, tanto en el total de la población (hazard ratio [HR] = 0,92; IC del 95%, 0,65-1,3) como en los que sobrevivieron al episodio índice (HR = 0,65; IC del 95%, 0,39-1,06; p = 0,086).
Finalmente, como los pacientes que fallecieron en las primeras horas (0,6%) y los no sometidos a cateterismo fueron asignados inicialmente al grupo no-EIP, se repitieron los análisis excluyendo a dichos pacientes, pero no se apreciaron cambios significativos.
Reperfusión en el SCACEST
Se dispone de datos válidos sobre el tipo de reperfusión de 3.000 (98,8%) registros. La tabla 8 muestra las características basales de los episodios de SCACEST sometidos a trombolisis (con o sin angioplastia de rescate) respecto a los sometidos a ICP primario y los no sometidos a ningún tipo de reperfusión, que en general fueron de riesgo mayor que los sometidos a alguna estrategia de reperfusión: mayor edad, más prevalencia de mujeres, diabetes, insuficiencia renal y grado Killip de mayor severidad. Por el contrario, los pacientes tratados con trombolisis tenían un perfil de riesgo más bajo que los demás.
La mortalidad hospitalaria cruda, calculada sobre 2.628 pacientes con datos válidos, fue mayor en los pacientes no sometidos a ningún tipo de estrategia que en los sometidos a trombolisis o ICP primario. En estos últimos también hubo más mortalidad intrahospitalaria que entre los sometidos a trombolisis. Las diferencias de mortalidad entre los pacientes según se realizara reperfusión o no fueron aumentando con el paso del tiempo. No así las diferencias de mortalidad entre la trombolisis y el ICP primario, que se atenuaron a los 6 meses.
Se practicó angioplastia después de trombolisis en un 11,3% del total de pacientes. La mortalidad de dicho subgrupo fue muy similar a la de los pacientes en que sólo se hizo trombolisis, tanto la intrahospitalaria (6,1%; IC del 95%, 3,6%-9,4%) como a los 6 meses (10,5%; IC del 95%, 7%-15%).
En el análisis multivariable realizado sobre el total de pacientes con datos válidos, no se observó una asociación de la trombolisis o del ICP primario con la mortalidad a los 6 meses. Sin embargo, en los pacientes que sobrevivieron al episodio índice, se observó una asociación relevante y estadísticamente significativa en quienes recibieron ICP primario respecto a los no reperfundidos (tabla 9). El efecto de la trombolisis en el pronóstico, comparado con la ausencia de reperfusión, no fue concluyente, al igual que el efecto del ICP primario frente al de la trombolisis. Se obtuvieron similares resultados con la variable «muerte o reingreso por SCA» a los 6 meses, tanto en la población total (trombolisis: HR = 1; IC del 95%, 0,77-1,4; ICP primario: HR = 1; IC del 95%, 0,73-1,45) como en los supervivientes al episodio índice (trombolisis: HR = 0,7; IC del 95%, 0,45-1 [p = 0,1]; ICP primario: HR = 0,53; IC del 95%, 0,3-0,9 [p = 0,03]).
Como análisis adicional, se excluyó del grupo de trombolisis a los pacientes que posteriormente siguieron una angioplastia de rescate, pero no se observaron diferencias de la asociación entre la trombolisis y la mortalidad en el total de la población (HR = 1,1; IC del 95%, 0,83-1,6) ni en los que sobrevivieron al episodio índice (HR = 0,82; IC del 95%, 0,49-1,3).
DISCUSIÓN
El estudio MASCARA ofrece una visión del perfil clínico, el manejo y los resultados de los pacientes ingresados por SCA en hospitales españoles un año después de la implantación de las guías de práctica clínica de la Sociedad Española de Cardiología4. Sus resultados indican que, en comparación con registros precedentes, en 2004-2005 se había producido un llamativo incremento en el uso de fármacos e intervenciones recomendadas. Sin embargo, valorados en el total de la población, no se observó, ajustando por los principales factores pronósticos basales, una asociación entre el ICP primario en el SCACEST y la EIP en el SCASEST con la mortalidad y la mortalidad o reingreso por SCA a los 6 meses. No así en los pacientes que sobrevivieron al episodio índice, en quienes sí se observó dicha asociación, aunque en el caso de la EIP no fue concluyente.
Manejo general del SCA
Los resultados del estudio son coherentes con los observados en otros registros7,8. Además, el registro MASCARA muestra un aumento considerable en la utilización de fármacos y procedimientos recomendados en las guías de práctica clínica en comparación con los registros PRIAMHO II y DESCARTES (tabla 5), hallazgos ya mostrados por estudios previos9,10. No obstante, las comparaciones entre registros ofrecen limitaciones importantes dadas las diferencias entre las poblaciones correspondientes y criterios de inclusión. En el caso del estudio MASCARA se añade el reciente cambio de definición de los SCA. Por ello, la comparación de sus resultados con registros de nuestro propio ámbito es arriesgada, sobre todo en lo que se refiere a las variables de resultado. Por ejemplo, en el DESCARTES se incluyó un 18% de pacientes sin confirmación de SCA2, mientras que en el MASCARA se exigía la verificación de ese diagnóstico5. Esto podría explicar las diferencias de mortalidad entre ambos. En el caso del SCACEST, la comparación con el estudio PRIAMHO II es aún más problemática, pues utilizó diferentes criterios de inclusión y definiciones1,11 y sólo incluyó a los pacientes que ingresaron en unidades coronarias.
EIP en el SCASEST
La EIP se realizó en una minoría de los pacientes (19,6%) y fundamentalmente en aquellos con menor riesgo basal, en contra de lo recomendado6. Dicho hallazgo, ya mostrado en otros registros8, señala la dificultad de implementar las guías de práctica clínica.
Varios factores en relación con el proceso asistencial (disponibilidad de hemodinámica, elementos logísticos, hábitos asistenciales, etc.) pueden haber contribuido a ello. La investigación de dichos factores no era un objetivo del registro MASCARA, y probablemente requieran un estudio más profundo. En todo caso, los resultados indican una posible limitación asistencial en algunos centros españoles con marcadas implicaciones pronósticas.
En el análisis ajustado no se observó una asociación de la EIP en el total de la población con las variables de resultado. La ausencia de dicha asociación podría estar en relación, al menos parcialmente, con la selección de los pacientes para EIP. Que en la muestra analizada la mayor parte de los factores más fuertemente asociados con el riesgo basal de muerte intrahospitalaria y a los 6 meses fueran más prevalentes en quienes no se siguió una EIP podría explicar la falta de asociación de ésta con el pronóstico tras el ajuste estadístico. Podría también explicar la diferencia de mortalidad observada entre ambos grupos durante el seguimiento, en el que se observó un incremento de la mortalidad a partir del alta hospitalaria marcadamente más elevado en los pacientes que no siguieron inicialmente una EIP (8,9%) respecto a los que sí la siguieron (4,6%). Cabría preguntarse si se habría obtenido resultados diferentes si los pacientes de mayor riesgo basal hubieran seguido una EIP. Otro factor a tener en cuenta, a la hora de explicar la falta de asociación de la EIP con el pronóstico, es la tasa de revascularización de los pacientes que no siguieron EIP (33,1%) (tabla 6), bastante mayor que la del estudio FRISC II (9%)12, que mostró beneficio de la EIP, y más cercana a la del estudio ICTUS (40%)13, que no lo mostró. Por último, hay que tener en cuenta que el mayor beneficio de la EIP es evidente sobre todo a largo plazo, y en el MASCARA sólo se pudo realizar el seguimiento a 6 meses.
La observación de una asociación de la EIP con el pronóstico en el análisis excluyendo a los pacientes que fallecieron durante el episodio índice es de interpretación compleja. Se puede hipotetizar que, como se ha mencionado previamente, factores asociados al proceso asistencial, en relación con la implementación inicial de una técnica que requiere un período de aprendizaje, haya podido determinar que sus resultados hospitalarios fueran peor de lo deseable, como indica una mortalidad bruta mayor que en la estrategia no intervencionista precoz. Quizá los pacientes en que se siguió una EIP y que sobrevivieron al episodio índice fueron aquellos en que se realizó de forma óptima y, de esta manera, en los que se concentró el potencial beneficio a corto plazo de la EIP. En todo caso, otros estudios han mostrado un exceso de mortalidad en la fase aguda de los pacientes revascularizados, aunque el pronóstico a largo plazo fue favorable para éstos12.
Reperfusión en el SCACEST
Como en el caso del SCASEST, el riesgo global de los pacientes sin reperfusión coronaria fue mayor que en los que se realizó, aunque las diferencias fueron menos importantes con el grupo tratado con ICP primario.
Destaca una mayor mortalidad hospitalaria del ICP primario con respecto a la trombolisis, probablemente en relación con una mayor prevalencia de factores muy relacionados con el pronóstico en ese grupo. No obstante, dicha diferencia en la mortalidad fue atenuándose con el tiempo, y perdió significación estadística a los 6 meses.
En el análisis ajustado, destaca una falta de asociación de la reperfusión (trombolisis o ICP primario) con las variables de resultado en el total de la población. Dicha tendencia se invirtió al excluir del análisis a los pacientes que fallecieron durante el episodio índice, lo que posiblemente refleja de nuevo que hay factores asociados al proceso asistencial que no se pudo considerar en el análisis, quizá relacionados con el pronóstico intrahospitalario y que pudieron actuar como confusores. Por ejemplo, los tiempos de reperfusión puerta-aguja y puerta-balón sólo se obtuvieron en un número insuficiente de pacientes, por lo que no se pudo introducirlos como variables de ajuste en el análisis. De todas maneras, los tiempos disponibles eran mayores que lo recomendado en las guías, y es poco plausible que los tiempos no registrados fueran menores. Quizá si hubiera estado disponible dicha variable en un número suficiente de pacientes, se hubiera podido identificar el subgrupo en que se siguió una estrategia óptima y posiblemente se concentró el beneficio de la reperfusión.
Como una aproximación indirecta a la identificación de dicho subgrupo, excluimos del análisis, al igual que en el SCASEST, a los pacientes que fallecieron durante el episodio índice, y entonces se observó un beneficio de la trombolisis, aunque no concluyente, quizá por falta de potencia estadística, y un beneficio clínicamente relevante y estadísticamente significativo del ICP primario. Igualmente se observó, siguiendo la misma estrategia, un beneficio no concluyente del ICP primario respecto a la trombolisis.
Validez interna y externa de los resultados del estudio
Se incluyeron en el análisis sólo los centros en que se verificó de forma directa e indirecta la inclusión muy completa y no sesgada (70%) para asegurar la validez interna de nuestros resultados.
Por lo que respecta a la validez externa, creemos que los 32 centros finalmente incluidos en este análisis representan adecuadamente la realidad asistencial española, pues los centros a los que se propuso la inclusión fueron seleccionados aleatoriamente y en los 18 centros excluidos había la misma proporción de centros con unidad de hemodinámica, lo que indicaría que su exclusión no introdujo un sesgo relevante. La estrategia de exclusión de los centros con participación deficiente no es exclusiva del presente registro. Otros estudios observacionales han llegado a unas tasas de participación de centros, también por criterios de calidad, no muy distintas del nuestro2.
Se debe tener presente que el MASCARA es un estudio de efectividad y no de eficacia, por lo que no se puede inferir de los resultados que la EIP o el ICP primario no sean beneficiosos cuando son aplicados en según qué condiciones. Es más, cualquier inferencia causal con este tipo de diseño es cuando menos arriesgada. Sin embargo, se puede hipotetizar que no haber observado una asociación entre las intervenciones en estudio, tras ajuste por los factores pronósticos basales, y el resultado podría estar en relación con la existencia de multitud de variables relacionadas con el proceso asistencial y cuya consideración no era objetivo del estudio.
Los resultados de un registro deben interpretarse en un marco temporal concreto. Es de esperar que los resultados obtenidos en el presente registro no correspondan completamente a los resultados actuales. Sin embargo, sí demuestran la dificultad que supone trasladar los resultados de los ensayos clínicos a la clínica diaria, y más en el caso de la implementación de estrategias terapéuticas cuya realización en un tiempo adecuado conlleva una logística compleja y cuyo resultado final depende de múltiples factores técnicos y organizativos.
Limitaciones
Como el presente estudio es observacional, no se puede descartar con toda garantía la existencia de un sesgo de inclusión. Por otro lado, como se ha mencionado, podría haber variables de confusión relacionadas con el proceso asistencial que no fueron consideradas, pues el estudio no tenía finalidad evaluativa. Sin embargo, dicha posibilidad no invalida las conclusiones del estudio, teniendo en cuenta sus objetivos.
El valor de los tiempos puerta-aguja y puerta-balón es limitado, pues se obtuvieron en número escaso, por lo que dicha variable ha de interpretarse con precaución. De la misma manera, tampoco se pudo contabilizar los SCA periprocedimiento, variable de interés a la hora de valorar el beneficio/perjuicio del intervencionismo.
En el caso del SCASEST, no se dispuso de información acerca del número de pacientes en que, sin pertenecer al grupo de la EIP, se había realizado previamente al cateterismo una prueba de detección de isquemia (estrategia «conservadora») o no (estrategia «intervencionista» no precoz).
CONCLUSIONES
La visión que el estudio MASCARA aporta de la atención a los SCA en España tras la difusión de las guías de práctica clínica, interpretado junto con los registros precedentes, indica que en 2004-2005 se produjo una evolución rápida hacia la adopción de nuevos fármacos y procedimientos invasivos, aunque no se observó una asociación de la EIP en el SCASEST ni de la repefusión en el SCACEST con el pronóstico a 6 meses en el conjunto de la población. Dichos hallazgos señalan la existencia de factores asociados al proceso asistencial que impiden que la implantación de dichas estrategias se haya asociado al pronóstico, y de ellos quizá el más importante sea la insuficiente adecuación de éstas al riesgo basal de los pacientes.
ANEXO. Investigadores del estudio MASCARA
Dr. Radován y Dra. Maulén (H. de Campdevanol; Girona). Dr. Ortiz de Murua, Dr. Marcos y Dr. Arribas (H. Virgen de la Concha; Zamora). Dr. Laperal y Dr. Casado (H. de Calatayud; Zaragoza). Dr. Bisbe (H. Sant Jaume de Olot; Girona). Dr. Bartomeu, Dra. Carrillo y Asunción Mateu (H. Universitario Sant Joan d'Alacant). Dr. Gutiérrez y Dr. Benítez (H. Virgen del Puerto; Plasencia). Dr. De Miguel, Dra. Martínez y Dra. Soriano (H. de Terrassa). Dr. Arias e Isabel Gómez (H. de Montecelo; Pontevedra). Dr. Ortega y Dr. Molina (H. Sta. María del Rossell; Cartagena). Dr. Herreros y Dr. Azcárate (Clínica Universitaria de Navara). Dr. Worner, Dr. Piqué y Purificación Cascant (H. Arnau de Vilanova; Lleida). Dr. Salvador y Dr. Aguar (Clínica Dr. Pesset; Valencia). Dr. Arós y Dr. Sanz (H. de Txagorritxu; Vitoria). Dr. Velasco y Dra. Belchi (H. Gral. Universitario de Valencia). Dr. Pagola y M. Amparo Pérez (H. Ciudad de Jaén). Dr. Sogorb y Dra. Oliver (H. Gral. Universitario de Alicante). Teresa Martorell, Dr. Bórqued y Dr. Verbal (H. Clínic i Provincial; Barcelona). Dr. Esplugues, Dr. Ribas y Cristina Carvajal (Ciudad Sanitaria de Bellvitge; Barcelona). Dr. Martín y Dr. Pabón (H. Universitario de Salamanca). Dr. Froufe, Dra. León y Dr. Montes (H. de Cruces; Bilbao). Dr. Poveda, Dra. Ruiz y Marta Calvo (H. Universitario Marqués de Valdecilla; Santander). Dr. Alcalde, Dr. Alguersuari, Dr. Otaegui y Purificación Cascant (H. Vall d'Hebron; Barcelona). Dr. Juan, Dra. Barrio y Dr. Estévez (H. Universitario Gregorio Marañón; Madrid). Dr. Moreno y Dra. Martín (H. San Cecilio; Granada). Dr. Fernández Avilés y Dr. Sánchez (H. Clínico Universitario de Valladolid). Dr. Bruguera, Dra. Soriano y Dr. Recasens (H. del Mar; Barcelona). Dr. Abizanda y Dra. Micó (H. Gral de Castellón). Dra. Huelmos (Fundación hospital de Alcorcón). Dr. Ortigosa y Dr. Silva (Clínica Puerta de Hierro; Madrid). Dr. Bardají, Dra. Serrano y Purificación Cascant (H. Joan XXIII; Tarragona). Dr. Sala, Isabel Ramió y Ruth Martí (H. Josep Trueta; Girona). Dr. Montón (H. Gral. Yagüe; Burgos).
ABREVIATURAS
ECG: electrocardiograma.
EIP: estrategia intervencionista precoz.
ICP: intervencionismo coronario percutáneo.
SCA: síndrome coronario agudo.
SCACEST: síndrome coronario agudo con elevación del ST.
SCASEST: síndrome coronario agudo sin elevación del ST.
VÉASE EDITORIAL EN PÁGS. 793-6
Financiación: RECAVA, FIS (PI04/1408, PI04/1583) y una beca sin restricciones de Bristol-Myers-Squibb.
En el anexo se relacionan los investigadores y hospitales participantes en el estudio MASCARA.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. G. Permanyer Miralda.
Unidad de Epidemiología. Servicio de Cardiología. Hospital Vall d'Hebron.
Pg. de la Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: gpermany@gmail.com
Recibido el 25 de octubre de 2007.
Aceptado para su publicación el 6 de mayo de 2008.