Palabras clave
INTRODUCCION
La atresia pulmonar con septo integro (APSI) es una cardiopatía grave que tiene una incidencia del 0,7 al 3,1% de las cardiopatías congénitas1. Se caracteriza por una gran variabilidad anatómica, donde el desarrollo del ventrículo derecho (VD) va desde una forma severamente hipoplásica y cuyo tratamiento definitivo es una correción de tipo univentricular, hasta la presencia de un VD normal o con un ligero hipodesarrollo con buen futuro para una corrección de tipo biventricular. Además del grado de desarrollo del VD, la insuficiencia tricuspídea (IT) es muy variable con o sin malformación de Ebstein y la circulación coronaria puede ser parcial o totalmente dependiente del VD2-5.
Para estos casos favorables con un VD de desarrollo aceptable, y si la distribución coronaria lo permite, el tratamiento en los primeros días de vida es la apertura valvular para favorecer el flujo pulmonar y el desarrollo de las cavidades derechas. En 1991, Latson6 comunicó el primer caso de apertura valvular con el extremo rígido de una guía, y en ese mismo año, Qureshi et al7 y Parsons et al8, mediante láser; en los años siguientes se utilizó también la radiofrecuencia con buenos resultados9-11.
Nuestra experiencia en la apertura valvular en la APSI comenzó en el año 200112. Basándonos en las técnicas mecánicas de Latson y con guías especiales para la obstrucción crónica total coronaria por su parte blanda, describimos una forma modificada menos agresiva dirigida con catéter lazo en su forma anterógrada. Durante estos años y de forma consecutiva realizamos 11 casos de apertura valvular en la APSI, con resultados buenos iniciales y en el seguimiento a medio plazo que son motivo de este trabajo.
MÉTODOS
Pacientes
Se trata de 11 pacientes neonatos (7 niñas y 4 niños) con una edad de 9 ± 18 días (2-64 días), con un peso que varía de 2,5 a 3,4 kg y una superficie corporal (SC) de 0,20 ± 0,02 m2.
Todos ellos fueron diagnosticados en nuestro centro y en los de referencia de APSI. Fueron ingresados en la unidad de cuidados intensivos pediátricos y estabilizados mediante la perfusión de prostaglandina E1 (PGE1); a pesar de ello, en 4 casos el procedimiento se realizó de urgencia debido a la inestabilidad clínica.
Se llevó a cabo un estudio ecocardiográfico siguiendo los criterios de Kleinman13: evaluación de flujo pulmonar por un ductus izquierdo y único en todos los casos; presencia o no de sinusoides ventriculocoronarios; tamaño del VD y su formación en una, dos o tres partes, y la competencia de las válvulas pulmonar (VP) y tricúspide (VT). Se midieron el anillo pulmonar y la z pulmonar, así como el anillo tricuspídeo en apical 4 cámaras y la z de la tricúspide que expresa el desarrollo del VD14,15, determinándose estos valores según el normograma de Hanley et al3:
Valor z = diámetro medido diámetro medio normal / desviación estándar del diámetro medio normal
Técnica de valvuloplastia
El procedimiento se realizó según la técnica previamente descrita6,12,16 por punción de la arteria y la vena femorales, con introductores del 4 y 5 Fr. Se llevó a cabo una aortografía con el fin de excluir una circulación coronaria dependiente de sinusoides, así como una ventriculografía derecha en proyección anteroposterior y lateral, y posicionamiento del lazo de Goose-neck de 5 mm (Microvena) por el ductus sobre la VP. Se introdujo un catéter coronario derecho Judkins 3,5 en 7 casos y Goodale Lubin en 4 casos hasta el VD y justo debajo de la VP «coronada» por el lazo. Se efectuó la conexión del catéter con llave en «Y» de angioplastia coronaria y, por ésta, se introdujeron guías especiales de 0,014 pulgadas para la obstrucción crónica total coronaria siempre por su parte blanda: Crossit 200 y 300 (Guidant) en 7 casos; Choice P-T Graphix (Boston) en 3 casos y Asahi Confianza (Abbot) en un caso. Con el catéter apoyado sobre la VP se realizan maniobras de rotación con el torquer dirigiendo la guía al lazo y, una vez pasado a su través, se extrae por la arteria femoral, estableciéndose un circuito arteriovenoso exteriorizado. Con la estabilidad que este circuito proporciona, se dilata progresivamente la VP con catéter monorraíl coronario de bajo perfil de 2 y 4 mm y, una vez abierta la válvula, deslizamos un catéter Goodale Lubin hasta la aorta descendente, por el cual podemos avanzar una guía de 0,035 pulgadas. Con esta guía progresamos balones de 6 mm, llegándose a un diámetro de balón máximo entre 8 y 12 mm.
En 3 casos no fue posible realizar esta técnica anterógrada, ante lo cual se dejó un catéter centinela en el infundíbulo, se retiró el lazo y por su vaina, que se posicionó sobre la válvula, se perforó de forma retrógrada capturándose la guía con el lazo en venas cavas y se procedió de forma similar a la técnica previa, estableciéndose el circuito arteriovenoso. Finalmente, se realizan el control angiográfico y la toma de presiones en la forma habitual (figs. 1-5).
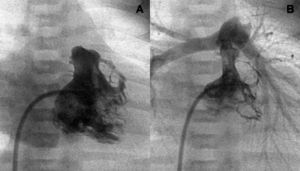
Fig. 1. Ventriculografía derecha. Ventrículo tripartito con buen desarrollo anterior y posterior a la pertura valvular (A y B).
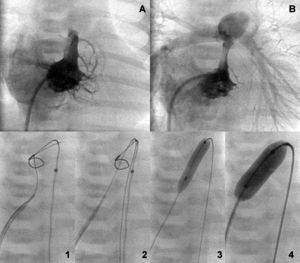
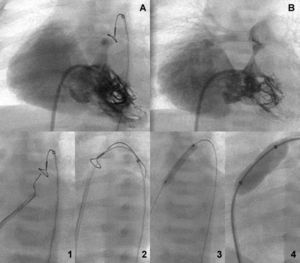
Fig. 2. Ventrículo bipartito antes y después de la apertura (A y B). Secuencia de perforación y valvuloplastia secuencial anterógrada (1-4).
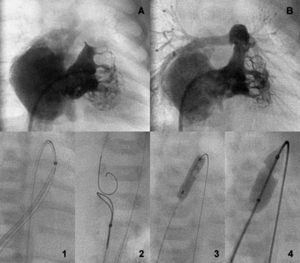
Fig. 3. Ventrículo bipartito antes y después de la apertura valvular (A y B). Secuencia de perforación retrógrada con captura de la guía por el lazo en la vena cava inferior y valvuloplastia secuencial anterógrada (1-4).
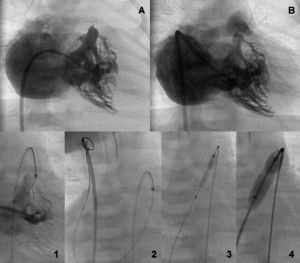
Fig. 4. Ventrículo tripartito con insuficiencia tricuspídea severa antes y después de la apertura valvular (A y B). Secuencia de perforación retrógrada con captura de la guía por lazo en la cava superior y valvuloplastia secuencial anterógrada (1-4).
Fig. 5. Ventrículo tripartito y lazo de Goose-Neck sobre la válvula atrésica (A). Perforación anterógrada y dilatación progresiva (1-4). Apertura valvular (B).
Tras el procedimiento, los pacientes fueron ingresados de nuevo en la unidad intensiva neonatal, manteniéndose la perfusión de PGE1 durante 5 ± 4 días, que fue reducida en los días siguientes de forma progresiva. El seguimiento se realizó en las consultas externas de cardiología pediátrica.
Las variables continuas se expresan como media ± desviación estándar y las categóricas como porcentaje. Se aplicó el test de la t de Student para datos emparejados y se consideraron significativos los valores de p < de 0,05. Los datos fueron introducidos en el programa SPSS versión 11.01.
RESULTADOS
En los 11 casos se confirmaron los datos ecocardiográficos con presencia de un infundíbulo y continuidad ventrículo pulmonar. Ocho presentaban un VD tripartito y 3, bipartito por obliteración de la porción trabeculada; 2 mostraron, además, obstrucción subpulmonar muscular y uno, sinusoides ventriculocoronarios, sin obstrucciones anatómicas y flujo coronario preservado en la aortografía.
Con esta técnica se llegó a dilatar la VP con un diámetro de balón máximo de 9,6 ± 1,2 mm8-12 con una relación balón/anillo de 143 ± 28%, obteniéndose los siguientes resultados:
1. Presencia de indentación o muesca en los catéteres balón que progresivamente abrieron la VP.
2. Reducción de la presión de VD de 97 ± 17 a 48 ± 13 mmHg (p < 0,001), con un gradiente valvular final de 18 ± 16 mmHg; en 2 casos persistió un gradiente superior a 40 mmHg y ambos presentaban obstrucción muscular-hipoplasia en la salida de VD.
3. Signos angiográficos de apertura de la VP con válvula móvil y buena contrastación del tronco y las ramas pulmonares.
4. Reducción en el grado de IT de 3,3 ± 0,9 a 2 ± 1,1 (p < 0,001) en la ventriculografía final, que se midió en 4 grados según la densidad de la contrastación de la aurícula derecha.
5. Ausencia de complicaciones inmediatas, taponamiento-derrame pericárdico o perforación cardiaca o de arteria pulmonar.
La anatomía del VD y los datos hemodinámicos anteriores y posteriores a la valvuloplastia se muestran en la tabla 1.
Tras el procedimiento, los pacientes fueron ingresados en la unidad de cuidados intensivos neonatal de una forma estable. Sin embargo, uno de ellos falleció 24 h después por un cuadro de embolismo pulmonar con gammagrafía pulmonar demostrativa y trombosis en las venas de la extremidad inferior derecha confirmada mediante Doppler.
En los siguientes días se redujo paulatinamente la infusión de PGE1 y en 6 casos (54%) no se realizó ningún otro procedimiento; en 4 casos (36%) fue preciso un flujo pulmonar adicional en el primer mes: 2 fístulas centrales, un Blalock-Taussig modificado y la implantación de un stent coronario de 4 × 18 en el ductus en otro caso. Los pacientes fueron dados de alta tras una estancia de 30 ± 15 días.
En el seguimiento de 25 ± 21 meses (intervalo, 2-60 meses), 2 pacientes con fístula previa fallecieron: uno de ellos a los 2 meses con un cuadro de insuficiencia cardiaca, realizándose un cierre quirúrgico de la fístula que evolucionó con un cuadro gravísimo de shock irrecuperable; el otro paciente falleció a los 5 meses, tras ingresar con un cuadro febril y una neumonía con una evolución tórpida, y posteriormente signos de gasto bajo grave; se realizó un cateterismo urgente que demostró la fístula permeable y se decidió realizar una intervención de Glenn, pero el paciente presentó un paro irrecuperable previo a la cirugía.
En 2 casos sintomáticos, y ante la presencia de gradientes severos de 50 y 60 mmHg y un VD muy hipoplásico-bipartito a la edad de 2 años y 2 años y medio, se realizó cirugía con parche de ampliación de la salida del VD y en uno de ellos además, intervención de Glenn bidireccional asociada (ventrículo y medio) con buena evolución en ambos.
En este seguimiento, los datos más relevantes fueron los siguientes:
1. Supervivencia del 72% de los niños en muy buena situación funcional, que alcanzaron un buen desarrollo.
2. Reducción de la presión de VD desde 48 ± 13 mmHg (hemodinámica) posvalvuloplastia hasta 33 ± 13 mmHg (Doppler) (p < 0,05), incluidos los casos con desobstrucción quirúrgica.
3. Incremento en el diámetro de la VT de 10 ± 2 a 16,5 ± 2 mm (p < 0,01) y reducción, aunque no significativa, de la z score de la VT de 1,1 ± 1,3 a 1,3 ± 1 a pesar del buen desarrollo somático de los niños.
4. Reducción no significativa del grado de la IT de 2 ± 1 a 1,3 ± 0,7 (p = NS).
5. Crecimiento del anillo de la VP de 6,7 ± 1,4 a 13 ± 1,8 mm (p < 0,001) y de la z pulmonar de 2,2 ± 1,9 a 0,1 ± 1,7 aunque no de forma significativa (p = NS).
6. En todos los casos se observó una insuficiencia pulmonar residual entre leve y moderada cuantificada de 1,8 ± 0,5.
DISCUSION
La APSI es una cardiopatía congénita con gran diversidad morfológica1-5. Esto se demostró en el estudio de colaboración del Reino Unido e Irlanda realizado por Daubeney et al17. De 183 casos, la atresia fue membranosa en el 74,7% y muscular en el 25,3%; el VD fue bipartito en el 33,6% de los casos y unipartito en el 7%; se identificaron anomalías coronarias en el 45,8% con estenosis/interrupción/ectasia en el 7,6% y la malformación de Ebstein se observó en 18 pacientes.
Las características anatómicas y morfológicas del VD son el principal determinante de la actitud terapéutica y la evolución de los pacientes con esta cardiopatía17-19. La mayoría de los autores considera que una reparación biventricular puede ser inviable cuando la z de la VT es menor de 4. Para Wang et al20, el tratamiento con catéter puede ser definitivo con una z tricúspide ≥ 0,1, z pulmonar ≥ 4,1 y relación de áreas ventriculares ≥ 0,65, y para Cheatham14, cuando el anillo de la VT es > 11, el de VP ≥ 7 mm y el volumen de VD ≥ 30 ml/m2.
En un intento de facilitar la actitud terapéutica, Alwi21 publicó recientemente un algoritmo sobre la actitud terapéutica en estos pacientes: grupo A, pacientes con el VD tripartito, bien desarrollado y atresia membranosa con z tricúspide > 2,5 cuyo tratamiento inicial, y quizá definitivo, es la ape rtura valvular mediante radiofrecuencia. Grupo C, pacientes con severa hipoplasia de VD unipartito, con z tricúspide < 5 donde el tratamiento inicial es la septostomía atrial, stent en ductus o Blalock-Taussig modificado, y como definitivo, la técnica de Glenn bidireccional a los 6-12 meses seguido de la intervención de Fontan. El grupo B o intermedio con el VD límite, con buen infundíbulo y porción trabeculada reducida con z tricúspide de 2,5 a 4,5 cuyo tratamiento inicial es la valvulotomía, stent en ductus y posible septostomía auricular; en este grupo también es frecuente la necesidad de reparación del tracto de salida del VD o del anillo de la VP y el «ventrículo y medio» cuando el VD no se desarrolla adecuadamente.
En algunos estudios, con la técnica de radiofrecuencia se demuestra una mayor eficacia que con la valvulotomía quirúrgica y con una menor mortalidad22, aunque en otros no se confirma y sí se demuestra una menor incidencia de gasto bajo posprocedimiento19. Tras los primeros informes sobre la apertura valvular en la APSI6-10, la técnica láser y, sobre todo, la radiofrecuencia experimentaron una gran expansión, publicándose diferentes series11,18,20,22-28. Los resultados con esta última técnica en la revisión de Benson et al29 muestran el éxito en el 87% de los casos, con una incidencia de complicaciones del 15%, de mortalidad del 8% y de necesidad de flujo adicional del 33%.
Las principales dificultades que se han descrito con la técnica mecánica de Latson6 se deben a la agresividad del extremo rígido de la guía, que puede perforar el tracto de salida y/o la arteria pulmonar, así como también la inestabilidad de posición del catéter subpulmonar cuando progresa la parte firme de la guía14. Con esta técnica, los resultados han sido inferiores a los obtenidos con radiofrecuencia, con un éxito inicial del 68% , una mortalidad del 4% y necesidad de un flujo pulmonar adicional en el 48%14.
En nuestra experiencia con casos que en principio son favorables para la apertura valvular y que corresponden al grupo A y B de Alwi21, conseguimos la apertura valvular en todos ellos y de una forma consecutiva durante un período de 5 años. Empleamos una técnica de Latson modificada. Nunca utilizamos el extremo rígido de la guía, sino guías especiales para la obstrucción crónica total coronaria, siempre por su parte más blanda y con orientación al lazo supravalvular. Ello permite una mayor estabilidad del catéter, que no se desplaza de su posición, y una menor agresividad, sin que se haya producido ningún caso de taponamiento o derrame pericárdico. La guía más eficaz en nuestra experiencia ha sido la «Cross it» la cual, además de tener cierta firmeza distal, presenta un afilamiento en su punta desde 0,014 hasta 0,010 pulgadas, con capacidad de enclavamiento y oradación al realizarse un movimiento rotacional con el apoyo del catéter próximo a la membrana a la cual perfora, dirigiéndose al lazo, al ductus y a la aorta descendente. Con respecto al catéter, hemos observado que, para infundíbulos amplios, el más estable es el Judkins derecho, y para infundíbulos estrechos, el Goodale Lubin, con el que se debe cuidar el paso de la guía por el orificio distal y evitar los 2 laterales.
El circuito arteriovenoso exteriorizado que facilita apoyo, junto con el bajo perfil de los catéteres monorraíl coronarios, permiten la apertura valvular inicial, procediéndose de una forma progresiva, como se ha referido12,16. Cuando la técnica anterógrada no era posible, realizamos ésta de forma retrógrada con efectividad, para luego dilatar progresivamente con los catéteres balón de forma anterógrada.
Consideramos que con la utilización de guías especiales para la obstrucción crónica total coronaria por su parte blanda hemos mejorado los resultados de la técnica mecánica, consiguiéndose la apertura valvular en el 100% de los casos y el éxito global del procedimiento en el 90%, con una mortalidad del 9% y necesidad de flujo adicional en un 36%.
En los diferentes estudios de seguimiento a medio y largo plazo se muestra una gran variedad de resultados que dependen en gran parte de la variabilidad anatómica y de la actitud terapéutica seguida18,19,30. La mortalidad se ha relacionado con el procedimiento de apertura, con la cirugía necesaria posterior o la definitiva, y también inherente a la cardiopatía en sí misma, en su evolución. En los estudios más amplios, la supervivencia es del 60-70% a los 5 años19,30 y puede compararse con la nuestra de un 72%, aunque con un seguimiento menor.
La apertura valvular permite un flujo mayor por la VT, el VD y la VP favoreciendo el desarrollo de estas estructuras; como en otras experiencias, observamos que, aunque la VP y la VT incrementan significativamente su diámetro, este aumento no es proporcional a la superficie corporal y no se aprecian cambios significativos de la puntuación z de la VT ni de la VP; de alguna manera, esto indica que la presencia de un cierto grado de hipodesarrollo de la VT y de las cavidades derechas no es imprescindible para mantener un flujo pulmonar suficiente18.
Las limitaciones que puede tener este trabajo se deben al número reducido de pacientes y a la ausencia de grupo control; sin embargo, se refuerza su valor al tratarse de casos consecutivos. Puede existir variabilidad interobservador en las mediciones cuantitativas y semicuantitativas realizadas en el seguimiento. Además, debe tenerse en cuenta que este grupo de hemodinámica realiza simultáneamente intervencionismo infantil y adulto, con amplia experiencia en desobstrucción coronaria, y sus resultados no deben generalizarse.
CONCLUSIONES
1. La valvuloplastia pulmonar con técnica mecánica sigue siendo válida en la APSI.
2. La modificación de la técnica clásica mediante guías especiales para la obstrucción crónica total coronaria por su parte blanda dirigida es menos agresiva y mejora los resultados.
3. En esta serie con anatomía favorable, los resultados son superponibles a los que se obtienen mediante radiofrecuencia.
ADDENDUM
En el tiempo de corrección de este trabajo se realizaron 2 casos con éxito.
AGRADECIMIENTO
A los Dres. Alberto Cabrera, José I, Arana y Carlos Romero por su colaboración.
Correspondencia: Dr. J. Alcíbar-Villa.
Sección de Hemodinámica. Hospital de Cruces.
Plaza Cruces, s/n. 48903 Baracaldo. Vizcaya. España.
Correo electrónico: jalcibar@hcru.osakidetza.net
Recibido el 15 de enero de 2007.
Aceptado para su publicación el 10 de mayo de 2007.