Introducción y objetivos
Los contrastes iodados pueden bloquear la síntesis de hormonas tiroideas. Nuestros objetivos fueron estudiar la incidencia de alteraciones tiroideas poscateterismo en niños con cardiopatía congénita, y analizar los factores predisponentes al desarrollo de hipotiroidismo postangiografía y evaluar la duración de éste.
Pacientes y Métodos
Entre febrero de 1993 y abril de 1997 se analizaron los niveles de tirotropina (TSH) y tiroxina libre (FT4) previos al cateterismo y en las dos semanas siguientes a éste, en 99 niños cardiópatas menores de tres años. En aquellos que presentaron elevación de la TSH postangiografía se repitieron semanalmente las determinaciones hasta observar su normalización, o hasta que se indicó tratamiento sustitutivo. Tanto los datos de los pacientes (edad, exposición previa a contrastes, cardiopatía, malformaciones asociadas, insuficiencia renal, gravedad, tratamiento, etc.) como los datos del cateterismo (cantidad y tipo de contraste, etc.) se sometieron al análisis univariante.
Resultados
En la primera semana poscateterismo se observó elevación de la cifra media de TSH y disminución de la cifra media de FT4,ambas significativas (p < 0,01), respecto a los valores basales. Diecinueve pacientes (19,2%) presentaron patrón de hipotiroidismo (cifras de TSH >10 mUI/ml), mantenido más de tres semanas en 6 casos. La presencia de síndromes polimalformativos fue el factor de riesgo más claramente asociado tanto al desarrollo de hipotiroidismo postangiografía (p < 0,01) como a la mayor duración de éste.
Conclusión
En los pacientes portadores de síndromes polimalformativos debería realizarse un control de función tiroidea tras la realización de angiocardiografía con contrastes iodados.
Palabras clave
Tiroides
Pediatría
Cateterismo cardíaco
Cardiopatías congénitas
Medios de contraste
INTRODUCCIÓN
En el cateterismo cardíaco, la opacificación del sistema cardiovascular se consigue mediante la inyección de un material radiopaco. Estos medios de contraste se componen de moléculas orgánicas a las que se incorporan un cierto número de átomos de yodo, que por su elevado número atómico absorbe en gran medida la radiación X. Los agentes usados en angiocardiografía pediátrica tienen concentraciones de yodo que oscilan entre los 300 y 350 mg/ml.
Cuando se produce un aumento brusco en las concentraciones plasmáticas de yodo (como sucede tras la inyección intravenosa de contraste yodado), y aumenta el contenido en yodo dentro de la glándula tiroides por encima de un determinado nivel, disminuye la organificación de este elemento, aumenta la relación monoyodotironina/diyodotironina y disminuye la síntesis de hormonas tiroideas (efecto Wolff-Chaikoff) 1,2. En condiciones normales, las concentraciones de hormonas tiroideas circulantes permanecen dentro del rango eutiroideo, y en pocos días se recupera la síntesis hormonal («fenómeno de escape»). Sin embargo, en los pacientes con enfermedad tiroidea (enfermedad de Graves, tiroiditis de Hashimoto, etc.) o incluso en aquellos que presentan disfunción tiroidea subclínica, estos mecanismos de adaptación fracasan a menudo, y las sobrecargas de yodo pueden desencadenar situaciones de hipotiroidismo 3-5 y más raramente de hipertiroidismo 6,7. El tiroides del feto y el recién nacido son otro ejemplo clásico de susceptibilidad aumentada a las sobrecargas de yodo: se han descrito casos de hipotiroidismo y bocio en fetos tras realización de amniofetografía 8,9, y en los recién nacidos ingresados en unidades de cuidados intensivos tras utilización tópica de desinfectantes yodados 10-12,14,15 o la inyección de pequeñas cantidades (1-2 ml) de contraste para control de posición de catéteres 13,16. Así, en el estudio de Ares et al 16, los niños prematuros expuestos a cantidades de contraste yodado inferiores a 1 ml, tras la inserción del catéter central, presentaban elevación de las cifras de TSH y disminución de las de T4 respecto a los prematuros no expuestos al yodo, precisando alguno de ellos tratamiento hormonal sustitutivo. En este tipo de pacientes, es fundamental el diagnóstico precoz de las situaciones de hipotiroidismo, para instaurar el tratamiento sustitutivo y evitar las secuelas neurológicas que el hipotiroidismo, aunque sea transitorio, puede dejar en el cerebro en desarrollo del niño 17-20. Los estudios publicados sobre función tiroidea en niños tras la realización de cateterismo cardíaco son escasos 21-23 y limitados al primer año de vida, pero señalan una incidencia significativa de hipertirotropinemia (hasta el 28%) y de hipotiroidismo (hasta el 35%, con los contrastes iónicos), que en algunos casos precisó la instauración de tratamiento sustitutivo con tiroxina. Por otra parte, y aunque alguno de estos trabajos señalan posibles factores predisponentes al desarrollo de hipotiroidismo tras exposición a contrastes yodados (edad menor de 3 meses 21, mayor cantidad de contraste utilizada 13, prematuridad 15,16, insuficiencia renal 22, etc.) éste es un tema todavía poco claro. Así, en el estudio de Linder 23 sobre una muestra de 21 neonatos con cardiopatía congénita expuestos a cateterismo y/o cirugía cardíaca (empleando povidona yodada para la desinfección del campo quirúrgico) no se encuentran diferencias significativas en la edad gestacional entre los niños que presentan elevación de la TSH y/o disminución de la T4 y los que no presentaron alteración de su función tiroidea tras la exposición al yodo.
Los objetivos de nuestro trabajo fueron: estudiar la incidencia de alteraciones tiroideas en niños con cardiopatía congénita tras la realización del cateterismo cardíaco, analizar los posibles factores predisponentes al desarrollo de hipotiroidismo postangiografía, y evaluar la duración del trastorno hormonal. PACIENTES Y MÉTODOS
Selección de pacientes
Entre febrero de 1993 a mayo de 1994 y de abril de 1996 a abril de 1997 se estudiaron 99 niños con cardiopatía congénita, de edades comprendidas entre 1 día y tres años (media 9,3 ± 11,1 meses). Todos ellos presentaban cifras normales de hormonas tiroideas en la determinación basal, y ninguno recibió, durante el período de seguimiento, tratamiento con fármacos que pueden alterar la función tiroidea (amiodarona, propranolol, etc.).
Métodos
En todos los niños se analizó la tiroxina libre (FT4) y la hormona estimulante del tiroides (TSH) previa a la realización del cateterismo y en la primera semana poscateterismo. En aquellos pacientes que presentaron elevación significativa de la TSH tras el cateterismo se repitieron las determinaciones hormonales semanalmente hasta observar su normalización o hasta que se consideró indicado el tratamiento sustitutivo. La determinación de FT4 y TSH se hizo mediante enzimoinmunoensayo, siendo el rango de normalidad para la TSH de 0,1-6,3 mUI/ml, y para la FT4 de 0,75-2,1 ng/dl.
En todos los casos se recogieron los siguientes datos: edad cronológica (edad media, 9,3 ± 11 meses; rango 1 día a 36 meses) y edad gestacional (antecedente de prematuridad en 16 pacientes); sexo (51 varones y 48 mujeres); peso (6,1 ± 3,5 kg; rango 1,3-16 kg); talla; superficie corporal (0,3 ± 0,13 m 2; rango, 0,1-0,63 m 2); historia de exposición a contrastes yodados en los tres meses previos al cateterismo (n = 31); tipo de cardiopatía (tabla 1); presencia de malformaciones asociadas a la cardiopatía (tabla 2); gravedad clínica del paciente (expresada a través del Therapeutic Intervention Scoring System de Cullen 24) en el momento de realizarse la angiografía y durante el período de seguimiento; presencia de insuficiencia hepática (5 pacientes) o renal (12 pacientes); fármacos recibidos durante el período de estudio, y realización de cirugía cardíaca cerrada o extracorpórea en las 2 semanas siguientes al cateterismo.
El cateterismo se realizó mediante técnica percutánea, evitando la utilización de desinfectantes yodados para la preparación del campo. En todos los casos se registraron el tipo de contraste empleado (iohexol en 59 pacientes e iopromida en 40 pacientes), cantidad de contraste inyectada expresada en cm 3 por kg de peso (6,5 ± 2,03; rango, 1,7-13,2) y tiempo de radioescopia (en minutos) utilizado en cada procedimiento (28 ± 18; rango, 7-88 min).
Análisis estadístico
El estudio descriptivo de los datos se realizó mediante media, rango y desviación estándar para las variables cuantitativas. Para la comparación de medias de datos apareados se utilizó la t de Student apareada en aquellos parámetros con distribución normal, y el test de Wilcoxon en caso contrario.
Tanto las características clínicas del paciente como los datos técnicos del cateterismo fueron sometidos a un análisis univariante con objeto de seleccionar las variables relacionadas con el desarrollo de hipotiroidismo postangiografía. Se empleó el test de la t de Student para las variables cuantitativas y el test de la c2 para las cualitativas. Posteriormente, seleccionando las variables relacionadas con el desarrollo de hipotiroidismo, se aplicó un modelo de regresión logística (coeficiente de correlación de Spearman) en el análisis multivariante, para evitar factores de confusión y calcular el riesgo relativo de padecer hipotiroidismo postangiografía en cada grupo de estudio.
RESULTADOS
Variación de las cifras hormonales
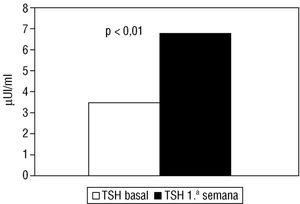
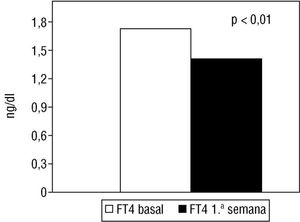
En la primera semana poscateterismo se observó un aumento significativo (p < 0,01) de la cifra media de TSH (fig. 1) y disminución de la cifra media de tiroxina libre (fig. 2) respecto a los valores basales.
Incidencia de hipotiroidismo
Diecinueve de los 99 pacientes estudiados (19,2%) presentaron un patrón de hipotiroidismo subclínico (TSH > 10 mUI/ml con FT4 normal) o clínico (TSH > 20 mUI/ml, FT4 disminuida o sintomatología compatible con el diagnóstico). En ocho de los niños la elevación de la TSH se acompañó de hipotiroxinemia.
Factores de riesgo para el desarrollo de hipotiroidismo
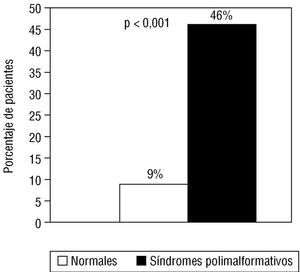
La presencia de cromosomopatías o síndromes polimalformativos se relacionó de forma estadísticamente significativa (p < 0,01) con una mayor incidencia de hipotiroidismo postangiografía, como se expone en la tabla 3. Sin embargo, en los casos con una única malformación asociada a la cardiopatía no se observaron alteraciones tiroideas por lo que, a efectos del estudio estadístico, los pacientes fueron agrupados del siguiente modo: grupo I: pacientes con fenotipo normal o una única malformación asociada a la cardiopatía, y grupo II: cromosomopatías y síndromes polimalformativos, resultando la incidencia de hipotiroidismo postangiografía muy superior en el grupo II, como se aprecia en la figura 3.
La incidencia de hipotiroidismo postangiografía en los distintos grupos de cardiopatías se expone en la tabla 4. La distribución de los datos no permitió analizar si las diferencias entre los distintos grupos fueron significativas.
La edad (tabla 5), el peso, el antecedente de prematuridad (tabla 6), la gravedad clínica, la presencia de insuficiencia renal o hepática, la exposición previa a contrastes yodados y el tratamiento farmacológico no pusieron de manifiesto relación significativa con la aparición de hipotiroidismo. Únicamente se observó relación entre la aparición de hipotiroidismo y la realización de cirugía cardíaca cerrada o con extracorpórea (tabla 7), aunque con significación estadística límite (p = 0,054). Los factores dependientes del cateterismo (tiempo de radioescopia, cantidad y tipo de contraste empleado) tampoco mostraron relación con el desarrollo de hipotiroidismo.
En el análisis multivariante (en el que se incluyeron todas las variables que habían alcanzado en el análisis univariante un valor de p < 0,25, así como el tipo de cardiopatía), la presencia de síndromes polimalformativos resultó el factor de riesgo con mayor significación estadística (p < 0,01) para el desarrollo de hipotiroidismo postangiografía (tabla 8).
Duración del hipotiroidismo
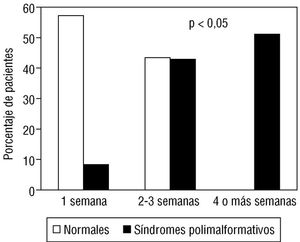
Los pacientes que presentaron patrón de hipotiroidismo fueron clasificados en función de la duración de éste, como se expone en la tabla 9. Nuevamente, la presencia de síndromes polimalformativos se asoció de forma significativa (p < 0,05) a la mayor duración del trastorno hormonal, observándose una relación de aumento prácticamente lineal en la proporción de pacientes con cromosomopatías al aumentar la duración del hipotiroidismo (fig. 4).
Fig. 1. Variación de la cifra media de TSH en la primera semana poscateterismo (TSH 1.a semana) respecto a los valores basales (TSH basal).
Fig. 2. Variación de la cifra media de FT4 (tiroxina libre) en la primera semana poscateterismo (FT4 1.a semana) respecto a los valores basales (FT4 basal).
Fig. 4. Relación entre la duración del hipotiroidismo postangiografía y la presencia de síndromes polimalformativos.
Fig. 3. Diferencias en la incidencia de hipotiroidismo postangiografía entre los niños «normales» y los portadores de síndromes polimalformativos.
DISCUSIÓN
La incidencia de hipotiroidismo postangiografía encontrada en los pacientes de nuestro estudio resulta comparable a las publicadas por otros autores en poblaciones de neonatos a término y prematuros expuestos a dosis farmacológicas de yodo 11,23,25.
Factores relacionados con el desarrollo de hipotirodismo
Contrariamente a lo señalado en otros estudios 21, la incidencia de hipotiroidismo tras exposición a contrastes yodados no disminuyó al aumentar la edad de nuestros pacientes: el 17,2% en los menores de un mes, el 25% en los de uno a seis meses y el 16,7% en los de 6 meses a 3 años. Este hecho, en el que influyen las características de la población estudiada (p. ej., asociación de cromosomopatías, etc.), nos lleva a suponer que estas alteraciones podrían producirse también en los niños mayores de 3 años, en los que hasta el momento no se ha estudiado este fenómeno.
La presencia de cromosomopatías o síndromes polimalformativos asociados a la cardiopatía fue el factor de riesgo más claramente relacionado, tanto con el desarrollo de hipotiroidismo (p < 0,01) como con la mayor duración del trastorno hormonal (p < 0,05). Esta asociación se explicaría por la existencia en estos niños de una alteración tiroidea subclínica previa (genéticamente determinada), que sería la responsable del fallo de los mecanismos de autorregulación.
Entre los pacientes portadores de síndromes polimalformativos incluidos en nuestro estudio, el grupo más numeroso (44,8%) lo constituían los afectados por el síndrome de Down, que presentaron la inciden-cia más elevada de hipotiroidismo postangiografía (53,8%). Como ya es sabido, en los portadores de la trisomía 21 son frecuentes los estados de hipotiroidismo, ya sean debidos a mecanismos de autoinmunidad 26,27 o a disgenesia tiroidea congénita 28,29, pero hasta la fecha no se había descrito en estos pacientes la aparición de hipotiroidismo tras la inyección de contrastes yodados; por otra parte, las situaciones de hipotiroidismo, incluso subclínico, se han relacionado en los niños con retraso en la curva de crecimiento 30 y mayor incidencia de demencia senil en los adultos con síndrome de Down 31.
Del mismo modo, en los pacientes portadores del síndrome de Turner o Noonan encontramos una incidencia muy elevada de hipotiroidismo tras la realización de la angiografía, cuya relación con las alteraciones tiroideas subclínicas que frecuentemente presentan estos síndromes 32,33, es muy probable. Otro de los subgrupos de nuestro estudio que presentó una incidencia elevada (50%) de hipotiroidismo fue el de los portadores del síndrome de DiGeorge, en el que también están descritas hipoplasia 34-36 o disgenesia tiroidea 37 e hipotiroidismos primarios 38.
Implicaciones clínicas del hipotiroidismo inducido por la angiografía
En la edad pediátrica, las situaciones de hipotiroidismo, aunque sean transitorias, pueden tener repercusiones en el desarrollo neurológico y somático del niño 18,19, por lo que cuando éstas se prolongan durante más de 3-4 semanas debe considerarse iniciar el tratamiento hormonal sustitutivo (dependiendo de la edad, situación clínica, severidad del hipotiroidismo, patología asociada, etc.).
Por otra parte, en diversos estudios sobre pacientes con insuficiencia cardíaca o enfermos críticos en general, la hipotiroxinemia aparece como factor de mal pronóstico 39 e indicador de mayor mortalidad; y a la inversa, son cada vez más numerosos los trabajos que demuestran un efecto inotrópico beneficioso de la hormona tiroidea administrada por vía intravenosa en el postoperatorio inmediato tras cirugía cardíaca con circulación extracorpórea 40, o enfermos en shock cardiogénico 41. En el trabajo de Bettendorf 42, sobre 132 niños con cardiopatía congénita sometidos a cirugía extracorpórea, aquellos que desarrollaban hipotiroidismo secundario transitorio precisaban ventilación mecánica más prolongada y mayores dosis de diuréticos y fármacos vasoactivos. De este modo, también las situaciones de hipotiroidismo primario transitorio que aparecen en algunos lactantes con cardiopatía congénita tras la realización del cateterismo cardíaco pueden actuar per se como un factor agravante en el curso de su enfermedad.
Limitaciones del estudio
En primer lugar, es posible que por la periodicidad elegida para realizar las determinaciones hormonales (1 por semana) algunas situaciones de hipotiroidismo de muy corta duración no fueran detectadas, si bien la repercusión clínica de las mismas es poco importante. En segundo lugar, la elevada incidencia de hipotiroidismo observada en los subgrupos de pacientes con menor número de casos (p. ej., 2 casos de síndrome de Turner/Noonan, 4 casos de síndrome de DiGeorge, etc.) precisaría confirmación en ulteriores estudios con un número más elevado de enfermos. CONCLUSIÓN
1. La incidencia encontrada de hipotiroidismo postangiografía en los niños menores de tres años justificaría en principio la realización de un control de función tiroidea tras dicha exploración.
2. La asociación de síndromes polimalformativos a la cardiopatía es el factor de riesgo más claramente asociado, tanto al desarrollo de hipotiroidismo como a la mayor duración de éste.
3. Puesto que las situaciones de hipotiroidismo de duración mayor de tres semanas se produjeron sólo en los portadores de síndromes polimalformativos, al menos en este tipo de pacientes debería ser obligada la realización de un screening de función tiroidea tras la angiografía con contrastes yodados, ya que algunos de estos niños pueden precisar tratamiento sustitutivo.
En el cateterismo cardíaco, la opacificación del sistema cardiovascular se consigue mediante la inyección de un material radiopaco. Estos medios de contraste se componen de moléculas orgánicas a las que se incorporan un cierto número de átomos de yodo, que por su elevado número atómico absorbe en gran medida la radiación X. Los agentes usados en angiocardiografía pediátrica tienen concentraciones de yodo que oscilan entre los 300 y 350 mg/ml.
Cuando se produce un aumento brusco en las concentraciones plasmáticas de yodo (como sucede tras la inyección intravenosa de contraste yodado), y aumenta el contenido en yodo dentro de la glándula tiroides por encima de un determinado nivel, disminuye la organificación de este elemento, aumenta la relación monoyodotironina/diyodotironina y disminuye la síntesis de hormonas tiroideas (efecto Wolff-Chaikoff) 1,2. En condiciones normales, las concentraciones de hormonas tiroideas circulantes permanecen dentro del rango eutiroideo, y en pocos días se recupera la síntesis hormonal («fenómeno de escape»). Sin embargo, en los pacientes con enfermedad tiroidea (enfermedad de Graves, tiroiditis de Hashimoto, etc.) o incluso en aquellos que presentan disfunción tiroidea subclínica, estos mecanismos de adaptación fracasan a menudo, y las sobrecargas de yodo pueden desencadenar situaciones de hipotiroidismo 3-5 y más raramente de hipertiroidismo 6,7. El tiroides del feto y el recién nacido son otro ejemplo clásico de susceptibilidad aumentada a las sobrecargas de yodo: se han descrito casos de hipotiroidismo y bocio en fetos tras realización de amniofetografía 8,9, y en los recién nacidos ingresados en unidades de cuidados intensivos tras utilización tópica de desinfectantes yodados 10-12,14,15 o la inyección de pequeñas cantidades (1-2 ml) de contraste para control de posición de catéteres 13,16. Así, en el estudio de Ares et al 16, los niños prematuros expuestos a cantidades de contraste yodado inferiores a 1 ml, tras la inserción del catéter central, presentaban elevación de las cifras de TSH y disminución de las de T4 respecto a los prematuros no expuestos al yodo, precisando alguno de ellos tratamiento hormonal sustitutivo. En este tipo de pacientes, es fundamental el diagnóstico precoz de las situaciones de hipotiroidismo, para instaurar el tratamiento sustitutivo y evitar las secuelas neurológicas que el hipotiroidismo, aunque sea transitorio, puede dejar en el cerebro en desarrollo del niño 17-20. Los estudios publicados sobre función tiroidea en niños tras la realización de cateterismo cardíaco son escasos 21-23 y limitados al primer año de vida, pero señalan una incidencia significativa de hipertirotropinemia (hasta el 28%) y de hipotiroidismo (hasta el 35%, con los contrastes iónicos), que en algunos casos precisó la instauración de tratamiento sustitutivo con tiroxina. Por otra parte, y aunque alguno de estos trabajos señalan posibles factores predisponentes al desarrollo de hipotiroidismo tras exposición a contrastes yodados (edad menor de 3 meses 21, mayor cantidad de contraste utilizada 13, prematuridad 15,16, insuficiencia renal 22, etc.) éste es un tema todavía poco claro. Así, en el estudio de Linder 23 sobre una muestra de 21 neonatos con cardiopatía congénita expuestos a cateterismo y/o cirugía cardíaca (empleando povidona yodada para la desinfección del campo quirúrgico) no se encuentran diferencias significativas en la edad gestacional entre los niños que presentan elevación de la TSH y/o disminución de la T4 y los que no presentaron alteración de su función tiroidea tras la exposición al yodo.
Los objetivos de nuestro trabajo fueron: estudiar la incidencia de alteraciones tiroideas en niños con cardiopatía congénita tras la realización del cateterismo cardíaco, analizar los posibles factores predisponentes al desarrollo de hipotiroidismo postangiografía, y evaluar la duración del trastorno hormonal. PACIENTES Y MÉTODOS
Selección de pacientes
Entre febrero de 1993 a mayo de 1994 y de abril de 1996 a abril de 1997 se estudiaron 99 niños con cardiopatía congénita, de edades comprendidas entre 1 día y tres años (media 9,3 ± 11,1 meses). Todos ellos presentaban cifras normales de hormonas tiroideas en la determinación basal, y ninguno recibió, durante el período de seguimiento, tratamiento con fármacos que pueden alterar la función tiroidea (amiodarona, propranolol, etc.).
Métodos
En todos los niños se analizó la tiroxina libre (FT4) y la hormona estimulante del tiroides (TSH) previa a la realización del cateterismo y en la primera semana poscateterismo. En aquellos pacientes que presentaron elevación significativa de la TSH tras el cateterismo se repitieron las determinaciones hormonales semanalmente hasta observar su normalización o hasta que se consideró indicado el tratamiento sustitutivo. La determinación de FT4 y TSH se hizo mediante enzimoinmunoensayo, siendo el rango de normalidad para la TSH de 0,1-6,3 mUI/ml, y para la FT4 de 0,75-2,1 ng/dl.
En todos los casos se recogieron los siguientes datos: edad cronológica (edad media, 9,3 ± 11 meses; rango 1 día a 36 meses) y edad gestacional (antecedente de prematuridad en 16 pacientes); sexo (51 varones y 48 mujeres); peso (6,1 ± 3,5 kg; rango 1,3-16 kg); talla; superficie corporal (0,3 ± 0,13 m 2; rango, 0,1-0,63 m 2); historia de exposición a contrastes yodados en los tres meses previos al cateterismo (n = 31); tipo de cardiopatía (tabla 1); presencia de malformaciones asociadas a la cardiopatía (tabla 2); gravedad clínica del paciente (expresada a través del Therapeutic Intervention Scoring System de Cullen 24) en el momento de realizarse la angiografía y durante el período de seguimiento; presencia de insuficiencia hepática (5 pacientes) o renal (12 pacientes); fármacos recibidos durante el período de estudio, y realización de cirugía cardíaca cerrada o extracorpórea en las 2 semanas siguientes al cateterismo.
El cateterismo se realizó mediante técnica percutánea, evitando la utilización de desinfectantes yodados para la preparación del campo. En todos los casos se registraron el tipo de contraste empleado (iohexol en 59 pacientes e iopromida en 40 pacientes), cantidad de contraste inyectada expresada en cm 3 por kg de peso (6,5 ± 2,03; rango, 1,7-13,2) y tiempo de radioescopia (en minutos) utilizado en cada procedimiento (28 ± 18; rango, 7-88 min).
Análisis estadístico
El estudio descriptivo de los datos se realizó mediante media, rango y desviación estándar para las variables cuantitativas. Para la comparación de medias de datos apareados se utilizó la t de Student apareada en aquellos parámetros con distribución normal, y el test de Wilcoxon en caso contrario.
Tanto las características clínicas del paciente como los datos técnicos del cateterismo fueron sometidos a un análisis univariante con objeto de seleccionar las variables relacionadas con el desarrollo de hipotiroidismo postangiografía. Se empleó el test de la t de Student para las variables cuantitativas y el test de la c2 para las cualitativas. Posteriormente, seleccionando las variables relacionadas con el desarrollo de hipotiroidismo, se aplicó un modelo de regresión logística (coeficiente de correlación de Spearman) en el análisis multivariante, para evitar factores de confusión y calcular el riesgo relativo de padecer hipotiroidismo postangiografía en cada grupo de estudio.
RESULTADOS
Variación de las cifras hormonales
En la primera semana poscateterismo se observó un aumento significativo (p < 0,01) de la cifra media de TSH (fig. 1) y disminución de la cifra media de tiroxina libre (fig. 2) respecto a los valores basales.
Incidencia de hipotiroidismo
Diecinueve de los 99 pacientes estudiados (19,2%) presentaron un patrón de hipotiroidismo subclínico (TSH > 10 mUI/ml con FT4 normal) o clínico (TSH > 20 mUI/ml, FT4 disminuida o sintomatología compatible con el diagnóstico). En ocho de los niños la elevación de la TSH se acompañó de hipotiroxinemia.
Factores de riesgo para el desarrollo de hipotiroidismo
La presencia de cromosomopatías o síndromes polimalformativos se relacionó de forma estadísticamente significativa (p < 0,01) con una mayor incidencia de hipotiroidismo postangiografía, como se expone en la tabla 3. Sin embargo, en los casos con una única malformación asociada a la cardiopatía no se observaron alteraciones tiroideas por lo que, a efectos del estudio estadístico, los pacientes fueron agrupados del siguiente modo: grupo I: pacientes con fenotipo normal o una única malformación asociada a la cardiopatía, y grupo II: cromosomopatías y síndromes polimalformativos, resultando la incidencia de hipotiroidismo postangiografía muy superior en el grupo II, como se aprecia en la figura 3.
La incidencia de hipotiroidismo postangiografía en los distintos grupos de cardiopatías se expone en la tabla 4. La distribución de los datos no permitió analizar si las diferencias entre los distintos grupos fueron significativas.
La edad (tabla 5), el peso, el antecedente de prematuridad (tabla 6), la gravedad clínica, la presencia de insuficiencia renal o hepática, la exposición previa a contrastes yodados y el tratamiento farmacológico no pusieron de manifiesto relación significativa con la aparición de hipotiroidismo. Únicamente se observó relación entre la aparición de hipotiroidismo y la realización de cirugía cardíaca cerrada o con extracorpórea (tabla 7), aunque con significación estadística límite (p = 0,054). Los factores dependientes del cateterismo (tiempo de radioescopia, cantidad y tipo de contraste empleado) tampoco mostraron relación con el desarrollo de hipotiroidismo.
En el análisis multivariante (en el que se incluyeron todas las variables que habían alcanzado en el análisis univariante un valor de p < 0,25, así como el tipo de cardiopatía), la presencia de síndromes polimalformativos resultó el factor de riesgo con mayor significación estadística (p < 0,01) para el desarrollo de hipotiroidismo postangiografía (tabla 8).
Duración del hipotiroidismo
Los pacientes que presentaron patrón de hipotiroidismo fueron clasificados en función de la duración de éste, como se expone en la tabla 9. Nuevamente, la presencia de síndromes polimalformativos se asoció de forma significativa (p < 0,05) a la mayor duración del trastorno hormonal, observándose una relación de aumento prácticamente lineal en la proporción de pacientes con cromosomopatías al aumentar la duración del hipotiroidismo (fig. 4).
Fig. 1. Variación de la cifra media de TSH en la primera semana poscateterismo (TSH 1.a semana) respecto a los valores basales (TSH basal).
Fig. 2. Variación de la cifra media de FT4 (tiroxina libre) en la primera semana poscateterismo (FT4 1.a semana) respecto a los valores basales (FT4 basal).
Fig. 4. Relación entre la duración del hipotiroidismo postangiografía y la presencia de síndromes polimalformativos.
Fig. 3. Diferencias en la incidencia de hipotiroidismo postangiografía entre los niños «normales» y los portadores de síndromes polimalformativos.
DISCUSIÓN
La incidencia de hipotiroidismo postangiografía encontrada en los pacientes de nuestro estudio resulta comparable a las publicadas por otros autores en poblaciones de neonatos a término y prematuros expuestos a dosis farmacológicas de yodo 11,23,25.
Factores relacionados con el desarrollo de hipotirodismo
Contrariamente a lo señalado en otros estudios 21, la incidencia de hipotiroidismo tras exposición a contrastes yodados no disminuyó al aumentar la edad de nuestros pacientes: el 17,2% en los menores de un mes, el 25% en los de uno a seis meses y el 16,7% en los de 6 meses a 3 años. Este hecho, en el que influyen las características de la población estudiada (p. ej., asociación de cromosomopatías, etc.), nos lleva a suponer que estas alteraciones podrían producirse también en los niños mayores de 3 años, en los que hasta el momento no se ha estudiado este fenómeno.
La presencia de cromosomopatías o síndromes polimalformativos asociados a la cardiopatía fue el factor de riesgo más claramente relacionado, tanto con el desarrollo de hipotiroidismo (p < 0,01) como con la mayor duración del trastorno hormonal (p < 0,05). Esta asociación se explicaría por la existencia en estos niños de una alteración tiroidea subclínica previa (genéticamente determinada), que sería la responsable del fallo de los mecanismos de autorregulación.
Entre los pacientes portadores de síndromes polimalformativos incluidos en nuestro estudio, el grupo más numeroso (44,8%) lo constituían los afectados por el síndrome de Down, que presentaron la inciden-cia más elevada de hipotiroidismo postangiografía (53,8%). Como ya es sabido, en los portadores de la trisomía 21 son frecuentes los estados de hipotiroidismo, ya sean debidos a mecanismos de autoinmunidad 26,27 o a disgenesia tiroidea congénita 28,29, pero hasta la fecha no se había descrito en estos pacientes la aparición de hipotiroidismo tras la inyección de contrastes yodados; por otra parte, las situaciones de hipotiroidismo, incluso subclínico, se han relacionado en los niños con retraso en la curva de crecimiento 30 y mayor incidencia de demencia senil en los adultos con síndrome de Down 31.
Del mismo modo, en los pacientes portadores del síndrome de Turner o Noonan encontramos una incidencia muy elevada de hipotiroidismo tras la realización de la angiografía, cuya relación con las alteraciones tiroideas subclínicas que frecuentemente presentan estos síndromes 32,33, es muy probable. Otro de los subgrupos de nuestro estudio que presentó una incidencia elevada (50%) de hipotiroidismo fue el de los portadores del síndrome de DiGeorge, en el que también están descritas hipoplasia 34-36 o disgenesia tiroidea 37 e hipotiroidismos primarios 38.
Implicaciones clínicas del hipotiroidismo inducido por la angiografía
En la edad pediátrica, las situaciones de hipotiroidismo, aunque sean transitorias, pueden tener repercusiones en el desarrollo neurológico y somático del niño 18,19, por lo que cuando éstas se prolongan durante más de 3-4 semanas debe considerarse iniciar el tratamiento hormonal sustitutivo (dependiendo de la edad, situación clínica, severidad del hipotiroidismo, patología asociada, etc.).
Por otra parte, en diversos estudios sobre pacientes con insuficiencia cardíaca o enfermos críticos en general, la hipotiroxinemia aparece como factor de mal pronóstico 39 e indicador de mayor mortalidad; y a la inversa, son cada vez más numerosos los trabajos que demuestran un efecto inotrópico beneficioso de la hormona tiroidea administrada por vía intravenosa en el postoperatorio inmediato tras cirugía cardíaca con circulación extracorpórea 40, o enfermos en shock cardiogénico 41. En el trabajo de Bettendorf 42, sobre 132 niños con cardiopatía congénita sometidos a cirugía extracorpórea, aquellos que desarrollaban hipotiroidismo secundario transitorio precisaban ventilación mecánica más prolongada y mayores dosis de diuréticos y fármacos vasoactivos. De este modo, también las situaciones de hipotiroidismo primario transitorio que aparecen en algunos lactantes con cardiopatía congénita tras la realización del cateterismo cardíaco pueden actuar per se como un factor agravante en el curso de su enfermedad.
Limitaciones del estudio
En primer lugar, es posible que por la periodicidad elegida para realizar las determinaciones hormonales (1 por semana) algunas situaciones de hipotiroidismo de muy corta duración no fueran detectadas, si bien la repercusión clínica de las mismas es poco importante. En segundo lugar, la elevada incidencia de hipotiroidismo observada en los subgrupos de pacientes con menor número de casos (p. ej., 2 casos de síndrome de Turner/Noonan, 4 casos de síndrome de DiGeorge, etc.) precisaría confirmación en ulteriores estudios con un número más elevado de enfermos. CONCLUSIÓN
1. La incidencia encontrada de hipotiroidismo postangiografía en los niños menores de tres años justificaría en principio la realización de un control de función tiroidea tras dicha exploración.
2. La asociación de síndromes polimalformativos a la cardiopatía es el factor de riesgo más claramente asociado, tanto al desarrollo de hipotiroidismo como a la mayor duración de éste.
3. Puesto que las situaciones de hipotiroidismo de duración mayor de tres semanas se produjeron sólo en los portadores de síndromes polimalformativos, al menos en este tipo de pacientes debería ser obligada la realización de un screening de función tiroidea tras la angiografía con contrastes yodados, ya que algunos de estos niños pueden precisar tratamiento sustitutivo.
Bibliografía
[1]
Plasma inorganic iodide as a homeostatic regulator of thyroid function. J Biol Chem 1948; 174: 555-564.
[2]
The inhibitory action of excessive iodine upon the synthesis of diiodotyrosine and of thyroxine in the thyroid gland of the normal rat. Endocrinology 1948; 43: 174-179.
[3]
Significance of the iodide-perclorate discharge test in patients with I111 treated and untreated hyperthyroidism. J Clin Endocrinol 1972; 34: 32-338.
[4]
Iodide-induced thyrotoxicosis in Boston. N Engl J Med 1972; 287: 523-527.
[5]
Significance of iodide-perchlorate discharge test for detection of iodine organification defect of the thyroid. J Clin Endoctinol 1970; 31: 144-146.
[6]
Increase in thyrotoxicosis in endemic goiter area after iodination of bread. Lancet 1970; 1: 500-502.
[7]
Iodine-induced hyperthyroidism due to nonionic contrast radiography in the elderly. Am J Med 1993; 95: 78-81.
[8]
Congenital goitre and hypothyroidism due to intra-uterine application of iodine-containing contrast medium. Acta Paediat Scand 1973; 62: 108-109.
[9]
Un accident de l'amniofetographie: l'hypothyroidie. Arch Fr Pediatr 1977; 34: 543-551.
[10]
Goitre and hypothyroidism in the newborn after cutaneous absorption of iodine. Arch Dis Child 1978; 53: 495-498.
[11]
Topical iodine-containig antiseptics and neonatal hypothyroidism in very-low-birth-weight infants. Lancet 1989; 16: 661-664.
[12]
Iodine in contrast agents and skin disinfectants is the major cause for hypothyroidism in premature infants during intensive care. Horm Res 1987; 28: 42-49.
[13]
Hypothyroidie transitoire aprés opacification iodée des cathéters, épicutanéocaves en réanimation néonatale. Arch Fr Pediatr 1993; 50: 271-274.
[14]
Measurement of urinary iodine excretion to reveal iodine excess in neonatal transient hypothyroidism. J Pediatr Endocrinol Metab 1998; 11: 739-743.
[15]
Topical iodine-containing antiseptics and subclinical hypothyroidism in preterm infants. J Pediatr 1997; 131: 434-439.
[16]
Thyroid complications, including overt hypothyroidism, related to the use of non-radiopaque silastic catheters for parenteral feeding in prematures requiring injection of small amounts of an iodinated contrast medium. Acta Paediatr 1995; 84: 579-581.
[17]
Thyroid and developing brain: anatomical and behavioural effects. En: Hamburgh M, Barrington EJW, editores. Hormones in development. Nueva York: Appleton-Century-Crofts, 1971; 345-355.
[18]
Low serum thyroxine concentrations and neural maduration in preterm infants. Arch Dis Child 1986; 61: 862-866.
[19]
Low plasma triiodothyronine concentrations and outcome in preterm infants. Arch Dis Child 1988; 63: 1201-1206.
[20]
Impairment of neuromotor and cognitive development in iodine-deficient schoolchildren with normal physical growth. Acta Endocrinol 1.993; 129: 501-504.
[21]
Transiente Hypothyreose nach Gabe Von Röentgenkontrastmitteln bei Neugeborenen und Säulingen.Medwelt 1983; 34: 23-28.
[22]
Zum Problem des Einflusses moderner jodhaltiger Kontrastmittel auf den Stoffwechselder Thyroidea im Säuglingsalter. En: Kaufman, editor. Kontrastmittel in der Kinderradiologie. Berlín: Schering, 1986; 82-92.
[23]
Iodine and hypothyroidism in neonates with congenital heart disease. Arch Dis Child Fetal Neonatal Ed 1997; 77: 239-240.
[24]
Therapeutic intervention scoring system: a method for cuantitative comparison of patient care. Crit Care Med 1974; 2: 57-60.
[25]
Iodine-induced alterations of thyroid function in newborn infants after prenatal and perinatal exposure to povidone iodine. J Pediatr 1983; 102: 935-938.
[26]
Autoimmune thyroid disease in children with mongolism. Arch Dis Child 1969; 44: 454-460.
[27]
Down syndrome and thyroid function. Lancet 1975; 2: 1308.
[28]
Abnormalities of thyroid function in infants with Down syndrome. J Pediatr 1984; 104: 545- 549.
[29]
Thyroid function in young children with Down syndrome. Am J Dis Child 1986; 140: 479-483.
[30]
Growth studies in infants and children with Down syndrome and elevated levels of thyrotropin. Am J Dis Child 1988; 142: 1302-1306.
[31]
Autoimmune thyroiditis associated with mild «subclinical» hypothyroidism in adults with Down syndrome: a comparison of patients with and without manifestations of Alzheimer disease. Am J Med Genet 1990; 36: 148-154.
[32]
Organ- specific autoantibodies in children with common endocrine diseases. J Pediatr 1982; 100: 8-14.
[33]
High incidence of thyroid disturbaces in 49 childern with Turner syndrome. J Pediatr 1987; 111: 258-261.
[34]
The spectrum of the DiGeorge syndrome. J Pediatr 1979; 94: 883-890.
[35]
DiGeorge's or the III-IV pharingeal pouch syndrome. Pathology and a theory of pathogenesis. Perspect Pediatr Pathol 1975; 2: 173-206.
[36]
Genetic disorders and major extracardiac anomalies associated with the hypoplastic left heart syndrome. Pediatrics 1988; 82: 698-706.
[37]
DiGeorge anomaly in an infant with deletion of chromosome 22 and duplication (9p) due to adjacent type II disjunction. Am J Med Genet 1991; 38: 569-573.
[38]
DiGeorge sindrome: part of CATCH 22. J Med Genet 1993; 30: 852-856.
[39]
Hypothyroxinemia in critically ill patientes as a predictor of high mortality. JAMA 1981; 245: 43-45.
[40]
Impact of triiodothyronine on the survival of high-risk patients undergoing open heart surgery. Cardiology 1996; 87: 509-515.
[41]
Potencial terapéutico de la hormona tiroidea intravenosa en el shock cardiogénico. Cardiovascular 1998: 223-224.
[42]
Transient secondary hypothyroidism in children after cardiac surgery. Pediatr Res 1997; 41: 375-379.