Introducción y objetivos
El propósito de este estudio ha sido comparar los diferentes tipos morfológicos de miocardiopatía hipertrófica observados mediante tomogammagrafía miocárdica de perfusión con los del ecocardiograma.
Material y Métodos
En 76 de 119 pacientes (64%) con miocardiopatía hipertrófica, el ecocardiograma permitió una aceptable visualización de todos los segmentos del ventrículo izquierdo en la proyección paraesternal transversal y la asignación de los pacientes a alguno de los 6 tipos morfológicos clásicos: tipo I (hipertrofia septal anterior), tipo II (hipertrofia septal anterior y septal posterior), tipo III (hipertrofia septal y anterolateral), tipo IV (hipertrofia septal posterior y/o anterolateral), tipo V (hipertrofia concéntrica) y tipo VI (hipertrofia apical). Sin conocimiento de los datos ecocardiográficos, dos observadores experimentados intentaron asignar con las imágenes del eje corto de la tomogammagrafía miocárdica de perfusión en reposo con
Resultados
La concordancia global entre las dos técnicas fue del 75%. El tipo III fue el más frecuente, tanto en el ecocardiograma (76%) como en la tomografía miocárdica de perfusión (74%), aunque también fue el que originó la mayoría de discrepancias. Con la tomogammagrafía miocárdica de perfusión se observó en 4 pacientes una hipertrofia localizada en la región septal e inferior que no correspondía a ninguno de los 6 tipos de la clasificación ecocardiográfica clásica y que por ecocardiograma había sido clasificada como tipo III en 3 casos y en 1 como tipo V.
Conclusión
Se observó concordancia entre el ecocardiograma y la tomogammagrafía miocárdica de perfusión en la clasificación morfológica de la mayoría (75%) de los pacientes con miocardiopatía hipertrófica, aunque se hallaron discrepancias con respecto al ecocardiograma, sobre todo en el tipo III.
Palabras clave
Ecocardiografía
Gammagrafía
Miocardio
Miocardiopatía hipertrófica
INTRODUCCIÓN
La miocardiopatía hipertrófica (MH) es una enfermedad hereditaria autosómica dominante con una expresividad genética, clínica y morfológica muy variada 1-7. Su diagnóstico se basa en el hallazgo ecocardiográfico de una hipertrofia ventricular izquierda en ausencia de cualquier causa cardíaca (estenosis valvular o subvalvular aórtica) o extracardíaca (hipertensión arterial sistémica, coartación de aorta) capaz de producirla 8.
Por ecocardiografía bidimensional se han descrito diferentes tipos morfológicos de MH de acuerdo con la distribución de la hipertrofia. Maron et al 9 establecieron una clasificación morfológica de cuatro tipos: tipo I, hipertrofia septal-anterior; tipo II, hipertrofia septal-anterior y septal-posterior; tipo III, hipertrofia septal y antero-lateral, y tipo IV, hipertrofia septal-posterior y/o antero-lateral. Esta clasificación no incluía la hipertrofia concéntrica y la hipertrofia apical descrita por los japoneses 10. Por este motivo, Candell-Riera et al 11, en 1986, agregaron estos 2 tipos morfológicos como V y VI, respectivamente.
La gammagrafía miocárdica de perfusión es una técnica ampliamente utilizada para el diagnóstico 12,13 y estratificación de riesgo 14-17 en la cardiopatía isquémica, pero que también se ha empleado en los pacientes con MH, tanto para descartar enfermedad coronaria asociada 18-20 como para caracterizarla morfológicamente 21,22. Aunque su poder de resolución espacial es inferior al del eco y al de otras técnicas, como la resonancia magnética nuclear 23, también permite observar la distribución de la hipertrofia y, por tanto, clasificar a estos pacientes en los diferentes tipos morfológicos. El conocimiento de estos patrones es importante para valorar las imágenes gammagráficas de estos enfermos. El propósito de este trabajo ha sido comparar la clasificación morfológica de la MH obtenida mediante SPET con la clasificación ecocardiográfica. MATERIAL Y MÉTODOS
Entre mayo de 1989 y febrero de 1999 se diagnosticaron 119 pacientes de MH (52 ± 13 años, 40 mujeres y 70 con gradiente obstructivo dinámico intraventricular) mediante ecocardiografía-Doppler. En 76 (64%) de estos pacientes fue posible, mediante eco, establecer una adecuada valoración de todos los segmentos del ventrículo izquierdo en la proyección paraesternal transversal en los músculos papilares que permitiera incluirlos en alguno de los 6 tipos morfológicos previamente descritos 11. La comparación entre los resultados del eco y del SPET se llevó a cabo en estos 76 pacientes (53 ± 12 años; 30 mujeres y 44 obstructivos).
Ecocardiograma
El diagnóstico de MH se basó en la demostración ecocardiográfica de hipertrofia ventricular izquierda (asimétrica o simétrica) en ausencia de cualquier enfermedad cardíaca o sistémica capaz de ocasionarla. Los criterios para definir hipertrofia fueron los siguientes: grosor telediastólico de los segmentos septal-anterior y postero-lateral igual o superior a 15 mm y de los segmentos antero-lateral y septal-posterior igual o superior a 17 mm. Con estos criterios se intentaba descartar potenciales errores, atribuibles a la resolución lateral, de 2-5 mm.
Para la práctica del ecocardiograma-Doppler se utilizaron indistintamente dos ecógrafos: Ving Med Sonotron CFM 750 y Hewlett Packard SONOS-1000.
Con el ecocardiograma bidimensional se realizó el registro de las proyecciones paraesternal longitudinal, paraesternal transversal mitral y de músculos papilares, y apical de 4 y 2 cavidades. En la proyección paraesternal transversal, el miocardio ventricular izquierdo fue dividido en 4 segmentos: septal-anterior, septal-posterior, antero-lateral y postero-lateral (fig. 1). Las medidas del grosor de estos segmentos se realizaron en el centro de los mismos.
Con el fin de establecer una clasificación morfológica según la localización de la hipertrofia, se consideraron tan sólo las proyecciones paraesternales transversales, asumiéndose como hipertróficos los segmentos septal-anterior y postero-inferior si su grosor era igual o superior a 15 mm, y los segmentos septal-posterior y antero-lateral si su grosor era igual o superior a 17 mm. Los pacientes fueron distribuidos en uno de los siguientes 6 grupos morfológicos 11: tipo I, hipertrofia de localización a nivel septal-anterior; tipo II, hipertrofia localizada a nivel septal-anterior y septal-posterior, tipo III, hipertrofia septal y antero-lateral; tipo IV, hipertrofia septal-posterior y/o antero-lateral; tipo V, hipertrofia concéntrica o simétrica de todos los segmentos, y tipo VI, hipertrofia apical no detectable en la proyección paraesternal transversal mitral pero sí en los músculos papilares.
Por Doppler se valoró en todos los pacientes el gradiente máximo dinámico intraventricular, considerándose que la MH era obstructiva cuando era mayor de 25 mmHg.
Tomogammagrafía miocárdica
A todos los pacientes se les practicó un SPET de esfuerzo-reposo, con 99mTc-tetrofosmina (protocolo corto), aunque el análisis morfológico se realizó en las imágenes de reposo. La primera dosis de 99mTc-tetrofosmina (administrada 30-60 s antes de finalizar el esfuerzo) fue de 8-10 mCi, y la segunda dosis (en reposo) fue de 24-30 mCi.
Para la adquisición de las imágenes se utilizó una gammacámara Elscint SP4, dotada de un colimador de alta resolución, con órbita semicircular de 180 grados, en modo «step-and-shoot», iniciada en oblicua anterior derecha 30 grados y con detecciones cada 3 grados (de 20 s).
En la reconstrucción se generaron cortes transversales del tórax del paciente. Para la mejor valoración del estudio se amplió la imagen (factor zoom) y se reorientó el eje largo ventricular con el ápex hacia la pared lateral a la derecha del observador y el ventrículo derecho a la izquierda. Sobre estos cortes se generaron las imágenes del eje largo horizontal, que cortaban horizontalmente el ventrículo siguiendo el eje ápico-basal y se presentaron desde la pared inferior hacia la anterior. Perpendiculares a éstos se formaron las imágenes de eje corto que se presentaron en una progresión desde el ápex a la base con el ventrículo derecho a la izquierda. Posteriormente se seleccionaron los cortes del eje largo vertical sobre la imagen de eje largo horizontal, que fueron presentados consecutivamente desde el septum hasta la pared lateral del ventrículo izquierdo con el ápex a la derecha del observador.
Una vez obtenidas las imágenes se procedió a la valoración visual del tipo morfológico en las proyecciones de eje corto en reposo, desde el sector apical al basal. Se consideraron cuatro regiones: septal, anterior, lateral e inferior (fig. 1). De acuerdo con el número de regiones que comprometía la hipertrofia, y por consenso entre dos observadores experimentados que desconocían el resultado del eco, se intentó asignar cada uno de los casos a alguno de los 6 tipos morfológicos 11 (fig. 2).
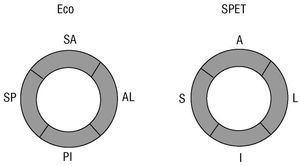
Fig. 1. Regiones en que fue dividido el miocardio ventricular izquierdo en las proyecciones paraesternal transversal del ecocardiograma y en el eje corto del SPET. A: anterior; AL: antero-lateral; I: inferior; PI: posterior-inferior; S: septal; SA: septal anterior; SP: septal posterior.
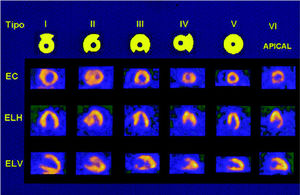
Fig. 2. Imágenes tomográficas de los 6 tipos clásicos de miocardiopatía hipertrófica.
RESULTADOS
Ecocardiograma
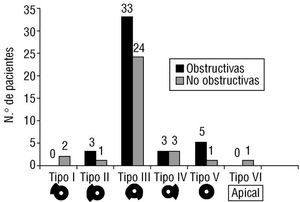
El 58% (44/76) de los pacientes tenían obstrucción dinámica intraventricular (> 25 mmHg) que oscilaba entre 25 y 164 mmHg (medio: 60 mmHg). De los tipos morfológicos, el más frecuente fue el tipo III tanto en las formas obstructivas como no obstructivas (fig. 3).
SPET
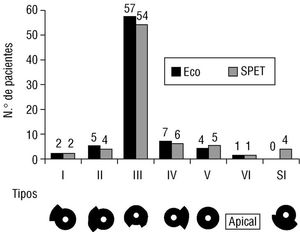
En todos los pacientes pudo realizarse la valoración morfológica de la MH mediante SPET. Como puede observarse en la figura 4, el tipo más frecuente de MH fue el tipo III con gran diferencia con respecto al resto. Cuatro pacientes no pudieron incluirse en ninguno de los tipos morfológicos descritos previamente por ecocardiograma ya que la hipertrofia correspondía a los segmentos septal e inferior (fig. 5). El ecocardiograma de tres de estos cuatro pacientes correspondía al tipo III y el restante al tipo V. En un 21% de casos se observaron defectos reversibles de perfusión y en un 15% de casos defectos fijos.
Eco frente a SPET
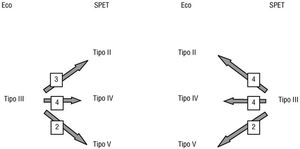
La proporción de pacientes en cada tipo morfológico fue similar, pero se observaron discordancias entre el eco y el SPET en 19 pacientes (25%) (fig. 6). Nueve pacientes clasificados como tipo III por el eco fueron clasificados como tipo II (n = 3), tipo IV (n = 4) y tipo V (n = 2) por el SPET. Diez pacientes diagnosticados como tipo III por el SPET fueron clasificados como tipo II (n = 4), tipo IV (n = 4) y tipo V (n = 2) por el eco (fig. 6). Todos los pacientes en los que el segmento septal-posterior era hipertrófico tenían obstrucción dinámica entre 48 y 148 mmHg en el tracto de salida del ventrículo izquierdo.
Fig. 3. Distribución ecocardiográfica de los diferentes tipos morfológicos de las miocardiopatías hipertróficas obstructivas y no obstructivas.
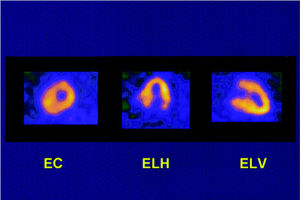
Fig. 5. Imágenes tomográficas de hipertrofia septal e inferior. EC: eje corto; ELH: eje largo horizontal; ELV: eje largo vertical.
Fig. 6. Discrepancias entre el ecocardiograma y el SPET.
Fig. 4. Distribución de los diferentes tipos morfológicos en el ecocardiograma y en el SPET. SI: septal inferior.
DISCUSIÓN
Si bien el ecocardiograma es la exploración básica para el diagnóstico de la MH, puesto que ofrece una gran resolución espacial del grosor septal anterior e inferoposterior del ventrículo izquierdo, sólo entre un 49 y 67% 11,24 de los casos ofrece una aceptable valoración de todos los segmentos que permita establecer una clasificación morfológica.
En nuestra serie, el ecocardiograma permitió visualizar y medir correctamente todos los segmentos del ventrículo izquierdo en la proyección paraesternal transversal sólo en 76 de 119 (64%) pacientes. Con el SPET se obtuvo una satisfactoria visualización de todos los segmentos en el eje corto por lo que, aunque la resolución espacial de la técnica no permitiera medir el grosor de los mismos, sí que posibilitó establecer una clasificación morfológica subjetiva de todos los casos.
El tipo más frecuente de miocardiopatía hipertrófica fue el tipo III, tanto en el ecocardiograma (75%) como en el SPET (74%). Estos resultados se asemejan a los obtenidos por otros autores y que oscilan entre el 51 y el 63% 11,24-26.
A pesar de que la proporción de pacientes incluidos en cada uno de los diferentes tipos morfológicos fue similar, tanto en el eco como en el SPET, hubo un 25% de casos en los que la clasificación tomogammagráfica no coincidió con la del eco, correspondiendo principalmente al tipo III (fig. 6). Las causas de estas discordancias en la clasificación pueden ser múltiples. En primer lugar, pueden existir dificultades para definir con claridad los límites del tabique interventricular (TIV) sobre todo en el SPET pues, en muchos casos, los límites del ventrículo derecho no se visualizan correctamente con esta exploración. Por otra parte, los segmentos en los que se divide convencionalmente el ventrículo izquierdo en la proyección paraesternal transversal del eco y en el eje corto del SPET no se corresponden con exactitud (fig. 1). Una subóptima visualización de los segmentos antero-lateral y septal-posterior por ecocardiograma tambien puede contribuir a estas discrepancias. Por último, la presencia de defectos fijos de perfusión en un 15% de los pacientes también puede ser un factor que ayude a explicar en parte estas discrepancias aunque, en principio, estos defectos fijos corresponderían a zonas de fibrosis miocárdica, zonas que también deberían observarse adelgazadas en el eco.
Además de los 6 tipos clásicos de MH descritos por eco, por SPET se observó, en cuatro pacientes, una hipertrofia localizada en los segmentos septal e inferior. Tres de estos 4 pacientes fueron clasificados como tipo III por eco y uno como tipo V. Este mismo tipo de hipertrofia fue descrito por Maron et al 27 después de haber establecido su clasificación morfológica. En otro trabajo, Lewis et al 28, en un subgrupo de 17 pacientes con MH estudiados con ecocardiograma bidimensional, encontró un marcado engrosamiento de la pared posterior del ventrículo izquierdo con un TIV normal o levemente engrosado. Este tipo de hipertrofia posterior se observaba sobre todo en pacientes más jóvenes, con una importante sintomatología y con gradientes dinámicos más severos, hecho que parece apoyar los resultados de otras series 10 y de la que nos ocupa, puesto que todos los pacientes con hipertrofia del segmento septal posterior tenían obstrucción dinámica.
Así pues, aunque el SPET no sea la exploración idónea para el estudio morfológico de la MH, permitió clasificar a todos los pacientes con una concordancia en el 75% de los casos.
La miocardiopatía hipertrófica (MH) es una enfermedad hereditaria autosómica dominante con una expresividad genética, clínica y morfológica muy variada 1-7. Su diagnóstico se basa en el hallazgo ecocardiográfico de una hipertrofia ventricular izquierda en ausencia de cualquier causa cardíaca (estenosis valvular o subvalvular aórtica) o extracardíaca (hipertensión arterial sistémica, coartación de aorta) capaz de producirla 8.
Por ecocardiografía bidimensional se han descrito diferentes tipos morfológicos de MH de acuerdo con la distribución de la hipertrofia. Maron et al 9 establecieron una clasificación morfológica de cuatro tipos: tipo I, hipertrofia septal-anterior; tipo II, hipertrofia septal-anterior y septal-posterior; tipo III, hipertrofia septal y antero-lateral, y tipo IV, hipertrofia septal-posterior y/o antero-lateral. Esta clasificación no incluía la hipertrofia concéntrica y la hipertrofia apical descrita por los japoneses 10. Por este motivo, Candell-Riera et al 11, en 1986, agregaron estos 2 tipos morfológicos como V y VI, respectivamente.
La gammagrafía miocárdica de perfusión es una técnica ampliamente utilizada para el diagnóstico 12,13 y estratificación de riesgo 14-17 en la cardiopatía isquémica, pero que también se ha empleado en los pacientes con MH, tanto para descartar enfermedad coronaria asociada 18-20 como para caracterizarla morfológicamente 21,22. Aunque su poder de resolución espacial es inferior al del eco y al de otras técnicas, como la resonancia magnética nuclear 23, también permite observar la distribución de la hipertrofia y, por tanto, clasificar a estos pacientes en los diferentes tipos morfológicos. El conocimiento de estos patrones es importante para valorar las imágenes gammagráficas de estos enfermos. El propósito de este trabajo ha sido comparar la clasificación morfológica de la MH obtenida mediante SPET con la clasificación ecocardiográfica. MATERIAL Y MÉTODOS
Entre mayo de 1989 y febrero de 1999 se diagnosticaron 119 pacientes de MH (52 ± 13 años, 40 mujeres y 70 con gradiente obstructivo dinámico intraventricular) mediante ecocardiografía-Doppler. En 76 (64%) de estos pacientes fue posible, mediante eco, establecer una adecuada valoración de todos los segmentos del ventrículo izquierdo en la proyección paraesternal transversal en los músculos papilares que permitiera incluirlos en alguno de los 6 tipos morfológicos previamente descritos 11. La comparación entre los resultados del eco y del SPET se llevó a cabo en estos 76 pacientes (53 ± 12 años; 30 mujeres y 44 obstructivos).
Ecocardiograma
El diagnóstico de MH se basó en la demostración ecocardiográfica de hipertrofia ventricular izquierda (asimétrica o simétrica) en ausencia de cualquier enfermedad cardíaca o sistémica capaz de ocasionarla. Los criterios para definir hipertrofia fueron los siguientes: grosor telediastólico de los segmentos septal-anterior y postero-lateral igual o superior a 15 mm y de los segmentos antero-lateral y septal-posterior igual o superior a 17 mm. Con estos criterios se intentaba descartar potenciales errores, atribuibles a la resolución lateral, de 2-5 mm.
Para la práctica del ecocardiograma-Doppler se utilizaron indistintamente dos ecógrafos: Ving Med Sonotron CFM 750 y Hewlett Packard SONOS-1000.
Con el ecocardiograma bidimensional se realizó el registro de las proyecciones paraesternal longitudinal, paraesternal transversal mitral y de músculos papilares, y apical de 4 y 2 cavidades. En la proyección paraesternal transversal, el miocardio ventricular izquierdo fue dividido en 4 segmentos: septal-anterior, septal-posterior, antero-lateral y postero-lateral (fig. 1). Las medidas del grosor de estos segmentos se realizaron en el centro de los mismos.
Con el fin de establecer una clasificación morfológica según la localización de la hipertrofia, se consideraron tan sólo las proyecciones paraesternales transversales, asumiéndose como hipertróficos los segmentos septal-anterior y postero-inferior si su grosor era igual o superior a 15 mm, y los segmentos septal-posterior y antero-lateral si su grosor era igual o superior a 17 mm. Los pacientes fueron distribuidos en uno de los siguientes 6 grupos morfológicos 11: tipo I, hipertrofia de localización a nivel septal-anterior; tipo II, hipertrofia localizada a nivel septal-anterior y septal-posterior, tipo III, hipertrofia septal y antero-lateral; tipo IV, hipertrofia septal-posterior y/o antero-lateral; tipo V, hipertrofia concéntrica o simétrica de todos los segmentos, y tipo VI, hipertrofia apical no detectable en la proyección paraesternal transversal mitral pero sí en los músculos papilares.
Por Doppler se valoró en todos los pacientes el gradiente máximo dinámico intraventricular, considerándose que la MH era obstructiva cuando era mayor de 25 mmHg.
Tomogammagrafía miocárdica
A todos los pacientes se les practicó un SPET de esfuerzo-reposo, con 99mTc-tetrofosmina (protocolo corto), aunque el análisis morfológico se realizó en las imágenes de reposo. La primera dosis de 99mTc-tetrofosmina (administrada 30-60 s antes de finalizar el esfuerzo) fue de 8-10 mCi, y la segunda dosis (en reposo) fue de 24-30 mCi.
Para la adquisición de las imágenes se utilizó una gammacámara Elscint SP4, dotada de un colimador de alta resolución, con órbita semicircular de 180 grados, en modo «step-and-shoot», iniciada en oblicua anterior derecha 30 grados y con detecciones cada 3 grados (de 20 s).
En la reconstrucción se generaron cortes transversales del tórax del paciente. Para la mejor valoración del estudio se amplió la imagen (factor zoom) y se reorientó el eje largo ventricular con el ápex hacia la pared lateral a la derecha del observador y el ventrículo derecho a la izquierda. Sobre estos cortes se generaron las imágenes del eje largo horizontal, que cortaban horizontalmente el ventrículo siguiendo el eje ápico-basal y se presentaron desde la pared inferior hacia la anterior. Perpendiculares a éstos se formaron las imágenes de eje corto que se presentaron en una progresión desde el ápex a la base con el ventrículo derecho a la izquierda. Posteriormente se seleccionaron los cortes del eje largo vertical sobre la imagen de eje largo horizontal, que fueron presentados consecutivamente desde el septum hasta la pared lateral del ventrículo izquierdo con el ápex a la derecha del observador.
Una vez obtenidas las imágenes se procedió a la valoración visual del tipo morfológico en las proyecciones de eje corto en reposo, desde el sector apical al basal. Se consideraron cuatro regiones: septal, anterior, lateral e inferior (fig. 1). De acuerdo con el número de regiones que comprometía la hipertrofia, y por consenso entre dos observadores experimentados que desconocían el resultado del eco, se intentó asignar cada uno de los casos a alguno de los 6 tipos morfológicos 11 (fig. 2).
Fig. 1. Regiones en que fue dividido el miocardio ventricular izquierdo en las proyecciones paraesternal transversal del ecocardiograma y en el eje corto del SPET. A: anterior; AL: antero-lateral; I: inferior; PI: posterior-inferior; S: septal; SA: septal anterior; SP: septal posterior.
Fig. 2. Imágenes tomográficas de los 6 tipos clásicos de miocardiopatía hipertrófica.
RESULTADOS
Ecocardiograma
El 58% (44/76) de los pacientes tenían obstrucción dinámica intraventricular (> 25 mmHg) que oscilaba entre 25 y 164 mmHg (medio: 60 mmHg). De los tipos morfológicos, el más frecuente fue el tipo III tanto en las formas obstructivas como no obstructivas (fig. 3).
SPET
En todos los pacientes pudo realizarse la valoración morfológica de la MH mediante SPET. Como puede observarse en la figura 4, el tipo más frecuente de MH fue el tipo III con gran diferencia con respecto al resto. Cuatro pacientes no pudieron incluirse en ninguno de los tipos morfológicos descritos previamente por ecocardiograma ya que la hipertrofia correspondía a los segmentos septal e inferior (fig. 5). El ecocardiograma de tres de estos cuatro pacientes correspondía al tipo III y el restante al tipo V. En un 21% de casos se observaron defectos reversibles de perfusión y en un 15% de casos defectos fijos.
Eco frente a SPET
La proporción de pacientes en cada tipo morfológico fue similar, pero se observaron discordancias entre el eco y el SPET en 19 pacientes (25%) (fig. 6). Nueve pacientes clasificados como tipo III por el eco fueron clasificados como tipo II (n = 3), tipo IV (n = 4) y tipo V (n = 2) por el SPET. Diez pacientes diagnosticados como tipo III por el SPET fueron clasificados como tipo II (n = 4), tipo IV (n = 4) y tipo V (n = 2) por el eco (fig. 6). Todos los pacientes en los que el segmento septal-posterior era hipertrófico tenían obstrucción dinámica entre 48 y 148 mmHg en el tracto de salida del ventrículo izquierdo.
Fig. 3. Distribución ecocardiográfica de los diferentes tipos morfológicos de las miocardiopatías hipertróficas obstructivas y no obstructivas.
Fig. 5. Imágenes tomográficas de hipertrofia septal e inferior. EC: eje corto; ELH: eje largo horizontal; ELV: eje largo vertical.
Fig. 6. Discrepancias entre el ecocardiograma y el SPET.
Fig. 4. Distribución de los diferentes tipos morfológicos en el ecocardiograma y en el SPET. SI: septal inferior.
DISCUSIÓN
Si bien el ecocardiograma es la exploración básica para el diagnóstico de la MH, puesto que ofrece una gran resolución espacial del grosor septal anterior e inferoposterior del ventrículo izquierdo, sólo entre un 49 y 67% 11,24 de los casos ofrece una aceptable valoración de todos los segmentos que permita establecer una clasificación morfológica.
En nuestra serie, el ecocardiograma permitió visualizar y medir correctamente todos los segmentos del ventrículo izquierdo en la proyección paraesternal transversal sólo en 76 de 119 (64%) pacientes. Con el SPET se obtuvo una satisfactoria visualización de todos los segmentos en el eje corto por lo que, aunque la resolución espacial de la técnica no permitiera medir el grosor de los mismos, sí que posibilitó establecer una clasificación morfológica subjetiva de todos los casos.
El tipo más frecuente de miocardiopatía hipertrófica fue el tipo III, tanto en el ecocardiograma (75%) como en el SPET (74%). Estos resultados se asemejan a los obtenidos por otros autores y que oscilan entre el 51 y el 63% 11,24-26.
A pesar de que la proporción de pacientes incluidos en cada uno de los diferentes tipos morfológicos fue similar, tanto en el eco como en el SPET, hubo un 25% de casos en los que la clasificación tomogammagráfica no coincidió con la del eco, correspondiendo principalmente al tipo III (fig. 6). Las causas de estas discordancias en la clasificación pueden ser múltiples. En primer lugar, pueden existir dificultades para definir con claridad los límites del tabique interventricular (TIV) sobre todo en el SPET pues, en muchos casos, los límites del ventrículo derecho no se visualizan correctamente con esta exploración. Por otra parte, los segmentos en los que se divide convencionalmente el ventrículo izquierdo en la proyección paraesternal transversal del eco y en el eje corto del SPET no se corresponden con exactitud (fig. 1). Una subóptima visualización de los segmentos antero-lateral y septal-posterior por ecocardiograma tambien puede contribuir a estas discrepancias. Por último, la presencia de defectos fijos de perfusión en un 15% de los pacientes también puede ser un factor que ayude a explicar en parte estas discrepancias aunque, en principio, estos defectos fijos corresponderían a zonas de fibrosis miocárdica, zonas que también deberían observarse adelgazadas en el eco.
Además de los 6 tipos clásicos de MH descritos por eco, por SPET se observó, en cuatro pacientes, una hipertrofia localizada en los segmentos septal e inferior. Tres de estos 4 pacientes fueron clasificados como tipo III por eco y uno como tipo V. Este mismo tipo de hipertrofia fue descrito por Maron et al 27 después de haber establecido su clasificación morfológica. En otro trabajo, Lewis et al 28, en un subgrupo de 17 pacientes con MH estudiados con ecocardiograma bidimensional, encontró un marcado engrosamiento de la pared posterior del ventrículo izquierdo con un TIV normal o levemente engrosado. Este tipo de hipertrofia posterior se observaba sobre todo en pacientes más jóvenes, con una importante sintomatología y con gradientes dinámicos más severos, hecho que parece apoyar los resultados de otras series 10 y de la que nos ocupa, puesto que todos los pacientes con hipertrofia del segmento septal posterior tenían obstrucción dinámica.
Así pues, aunque el SPET no sea la exploración idónea para el estudio morfológico de la MH, permitió clasificar a todos los pacientes con una concordancia en el 75% de los casos.
Bibliografía
[1]
Hypertrophic cardiomyopathy: the importance of the site and extent of hypertrophy-a review. Prog Cardiovasc Dis 1985; 28: 1-83.
[2]
Hypertrophic cardiomyopathy: interrelation of clinical manifestations, pathophysiology and therapy. N Engl J Med 1987; 316: 780-789.
[3]
Characteristics and prognostic implications of myosin missense mutations in familial hypertrophic cardiomyopathy. N Engl J Med 1992; 326: 1108-1114.
[4]
Hypertrophic cardiomyopathy: clinical spectrum and treatment. Circulation. 1995;92:1680-92.
[5]
Hypertrophic cardiomyopathy. Lancet 1997; 350: 127-133.
[6]
Impact of laboratory molecular diagnosis on contemporary diagnostic criteria for genetically transmitted cardiovascular diseases: hypertrophic cardiomyopathy, long-QT syndrome, and Marfan Syndrom. Circulation 1998; 98: 1460-1471.
[7]
Clinical course of hipertrophic cardiomyopathy in a regional United States cohort. JAMA 1999; 281: 650-655.
[8]
Hypertrophic cardiomyopathy: a discussion of nomenclature. Am J Cardiol 1979; 43: 1242-1244.
[9]
Hypertrophic cardiomyopathy. Curr Probl Cardiol 1993; 18: 643-704.
[10]
Hypertrophic cardiomyopathy with giant negative T waves (apical hypertrophy): ventriculographic and echocardiographic features in 30 patients. Am J Cardiol 1979; 44: 401-412.
[11]
Clasificación de la miocardiopatía hipertrófica mediante ecocardiografía bidimensional. Rev Esp Cardiol 1986; 39: 358-363.
[12]
Eficacia diagnóstica del SPET frente a la ergometría convencional y a la gammagrafía planar. En: Candell J, Castell J, Aguadé S, editores. Miocardio en riesgo y miocardio viable. Diagnóstico mediante SPET. Barcelona: Doyma S.A., 1998; 79-106.
[13]
SPET miocárdico de esfuerzo y con estimulación farmacológica. En: Candell J, Castell J, Aguadé S, editores. Miocardio en riesgo y miocardio viable. Diagnóstico mediante SPET. Barcelona: Doyma S.A., 1998, 107-132.
[14]
La tomogammagrafía miocárdica de esfuerzo en el diagnóstico de la enfermedad coronaria multivaso. Rev Esp Cardiol 1997; 50: 635-642.
[15]
Pronóstico de los pacientes con angina y con isquemia silente en la tomogammagrafía de esfuerzo con 99m Tc-MIBI. Rev Esp Cardiol 1998; 51: 297-301.
[16]
Cuantificación de la isquemia miocárdica en regiones dependientes de arterias coronarias ocluidas de pacientes sin infarto previo. Rev Esp Cardiol 1998; 51: 388-395.
[17]
Eficacia diagnóstica de la tomogammagrafía miocárdica en la detección de reestenosis coronaria postangioplastia. Rev Esp Cardiol 1998; 51: 648-654.
[18]
Assessment of chest pain in hypertrophic cardiomyopathy using exercise thallium-201 myocardial scintigraphy. Br Heart J 1980; 44: 650-656.
[19]
Significance of positive or negative thallium-201 scintigraphy in hypertrophic cardiomyopathy. Am J Cardiol 1989; 64: 498-503.
[20]
Dipyridamole stress thallium-201 perfusion abnormalities in patients with hypertrophic cardiomyopathy. Relationship to clinical presentation and outcome. Eur Heart J 1998; 19: 500-507.
[21]
Idiopathic hypertrophic subaortic stenosis: detection by thallium-201 myocardial perfusion imaging. N Engl J Med 1975; 293: 1113-1116.
[22]
Recognition of regional hypertrophic cardiomyopathy using thallium-201 emission-computed tomography: comparison with two-dimensional echocardiography. Am J Cardiol 1984; 53: 1095-1102.
[23]
Comparison of morphologic assessment of hypertrophic cardiomyopathy by magnetic resonance versus echocardiographic imaging. Am J Cardiol 1997; 79: 1651-1656.
[24]
Patterns and significance of distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy. Am J Cardiol 1981; 48: 418-428.
[25]
Distribution of left ventricular hypertrophy in hypertrophic cardiomyopathy: a two-dimensional echocardiographic study. J Am Coll Cardiol 1983; 2: 437-444.
[26]
Ecocardiografía, técnica-M y bidimensional en el análisis de las miocardiopatías. Rev Lat Cardiol 1981; 2: 443-455.
[27]
Unusual distribution of left ventricular hypertrophy in obstructive hypertrophic cardiomyopathy: localized posterobasal free wall thickening in two patients. J Am Coll Cardiol 1985; 5: 1474-1477.
[28]
Hypertrophic cardiomyopahty characterized by marked hypertrophy of the posterior left ventricular free wall: significance and clinical implications. J Am Coll Cardiol 1991; 18: 421-428.