Palabras clave
INTRODUCCIÓN
En los últimos años se ha reconocido el papel clave del proceso inflamatorio, y en particular la activación del sistema inmunitario celular, en la patogenia de la aterosclerosis coronaria y el inicio del síndrome coronario agudo (SCA). Diversos hallazgos han puesto en evidencia que las células inflamatorias del sistema monocítico/macrofágico participan desde los estadios más precoces en la génesis de las lesiones ateroscleróticas, y su activación contribuye de forma significativa a su progresión y su desestabilización1. Además, en los SCA hay un incremento de la activación monocitaria/macrofágica, y este hecho está relacionado con un mayor riesgo de recurrencia2,3.
La neopterina, metabolito derivado de la vía biosintética de la guanosina trifosfato-biopterina, es un excelente marcador biológico de activación del sistema inmunitario celular4. Monocitos y macrófagos, activados por acción del interferón (IFN) gamma secretado por los linfocitos T helper tipo 1 estimulados, en el ser humano son la fuente más importante de neopterina5.
Cuando se activa el sistema inmunitario celular, como ocurre en numerosas enfermedades de etiología autoinmunitaria e infecciosa, así como en el rechazo de los injertos, es posible encontrar en suero y otros líquidos orgánicos concentraciones de neopterina considerablemente elevadas. Por lo tanto, su determinación es una herramienta útil para el seguimiento de la actividad de la enfermedad y la respuesta al tratamiento en su caso6.
Asimismo, se ha demostrado la existencia de concentraciones elevadas de neopterina en pacientes con síndrome coronario agudo y crónico7. Este hallazgo se ha puesto en relación no sólo con la extensión y la severidad de la enfermedad aterosclerótica coronaria8,9, sino que además se correlaciona con el grado de vulnerabilidad de las placas ateroscleróticas y con una intensa actividad inflamatoria en ellas10,11. Por ello, en la actualidad se considera que la neopterina es un buen marcador biológico de enfermedad arterial coronaria12.
Es un hecho bien conocido que la distribución del momento de presentación de los SCA a lo largo del día no es uniforme, sino que experimenta variaciones rítmicas. Así, por ejemplo, se ha demostrado con claridad que el comienzo del infarto agudo de miocardio (IAM) ocurre con mayor frecuencia en las primeras horas de la mañana13. Estudios realizados sobre la bioperiodicidad de la respuesta inmunitaria en sujetos sanos ponen en evidencia que tanto el número como las funciones de las células del sistema inmunitario, así como el grado de actividad de los procesos inflamatorios, pueden variar con el correr del día14. Sin embargo, hay pocos datos sobre la posibilidad de que el sistema inmunitario celular pueda fluctuar rítmicamente en los pacientes con SCA. El objetivo de este trabajo ha sido estudiar las concentraciones séricas de neopterina en pacientes con SCA con elevación persistente del segmento ST (SCACEST) tratados con angioplastia primaria en fase de luz y en fase de oscuridad durante el día. Se comparó las determinaciones obtenidas en los pacientes con SCACEST con las obtenidas en un grupo control de sujetos sin evidencias clínicas de enfermedad aterosclerótica para estudiar si los patrones luz-oscuridad eran diferentes. La hipótesis fundamental de nuestro estudio es que los pacientes con SCACEST tratados con angioplastia primaria presentan concentraciones séricas de neopterina significativamente superiores que los sujetos control y que, además, en los pacientes con SCACEST esas concentraciones presentan variaciones diurnas.
MÉTODOS
Sujetos del estudio
Desde enero de 2001 a diciembre de 2002, 155 pacientes con el diagnóstico de IAM fueron atendidos en la Unidad de Coronarias (UC) del Hospital Universitario de Canarias. De esta población, se seleccionó como casos del estudio a los pacientes que presentaban SCACEST a los que se dio tratamiento de reperfusión mediante angioplastia primaria. Asimismo, durante el mismo periodo, se seleccionó un grupo control compuesto por sujetos de similares edad y sexo, todos ellos sin antecedentes de enfermedad, toma de medicación ni adicción a drogas y sin evidencias de enfermedad cardiaca, vascular, metabólica, neoplásica o inflamatoria determinadas mediante cuidadosas anamnesis y exploración física, radiografía de tórax, electrocardiograma basal y analítica general de sangre y orina habituales. En todos los sujetos del estudio se cribó por diabetes mellitus, y se consideró entre los criterios de inclusión sólo a los sujetos no diabéticos. Fueron criterios de exclusión en el estudio curso o antecedentes de enfermedad arterial periférica, enfermedad infecciosa específica y no específica, enfermedades autoinmunitarias y del tejido colágeno, enfermedades malignas, adicción a drogas, tratamiento inmunosupresor, radioterapia o quimioterapia, insuficiencia renal aguda o crónica y enfermedades hepáticas. Todos los sujetos dieron su consentimiento informado antes de entrar en el estudio. El estudio fue aprobado por el comité de ética de nuestra institución.
Protocolo del estudio
Los sujetos del estudio, tanto casos como controles, fueron estudiados en la UC en condiciones ambientales de luz y oscuridad estrictamente controladas. Cada una de las habitaciones de la UC de nuestra institución es independiente, posee una ventana al exterior y dispone de la facilidad para conseguir un excelente aislamiento acústico y lumínico. Las condiciones lumínicas ambientales de la UC durante el estudio fueron similares a las del ciclo luz-oscuridad externo normal. El periodo de luz en la UC tuvo una duración de 14 h (con una intensidad de luz de 1.745 ± 33 lux) y el periodo de oscuridad fue de 10 h (con una intensidad de luz de 1,33 ± 0,3 lux). La intensidad de la luz fue medida a la altura de la cara de los sujetos. El encendido y el apagado de las luces se produjeron a las 7.00 y a las 21.00, respectivamente. A los sujetos del estudio, una vez ingresados en la UC, se les implantó un catéter con un cierre de heparina en la vena antecubital del antebrazo para la extracción de sangre. Se extrajo una muestra para realizar las determinaciones analíticas habituales según los protocolos diagnósticos de nuestra UC. Todos los sujetos permanecieron en reposo durante el estudio. Las muestras de sangre para determinar las concentraciones séricas de neopterina fueron extraídas a las 10.00 (periodo de luz) y a las 3.00 (periodo de oscuridad). En los pacientes con SCA, dichas muestras se recogieron en las primeras 24 h del inicio de los síntomas. La muestra de sangre a las 3.00 fue extraída por una enfermera especialmente entrenada, en la oscuridad, con ayuda de una pequeña linterna de tenue luz roja (intensidad de luz < 30 lux), evitando en todo momento dirigir el haz de luz hacia la cara de los sujetos mientras éstos estaban durmiendo. Las muestras de suero, obtenidas mediante centrifugación de la sangre, fueron alicuotadas en varios tubos y almacenadas a -80 °C hasta su análisis.
Métodos de laboratorio
Se determinaron las concentraciones plasmáticas de colesterol total, colesterol de las lipoproteínas del alta densidad (cHDL), colesterol de las lipoproteínas de baja densidad (cLDL), triglicéridos y glucosa mediante los procedimientos estandarizados por el laboratorio central de nuestra institución. Se determinaron los valores de troponina I mediante el método inmunoenzimático basado en una técnica de ELISA en sandwich (Beohringer Mannheim, Alemania). Las concentraciones séricas de neopterina se determinaron utilizando un método de ELISA, siguiendo las especificaciones de la casa suministradora de los kits (DRG Instruments, GmbH, Marburg, Alemania). En este test de ELISA, el límite de detección de neopterina más bajo fue de 0,7 nmol/l y los coeficientes de variabilidad intraanalítica e interanalítica fueron del 5,3 y el 9%, respectivamente.
Análisis estadístico
Para el análisis de los datos se utilizó el programa estadístico SPSS 10.0.1 para PC (SPSS Inc. Analytical Software, Chicago, Illinois, Estados Unidos) y Statistica versión 5.0 (StatSoft., Tulsa, Oklahoma, Estados Unidos). Todas las variables categóricas se expresan como porcentajes y las variables cuantitativas se expresan como media ± desviación estándar. Se comprobó la proximidad a la normalidad de las distribuciones de las variables continuas mediante la prueba de Kolmogorov-Smirnov. Para comparar las variables continuas entre casos y controles, se utilizó el test de la t de Student. Se utilizó el test de la c2 para comparar dos variables cualitativas. El análisis de las variaciones entre luz y oscuridad de las concentraciones de neopterina en los pacientes con SCACEST y los sujetos control se realizó mediante un MANOVA, usando como variable independiente la variable grupo (pacientes con SCACEST frente a sujetos control) y como variable dependiente de medidas repetidas, el periodo (luz fente a oscuridad). Se consideraron estadísticamente significativos los valores de p < 0,05.
RESULTADOS
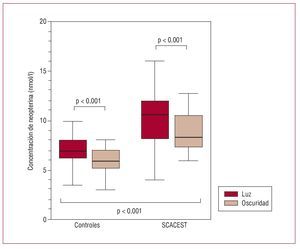
La muestra de sujetos incluidos en este estudio estuvo constituida por 96 pacientes con SCACEST tratados con angioplastia primaria y un grupo control compuesto por 84 sujetos sin evidencias clínicas de enfermedad cardiaca, vascular, metabólica, neoplásica o inflamatoria. En el grupo de pacientes con SCACEST, la fracción de eyección ventricular izquierda media fue del 47% ± 12%; se encontró enfermedad coronaria multivaso en 11 (11,45%) pacientes y 15 (15,6%) presentaron clínica de insuficiencia ventricular, expresada como una clase Killip > 1. El resto de las características clínicas y los parámetros analíticos basales de los sujetos del estudio (pacientes con SCACEST y sujetos control) se muestran en las tablas 1 y 2. Como puede apreciarse en la tabla 1, no hubo diferencias significativas en cuanto a edad, sexo y distribución de los factores de riesgo de enfermedad arterial coronaria entre los casos y el grupo control. En la tabla 2 se muestran las concentraciones de colesterol total con sus diferentes fracciones, triglicéridos, glucosa y troponina I, que no mostraron diferencias significativas entre los casos y el grupo control, excepto para la troponina I que, como era de esperar, mostró cifras significativamente más elevadas en el grupo de pacientes con SCACEST. En la figura 1 se muestran las concentraciones de neopterina en la fase de luz y en la fase de oscuridad tanto del grupo de pacientes con SCACEST como del grupo control. En ambos grupos, las concentraciones séricas de neopterina presentan un patrón de variación luz-oscuridad: las concentraciones medias séricas de neopterina fueron significativamente mayores en la fase de luz que en la fase de oscuridad, tanto en el grupo control (luz frente a oscuridad, 6,98 ± 1,96 frente a 5,87 ± 2 nmol/l; p < 0,001) como en el grupo de pacientes con SCACEST (luz frente a oscuridad, 10,2 ± 3,8 frente a 8,84 ± 2,22 nmol/l; p < 0,001).
Fig. 1. Concentraciones séricas de neopterina en periodo de luz y periodo de oscuridad en el grupo de pacientes con síndrome coronario agudo con elevación del segmento ST (SCACEST) y en el grupo control. MANOVA: controles frente a SCACEST, p < 0,001; controles en periodo de luz frente a oscuridad, p < 0,001; SCACEST en periodo de luz frente a oscuridad, p < 0,001.
Por otra parte, los pacientes con SCACEST mostraron cifras de neopterina significativamente mayores que el grupo de sujetos control durante los mismos periodos (p < 0,001). No se observó, sin embargo, efecto de interacción entre ambos factores estudiados: grupo (pacientes con SCACEST fente a sujetos control) y periodo (luz frente a oscuridad) (p = 0,58).
DISCUSIÓN
La información disponible sobre la existencia de variaciones diurnas de la activación del sistema inmunitario celular en pacientes con enfermedad arterial coronaria aterosclerótica es escasa. El principal hallazgo de este estudio ha sido encontrar variaciones luz-oscuridad en la producción de neopterina en pacientes con SCACEST tratados con angioplastia primaria.
El sistema inmunitario celular participa de forma crucial en la respuesta inflamatoria que genera la rotura de la placa aterosclerótica y el desencadenamiento de los SCA15. Se produce un incremento en el número y la actividad de las células T en las placas ateroscleróticas inestables y de las células T helper tipo 1 productoras de IFNg en la sangre periférica de los pacientes con enfermedad arterial coronaria aterosclerótica, y en particular en aquellos con SCA16,17. Por lo tanto, las concentraciones séricas de neopterina reflejarían, en cada individuo, el grado de activación del sistema inmunitario celular. De acuerdo con ello, estudios previos demuestran que los pacientes con SCA presentan concentraciones de neopterina en sangre periférica significativamente mayores que los sujetos normales7-9.
Nuestros resultados concuerdan con ellos y muestran que las cifras de neopterina son significativamente mayores en los pacientes con SCACEST que en los sujetos control, tanto en la fase de luz como en la de oscuridad. En los pacientes con SCA el grado de aumento de la concentración de neopterina se correlaciona con la presencia de lesiones complejas y vulnerables y su número8,10,11. Además, en los pacientes con enfermedad arterial coronaria estable la concentración de neopterina es mayor en los que contraen una enfermedad más rápidamente progresiva18,19. Por otro lado, se ha demostrado que las concentraciones séricas de neopterina no se correlacionan con las concentraciones séricas de los marcadores biológicos de necrosis miocárdica20. Por lo tanto, en los pacientes con SCACEST el aumento de neopterina, más que representar una respuesta inmunitaria al daño miocárdico, refleja el grado de actividad inmunitaria celular en la enfermedad y la vulnerabilidad de las lesiones ateroscleróticas. Hemos de señalar que, en los sujetos de nuestro estudio, la distribución de los factores de riesgo proaterogénicos fue similar entre los grupos. Esto hace improbable que una diferencia en la prevalencia de estos factores pudiera explicar las diferencias encontradas en la concentración de neopterina entre uno y otro grupo y en los periodos estudiados.
Que haya variaciones circadianas en el momento de inicio de las manifestaciones clínicas de la enfermedad cardiovascular indicaría que podrían estar promovidas, en cierta forma, por ritmos fisiológicos o fenómenos que mostrasen una organización temporal similar, con «picos de actividad» en un determinado momento del día o de la noche21,22. De esta forma, se ha puesto de manifiesto la existencia de variaciones diurnas de la presión arterial, la frecuencia cardiaca, factores humorales como el incremento de las catecolaminas, la agregación plaquetaria y la reducción de la actividad del activador tisular del plasminógeno en las primeras horas de la mañana, que podrían contribuir a desencadenar fenómenos trombóticos23. Además, Tanaka et al24 han objetivado recientemente que hay variaciones circadianas en la incidencia de la rotura de la placa aterosclerótica.
En el ser humano, los procesos inflamatorios y la respuesta inmunitaria presentan ritmos circadianos. Estos fenómenos se encuentran bajo control neuroendocrino central25, en concreto de la glándula pineal a través de la diferente secreción en luz y oscuridad de su principal producto hormonal, la melatonina26. Born et al27 han demostrado la existencia de fluctuaciones circadianas en el número de los diferentes tipos de células inmunitarias circulantes, y han visto que cada subtipo celular tiene un máximo en sangre periférica que varía en función del momento del día. En particular, el número de monocitos y diversos subtipos de linfocitos T alcanza su valor máximo en la fase de sueño durante el periodo de oscuridad. Por otro lado, se ha puesto en evidencia que la producción de citocinas proinflamatorias tiene ritmo diurno28. Nuestro grupo ha demostrado en pacientes con IAM la existencia de variaciones luz-oscuridad en la producción de citocinas proinflamatorias29, así como variaciones diurnas en las concentraciones séricas de algunos marcadores de la inflamación, como la interleucina 630, la proteína C reactiva31 y otros mediadores como la metaloproteinasa de la matriz 932.
La existencia de variaciones diurnas en la producción de neopterina ha sido descrita previamente en sujetos sanos33,34. Sin embargo, los resultados de nuestro estudio extienden esta observación a los pacientes con SCA. Auzéby et al33 han demostrado la existencia de un ritmo circadiano en la excreción urinaria de neopterina en sujetos sanos. Esos autores describieron que la excreción urinaria de neopterina es máxima a primeras horas de la mañana, y señalan que eso reflejaría una activación previa de los linfocitos T circulantes35. En contraste con ellos, nuestro grupo propone que las variaciones diurnas de las concentraciones séricas de neopterina en sujetos sanos podrían estar influidas, al menos en parte, por el ritmo circadiano en la producción de melatonina34.
El hallazgo de variaciones diurnas de la activación del sistema inmunitario celular en pacientes con SCA, en nuestra opinión, puede tener relevancia por varios motivos. En primer lugar, aporta información muy interesante que contribuye a conocer el mecanismo fisiopatológico que pudiera explicar, al menos en parte, la existencia de variaciones diurnas en el momento de presentación de los SCA. En segundo lugar, la existencia de variaciones diurnas de la producción de neopterina y de otros marcadores de la inflamación debe tenerse en cuenta no sólo a la hora de planificar el momento de realizar extracciones sanguíneas con propósitos diagnósticos, sino además en el diseño de futuros estudios sobre la inflamación en pacientes con SCA36. Finalmente, que las funciones inmunitarias en los SCA tengan ritmo diurno indica la posibilidad de que la respuesta inmunitaria podría ser modificada y terapéuticamente manipulada. Esto podría tener implicaciones a la hora de optimizar el tratamiento.
No obstante, nuestro estudio tiene algunas limitaciones. Se trata de un estudio de casos y controles con un tamaño de muestra relativamente reducido. No haber realizado determinaciones seriadas diurnas y nocturnas impide aseverar que hay un ritmo circadiano en la producción de neopterina. Sin embargo, las diferencias encontradas en las concentraciones séricas de neopterina en la fase de luz y en la de oscuridad, aunque de escasa magnitud, son suficientemente significativas como para permitir afirmar que existen variaciones diurnas en su producción y, por lo tanto, en el grado de activación del sistema inmunitario celular en los pacientes con SCA. Una importante limitación en nuestro estudio que tener en cuenta es que la producción endógena de neopterina se puede incrementar ante situaciones de estrés. Aunque es posible que este factor pudiera explicar, en buena parte, el incremento observado en las primeras 24 h del IAM, hay que señalar que el incremento observado en las concentraciones urinarias de neopterina ante situaciones de estrés emocional se ha descrito de forma más tardía, en un periodo que va de 36 a 84 h después37,38. Por otro lado, hemos determinado las concentraciones de neopterina en muestras de sangre venosa periférica, no en sangre procedente del seno coronario. Por lo tanto, hemos asumido que las concentraciones séricas de neopterina son reflejo del proceso inflamatorio que acontece en el ámbito arterial coronario. En este sentido, un estudio previo de Fyfe et al39 demostró que no había diferencias significativas en las concentraciones de neopterina cuando ésta se determinaba en sangre procedente de seno coronario frente a las de sangre procedente de vena cava superior.
CONCLUSIONES
Los resultados de nuestro estudio demuestran la existencia de variaciones diurnas en la concentración sérica de neopterina en pacientes con SCACEST tratados con angioplastia primaria y permiten afirmar que existen variaciones diurnas en la activación de la respuesta inmunitaria celular en ellos. La trascendencia de este hallazgo reside en contribuir a conocer el mecanismo fisiopatológico que pudiera explicar, al menos en parte, la existencia de variaciones diurnas en el momento de presentación de los SCA. No obstante, es necesario realizar más estudios que ayuden a clarificar los mecanismos que subyacen a la periodicidad de la presentación de las manifestaciones clínicas de la enfermedad cardiovascular. Ello podría contribuir al diseño de estrategias de intervención que proporcionasen mejor protección en los momentos de mayor riesgo.
AGRADECIMIENTOS
Los autores agradecen a Alejandro Jiménez Sosa, de la Unidad de Investigación del Hospital Universitario de Canarias, su asistencia como asesor estadístico en la revisión del manuscrito.
ABREVIATURAS
IAM: infarto agudo de miocardio.
IFNg: interferón gamma.
SCA: síndrome coronario agudo.
SCACEST: síndrome coronario agudo con elevación persistente del segmento ST.
UC: unidad de coronarias.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. M.J. García-González.
Unidad de Coronarias. Servicio de Cardiología. Hospital Universitario de Canarias.
Ctra. La Cuesta-Taco. Ofra, s/n. San Cristóbal de La Laguna. 38320 Santa Cruz de Tenerife. España.
Correo electrónico: mjgg181262@hotmail.com
Recibido el 15 de diciembre de 2007.
Aceptado para su publicación 5 de agosto de 2008.