Los valores elevados de endotelina-1 (ET-1) se han relacionado con un mal pronóstico tras un infarto agudo de miocardio con elevación del ST (IAMCEST). La vasoconstricción de la microcirculación coronaria parece ser el mecanismo causal. El objetivo de este estudio es analizar los efectos de la ET-1 sobre la microcirculación coronaria, el tamaño del infarto, la fracción de eyección del ventrículo izquierdo (FEVI) y el miocardio rescatado tras un IAMCEST.
MétodosSe determinaron los valores de ET-1 de 127 pacientes (6-24h) tras un IAMCEST. En 97 pacientes se realizó una resonancia magnética para evaluar la obstrucción microvascular (OM), el tamaño del infarto y la FEVI. El índice de miocardio rescatado (IMR) se definió como el porcentaje de área en riesgo angiográfica sin necrosis en la resonancia.
ResultadosLa edad media de la población fue de 60,9±11,8 años (77% varones). Los pacientes con valores de ET-1 por encima de la mediana presentaron un mayor porcentaje de OM (77,7% si ET-1>6,8 pg/ml frente a 16,6% si ET-1 ≤ 6,8 pg/ml; p<0,001) y menor IMR (13,8%±26% si ET-1>6,8 pg/ml frente a 37,4%±26% si ET-1 ≤ 6,8 pg/ml; p=0,02). Los valores de ET-1 no se asociaron de manera significativa con el tamaño del infarto (p=0,11) ni con la FEVI (p=0,16). En el análisis multivariable, los valores de ET-1 fueron predictores de OM (odds ratio [OR]=2,78; intervalo de confianza [IC] del 95%, 1,16-6,66; p=0,021) e IMR ≤ percentil 25 (OR=1,69; IC del 95%, 1,01-2,81; p=0,04).
ConclusionesLos valores elevados de ET-1 tras un IAMCEST se asocian a un mayor porcentaje de OM y un menor IMR.
Palabras clave
El daño de reperfusión asociado al intervencionismo coronario percutáneo (ICP) tras un infarto agudo de miocardio con elevación del segmento ST (IAMCEST) ha sido objeto de intenso estudio durante los últimos años, debido a su elevada incidencia1 (alrededor del 40%) y su mal pronóstico2,3,4,5,6.
El daño de reperfusión es un proceso multifactorial que se centra en la microcirculación coronaria7,8,9, donde el endotelio coronario es su regulador más importante. La endotelina-1 (ET-1), liberada por las células endoteliales, es el vasoconstrictor endógeno más potente identificado hasta el momento10,11, además de un modulador importante de la función de los neutrófilos9,12,13 y un estimulador de la expresión de moléculas de adhesión de superficie14.
La concentración de ET-1 aumenta 3-4 h después del inicio del IAMCEST, alcanza un máximo en las primeras 24 h y se mantiene elevada tras 48 h15. Los valores elevados de ET-1 tras una ICP se han relacionado con un mal pronóstico, incluida una mayor mortalidad a 30 días16. La vasoconstricción microvascular, junto con la adhesión de los leucocitos, parece ser el mecanismo que subyace a la lesión producida por la ET-1, aunque esto sólo se ha establecido en modelos animales17,18. En el ser humano, la evidencia de lesión microvascular se ha obtenido mediante evaluación angiográfica, principalmente a través de métodos indirectos como el grado de flujo thrombolysis in myocardial infarction (TIMI) y el grado de opacificación o blush miocárdico (MBG)19 y más recientemente mediante el estudio con resonancia magnética cardiaca (RMC)20.
La RMC con contraste (ce-CMR) permite una caracterización precisa de varios parámetros cardiacos, como la presencia de obstrucción microvascular (OM) y el porcentaje de miocardio rescatado. El objetivo de este estudio es analizar la relación entre la concentración de ET-1 y los parámetros del daño miocárdico derivados de la ce-CMR, como la OM, el tamaño del infarto, el miocardio rescatado y la función del ventrículo izquierdo (VI). Como objetivo secundario se evaluó la relación entre las concentraciones de ET-1 y la mortalidad a 30 días, el Killip al ingreso y los parámetros de reperfusión angiográfica.
MétodosSe trata de un estudio prospectivo realizado en un centro hospitalario. El protocolo del estudio fue aprobado por el comité ético de nuestro centro, siguiendo las directrices éticas de la Declaración de Helsinki de 1975. Todos los pacientes dieron su consentimiento informado por escrito antes de la inclusión en el estudio.
Población en estudioEntre junio de 2007 y diciembre de 2008, se evaluó de manera prospectiva a 151 pacientes consecutivos a los que se practicó una ICP primaria o de rescate por un primer IAMCEST. Los criterios de inclusión fueron: dolor torácico prolongado (> 30 min) con una elevación del segmento ST>1 mm en dos o más derivaciones adyacentes en las 24 h siguientes al inicio de los síntomas. Los criterios de exclusión fueron: antecedentes quirúrgicos o traumáticos recientes, insuficiencia renal (creatinina>1,5 mg/dl) o la presencia de una enfermedad maligna, una enfermedad inflamatoria aguda o crónica o una infección previa.
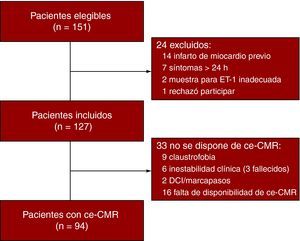
Del total de 151 pacientes evaluados, finalmente se incluyó a 127. De estos, 94 dispusieron de una exploración de ce-CMR completa (Figura 1).
Figura 1. Diagrama de flujo. ce-CMR: resonancia magnética cardiaca con contraste; DCI: desfibrilador cardiaco implantable; ET-1: endotelina-1.
Obtención de muestras de sangre y análisis de laboratorioSe obtuvieron dos muestras de sangre de una vena periférica para las determinaciones de ET-1: la primera entre 4 y 24 h (media, 10,8±7,5 h) tras el inicio de los síntomas y la segunda a las 48 h (media, 45±8,1 h). La primera muestra fue la de referencia para todos los análisis.
Las muestras se decantaron en tubos con ácido etilendiaminotetraacético, se centrifugaron a 3.000rpm durante 15 min y se conservaron a –80°C hasta el momento del análisis. Las concentraciones plasmáticas de ET-1 se determinaron mediante radioinmunoanálisis con el empleo de anticuerpo anti-ET-1 de conejo (Peninsula Laboratories Inc., San Carlos, California, Estados Unidos). Todas las determinaciones se repitieron y se promediaron. La media de los coeficientes de variación intraanalítica fue del 6,1%.
Intervención coronaria percutánea y análisis angiográficoSe utilizó un abordaje transradial o transfemoral con un catéter de 6 Fr. Se administró heparina no fraccionada a una dosis de 60 UI/kg y se utilizó una dosis de carga de 300 mg de clopidogrel durante la ICP. Nuestro protocolo incluyó la administración de abciximab antes de la ICP en caso de ausencia de contraindicaciones. La decisión respecto al uso de dispositivos de trombectomía, la implantación directa de stents o la administración intracoronaria de adenosina se dejó a criterio del hemodinamista.
La evaluación angiográfica se realizó siempre de forma independiente por dos hemodinamistas experimentados e incluyó la determinación del grado de flujo TIMI21, el MBG22, el grado de circulación colateral Rentrop23 y el área angiográfica en riesgo, determinada mediante la puntuación del Bypass Angioplasty Revascularization Investigation (BARI)24,25. La reperfusión subóptima se definió como un flujo TIMI tras la intervención ≤ 2 o un MBG ≤ 2 a pesar de un flujo TIMI 3.
Análisis de la resonancia magnética cardiacaLas exploraciones de RMC se realizaron con un escáner clínico de 1,5 T (CV Signa, GE, Milwaukee, Wisconsin, Estados Unidos) equipado con un programa informático específico cardiaco y una espiral de superficie phased-array cardiaca de cuatro elementos. Además de las proyecciones estándar de dos, tres y cuatro cámaras, se obtuvieron imágenes de eje corto secuenciales, cada 10 mm sin interrupción, desde la base del VI hasta el vértice, con objeto de alcanzar una cobertura plena del VI. Todas las imágenes se obtuvieron mientras el paciente aguantaba la respiración y se sincronizaron electrocardiográficamente. La evaluación funcional del VI se realizó con imágenes de secuencia de precesión libre en estado de equilibrio estable (FIESTA) estándar.
Se utilizó una secuencia de pulso de gradiente-eco rápida con recuperación de inversión segmentada estándar en posiciones idénticas 10-15 min después de la administración intravenosa de gadodiamida (Omniscan, Amersham Health, Madrid, España) a una dosis de 0,2 mmol/kg. El tiempo de inversión medio, ajustado al cero para el miocardio normal, fue de 200-220 ms. El tamaño de matriz se fijó en 256 y el campo de visión medio fue de 360 mm, con lo que se obtenía un tamaño de vóxel típico de 1,4×1,4×10 mm. Todas las imágenes de RMC se recortaron, se interpolaron por un factor de 3 y las identificó de forma anónima para su análisis un cardiólogo experimentado independiente que no conocía ningún dato clínico ni angiográfico.
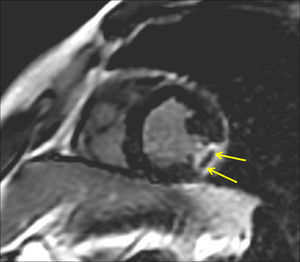
La OM se definió como cualquier área de hipocaptación de contraste tardía rodeada de una hipercaptación en las imágenes de ce-CMR (Figura 2).
Figura 2. Captación tardía de contraste en la resonancia magnética cardiaca con contraste de un paciente con un valor de endotelina-1 ≥ mediana al ingreso, que muestra una cicatriz transmural de la pared lateral con obstrucción microvascular en la proyección de eje corto. Las flechas muestran un área de hipocaptación tardía rodeada de hipercaptación que define la presencia de obstrucción microvascular.
El miocardio infartado, definido como las áreas de hipercaptación con una intensidad de señal 2 desviaciones estándar por encima de la del miocardio remoto normal, fue evaluado por un observador experimentado mediante planimetría manual en las imágenes con contraste de eje corto. El área total de infarto en los cortes de eje corto secuenciales se dividió por el volumen total de miocardio del VI para calcular el tamaño del infarto como porcentaje del volumen de miocardio del VI. El tamaño del infarto determinado mediante ce-CMR se restó del área angiográfica en riesgo estimada para calcular el miocardio rescatado, expresado como porcentaje del volumen de pared del VI. Con objeto de tener en cuenta las diferencias del área anatómica en riesgo, se calculó un índice de miocardio rescatado (IMR) de la siguiente forma: IMR=[área en riesgo según la angiografía – tamaño del infarto según la ce-CMR]×100 / área en riesgo según la angiografía, expresado como porcentaje del área en riesgo24,25.
Con el empleo de instrumentos especialmente adaptados de Image J (National Institutes of Health, Bethesda, Maryland, Estados Unidos), se trazaron manualmente los límites endocárdico y epicárdico en las imágenes de cine de eje corto secuenciales telesistólica y telediastólica, con objeto de calcular los volúmenes telesistólico y telediastólico del VI, así como la masa del VI y la fracción de eyección del VI (FEVI) (%).
Análisis estadísticoLos resultados se expresan en forma de media±desviación estándar o mediana, según la normalidad de la distribución evaluada con la prueba de Shapiro-Wilks. Las comparaciones de los grupos se realizaron mediante el test de la t de Student para datos no apareados o la de la U de Mann-Whitney para las variables continuas y la prueba de la χ2 o la prueba exacta de Fisher para las variables discretas. Se llevó a cabo un análisis de regresión logística multivariable para identificar si la ET-1, como variable continua, se asociaba de manera independiente con la OM y el miocardio rescatado. Para la creación del modelo multivariable se analizaron diversas variables, como las características basales (edad, sexo, factores de riesgo cardiovascular), el tiempo hasta la reperfusión, el grado de circulación colateral Rentrop, el área en riesgo y el uso de abciximab, adenosina y dispositivos de aspiración. Las variables que mostraron una tendencia (p<0,1) o un valor significativo (p<0,05) en el análisis univariable fueron incluidas en el modelo. Además, los autores incluyeron también el uso de abciximab, adenosina y dispositivos de aspiración en el modelo de la OM, al tratarse de moduladores de daño de reperfusión reconocidos26,27,28. Para obtener una evaluación adicional del valor de la ET-1 respecto a la OM, se generaron curvas de características operativas del receptor (ROC) y se calculó el área bajo la curva (AUC). Los resultados se consideraron estadísticamente significativos para un valor de p<0,05. Los análisis estadísticos se realizaron con el programa SPSS v14.0 (Chicago, Illinois, Estados Unidos).
ResultadosCaracterísticas de los pacientesLas características clínicas de la población se muestran en la Tabla 1. Se realizó una ICP primaria a 109 pacientes (86%) y una ICP de rescate a 18 pacientes (14%). El tiempo de síntomas-balón medio para las ICP primarias y de rescate fue de 282±189 y 412±356 min respectivamente. En caso de ICP de rescate, el tiempo de síntomas-lisis medio fue de 230±260 min. Las características angiográficas de la cohorte estudiada se indican en la Tabla 2. Se observó una reperfusión subóptima en el 43% de los pacientes. Cuatro pacientes (3%) fallecieron en los primeros 30 días siguientes al ingreso, a causa de shock cardiogénico en 3 de ellos e insuficiencia cardiaca refractaria en 1. El 48% de los pacientes presentaron OM en las imágenes de ce-CMR.
Tabla 1. Características clínicas de los pacientes (n=127).
| Edad (años) | 60,9±11,8 |
| Varones | 77,2 |
| Hipertensión | 51,2 |
| Hipercolesterolemia | 37 |
| Diabetes | 17,3 |
| Fumadores | 49,6 |
| ICP previo | 8,7 |
| Bypass arterial coronario previo | 0,8 |
| Presión arterial sistólica (mmHg) | 129,3±31,6 |
| Frecuencia cardiaca (lat/min) | 77,2±19,1 |
| Ubicación del IAM: cara anterior | 47,2 |
| Tiempo: síntomas-balón (min) | 339±276 |
| Killip al ingreso | |
| I | 91,2 |
| II | 4,8 |
| III | 0,8 |
| IV | 3,2 |
IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo.
Los datos expresan porcentajes o media±desviación estándar.
Tabla 2. Datos angiográficos y del procedimiento (n=127).
| Vaso relacionado | |
| DAI | 42,5 |
| CXI | 18,1 |
| ACD | 37,7 |
| InI | 1,7 |
| Número de vasos afectados | |
| 1 | 71,4 |
| 2 | 23 |
| 3 | 5,6 |
| TIMI previo al ICP | |
| 0 | 58,7 |
| 1 | 6,6 |
| 2 | 15,7 |
| 3 | 19 |
| TIMI tras el ICP | |
| 1 | 0,8 |
| 2 | 5,6 |
| 3 | 93,6 |
| MBG tras el ICP | |
| 1 | 7,6 |
| 2 | 32,2 |
| 3 | 60,2 |
| Circulación colateral previa al ICP (grado Rentrop) | |
| 0 | 31 |
| 1 | 55 |
| 2 | 11 |
| 3 | 3 |
| Vasos tratados | |
| 1 | 92,1 |
| 2 | 7,1 |
| 3 | 0,8 |
| Abciximab | 64 |
| Dispositivos de aspiración | 21 |
| Adenosina intracoronaria | 22 |
| Implantación directa de stents | 49 |
ACD: arteria coronaria derecha; CXI: circunfleja izquierda; DAI: descendente anterior izquierda; ICP: intervencionismo coronario percutáneo; InI: intermedia izquierda; MBG: grado de opacificación o blush miocárdico; TIMI: thrombolysis in myocardial infarction.
Los datos expresan porcentajes.
La mediana de los valores de ET-1 en las primeras 24 h fue de 6,8 [intervalo intercuartílico, 5,4-8,5] pg/ml. Como se muestra en la Tabla 3, los pacientes con concentraciones de ET-1 por encima de la mediana presentaron un porcentaje de OM superior (77,7% si ET-1>6,8 pg/ml frente a 16,6% si ET-1 ≤ 6,8 pg/ml; p<0,001) y un IMR inferior (13,8%±26% si ET-1>6,8 pg/ml frente a 37,4%±26% si ET-1 ≤ 6,8 pg/ml; p=0,02). Los valores de ET-1 situados por encima de la mediana también se asociaron con un mayor Killip al ingreso, peor MBG tras ICP y una mayor mortalidad a 30 días. Las concentraciones de ET-1 no variaron de manera significativa con el uso de abciximab, adenosina, dispositivos de aspiración o implantación directa de stents.
Tabla 3. Análisis univariable de la asociación de la endotelina-1 con las variables de resonancia magnética cardiaca, el área angiográfica en riesgo, la clase de Killip al ingreso, el grado de blush miocárdico y la mortalidad a 30 días.
| Endotelina-1 ≤ 6,8 pg/ml | Endotelina-1>6,8 pg/ml | p | |
| Obstrucción microvascular (%) | 16,6 | 77,7 | 0,001 |
| Índice de miocardio rescatado (%) | 37,4±26,5 | 13,8±26,2 | 0,02 |
| Tamaño del infarto (%) | 19,1±11,2 | 26±11,3 | 0,11 |
| FEVI (%) | 46,7±10 | 42,3±8,1 | 0,16 |
| Área BARI en riesgo (%) | 29,9±9,1 | 29,9±10,6 | 0,98 |
| Killip al ingreso ≥ II (%) | 2 | 13 | 0,04 |
| MBG<3 (%) | 26,5 | 77,7 | 0,005 |
| Mortalidad a 30 días (%) | 0 | 7,4 | 0,03 |
BARI: Bypass Angioplasty Revascularization Investigation; FEVI: fracción de eyección del ventrículo izquierdo; MBG: grado de opacificación o blush miocárdico.
En el análisis multivariable se incluyeron los valores de ET-1, el sexo y el uso de dispositivos de aspiración, abciximab o adenosina para el modelo de la OM, y los valores de ET-1, el sexo, la presencia de diabetes mellitus y el uso de dispositivos de aspiración para el modelo del IMR. Los valores elevados de ET-1 fueron el único factor predictivo de OM significativo (odds ratio [OR]=2,78; intervalo de confianza [IC] del 95%, 1,16-6,66; p=0,021) y un IMS ≤ percentil 25 (OR=1,69; IC del 95%, 1,01-2,81; p=0,04).
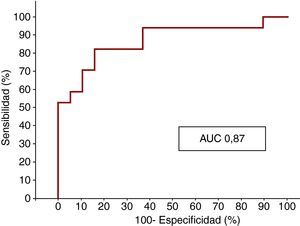
El análisis con curva ROC también puso de manifiesto que la concentración de ET-1 al ingreso es un indicador potente de OM, con un AUC de 0,87 (Figura 3).
Figura 3. Curva ROC que muestra la sensibilidad y la especificidad de la endotelina-1 para la obstrucción microvascular. AUC: área bajo la curva.
Endotelina-1 a las 48 hLa mediana del valor de ET-1 en las 48 h siguientes al inicio del infarto de miocardio fue de 5,92 [5,0–7,6] pg/ml. La ET-1 a las 48 h no mostró asociación significativa con la OM (p=0,24), el IMR (p=0,26), el tamaño del infarto (p=0,07), la FEVI (p=0,35), el MBG tras ICP<3 (p=0,08), el Killip al ingreso (p=0,127) o la mortalidad a 30 días (p=0,20). En la mayor parte de los pacientes (67%), la primera determinación de ET-1 fue más alta que las determinaciones posteriores. El patrón opuesto se dio con menos frecuencia (el 33% de los casos), pero se asoció con una mayor mortalidad a 30 días (0 frente al 7%; p=0,04).
DiscusiónLos resultados de nuestro estudio indican que existe relación entre concentraciones elevadas de ET-1 en las primeras 24 h tras un IAMCEST y la aparición de signos de lesión microvascular evaluados por resonancia magnética y variables angiográficas.
En el contexto del intenso interés que ha suscitado la evaluación del daño de reperfusión relacionado con el ICP primario, los resultados de este estudio no sólo confirman la asociación descrita entre los valores elevados de ET-1 y el daño de reperfusión, sino que ofrecen una nueva perspectiva sobre el mecanismo que ejercen en la microcirculación y el miocardio rescatado. A pesar de que el tamaño muestral fue pequeño, observamos asociación entre la expresión de ET-1 y varios parámetros de la ce-CMR relacionados con un peor pronóstico clínico.
Los valores elevados de ET-1 se asociaron de manera significativa con un mayor porcentaje de OM y un menor IMS. En cambio, no pudimos encontrar ninguna relación significativa respecto al tamaño del infarto, la FEVI o el área en riesgo según la puntuación BARI. Una posible explicación sería que los valores de ET-1 estarían relacionados con la reperfusión de un área específica. De este modo, los valores de ET-1 podrían ser más altos en un IAMCEST con una área en riesgo pequeña (p. ej., oclusión distal de una coronaria derecha) pero con una reperfusión alterada que en un paciente con un área en riesgo mayor (p. ej., oclusión proximal de la arteria descendente anterior) sin daño de reperfusión.
Tal como se preveía, la tasa de reperfusión angiográfica subóptima y la tasa de OM en la ce-CMR fueron muy similares (el 43 y el 48% respectivamente) y no mostraron diferencias respecto a los datos publicados anteriormente1.
En consonancia con los estudios previos17,29, los valores elevados de ET-1 también se asociaron con mayor incidencia de insuficiencia cardiaca congestiva al ingreso y mayor mortalidad a 30 días.
Las implicaciones relativas al momento del análisis también son importantes, puesto que las determinaciones de ET-1 se realizaron en las primeras 24 h tras el inicio del IAMCEST. Este hecho permitió una estimación temprana y adecuada de la reperfusión esperada y por tanto la opción de implementar estrategias específicas destinadas a reducir el daño de reperfusión en caso necesario. Aunque la experiencia clínica todavía es insuficiente, en modelos animales se ha demostrado que el uso de antagonistas de los receptores de endotelina se asocia a una reducción significativa de la lesión de isquemia-reperfusión tras el infarto de miocardio30,31 y una mejora de la protección miocárdica tras la cirugía cardiaca32. Los pacientes con un Killip al ingreso ≤ 2 podrían ser candidatos a estos tratamientos, dada la relación entre la aparición de insuficiencia cardiaca y los valores elevados de ET-1. Serán necesarios nuevos estudios para determinar si los pacientes con cifras de ET-1 elevadas son mejores candidatos para tratamiento con antagonistas de los receptores de la endotelina.
Según nuestros resultados, no se debe recomendar determinaciones aisladas de ET-1 a las 48 h del IAM, puesto que no se observó una relación significativa con ninguno de los parámetros clínicos, angiográficos o de ce-CMR. Sin embargo, una observación destacable es la importancia de realizar determinaciones seriadas, puesto que el aumento respecto a los valores basales puede identificar un subgrupo específico de pacientes con mayor riesgo de futuros eventos cardiacos. Esta observación concuerda con datos previos que indican que este patrón creciente de expresión de ET-1 se asocia a un aumento en las tasas de insuficiencia cardiaca e isquemia persistente14. Aunque el patrón decreciente fue el más frecuente en nuestra serie, en consonancia con los resultados publicados con anterioridad, observamos que el patrón creciente se asoció con mayor mortalidad a 30 días.
En resumen, el presente estudio destaca el papel de la ET-1 como un excelente marcador de disfunción microvascular. A la vista de los resultados presentados, debería considerarse introducir la determinación de la ET-1 en la práctica clínica diaria, especialmente en pacientes con IAMCEST de alto riesgo.
LimitacionesEste estudio presenta varias limitaciones. En primer lugar, sin determinaciones seriadas de la concentración de ET-1 circulante no se puede determinar el valor máximo real de ET-1 ni el tiempo transcurrido hasta alcanzarlo. Sin embargo, no hubo diferencias significativas en la media de los valores de ET-1 en las primeras 24 h. Además, este lapso flexible representa una ventaja respecto a la aplicación clínica diaria.
En segundo lugar, la ce-CMR no se realizó en algunos pacientes a causa de su inestabilidad clínica o de problemas técnicos. Aunque no pudimos evaluar su integridad microvascular, no los excluimos del análisis de los resultados clínicos y angiográficos.
Por último, algunos de los fármacos o dispositivos utilizados durante la ICP (como abciximab, adenosina intracoronaria o dispositivos de aspiración) podrían haber interferido en la integridad microvascular. Su uso, que se dejó al criterio del operador, fue más probable en los pacientes con daño de reperfusión. Por ejemplo, el uso de adenosina intracoronaria fue más frecuente en pacientes con peor reperfusión, y los dispositivos de aspiración se emplearon mayoritariamente en pacientes con una elevada carga trombótica y, por lo tanto, con mayor riesgo de embolización distal.
ConclusionesLa concentración de ET-1 elevada tras un infarto de miocardio se asocia con un mayor porcentaje de OM y un menor IMR.
FinanciaciónProyecto financiado por la Sociedad Española de Cardiología y el Hospital Clínic de Barcelona.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Recibido 31 Mayo 2010
Aceptado 29 Julio 2010
Autor para correspondencia: Servicio de Cardiología, Instituto del Tórax, Hospital Clínic de Barcelona, Universidad de Barcelona, Villarroel 170. 08036 Barcelona, España. freixa@clinic.ub.es