En los pacientes con insuficiencia cardiaca (IC) y disfunción sistólica del ventrículo izquierdo, el tratamiento con carboximaltosa férrica (FCM) intravenosa y con inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2) se asocia con beneficios clínicos sustanciales1. Sin embargo, continúan sin conocerse por completo los mecanismos que subyacen a estos efectos beneficiosos. Algunos resultados preliminares indican que los iSGLT2 pueden aumentar la disponibilidad celular del hierro2. En el ensayo Myocardial-IRON, se observó que, en los pacientes con IC y ferropenia, la FCM se asoció con cambios en la resonancia magnética cardiaca (RMC) indicativos de una repleción miocárdica de hierro (disminución de las secuencias de mapeo T2* y T1)3. En el presente análisis se evaluó la asociación entre el tratamiento con FCM y los primeros cambios a corto plazo en las secuencias de RMC de mapeo T2* y T1 tras el tratamiento inicial con iSGLT2.
Este es un análisis post hoc del ensayo clínico aleatorizado, a doble ciego y controlado con placebo Myocardial-IRON. Los criterios de inclusión y exclusión se han presentado en otra publicación, pero se incluyó a pacientes con IC estable, fracción de eyección del ventrículo izquierdo < 50% y ferropenia3. Se incluyó a un total de 53 pacientes aleatorizados 1:1 a la administración de FCM 1.000 mg (n=27) o placebo (n=26). Dos operadores experimentados llevaron a cabo las exploraciones de RMC mediante un escáner de resonancia magnética de 1,5 T y utilizando las espirales de superficie de 6 canales en disposición fásica (phased array) de columna. Se eligió una región de interés para el análisis de T1 y T2* en el tabique ventricular izquierdo medio. Se ha presentado en otra publicación una información detallada de las cuestiones técnicas3. Los criterios de valoración fueron el cambio del contenido miocárdico de hierro medido con las secuencias de RMC de mapeo T2* y T1 7 y 30 días después de la administración de FCM o placebo en los grupos de tratamiento con empagliflozina. Todos los pacientes dieron su consentimiento informado por escrito. El estudio se atiene a los principios establecidos en la Declaración de Helsinki y las buenas prácticas del International Council for Harmonisation. El protocolo del estudio fue aprobado por la Agencia Española del Medicamento y Productos Sanitarios y por el Comité Ético de Investigación Clínica del Hospital Clínico Universitario de Valencia. Todas las comparaciones estadísticas se llevaron a cabo según el principio de intención de tratar. Se utilizaron modelos de efectos mixtos lineales para evaluar los criterios de valoración. Todos los análisis se ajustaron respecto al valor inicial del resultado al que se aplicaba la regresión, la presencia de diabetes mellitus tipo 2 y el término de interacción de tratamiento * visita (a 7 días y a 30 días). No se introdujeron ajustes por comparaciones múltiples. Los modelos de efectos mixtos lineales se presentan en forma de medias de mínimos cuadrados con sus respectivos intervalos de confianza del 95% y valores de p. Todos los análisis se realizaron con el programa Stata 15.1. Se consideró significativo un valor de p bilateral de 0,05.
La mediana de edad fue de 73 [intervalo intercuartílico, 65-78] años; 40 (75,5%) pacientes eran varones, 29 (54,7%) tenían diabetes, 5 (9,4%) estaban en tratamiento estable con empagliflozina 10 mg/día y la mayoría (94,3%) se encontraba en la clase II de la New York Heart Association. Las medianas basales de la fracción de eyección del ventrículo izquierdo y la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) fueron del 39% [33%-47%] y 1.690 [1.010-2.828] pg/ml. Todos los pacientes presentaban ferropenia. No se observaron diferencias significativas en las características basales entre los grupos de tratamiento, incluidos los mapeos de T2* y T1 (tabla 1).
Características basales según el grupo de tratamiento
| Variables | Placebo sin empagliflozina(n=23) | Placebo y empagliflozina(n=3) | FCM sin empagliflozina(n=25) | FCM y empagliflozina(n=2) | p |
|---|---|---|---|---|---|
| Características demográficas y antecedentes patológicos | |||||
| Edad (años) | 71 [67-79] | 67 [59-77] | 73,5 [64-77] | 72 [65,5-79] | 0,886 |
| Varones | 16 (69,6) | 3 (100) | 19 (76) | 2 (100) | 0,821 |
| Hipertensión | 16 (69,6) | 3 (100) | 20 (80) | 2 (100) | 0,745 |
| Dislipemia | 13 (56,5) | 3 (100) | 16 (64) | 2 (100) | 0,435 |
| Diabetes mellitus | 11 (47,8) | 3 (100) | 13 (52) | 2 (100) | 0,260 |
| Exfumadores | 3 (13) | 1 (33,3) | 3 (12) | 0 | 0,635 |
| Enfermedad coronaria | 9 (39,1) | 1 (33,3) | 11 (44) | 2 (100) | 0,472 |
| Ingreso por ICA en el último año | 15 (65,2) | 1 (33,3) | 15 (60) | 1 (50) | 0,763 |
| EPOC | 4 (17,4) | 2 (66,7) | 7 (28) | 0 | 0,263 |
| Clase funcional de la NYHA | 0,435 | ||||
| II | 23 (100) | 3 (100) | 22 (88) | 2 (100) | |
| III | 0 | 0 | 3 (12) | 0 | |
| KCCQ (puntos) | 68 [54-90] | 91 [31-94] | 74 [63-92] | 80 [75-84] | 0,858 |
| Constantes vitales | |||||
| Frecuencia cardiaca (lpm) | 68 [65-77] | 64 [58-108] | 74 [70-82] | 68,5 [67-70] | 0,522 |
| PAS (mmHg) | 126 [113-148] | 122 [118-146] | 116 [109-130] | 139,5 [125-154] | 0,224 |
| Electrocardiograma | |||||
| Fibrilación auricular | 11 (47,8) | 3 (100) | 9 (36) | 1 (50) | 0,200 |
| BRI | 5 (21,7) | 1 (33,3) | 6 (24) | 0 | 1,000 |
| Parámetros de RMC | |||||
| FEVI (%) | 36 [30-46] | 33 [31-38] | 44 [38-49] | 41 [32-49] | 0,384 |
| Mapeo de T1basal (ms) | 1.068 [1.030-1.116] | 1.101 [1.082-1.152] | 1.082 [1.062-1.106] | 1.108,5 [1.037-1.180] | 0,196 |
| Mapeo de T2* basal (ms) | 38 [30-42] | 34 [33-77] | 40 [36-45] | 37 [34-40] | 0,527 |
| Analítica | |||||
| Hemoglobina (g/dl) | 13,4 [12,1-14,4] | 14,6 [13,1-14,8] | 13,0 [11,9-13,3] | 13,3 [13,1-13,4] | 0,204 |
| Saturación de transferrina (%) | 14,9 [9,6-19,0] | 21,9 [9,6-22,0] | 15,0 [12,0-19,2] | 16,0 [15,7-16,2] | 0,863 |
| Ferritina (ng/ml) | 47,1 [23,0-131,0] | 48,4 [30,0-65,0] | 77,0 [56,0-126,0] | 60,0 [58,0-62,0] | 0,292 |
| TFGe (ml/min/1,73 m2) | 64,3 [48,9-80,0] | 49,7 [46,8-9,2] | 59,4 [50,0-71,2] | 72,7 [50,4-95,0] | 0,867 |
| NT-proBNP (pg/ml) | 1.180 [1.010-2.849] | 1.990 [601-2.527] | 1.990 [976-2.830] | 2.255 [1.728-2.781] | 0,871 |
| Sodio sérico (mmol/l) | 141 [140-142] | 137 [135-144] | 140 [140-142] | 141 [140-142] | 0,633 |
| Potasio sérico (mmol/l) | 4,6 [4,4-4,9] | 4,6 [3,9-4,7] | 4,7 [4,2-5,0] | 4,4 [4,3-4,5] | 0,627 |
BRI: bloqueo de rama izquierda; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda descompensada; KCCQ: Kansas City Cardiomyopathy Questionnaire; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAS: presión arterial sistólica; RMC: resonancia magnética cardiaca; TFGe: tasa de filtrado glomerular estimada mediante la ecuación de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI).
Los valores expresan n (%) o mediana [intervalo intercuartílico].
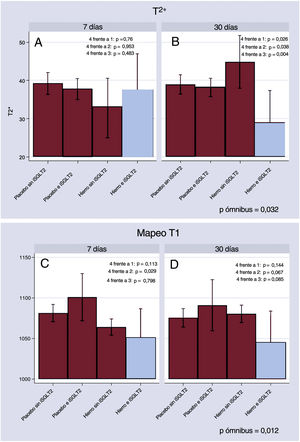
En el seguimiento, el T2* mostró diferencias entre los grupos de tratamiento (valor de p ómnibus=0,032). A los 7 días no se observaron diferencias (figura 1A). A los 30 días, los pacientes a los que se administró FCM y que estaban en tratamiento con empagliflozina mostraron unos valores significativamente inferiores de T2* (Δ, –15,8 [−26,5 a −5,1] ms; p=0,004) en comparación con lo observado en el grupo de FCM sin empagliflozina (figura 1B). En este mismo intervalo de tiempo, los valores de T2* continuaron siendo inferiores en comparación con los de las demás categorías de tratamiento (figura 1B).
Cambios en la RMC con mapeo T2* y T1 en los distintos grupos de tratamiento. A: cambios en T2* en la RMC a los 7 días. B: cambios en T2* en la RMC a los 30 días. C: cambios en T1 en la RMC a los 7 días. D: cambios en T1 en la RMC a los 30 días. Grupo 1: placebo sin empagliflozina; grupo 2: FCM sin empagliflozina; grupo 3: placebo con empagliflozina; grupo 4: FCM con empagliflozina. FCM: carboximaltosa férrica; RMC: resonancia magnética cardiaca.
De igual modo, el mapeo de T1 mostró también diferencias significativas entre los grupos de tratamiento (valor de p ómnibus = 0,012). A los 7 días, los pacientes del grupo de FCM y empagliflozina presentaron un mapeo de T1 inferior; sin embargo, la diferencia tan solo fue significativa en comparación con los pacientes a los que se administró el placebo y que estaban en tratamiento con empagliflozina (figura 1C). A los 30 días, en comparación con el grupo de FCM sin empagliflozina, los pacientes del grupo de FCM y empagliflozina presentaron una tendencia estadística a unos valores inferiores de mapeo T1 (figura 1D).
En este análisis post hoc, se observa que, entre los pacientes con IC estable, fracción de eyección del ventrículo izquierdo <50% y ferropenia, la repleción miocárdica de hierro tras la administración de FCM fue mayor en los que estaban en tratamiento con empagliflozina. Recientemente, en un subanálisis del ensayo EMPATROPISM, Santos-Gallego et al.4 señalaron que el tratamiento con empagliflozina puede aumentar la repleción miocárdica de hierro. Concretamente, estos autores observaron una disminución de T2* en la evaluación de la RMC después de 6 meses de tratamiento con iSGLT2 en comparación con el placebo y sin suplementos de hierro. La concentración de ferritina se redujó también significativamente y hubo un aumento del receptor de transferrina soluble en el grupo de tratamiento con empagliflozina4.
Los datos previos y los actuales respaldan la hipótesis de que los iSGLT2 parecen aumentar la disponibilidad miocárdica de hierro. Aunque no hay una explicación definitiva de este fenómeno, en un estudio de Ghanim et al.5 se señaló que la dapagliflozina causa una supresión de la hepcidina, que es una de las principales proteínas involucradas en la homeostasis del hierro que impide la liberación de hierro de los lugares de almacenamiento y está aumentada en los estados proinflamatorios, como la IC. En ese mismo estudio, la dapagliflozina aumentó también las concentraciones plasmáticas de transferrina y la expresión de los receptores de transferrina 1 y 2 encargadas de la entrada del hierro en los cardiomiocitos5.
El presente estudio tiene ciertas limitaciones. En primer lugar, es un análisis de subgrupos no preespecificado y un ensayo clínico pequeño. En segundo lugar, el número de pacientes en tratamiento con empagliflozina fue bajo y todos ellos tenían diabetes mellitus tipo 2, lo cual comporta una considerable incertidumbre respecto a las actuales observaciones. Serán necesarios nuevos estudios al respecto.
FINANCIACIÓNEl trabajo fue financiado en parte por una subvención no condicionada de Vifor Pharma, CIBERCV [subvenciones número 16/11/00420 y 16/11/00403], Unidad de Investigación Clínica y Ensayos Clínicos INCLIVA; SCReN; PT13/0002/0031 y PT17/0017/0003, cofinanciado por el Fondo Europeo de Desarrollo Regional-Instituto de Salud Carlos III y Proyectos de Investigación de la Sección de Insuficiencia Cardiaca 2017 de la Sociedad Española de Cardiología.
CONTRIBUCIÓN DE LOS AUTORESM. Lorenzo y R. de la Espriella contribuyeron por igual.
M. Lorenzo y R. de la Espriella se encargaron de la redacción de la versión preliminar del manuscrito así como de la elaboración de las tablas y figuras. I. Cardells se encargó del seguimiento de los pacientes durante el estudio y de la obtención de los datos. J.L. Górriz y A. Bayés-Genís han revisado el manuscrito y han participado en la corrección de errores y en las sugerencias de los revisores. J. Núñez se encargó de diseñar la hipótesis de trabajo, el análisis estadístico y la revisión de las diferentes versiones del manuscrito.
CONFLICTO DE INTERESESJ. Núñez ha recibido pagos por conferencias en comités y gastos de viajes de Novartis, Roche Diagnostics, Abbott, Rovi, Vifor Pharma, Novo Nordisk, Boehringer Ingelheim y AstraZeneca (pequeñas cantidades). A. Bayés-Genís ha recibido pagos por formar parte de consejos y gastos de viaje de Novartis, Roche Diagnostics, Vifor Pharma y Critical Diagnostics (pequeñas cantidades). Los demás autores no tienen nada que declarar.