Aunque las tasas de éxito de la recanalización de la oclusión coronaria total crónica siguen siendo subóptimas en las intervenciones coronarias percutáneas, el perfeccionamiento de las técnicas, incluido el abordaje retrógrado, hace albergar esperanzas respecto a la obtención de mejores resultados. Con la introducción del tratamiento antiagregante plaquetario y los stents liberadores de fármacos, junto con los abordajes anterógrados convencionales, cabe prever nuevos avances en la «última frontera» de la cardiología intervencionista. Este artículo se centra en la estrategia actual de recanalización en la intervención coronaria percutánea de la oclusión coronaria total crónica.
Palabras clave
Las tasas de éxito de la recanalización de la oclusión coronaria total crónica (OTC) con el abordaje anterógrado convencional continúan siendo subóptimas, del orden de un 65-70% en todo el mundo1, 2, principalmente debido a la imposibilidad de pasar la guía hasta la luz verdadera distal. La aplicación de stents liberadores de fármacos ha aportado una reducción significativa de las revascularizaciones del vaso diana en la intervención coronaria percutánea (ICP) cuando no hay una OTC y ha conducido también a un gran interés por la ICP-OTC, puesto que se ha desarrollado un abordaje retrógrado para la OTC a través de un vaso colateral, que podría mejorar la tasa de éxitos en la OTC compleja3, 4, 5.
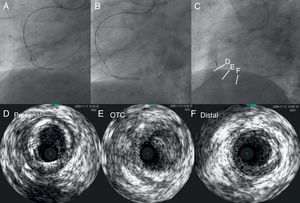
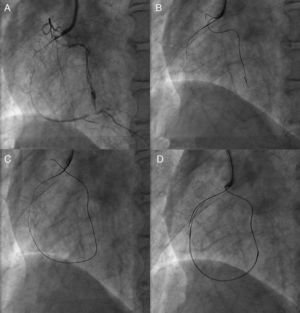
Las características desfavorables de la lesión para la ICP incluyen las oclusiones largas (tanto en longitud como en duración), la ausencia de muñón y la presencia de una rama colateral grande con un lugar de origen adyacente a la oclusión. Sin embargo, en casi la mitad de las OTC no se dispone de la fecha exacta de aparición; una anamnesis cuidadosa y los registros previos de electrocardiogramas, ecocardiografías y angiografías serían útiles para estimar la duración de la oclusión. Las imágenes radiológicas de alta calidad son uno de los elementos importantes para el éxito de la ICP y para evitar las complicaciones, y son preferibles para ello los sistemas biplanares de panel plano. Nunca se insistirá lo suficiente en la importancia de una evaluación cuidadosa de la angiografía antes de la intervención (Figura 1). Recientemente, se ha introducido la reconstrucción con alta resolución de las imágenes de tomografía computarizada (TC) coronaria, que son útiles para evaluar la OTC, sobre todo lo que respecta a su longitud y la extensión, así como la localización y la distribución de la calcificación, puesto que se ha descrito que oclusiones largas y calcificación intensa son los principales factores predictivos negativos para la ICP-OTC6.
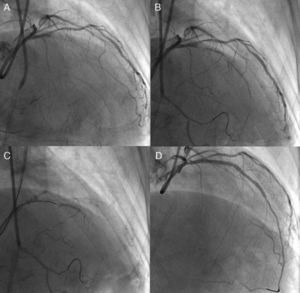
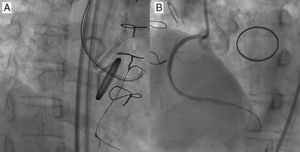
Figura 1. Necesidad de una evaluación angiográfica detallada. En la angiografía inicial, no se detectaron las colaterales del cono al tabique, por lo que se sobrevaloraron las características de la oclusión coronaria total crónica de la descendente anterior izquierda (A). La longitud actuarial de la oclusión no fue larga con una inyección doble más detallada (B); se logró pasar la guía y recanalizar con éxito la oclusión con un Miracle Bros® 3 g y la implantación de un stent liberador de fármaco, respectivamente (C y D).
Para conocer las técnicas actuales de ICP-OTC, resulta útil clasificar las estrategias en dos grupos principales: abordajes con una sola guía o con dos guías. Cada uno de ellos tiene, en general, tres pasos sucesivos crecientes: en primer lugar, los abordajes con una guía con cubierta (jacket), de polímero blando y de extremo fino; en segundo lugar, una guía con resorte espiral (spring-coil), de peso medio, y en tercer lugar, una guía de extremo fino y alto gramaje. Los abordajes dobles se basan en el empleo en primer lugar de una técnica de guía paralela, en segundo lugar de un abordaje bilateral (retrógrado) y finalmente de un abordaje bajo guía de ecografía intravascular (IVUS). Cuando se intenta realizar en ese orden las ICP-OTC tras adquirir experiencia y pericia suficientes, cabe prever una probabilidad de éxito de la recanalización de al menos un 90% en pacientes seleccionados con las indicaciones apropiadas. Los antecedentes clínicos y la situación en que se encuentre el paciente determinarán si es necesaria una intervención en un solo tiempo o en etapas o incluso la realización de un segundo o un tercer intento en caso de que la recanalización no tenga éxito.
La definición de la OTC y la indicación de la ICP se han comentado detalladamente en otra publicación7; así pues, este artículo se centra específicamente en los aspectos técnicos actuales de la intervención.
Preparación del dispositivoEs característico el uso de un abordaje bifemoral para la ICP-OTC (si no hay una enfermedad vascular periférica), con catéteres guía con orificios laterales para cada lugar de punción, uno (≥ 7 Fr) para la visualización de las colaterales distales y para un posible acceso retrógrado y el otro (≥ 7 Fr), para el abordaje anterógrado. Para disponer de un mejor apoyo, son útiles las vainas femorales largas (≥ 30 cm), especialmente en los casos de arterias tortuosas. El elemento de respaldo y los orificios laterales son las características esenciales a la hora de seleccionar el catéter guía: un respaldo adicional o un catéter guía tipo Amplatz® para la coronaria izquierda y uno de tipo Amplatz® para la derecha. Se comercializa también un catéter guía más corto (< 90 cm) para el acceso retrógrado. Cuando se prevé una ICP guiada por IVUS, es mejor utilizar un catéter guía de 8 Fr para acomodar dos catéteres (catéter de IVUS y microcatéter).
El catéter de IVUS de punta corta y bajo perfil (es decir, VOLCANO®; San Diego, Estados Unidos) es apropiado para la guía de la ICP-OTC. Es imprescindible la doble inyección simultánea de contraste para visualizar el lecho vascular distal más allá de la OTC, a través del lado de la arteria que irriga las colaterales.
Elección de la guía y del microcatéter en función de la estrategia de intervención coronaria percutáneaSe comercializan varias guías específicas para la OTC (Tabla 1), pero los elementos clave que tener en cuenta son los siguientes: a) extremo fino (0,009 ″) o no; b) cubierta de polímero o no; c) rigidez, y d) trazabilidad. Por ejemplo, para una OTC con extremo fino focal, sin una rama lateral, puede empezarse con una guía cubierta, de polímero, blanda y de extremo fino para el trayecto del microcanal inicial. Para una reentrada guiada por IVUS para pasar del espacio subintimal a la luz verdadera, puede ser necesaria una guía rígida, con extremo fino y alto gramaje. Dado que la fuerza de penetración de una guía depende de la carga de la punta (rigidez), el diámetro y la lubricidad, los nuevos operadores pueden elegir guías de una o dos fuerzas al principio para aprender la ICP-OTC. Con una estrategia de una sola guía, puede empezarse con una guía con cubierta de polímero, blanda de extremo fino; una de punta en resorte, sin extremo fino, de peso medio; y luego una guía rígida, de extremo fino y de alto gramaje, según la progresión en el segmento de OTC. Aunque no podamos detallar el fundamento patológico de la OTC, cierto porcentaje de casos de OTC contiene microcanales permeables de 160 a 230 μm, aun cuando continúen mostrando una oclusión angiográfica8. Aunque la cubierta proximal de la OTC tiende a ser una placa fibrocalcificada más rígida, en comparación con la cubierta distal de la OTC, la reciente aplicación de la guía con cubierta, de polímero blando, junto con un microcatéter, ha mejorado las posibilidades de recanalización anterógrada al primer intento. En consecuencia, podrían producirse éxitos «por casualidad» en hasta la mitad de los casos cuando se intenta el tratamiento en tipos seleccionados de OTC. Así pues, el primer objetivo en la capacitación para la ICP-OTC sería alcanzar al menos un 70-75% de éxitos en la intervención (estenosis ≤ 20% y flujo de grado 3 en la escala Thrombolysis In Myocardial Infarction [TIMI]) en un primer intento con un abordaje anterógrado sin que se produzcan complicaciones adversas importantes.
Tabla 1. Guías para las oclusiones coronarias totales crónicas
| Fabricante | Guía | Diámetro de la punta (pulgadas) | Carga de la punta (g) | Características de recubrimiento |
| Abbott Vascular | Cross-It® 100, 200, 300, 400 | 0,0140-0,0110 | 2, 2, 3, 4 | Hidrófilo |
| Pilot® 50, 150, 200 | 0,0140 | 2, 3, 6 | Recubrimiento de polímero | |
| Whisper® LS, ME, ES | 0,0140 | 1, 1 | Recubrimiento de polímero | |
| HT Progress 40, 80, 120 | 0,0140 | 4,8, 9,7, 13,9 | Recubrimiento de polímero | |
| HT Progress® 140T | 0,0105 | 12,5 | Recubrimiento de polímero | |
| HT Progress® 200T | 0,0090 | 13,3 | Recubrimiento de polímero | |
| Abbott/Asahi | Miracle® 3, 4,5, 6, 9, 12 | 0,0140 | 3, 4,5, 6, 9, 12 | Hidrófugo |
| Confianza® | 0,0140-0,0090 | 9 | Hidrófugo | |
| Confianza Pro® 9, 12 | 0,0140-0,0090 | 9, 12 | Hidrófilo, excepto la punta | |
| Confianza® 8-20 | 0,0140-0,0080 | 20 | Hidrófilo, excepto la punta | |
| Fielder FC® | 0,0140 | 1 | Recubrimiento de polímero | |
| X-treme® | 0,0140-0,0120 | 0,8 | Recubrimiento de polímero | |
| Terumo | Runthrough NS® | 0,0140 | 1-3 | Hidrófilo |
| Crosswire NT® | 0,0140 | 12 | Recubrimiento de polímero |
Las guías de polímero blando son Pilot® 50, Whisper® LS, HT Progress® 40 y Fielder XT® (extremo fino), las guías de resorte de peso medio Miracle® 3g, y 4.5g y Cross-it® 100 (extremo fino), y las guías de alto gramaje Cross-it® 400 (extremo fino), Miracle® 12g, HT Progress® 200T (extremo fino) y Confianza Pro® (extremo fino) 9 y 12g.
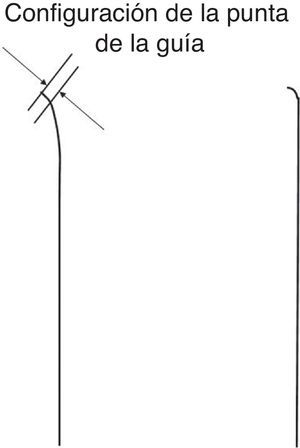
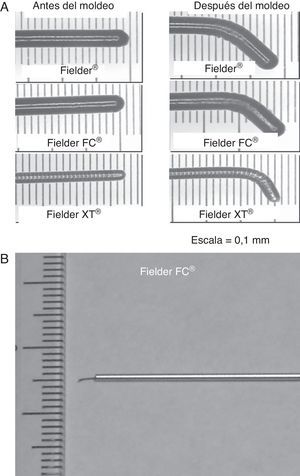
Debe moldearse la punta de la guía para que tenga la menor longitud posible, con un ángulo < 45° inicialmente. Sería preferible una segunda curva más suave para mejorar la maniobrabilidad de la guía. A la derecha se muestra una excepción a la regla: es necesario un ángulo bien definido (> 60°) con una curvatura de 1-2 mm, según el tamaño de la luz, para hacer pasar la guía desde el espacio subintimal a la luz verdadera, como parte de la técnica de guía paralela o de la introducción de la guía monitorizada por IVUS. Los dispositivos más adecuados para este fin son el Confianza Pro® (9 o 12 g; Asahi Intecc, Japón) o el Pilot® 200 (Abbott Vascular, Estados Unidos).
Figura 2. Configuración de la guía para la oclusión coronaria total crónica. La punta muy corta (< 1 mm) y curvada (< 45°) de la guía es imprescindible para el sondaje inicial en la oclusión coronaria total crónica sobre un microcatéter. Es necesaria una curva más pronunciada en situaciones más específicas.
Manipulación de la guíaExisten diferentes métodos para manipular la guía: estrategias de perforación, penetración y deslizamiento en la cubierta proximal, el interior de la OTC y la cubierta distal. Cada método tiene ventajas e inconvenientes, pero en general cualquiera de los métodos da mejores resultados en un segmento focal, corto y recto de una OTC no calcificada. Sin embargo, cuando se trata de una oclusión larga, tortuosa o calcificada, la guía debe elegirse de manera individualizada según las características de la lesión. Las placas fibrocalcificadas duras y la tortuosidad en el interior de la OTC continúan siendo obstáculos importantes para la ICP. Incluso las guías rígidas y de extremo fino pueden no ser capaces de penetrar en la calcificación, pero minimizan el desvío al pasar por ella. Sin embargo, la guía tiende a penetrar con demasiada profundidad en la capa subintimal cuando se trata de un segmento de OTC tortuoso o angulado. El autor cree que sería preferible la combinación de una estrategia de deslizamiento y penetración sobre un microcatéter, prestando especial atención a la punta de la guía en relación con la luz diana, en al menos dos proyecciones ortogonales.
Microcatéter ( tabla 2 )Los microcatéteres sobre la guía, de bajo perfil y rastreables, son un instrumento indispensable para la ICP-OTC, puesto que permiten un control preciso de la guía y cambiarla fácilmente. Para sacar el máximo partido a las guías STP®, tiene una importancia crucial avanzar el microcatéter hasta cerca de la punta para mejorar el control de la guía. Cuando es necesario cambiar la guía, se inyecta suero fisiológico en la luz para evitar la introducción de aire. Asimismo, cuando es necesario cambiar un microcatéter sobre una guía, la dilatación con balón (2,5 mm dentro de una guía de 7 Fr, p. ej.) más allá del microcatéter puede fijar la guía y facilitar los cambios de microcatéter (atrapamiento con balón).
Tabla 2. Microcatéteres aplicables para las oclusiones coronarias totales crónicas
| Fabricante | Catéter | Longitud (cm)/diámetro (Fr) del eje | Luz interna (pulgadas) |
| Cordis | Prowler® 14 | 150/1,9 | 0,017 |
| Prowler® 10 | 150/1,7 | 0,015 | |
| Transit® | 135/2,5 | 0,021 | |
| Abbott/Asahi | Tornus® 2,1 Fr | 135/2,1 | 0,016 |
| Tornus 88 Flex® 2,6 Fr | 135/2,6 | 0,024 | |
| Corsair® | 135/150/2,6 | 0,016 | |
| Terumo | Pro Great® | 130/150/2,4 | 0,019 |
| Finecross® | 130/150/1,8 | 0,018 | |
| Boston | Excelsior® | 175/2 | 0,019 |
| Excel® 14 | 150/1,9 | 0,017 |
| Fabricante | OTW | Tamaño de la esfera (mm)/longitud del eje (cm)/calibre (Fr) | Perfil de la punta (pulgadas) |
| Terumo | Ryujin Plus® | 1,25×10/148/2,5 | 0,017 |
| Invatec | Falcon® | 1×10/140-160/2,2 | 0,016 |
| Abbott | Voyager® | 1,50×12/143/2,5 | 0,017 |
| Boston | Apex® | 1,50×9/135/2,3 | 0,017 |
| Medtronic | Sprinter® | 1,50×6/138/2,5 | 0,016 |
Fr: French; OTW: over the wire ‘sobre la guía’.
De entre los microcatéteres existentes, Transit® (Cordis; Miami, Estados Unidos), Finecross® y Pro Great® (Terumo, Japón) tienen la ventaja de una luz grande y la trazabilidad para la inyección selectiva y la tortuosidad, mientras que Corsair® (135 y 150 cm, Asahi Intecc; Aichi, Japón) dispone de un mayor apoyo, incluso más allá de un segmento calcificado o tortuoso.
Técnica de guía paralelaNo visualizar una luz distal al superar la obstrucción con una guía indica un trayecto subintimal de la guía, con expansión del área dañada por la punta de la guía (la capa subintimal) que compromete la luz verdadera. Dado que la guía está como mínimo dentro del vaso, el paso siguiente será la técnica de guía paralela, con una guía más rígida antes de perder la visión de la luz distal. Se presenta un caso de aplicación de esta estrategia en las Figura 3.
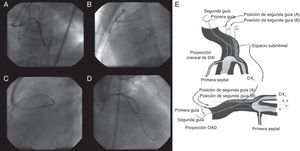
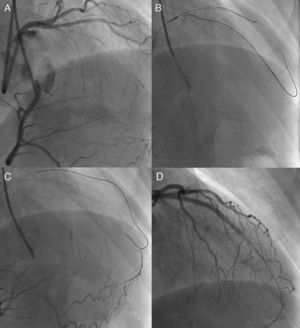
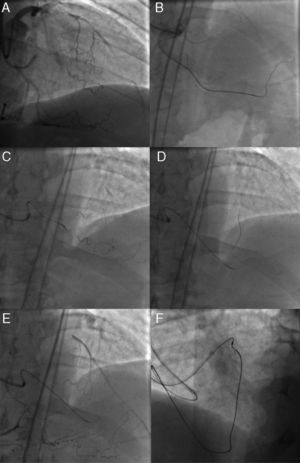
Figura 3. Método de guía paralela. Se intentó la intervención coronaria percutánea para una oclusión coronaria total crónica de la arteria descendente anterior izquierda tras un bypass (A); la primera guía de Miracle Bros® 3 g se salió de la vía hacia el objetivo (B). Se utilizó una guía Miracle Bros® 12 g como segunda guía para alcanzar la luz verdadera distal (C). El método de guía paralela permitió que la segunda guía accediera a la oclusión coronaria total crónica desde un lugar de entrada diferente, con lo que aumenta la probabilidad de llegar a la luz verdadera distal (D). E: conceptos del método 9 . DAI: arteria descendente anterior izquierda; DX1: primera arteria diagonal; OAD: oblicua anterior derecha.
El primer paso consiste en dejar colocada la primera guía, para facilitar la visualización y minimizar la inyección de contraste. A continuación puede introducirse la segunda guía por un microcatéter para facilitar su avance hacia el interior de la luz verdadera. Los puntos clave son: a) la segunda guía debe ser más rígida y más apta para la fuerza de torsión, como la Confianza Pro® 9 g o la Pilot® 200; b) la guía debe empezar en un punto de entrada de la OTC diferente, utilizando al menos dos proyecciones de visualización ortogonales; c) la penetración de la guía minimizará la expansión del área dañada, y d) el tiempo de introducción de la guía se limitará debido a la posible expansión del espacio subintimal (y la pérdida final de la visualización del vaso distal). Se muestra una representación esquemática en la Figura 3E9.
Introducción de la guía monitorizada por ecografía intravascularLa IVUS es una de las modalidades de imagen que permite visualizar un corte transversal del árbol coronario y puede centrarse en la distribución de la placa, la calcificación, el tamaño del vaso de referencia y la anatomía de las ramas laterales. Así pues, la IVUS puede ser aplicable en la ICP-OTC en los siguientes contextos: a) método de rama lateral para la introducción de la guía en la OTC hasta la luz verdadera desde la cubierta proximal, y b) reentrada subintimal desde la luz verdadera proximal. Actualmente la reentrada subintimal guiada por IVUS sería el último recurso para introducir una guía subintimal en la luz verdadera distal, puesto que el método puede ser aplicable incluso tras la pérdida de la localización del lecho vascular distal en la angiografía. Tras la dilatación con balón de 1,5-2 mm en el presunto espacio subintimal, la IVUS se introduce en el espacio y se visualiza para orientar la segunda guía hacia la luz verdadera. Los puntos clave son: a) es necesaria la capacidad de traducir las imágenes transversales de la IVUS a tres dimensiones; b) la segunda guía debe ser rígida y de extremo fino, sobre un microcatéter; por lo tanto, es obligado el uso de un calibre de 8 Fr; c) el punto de reentrada debe estar más cerca de la cubierta proximal, y d) se debe evitar la inyección de contraste, especialmente después de la dilatación de un balón pequeño. Así pues, el operador debe conocer la anatomía de las arterias coronarias en cuanto a la interpretación de la IVUS.
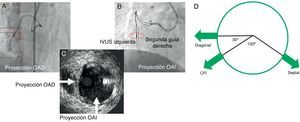
Conceptualmente, en la Figura 4 se describen las imágenes de IVUS del árbol coronario izquierdo y las ramas principales. Las imágenes transversales de la IVUS son básicamente las proyecciones que miran hacia abajo desde el ostium y desde la cabeza del paciente. Si se toman las 12 del reloj como posición craneal anteroposterior, la arteria descendente anterior izquierda muestra con frecuencia la anatomía de ramas laterales con la diagonal a las 9, la septal a las 4 y la arteria circunfleja izquierda a las 8. Así pues, una orientación clara en relación con las ramas laterales puede permitir la introducción de una segunda guía hacia la luz verdadera. La arteria coronaria derecha y la circunfleja izquierda presentan variaciones en la anatomía de las ramas laterales; por consiguiente, un método de dos guías es el más apropiado para definir una proyección angiográfica específica en relación con una imagen tomográfica de la IVUS (véase los detalles en la Figura 4).
Figura 4. Método de dos guías para arteria coronaria derecha o arteria circunfleja izquierda y modelo de sistema coronario izquierdo (una proyección desde el tronco principal izquierdo a la arteria descendente anterior izquierda) para orientar la imagen intravascular en las proyecciones angiográficas correspondientes. A: sonda de ecografía intravascular y la segunda guía en una proyección solapada en la imagen oblicua anterior derecha. B: proyección con una separación muy amplia, correspondiente a la ecografía intravascular a la izquierda de la segunda guía, en la imagen oblicua anterior izquierda. C: imagen de ecografía intravascular que revela una luz verdadera a las tres del reloj, proyecciones angiográficas de la oblicua anterior izquierda a las 6 y la oblicua anterior derecha a las 9 (la oblicua anterior derecha está situada a 90° en el sentido horario respecto a la imagen oblicua anterior izquierda). La segunda guía debe dirigirse al lado interno (a la derecha de la sonda de ecografía intravascular) en la imagen oblicua anterior izquierda para llegar a la luz verdadera. D: relaciones anatómicas de las principales ramas de la arteria coronaria izquierda en la sección transversal de la ecografía intravascular. CFI: circunfleja izquierda; IVUS: ecografía intravascular; OAD: oblicua anterior derecha; OAI: oblicua anterior izquierda. Cortesía de los Dres. Asakura y Kato, del Toyohashi Heart Center.
Importancia del paso de la guía de luz verdadera a luz verdaderaUna vez la guía ha llegado a la luz verdadera distal con un paso subintimal en algún segmento sin comprometer muchas ramas laterales, la implantación de un stent subintimal podría ser práctica para utilizar menos tiempo de irradiación y menos contraste que con un nuevo intento de redirigir la guía hacia la luz verdadera desde el punto de entrada. Cuanto más íntegro el lecho vascular distal, más probabilidades de restablecer un flujo TIMI 3. La permeabilidad a largo plazo parece ser excelente con los stents liberadores de fármacos. Sin embargo, cuando se dirige una guía hasta el segmento distal de una luz verdadera que irriga un área limitada de miocardio, la implantación de un stent puede dar lugar a un flujo subóptimo, especialmente en caso de desgarro y desprendimiento de una rama lateral. Un flujo lento en el extremo se asociará a una propensión elevada a la reestenosis e incluso la reoclusión. Así pues, la ICP-OTC debe planificarse de manera que reduzca al mínimo la entrada subintimal de la guía y que obtenga el máximo beneficio a largo plazo de la implantación de stents (aunque en algunos casos la introducción subintimal de la guía y la implantación de un stent resultan prácticamente inevitables en caso de una oclusión muy fibrocalcificada en un segmento con remodelado negativo). La IVUS sería de gran ayuda para determinar la posición de la guía si se dispone de ella, pero no hay nada que sustituya al juicio clínico sólido en el contexto de una recanalización realizada con éxito.
Abordaje retrógrado en la oclusión coronaria total crónica: intervención coronaria percutáneaAunque en el pasado las técnicas retrógradas se aplicaron a diversas OTC, el éxito alcanzado fue escaso. Como ejemplos de estas técnicas iniciales, cabe mencionar la guía kissing (Figura 5), la guía knuckle y el paso retrógrado directo (Figura 6, Figura 7). Sin embargo, las principales limitaciones de estas técnicas son que sólo se podía aplicarlas a determinados subgrupos de lesiones y, además, con una recanalización satisfactoria limitada. El fundamento y la técnica utilizados aquí son bastante diferentes de los de la ICP convencional; el operador debe tener un claro dominio del abordaje anterógrado antes de introducirse en las intervenciones de OTC retrógradas.
Figura 5. Técnica de guía kissing. Una guía anterógrada que pasa exactamente por la misma luz de la oclusión coronaria total crónica con una guía retrógrada en la imagen oblicua anterior derecha (A) y que logró alcanzar la luz verdadera distal (B).
Figura 6. Técnica de guía knuckle. En caso de oclusión coronaria total crónica de la arteria descendente anterior izquierda (A), la guía retrógrada se introduce con una punta de guía en bucle, que se introduce más profundamente en la oclusión (B) para facilitar el avance de la guía anterógrada y crear una disección subintimal (C), con lo que se consigue una recanalización satisfactoria (D). Sin embargo, la técnica suele verse dificultada por un grado de disección no controlable y por la posibilidad de desgarro y desprendimiento de ramas laterales.
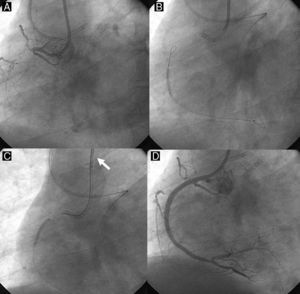
Figura 7. Paso directo de la guía retrógrada. Una guía retrógrada, respaldada por un balón sobre la guía (A y B), podría pasar por una oclusión coronaria total crónica hasta llegar a la luz vascular proximal y, finalmente, al catéter guía anterógrado (C: punta de la guía retrógrada, flecha blanca). Sobre esta guía, un balón retrógrado podría dilatar la oclusión coronaria total crónica y completar la intervención con el paso de la guía anterógrada y el despliegue de un stent (D).
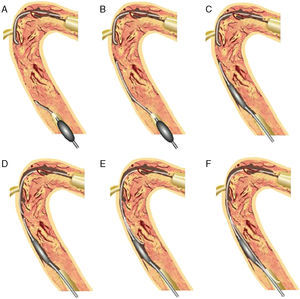
Trayecto subintimal anterógrado y retrógrado controladoEn 2005, el Dr. Kato desarrolló un abordaje retrógrado más completo. La técnica controlled antegrade and retrograde subintimal tracking (trayecto subintimal anterógrado y retrógrado controlado [CART®]) consiste en la introducción anterógrada de una guía a través de la OTC, utilizando una dilatación retrógrada con balón para crear una disección subintimal local para facilitar el paso de la guía a la luz verdadera distal10. En la figura se explica la forma en que la dilatación con balón retrógrada contribuye a movilizar las dos guías distintas uniéndolas en la misma luz (Figura 8).
Figura 8. Concepto de CART®10 . La guía anterógrada se introduce en la oclusión coronaria total crónica, y luego en el espacio subíntimo. La guía retrógrada se coloca en el extremo distal de la oclusión coronaria total crónica y luego se introduce en la oclusión coronaria total crónica, y finalmente en el espacio subintimal (A). Tras introducir un balón pequeño (1,5-2 mm) sobre la guía retrógrada hasta la subintimal (B), se debe hinchar el balón en el interior de la oclusión coronaria total crónica (C). Para mantener abierto el espacio subintimal, se debe dejar en su lugar el balón deshinchado (D). Las dos disecciones subintimales aportan un «espacio de reentrada» para la introducción de la guía anterógrada (E). A continuación, la guía anterógrada se introduce más, a lo largo del balón retrógrado deshinchado, hasta la luz verdadera distal (F). Esta técnica permite un trayecto subintimal limitado (disección) al segmento de oclusión coronaria total crónica y evita la dificultad de la reentrada en la luz verdadera distal. CART®: trayecto subintimal anterógrado y retrógrado controlado.
Es de una importancia crucial utilizar el balón del tamaño más ajustado dentro de la OTC para crear el espacio suficiente de reentrada de la guía (Figura 9). El acceso a la OTC distal se exploró principalmente a través de canales colaterales septales mediante una guía con cubierta de polímero sobre un microcatéter o balón sobre la guía; así pues, fue necesario dilatar el canal septal con un balón de 1,25 mm a baja presión, para introducir luego un tamaño superior de balón sobre la guía. Las principales limitaciones son el acceso limitado de los canales colaterales a la OTC diana, la estimación empírica del tamaño del balón retrógrado y el impredecible tiempo total de intervención.
Figura 9. Un caso de CART®. El menor tamaño de un balón retrógrado no era lo bastante grande para crear un «espacio de reentrada» para una guía anterógrada en el CART® (A). En el panel de la derecha, un balón más grande (2,5mm) había proporcionado satisfactoriamente el «espacio» para una reentrada de la guía anterógrada (B). Las líneas blancas indican el nivel de intensidad de imagen de la ecografía intravascular (C).En la ecografía intravascular, el segmento proximal de la coronaria total reveló la presencia de la sonda en el interior de la luz verdadera (D), mientras que dentro de la oclusión coronaria total crónica, la sonda estaba fuera de la luz verdadera muy ecogénica (E). En el segmento distal, la sonda volvía a la luz verdadera (F). Esto corresponde a la observación típica de la ecografía intravascular, tras un CART® realizado con éxito. CART® trayecto subintimal anterógrado y retrógrado controlado.
Según los datos de un registro, en un total de 157 pacientes consecutivos (con fracaso previo de ICP, 75,2%) se realizó una ICP retrógrada para una OTC11. Se alcanzó una recanalización retrógrada satisfactoria en el 65,6% de los casos, con una tasa general de éxitos técnicos del 85%. El paso por colateral se realizó por una vía septal en el 67,5%, epicárdica en el 24,8% y por injertos de bypass en el 7,6%. El Fielder FC® es el más comúnmente utilizado para el paso por colaterales. El abordaje retrógrado se completó con la aplicación de CART® en el 40,8% y con paso directo de la guía en el 24,8%. El paso de la OTC se obtuvo principalmente mediante guías más blandas en el abordaje retrógrado. Se produjeron lesiones mayores o menores de las colaterales y un taponamiento cardiaco tardío en el 0,6, el 10 y el 0,6% de los casos, respectivamente. No se produjo ninguna muerte en esta cohorte. Se observó un infarto de miocardio sin onda Q en el 3,2% de los casos y un infarto de miocardio con onda Q e ICP de emergencia en el 0,6%.
Técnica de CART® inversoCon la introducción de guías con cubierta, de polímero y blandas y de microcatéteres, se ha podido pasar colaterales más complejas de forma retrógrada. En 2008, el concepto de dilatador de canal se materializó mediante el catéter Corsair® (Asahi Intec; Aichi, Japón), que permite que la guía acceda a la parte distal de la OTC a través de cualquier colateral, incluidas las ramas septales, auriculares y epicárdicas12. Cuando la guía retrógrada supera la OTC cerca de la cubierta proximal, la IVUS anterógrada puede confirmar la posición de la guía retrógrada, y el tamaño del balón puede basarse en el tamaño del vaso de referencia. A continuación, un balón del tamaño apropiado puede dilatar por completo la OTC para crear un espacio de reentrada óptimo para la guía retrógrada. Una vez la guía entra en el catéter, se puede avanzar el Corsair® también sobre la guía de atrapamiento para cambiar las guías por una externalización de estas de 300 cm. Sobre esta guía larga, puede realizarse una dilatación adicional con balón «anterógrado» y la aplicación del stent. Esto es el comienzo del abordaje retrógrado actual predecible y fiable, denominado CART® inverso guiado por IVUS, desarrollado también por el Dr. Kato. En su trabajo, la recanalización retrógrada alcanzó una tasa de éxitos del 100% en 31 OTC; una aplicación del Corsair® del 87%, y una aplicación predominante de la reentrada con CART® inverso guiado por IVUS del 93,5%13. Sin embargo, el CART® continuó siendo necesario en el 6,5% de los casos. Así pues, los métodos son complementarios para obtener unas tasas elevadas de recanalización de OTC13. En la Figura 10 se muestra un ejemplo de esta técnica.
Figura 10. Un caso de CART® inverso. En un caso de angina después de una cirugía de bypass arterial coronario, el injerto venoso a la arteria descendente anterior izquierda estaba ocluido, igual que la descendente anterior izquierda nativa y la arteria coronaria derecha (A y B), y la arteria descendente posterior no se visualizaba a través del injerto venoso degenerado (C). La descendente anterior izquierda distal estaba irrigada por las colaterales de derecha a izquierda, principalmente a través de las ramas septales (D). La tomografía computarizada coronaria mostró la oclusión coronaria total crónica del tronco de la principal izquierda-descendente anterior izquierda, con una calcificación intensa y gruesa y sin indicios de espacio luminal (E). Se observaron tres colaterales bien desarrolladas, conectadas a la descendente anterior izquierda distal, en la angiografía rotacional pasando de la oblicua anterior derecha caudal a la anteroposterior caudal (F). La inyección superselectiva delimitó claramente los canales colaterales, y especialmente la intensa curvadura en el segmento septal inferior (G: círculo a trazos). La segunda septal más profunda era un posible canal para la introducción de la guía retrógrada (H). Dado que la primera guía de Fielder FC® no logró pasar por la tortuosidad inferior, se ensayó el Fielder XT®, que sí logró pasar (I). Se introdujo entonces el Corsair® sobre el Fielder XT® hasta la parte distal de la descendente anterior izquierda, y se cambió la guía retrógrada para pasar al Fielder FC® (J). Dado que la guía no pudo penetrar en la luz vascular proximal, como suele ocurrir (K), se introdujo la ecografía intravascular para identificar la guía a la derecha junto a la placa calcificada (el corte transversal de la guía se indica con flechas amarillas) y medir el tamaño del vaso de referencia (3,0-3,5 mm) para la reentrada de la guía (L). Se dilató por completo el balón de 3 mm a 10-12 atm, al tiempo que se manipulaba la guía retrógrada hacia el balón (M). (Es de destacar que este es un «CART® inverso modificado», en el que la reentrada de la guía se realiza mediante una dilatación con balón anterógrado dentro del espacio vascular.) Con la guía retrógrada del Miracle Bros® 3 g, la guía introdujo el catéter anterógrado. La ecografía intravascular mostró la posición de la guía dentro de la luz verdadera (N: la guía se indica con flechas amarillas). El Corsair® pudo pasar al catéter, sobre el cual se pudo cambiar la guía por otra de mayor longitud (RG3®330 cm, Asahi Intecc; Aichi, Japón) con objeto de externalizarla por el otro lado del conector en Y (O). A continuación se dilató el balón de 1,5mm y 2,5mm sobre la guía externalizada. Se utilizó un catéter de doble luz para colocar la segunda guía en la parte distal de la descendente anterior izquierda (P). Se pudo retirar el sistema retrógrado, introduciendo primero el Corsair® hacia la parte media de la descendente anterior izquierda para visualizar las colaterales sobre la guía con objeto de verificar la posible lesión del canal. Se dilató un balón anterógrado de 2mm en todo el trayecto (Q), y se desplegaron stents liberadores de fármacos de 2,5 × 28 y 3,0 × 33 mm (R). Aunque la dilatación del balón después del stent produjo una perforación coronaria (S), que se trató de inmediato con stents Graft Master® (Abbott Vascular; Estados Unidos), la intervención se completó con éxito (T). La angiografía realizada en el seguimiento a los 8 meses no mostró ninguna reestenosis (U). En este caso, el denominado «efecto blooming» en la tomografía computarizada llevó a una sobreestimación de la poca probabilidad de una recanalización satisfactoria. CART®: trayecto subintimal anterógrado y retrógrado controlado; DAI: descendente anterior izquierda; TPI: tronco de la principal izquierda.
En general, la más rígida es la menos recomendada como guía retrógrada, aunque su aplicación no dejaría de ser razonable en determinadas situaciones específicas. Entre ellas se encuentra la presencia de una placa fibrocalcificada dura, un segmento recto y la estrecha proximidad con el equipo anterógrado. La aplicación indiscriminada de guías rígidas retrógradas podría agravar la intervención. Por ejemplo, en el contexto del CART® inverso, la guía retrógrada más rígida podría comportar la entrada en un espacio subintimal más profundo, más allá del espacio de reentrada, sobre todo en ausencia de visualización con IVUS.
Una advertencia respecto a esta técnica: una vez dilatado el balón anterógrado para la reentrada de la guía retrógrada, no debe usarse inyección de contraste hasta el despliegue del último stent. De lo contrario, el contraste presurizado se inyectaría en el segmento dilatado, lo que causaría disección en espiral o hematoma (disección inducida por hidropresión) (Figura 11).
Figura 11. Una dificultad del CART® inverso. A-C: una pequeña cantidad de contraste creó un gran hematoma tras la reentrada de la guía retrógrada y obligó a colocar otros stents para cubrirlo. D-G: de proximal a distal.
Posibles candidatos para el abordaje retrógradoEl abordaje retrógrado es una técnica nueva, aún en evolución. En comparación con el abordaje anterógrado convencional, cabe esperar una tasa de éxitos superior con la combinación de los abordajes anterógrado y retrógrado. El paso por un vaso colateral con una guía se alcanza, según lo descrito, en un 73-87% de los casos en manos experimentadas10, 11. Dado que las características angiográficas convencionales que contraindican la ICP, como la oclusión roma con una rama lateral grande, las colaterales puente, la calcificación y la OTC larga, no se consideran factores predictivos negativos para las intervenciones retrógradas11, hay subgrupos sustanciales de casos de fallo anterógrado previo que son candidatos adecuados para el uso de este nuevo abordaje.
Los posibles candidatos aceptables serían: a) pacientes con un fracaso previo con indicación clara y gran motivación para la ICP; b) angina refractaria con OTC de vaso nativo en pacientes a los que se ha practicado un bypass arterial coronario; c) enfermedad de un solo vaso, con OTC en la arteria coronaria derecha o la arteria descendente anterior izquierda, sin afectar al ostium, y con función ventricular izquierda y función renal preservadas, y d) pacientes con enfermedad de múltiples vasos y comorbilidades que rechazan la cirugía de bypass arterial coronario.
El paso siguiente empieza con un examen detallado de los registros previos de la enfermedad coronaria o la ICP y de cualquier exploración de imagen disponible, centrándose en las posibles vías de colaterales, el grado y la localización de la calcificación y las posibles causas de complicaciones.
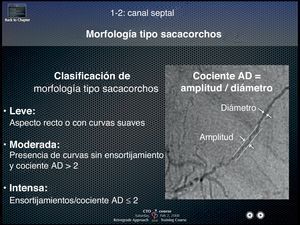
Paso con una guía por una colateralHay tres elementos que se debe tener en cuenta para el paso satisfactorio por una colateral: a) elección del canal; b) curvatura de la punta de la guía, y c) manipulación de la guía. El mejor vaso colateral para el paso de la guía retrógrada son las colaterales menos tortuosas y claramente visualizadas mediante una inyección supraselectiva, según lo ejemplificado por la conexión colateral (CC) del Dr. Werner de grado 1 o 2 (los grados de CC se establecen de la siguiente forma: CC0, ausencia de conexión continua; CC1, conexión continua filiforme, y CC2, conexión continua de tipo rama lateral pequeña)3. Por otro lado, los principales obstáculos para el paso de la guía son las angulaciones agudas, la curvatura brusca, la ramificación, la morfología en sacacorchos, la calcificación y la falta de visibilidad de la conexión CC con el vaso receptor11. Una regla básica para evitar el fracaso sería no elegir colaterales con intensa disposición en sacacorchos, caracterizadas por un cociente de amplitud respecto a diámetro < 2 (Figura 12) (cortesía del Dr. Kato, presentación de CCT 2008).
Figura 12. Fórmula diferencial para los canales colaterales en sacacorchos. Un cociente de amplitud respecto a diámetro del sacacorchos < 2 define una tortuosidad grave del canal colateral y generalmente impide el paso satisfactorio de la guía. AD: amplitud respecto a diámetro.
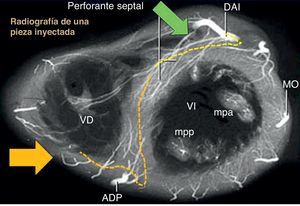
En caso de OTC en la arteria coronaria derecha, la posición craneal oblicua anterior derecha es la que se visualiza mejor en la angiografía para el examen de selección de colaterales septales procedentes de la arteria descendente anterior izquierda, mientras que la proyección caudal oblicua anterior derecha muestra la longitud real de la colateral (Figura 13)14, 15.
Figura 13. Relaciones anatómicas de los canales septales en las proyecciones angiográficas. La oblicua anterior derecha craneal (flecha verde) es la mejor proyección directa del origen de las ramas septales de la arteria descendente anterior izquierda, mientras que la oblicua anterior derecha caudal (flecha amarilla) es la mejor para las ramas septales inferiores. Generalmente, la ramificación originada en la descendente anterior izquierda permite un mejor paso de la guía que por las ramas inferiores de la arteria descendente posterior, con un trayecto más tortuoso, ramificado y en sacacorchos. ADP: arteria descendente posterior; DAI: descendente anterior izquierda; MO: marginal obtusa; mpa: músculo papilar anterior; mpp: músculo papilar posterior; OAD: oblicua anterior derecha; VD: ventrículo derecho; VI: ventrículo izquierdo.
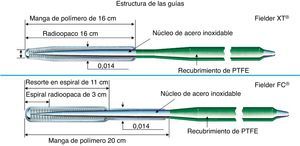
Hay dos tipos de guías con cubierta de polímero que son apropiadas para el paso a través de canales colaterales. Las guías de 0,014 ” (0,36 mm) sin extremo fino, como Fielder FC® (Asahi Intecc, Japón), Whisper® (Abbott Vascular, Estados Unidos), y las guías de 0,009 ″ (0,23 mm) con extremo fino como Fielder XT® (Asahi Intecc, Japón) (Figura 14). Ambas tienen una porción flexible en la punta, con un recubrimiento de polímero hidrófilo. Cuando se considera que el canal tiene un tamaño sustancial, una CC 1 o 2 (> 0,4 mm, límite inferior de visibilidad en el formato 512 × 512 DICOM®), el Fielder FC® sería el primero que ensayar, mientras que si se estima que alguna parte tiene menos de 0,4 mm y una tortuosidad de un grado menor con una CC 0 o 1, se recomendaría el Fielder XT®.
Figura 14. Estructura de las guías Fielder XT® y FC®. PTFE: politetrafluoroetileno.
Por lo que respecta a la curvatura de la punta de la guía, se recomienda una curvatura de la punta extremadamente pequeña (< 1mm) (Figura 15A) tras haber conducido el microcatéter hasta el segmento proximal del canal colateral mediante una guía flexible normal. Dado que la punta de estas guías es blanda, un golpeteo suave de la punta de la guía sobre la aguja de inserción sería el mejor método para crear una curva (Figura 15B).
Figura 15. Curva de la punta de la guía necesaria para el paso por el canal. Se recomienda una curva extremadamente pequeña (< 1,0 mm) en la guía con cubierta, de polímero blando (A). Sería mejor moldear la curva inicial sobre una aguja de inserción (B).
En cuanto a la manipulación de la guía, esta debe ser suave, con una rotación lenta, y se debe avanzarla y detenerla cuando aparece una serie de extrasístoles ventriculares o se aprecia una migración hacia la rama lateral. El avance y la rotación forzados podrían conducir a rotura del canal, perforación vascular y finalmente hematoma septal, que sería mortal al cabo de unas horas sin el tratamiento adecuado (es decir, embolización del canal). Así pues, debe tenerse especial cuidado en la manipulación de la guía en los canales colaterales.
Siempre que haya dudas respecto a la posición de la guía, se debe introducir el microcatéter y retirar la guía para inyectar contraste (sólo 2 ml) con objeto de determinar la dirección del flujo. Cuando una inyección revela un lavado del contraste, el canal está conectado con la cavidad ventricular derecha o izquierda. Cuanto el contraste permanece en el vaso, implica interrupción local (perforación focal). Estos son ejemplos de casos en que no es necesario ningún otro tratamiento y es mejor explorar otros canales. Por último, cuando se prevé un CART® inverso, hay que disponer de una guía larga flexible (guía RG3® o Fielder FC® 300cm, Asahi Intecc; Japón) para la externalización de la guía retrógrada.
Guía Fielder XT-R®Recientemente se ha desarrollado en Japón una guía con cubierta de polímero, con extremo fino (0,009 ”) y una punta más blanda, que podría utilizarse de forma segura en colaterales septales, auriculares y epicárdicas. La punta de la guía se caracteriza por una estructura de «espiral de cuerda» resistente al retorcimiento y se ha adoptado el mismo diseño en las guías Sion Blue flexibles, sin extremo fino. Se muestra un caso representativo en la Figura 16.
Figura 16. Un caso de uso de Fielder XT-R®. El caso corresponde a una oclusión coronaria total crónica de la arteria coronaria derecha con un catéter guía corto de calibre 8 Fr Amplatz® 1 con orificios laterales para un abordaje anterógrado (A). Dado que la Miracle Bros® 3 g y la Confianza Pro® 9 g podrían no alcanzar la luz vascular distal, se introdujo un Fielder XT-R® en la rama de cono homolateral (B), que pasó satisfactoriamente por la colateral sobre el Corsair® (C). La guía anterógrada Fielder XT® se introdujo también hasta la parte media del segmento como parte del abordaje bilateral (D).
Guía Sion Blue®Esta es también una nueva guía flexible de Asahi Intecc (Japón), que específica un tamaño de 0,014 ″ y una punta en resorte más resistente a la tortuosidad. Se muestra un caso representativo en la Figura 17.
Figura 17. Un caso de uso de la guía Sion Blue®, que corresponde a una oclusión coronaria total crónica de la arteria descendente anterior izquierda proximal, con un catéter guía de calibre 7 Fr corta Amplatz® 1 con orificios laterales para la derecha y uno de calibre 7 Fr con respaldo adicional 3.5 SH® para la izquierda (A). Dado que no se había logrado pasar las guías a través de la rama septal, se exploró el paso a través de una conexión de cono a tabique (B). La guía Sion Blue® pudo llegar al tabique sobre el Corsair® (C), y la curvatura de 60° de la punta permitió el paso por un giro marcado en la descendente anterior izquierda (D). Tras confirmar la posición de la guía (E), se introdujo el Corsair® hasta la parte proximal de la descendente anterior izquierda (F).
Microcatéter y Corsair®El Corsair® (Asahi Intecc, Japón) es un microcatéter, hecho con 10 guías trenzadas que se entrelazan para formar un tubo metálico en longitudes de 135 y 150 cm (Figura 18), que se recubre de un polímero. Un eje de 0,210 ” tiene una estructura de tipo Tornus® (Asahi Intecc, Japón) con una punta cubierta de un cono blando y de extremo fino (0,016 ″) destinado a mejorar la capacidad de paso en el microcanal y la maniobrabilidad de una guía retrógrada. De la punta al cuerpo, el Corsair® tiene un recubrimiento hidrófilo para potenciar la lubricidad con la fuerza de torsión necesaria para el avance y la recuperación a través de los canales colaterales y la OTC. Este catéter se puede aplicar en muchos canales colaterales sin ninguna dilatación con balón. Hay unos pocos principios que es preciso tener presentes al controlar el dispositivo:
1. Se recomienda una rotación suave para avanzarlo o retirarlo (en sentido de las agujas del reloj o en sentido contrario).
2. Cuando se encuentra una resistencia fuerte en el interior de un canal, hay que mantener una rotación suave. Si no es posible superarla, se retira el dispositivo y se cambia por un microcatéter de perfil bajo o un sistema de balón sobre guía. Ambos deben tener un eje más largo (> 145 cm) para dirigirlos hacia la OTC a lo largo de un canal colateral.
3. Al retirar dispositivos retrógrados, hay que asegurarse de que al traccionar de ellos no se lleve el catéter guía a una posición más profunda en el interior del ostium coronario. La punta de la guía puede causar lesiones, disección y, finalmente, una oclusión. Se muestra un caso representativo en la Figura 19.
Figura 19. Un caso de uso del Corsair®, que corresponde a una oclusión coronaria total crónica de la arteria coronaria derecha proximal con una angulación marcada a la altura del ostium, en la proyección oblicua anterior derecha craneal (A y B). Los catéteres guía fueron uno de calibre 7 Fr con respaldo adicional 3,5 con orificios laterales para la izquierda, y otro de calibre 7 Fr corto Amplatz® 1 con orificios laterales para la derecha. Una parte de la arteria coronaria derecha distal estaba irrigada por una rama ventricular muy tortuosa, procedente del segmento apical de la arteria descendente anterior izquierda (C). Se realizó una inyección superselectiva en la punta para delimitar la colateral ventricular epicárdica originada en la parte distal de la arteria descendente anterior izquierda (D). La guía Sion Blue® se pasó primero por el tercio proximal de la colateral con apoyo de Corsair®, y luego se continuó introduciendo por los segmentos muy incurvados con una nueva curva creada en la punta (> 45°) (E). Dado que hubo dificultades para el paso del Corsair®, se avanzó más la guía, de manera intencionada, en la rama posterolateral (F). Una rotación suave en la guía mientras se traccionaba de ella permitió que el Corsair® pasara por toda la colateral (G), y luego se redirigió la punta de la guía hacia la oclusión coronaria total crónica (H). Se cambió la guía por una Confianza Pro 9G para pasar la oclusión (I y J) y se reintrodujo la guía anterógrada mediante trayecto subíntimo anterógrado y retrógrado controlado inverso bajo visualización con ecografía intravascular (K). La angiografía final mostró un resultado excelente (L).
Figura 18. Configuración del microcatéter Asahi Corsair®.
En un estudio, la aplicación del Corsair® se asoció a una tasa más elevada de recanalización retrógrada en el 98,8% de los casos (n = 93), en comparación con el grupo en que no se usó el Corsair®, con un 92,5% (n = 93) tras haber pasado con éxito la guía retrógrada a través de un canal colateral (p = 0,030)12. El Corsair® se asoció también a mayor probabilidad de paso del canal colateral (96,8%) y de la OTC (84%), sin que aumentaran las lesiones mayores o menores de las colaterales. La aplicación de un abordaje retrógrado se realizó predominantemente con un CART® inverso en el 60,9% de los casos, seguido del paso retrógrado de un 20,6% en el grupo de Corsair®, mientras que en el grupo sin Corsair® hubo un CART® en el 64% y un paso de guía retrógrada en el 24,4% (p < 0,0001). Por último, el tiempo total de fluoroscopia y el tiempo total de intervención tendieron a ser menores en el grupo de Corsair® (respectivamente, 60,1 ± 26,3 frente a 67,8 ± 29,1min; p = 0,087; y 135,6 ± 57,4 frente a 155,5 ± 65min; p = 0,078).
Complicaciones asociadas a la intervenciónLas complicaciones específicas asociadas a un abordaje retrógrado son la rotura del canal colateral, la formación de un trombo y la isquemia total. Tal como se ha mencionado, la mayor parte de roturas de canal no requieren otro tratamiento11, excepto en casos de hematoma septal o taponamiento cardiaco, en los que es necesaria una hemostasia definitiva mediante oclusión embólica a través de un microcatéter. Son necesarias microespirales para embolizar el segmento del canal con la rotura en caso de que haya una hemorragia con propensión al taponamiento. En consecuencia, antes de retirar la guía retrógrada, debe visualizarse el lado donante del árbol arterial con la guía externalizada colocada. A continuación, los microcatéteres de ambos extremos de la guía externalizada podrían permitir el acceso al punto de hemorragia en caso de que se produzca rotura de la colateral.
La formación de un trombo se evita también irrigando con suero fisiológico el catéter guía y manteniendo un tiempo de coagulación activado > 300 s, que se verifica cada 30-60 min. Se puede minimizar la isquemia total mediante la manipulación cuidadosa del sistema retrógrado en relación con la colocación del catéter de guía retrógrado. Así pues, cuando hay una estenosis coronaria sustancial en el trayecto hacia las colaterales del lado donante, el tratamiento de avance con stents permite una instrumentación retrógrada estable y más segura. Por último, la disección inducida por el catéter, que la mayoría de las veces se produce cuando se retiran los catéteres retrógrados, podría prevenirse mediante una tracción constante del catéter guía al retirarlo del ostium, al tiempo que se aplica una rotación suave (en uno u otro sentido) en el Corsair® para extraerlo.
Perspectivas futurasEl abordaje retrógrado se ha perfeccionado y simplificado con una mayor aplicación de las guías con recubrimiento de polímero, más blandas, la IVUS y el Corsair®. Habrá más casos tratados con CART® inverso, aunque el CART® convencional continúa siendo necesario en situaciones de oclusión del ostium, algunas oclusiones intensamente calcificadas y cuando no se puede introducir el microcatéter en las oclusiones, entre otros. En la Tabla 3 se presentan las principales características del CART® y el CART® inverso.
Tabla 3. Comparación de CART® y CART® inverso resaltando las diferencias en los métodos de «reentrada» de la guía
| CART® | CART® inverso | |
| Paso principal de la guía | Anterógrado | Retrógrado |
| Ayuda para el paso de la guía | Fluoroscopia sola | Fluoro e IVUS |
| Modo de reentrada | Trayecto subintimal | Trayecto subintimal |
| Técnicas de reentrada en OTC | Balón retrógrado | Balón anterógrado tras IVUS |
| Reproducibilidad | Requiere experiencia | Alta en manos experimentadas |
| Riesgos | Igual que en OTC anterógrada + lesión del canal | Lesión del canal |
| Tiempo de intervención | Impredecible | Predecible |
CART®: controlled antegrade and retrograde subintimal tracking (trayecto subintimal anterógrado y retrógrado controlado); IVUS: ecografía intravascular; OTC: oclusión coronaria total crónica.
Aunque no hay todavía ningún ensayo prospectivo, controlado y aleatorizado concluyente que respalde o refute el posible efecto beneficioso de la ICP-OTC, debemos usar esta técnica con precaución, dado que la aplicación de nuevos dispositivos y la evolución de la técnica podrían hacer que las intervenciones de OTC complejas se asociaran a complicaciones en las que no se ha pensado. Existe la esperanza de que las nuevas técnicas de imagen, como la TC coronaria, puedan facilitar la planificación y la realización de las intervenciones de OTC de un modo más fiable y predecible. Las cuestiones aún no resueltas son los efectos a largo plazo de irradiar a los pacientes con rayos X, el efecto del contraste en la función renal y la necesidad de una formación especializada para conseguir la pericia técnica necesaria.
Información adicionalLos lectores interesados pueden consultar los libros especializados para profundizar en el conocimiento de cada uno de los temas tratados15.
Conflicto de interesesNinguno.
Autor para correspondencia: Cardiology Division, Sekishinkai Sayama Hospital, 1-33, Unoki, Sayama City, Saitama 353-1323, Japón. masahisa-yamane@sayamahp.org