El síndrome de QT largo (SQTL) se caracteriza por una prolongación del intervalo QT y arritmias ventriculares1. Más de 17 genes (que codifican canales de potasio, sodio y calcio) se han relacionado con él: en el 75% de los casos se encuentran variantes en KCNQ1 (SQTL 1), KCNH2 (SQTL 2) y SCN5A (SQTL 3). En al menos un 1-5%, se detectan variantes en otros genes como CACNA1C, relacionado con el síndrome de Timothy o SQTL 81,2.
Se presenta un caso de síndrome de Timothy que comenzó como miocardiopatía periparto (MPP), sin ninguna otra manifestación extracardiaca, entidad recientemente denominada Cardiac-only Timothy Syndrome (COTS)1.
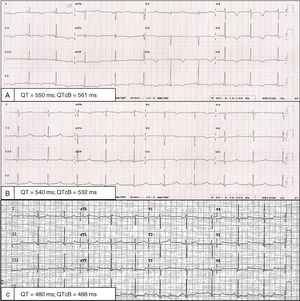
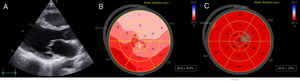
Una mujer de 32 años consultó por disnea 1 semana después del parto. La paciente había tenido otro embarazo años atrás, sin complicaciones. Estable hemodinámicamente, presentaba signos de congestión sistémica y pulmonar. El electrocardiograma mostró inversión generalizada de onda T con intervalo QT corregido por Bazett (QTc) de 561ms (figura 1A). No había recibido ningún fármaco prolongador del QT y se descartaron alteraciones hidroelectrolíticas. Un ecocardiograma transtorácico mostró un ventrículo izquierdo de tamaño normal, sin hipertrofia, con disfunción ventricular moderada (fracción de eyección del ventrículo izquierdo [FEVI] del 36%) e hipocinesia general. El strain longitudinal global era del –8,2% (figuras 2A y B, vídeo 1 del material adicional). No se observaron extrasístoles ni arritmias en la telemetría durante la hospitalización. Tras tratamiento con diuréticos, bisoprolol y enalapril, fue mejorando progresivamente y se le dio el alta hospitalaria tras 7 días. Persistía la inversión generalizada de la onda T de V1-V4 en el electrocardiograma y QTc de 532ms (figura 1B).
La evolución fue satisfactoria; un ecocardiograma transtorácico a los 6 meses evidenció una FEVI normal (68%) y un strain longitudinal global del –23% (figura 2C, vídeo 2 del material adicional). La resonancia cardiaca mostró función y tamaño biventricular normales, sin realce tardío. En el electrocardiograma desapareció la inversión de la onda T, pero persistía el QTc prolongado (figura 1C).
Se realizó un estudio genético mediante ultrasecuenciación masiva con un panel de 218 genes relacionados con canalopatías y miocardiopatías. Se detectó la variante p.Arg518Cys en el gen CACNA1C (exón 12), clasificada como patogénica según los criterios vigentes1,3,4. La paciente no tiene antecedentes familiares de muerte súbita ni de miocardiopatías; sus padres y su hijo presentan QTc normal, sin cardiopatía estructural, y no son portadores de la variante, por lo que es de novo.
Actualmente se encuentra asintomática y mantiene el QTc <500ms con bloqueadores beta y evitando los fármacos prolongadores del QT.
El gen CACNA1C codifica la subunidad alfa-1 del canal de calcio tipo L dependiente de voltaje; consta de 4 dominios homólogos (DI-DIV) interconectados y cada dominio incluye 6 segmentos transmembrana (S1-S6). Es esencial para la fase de meseta del potencial de acción, la excitabilidad, la contracción de los miocitos y la regulación de expresión génica1. Variantes patogénicas resultantes en pérdida de función del canal se han relacionado con síndromes de onda J, mientras que la ganancia de función se ha relacionado con 4 fenotipos diferentes1,2:
- a)
Síndrome de Timothy: caracterizado por SQTL, sindactilia, malformaciones cardiacas, dismorfismos faciales y trastornos del espectro autista. Se inicia en la infancia e implica alto riesgo de muerte súbita. Todas las variantes descritas son de novo en los diferentes segmentos transmembrana S61,2.
- b)
SQTL aislado: las variantes que lo originan ocurren en los linker citoplásmicos y los extremos terminales N y C2.
- c)
Sindactilia, retraso psicomotor e hipertensión pulmonar sin SQTL: se ha descrito recientemente en relación con la variante p.Arg1024Gly5.
- d)
COTS (síndrome de Timothy exclusivamente cardiaco): se ha descrito en 3 familias (12 casos) en las que existía alguno de los siguientes fenotipos a partir de los 20 años, sin hallazgos extracardiacos: SQTL, miocardiopatía hipertrófica (MCH), defectos septales y muerte súbita1. Se identificaron las variantes p.Arg518Cys y p.Arg518His, localizadas en el linker DI-DII. Había cosegregración, con penetrancia completa y expresividad variable, y ninguna fue de novo. Un caso índice, portadora de la variante de nuestra paciente, comenzó como MPP y SQTL a los 25 años; presentaba una comunicación interventricular, y 7 años después desarrolló MCH1, que nuestra paciente actualmente no padece. Recientemente se ha descrito otra familia con MCH, SQTL y la misma variante4. Estudios funcionales (whole cell patch clamp) mostraron una mezcla de pérdida y ganancia de función del canal, con menor densidad de corriente global y aumento de la corriente tardía y ventana1. Además, existen defectos en el tráfico del canal y menor concentración del mismo en la membrana celular1. Como este canal es fundamental para la excitabilidad-contracción muscular1, consideramos que puede producirse hipertrofia o disfunción ventricular transitoria por mal manejo del calcio.
La MPP se caracteriza por disfunción ventricular antes o después del parto. Aunque de etiología desconocida, existe evidencia actual de que la prevalencia de truncamientos en genes relacionados con miocardiopatía dilatada es similar en la MPP, y la titina es el más frecuente en ambas entidades, pero no el único6.
Se describe con este caso la asociación de MPP y SQTL como primera manifestación de COTS. La presencia de un SQTL junto con MPP o MCH debe suscitar la sospecha de posibles variantes patogénicas en CACNA1C.
CONFLICTO DE INTERESESI. Cárdenas-Reyes es empleada de Health in Code S.L. L. Monserrat-Iglesias es accionista de Health in Code S.L.