Estudiar la evolución y el significado pronóstico de la frecuencia cardiaca tras el trasplante cardiaco.
MétodosEstudio observacional de 170 pacientes que recibieron un trasplante cardiaco bicavo entre 1995 y 2005; todos estaban en ritmo sinusal. La frecuencia cardiaca en reposo se determinó a partir de electrocardiogramas al final del primer año tras el trasplante y anualmente hasta el décimo año. Mediante análisis de Cox, se evaluó la incidencia de eventos adversos en un seguimiento medio de 8,9±3,1 años. El evento principal del estudio fue la variable combinada muerte o disfunción del injerto.
ResultadosLa frecuencia cardiaca en reposo, medida al final del primer año tras el trasplante, fue un predictor independiente del evento combinado principal (hazard ratio = 1,054; intervalo de confianza del 95%, 1,028-1,080; p<0,001). Se observó una asociación estadísticamente significativa con la mortalidad total (hazard ratio = 1,058; intervalo de confianza del 95%, 1,030-1,087; p<0,001) y con la mortalidad por causas cardiacas (hazard ratio = 1,069; intervalo de confianza del 95%, 1,026-1,113; p=0,001), pero no con la disfunción del injerto (hazard ratio=1,028; intervalo de confianza del 95%, 0,989-1,069; p=0,161). Para los pacientes con frecuencia cardiaca ≥ 105 y < 90 lpm frente a aquellos con 90-104 lpm, las hazard ratio del evento principal fueron, respectivamente, 2,233 (intervalo de confianza del 95%, 1,250-3,989, p=0,007) y 0,380 (intervalo de confianza del 95%, 0,161-0,895; p=0,027). Este parámetro presentó una tendencia decreciente en los primeros 10 años del trasplante (p=0,001). Los pacientes con incremento neto de frecuencia cardiaca en el seguimiento mostraron mayor incidencia de eventos adversos.
ConclusionesLa frecuencia cardiaca elevada es un marcador pronóstico adverso tras el trasplante cardiaco.
Palabras clave
La frecuencia cardiaca (FC) elevada es un marcador independiente de riesgo cardiovascular1. En estudios previos se ha descrito una fuerte asociación entre FC e incidencia de eventos cardiovasculares en sujetos sanos2 y pacientes con hipertensión arterial3, enfermedad coronaria4 e insuficiencia cardiaca (IC)5. Además, el tratamiento crónico con agentes reductores de la FC, como bloqueadores beta e ivabradina, conlleva un beneficio pronóstico en algunos subgrupos de pacientes con enfermedad cardiaca6–8.
Actualmente el trasplante cardiaco (TxC) continúa siendo la alternativa terapéutica de elección en pacientes con IC refractaria. Para candidatos cuidadosamente seleccionados, el TxC ofrece excelentes resultados a largo plazo en supervivencia y calidad de vida9,10. Debido a la denervación autonómica, los pacientes con TxC presentan una FC en reposo más alta que los individuos con corazón nativo11. Pese a que habitualmente se considera normal este hallazgo, algunos estudios han señalado que los receptores de TxC con FC más alta podrían tener menos supervivencia12–14. En uno de esos estudios14, la reducción de la supervivencia se atribuyó a una mayor mortalidad por enfermedad vascular del injerto (EVI). Otros autores12, sin embargo, no han observado diferencias en la distribución de las causas de muerte en función de los valores de FC. La asociación causal entre FC y EVI es, en todo caso, controvertida15–17.
El propósito del estudio es analizar el significado pronóstico de la FC en los pacientes con TxC, centrándolo en su asociación con supervivencia, causas de muerte y función del injerto, así como describir su tendencia evolutiva a largo plazo.
MÉTODOSPoblación del estudioSe ha realizado un análisis retrospectivo basado en la cohorte histórica de pacientes adultos (edad>18 años) que recibieron un TxC ortotópico en nuestro centro entre 1995 y 2005. En el estudio se incluyó a todos los pacientes intervenidos mediante técnica bicava que sobrevivieron al menos 1 año y que en ese momento estaban en ritmo sinusal. Se excluyó a los pacientes con re-TxC, trasplante multiorgánico, anemia grave (hemoglobina < 10g/dl), marcapasos o tratamiento con bloqueadores beta, diltiazem, verapamilo, digoxina, amiodarona o ivabradina. El protocolo del estudio fue aprobado por el Comité Autonómico de Ética en la Investigación de Galicia.
ProtocoloLos pacientes fueron tratados según el protocolo local. Durante el postoperatorio inmediato, todos recibieron terapia de inducción con muromonab-CD3 o basiliximab. El régimen inmunosupresor de mantenimiento consistió en diferentes combinaciones de prednisona, anticalcineurínicos (tacrolimus o ciclosporina), agentes antiproliferativos (micofenolato mofetilo o azatioprina) e inhibidores de la m-TOR (everolimus o sirolimus).
Se realizaron biopsias endomiocárdicas sistemáticas durante el primer año tras el TxC, y posteriormente en caso de sospecha de rechazo agudo. La determinación de anticuerpos antidonante y marcadores inmunopatológicos de rechazo humoral también se realizó con base en los hallazgos clínicos. Se realizó angiografía coronaria a los pacientes con sospecha de EVI y, desde 2003, también a los pacientes asintomáticos, salvo contraindicación, tras 1 mes y 1, 5 y 10 años del TxC.
VariablesLa información para el estudio se recogió de modo retrospectivo mediante revisión de historias clínicas. La FC en reposo se determinó a partir de electrocardiogramas obtenidos en reposo, en pacientes estables, durante las visitas habituales en consulta externa. Se realizó una determinación basal de FC al final del primer año tras el TxC y posteriormente con periodicidad anual hasta el décimo año del TxC. La determinación basal se calculó como el promedio de todas las medidas de FC realizadas a partir de los electrocardiogramas obtenidos en las visitas a consulta entre el décimo y el duodécimo mes (cuarto trimestre) tras el TxC. Se obtuvo información actualizada acerca del estado vital de todos los pacientes del estudio en marzo de 2012. No se registraron pérdidas de seguimiento.
El evento principal del estudio fue la variable combinada muerte por cualquier causa o disfunción del injerto. Otros eventos analizados fueron los 2 componentes individuales del evento principal y la muerte por causa cardiaca. Se definió disfunción del injerto como cualquier hospitalización por IC clínica en presencia de fracción de eyección del ventrículo izquierdo (FEVI) < 45%, determinada por ecocardiograma o por ventriculografía, o en presencia de fisiología restrictiva del injerto determinada por ecocardiografía o por estudio hemodinámico invasivo18. La muerte por causa cardiaca se definió como la causada por IC, isquemia miocárdica o arritmia, incluidas las atribuibles a rechazo agudo, EVI y cualquier muerte súbita inexplicada.
Las causas de muerte se recogieron a partir de informes de autopsia y certificados de defunción. A los pacientes hospitalizados por disfunción del injerto se les practicó un protocolo diagnóstico completo que incluía ecocardiograma transtorácico, coronariografía, estudio hemodinámico y biopsia endomiocárdica. Se estableció el diagnóstico de EVI en presencia de alguna estenosis coronaria focal > 50% de un vaso epicárdico principal o engrosamiento concéntrico difuso de todo el vaso. Se consideró rechazo agudo celular como causa de disfunción del injerto en caso de clasificarlo como grado histológico 2R o superior19. En ausencia de otras causas, se asumió rechazo humoral como causa de disfunción del injerto en pacientes que presentaban inmunofluorescencia directa positiva para C4d con patrón pericapilar.
Análisis estadísticoLas variables categóricas se presentan como proporciones, mientras que las continuas se presentan como media±desviación estándar. Hemos empleado el test de Kolmogorov-Smirnov para estudiar la adecuación de los valores de FC a la distribución normal. La asociación entre características clínicas basales y FC se analizó mediante el coeficiente de correlación de Pearson en el caso de las variables continuas, el test de la t de Student en caso de variables cualitativas dicotómicas y el test ANOVA (análisis de la varianza) con corrección de Bonferroni en caso de variables cualitativas con 3 o más categorías.
Hemos utilizado la regresión multivariable de Cox para determinar el significado pronóstico de la FC en reposo al final del primer año tras el TxC. Con base en la experiencia clínica y la literatura previa, se seleccionaron las siguientes variables candidatas para dicho análisis: edad del donante, edad del receptor, sexo del donante, sexo del receptor, diabetes mellitus, cardiopatía de base y estado serológico de citomegalovirus, creatinina sérica y tipo de inmunosupresión. Para cada uno de los eventos estudiados, se construyó un modelo multivariable de ajuste en el que se retuvieron las variables cuya entrada o salida causaba un cambio relevante en la hazard ratio (HR) de la variable cuyo efecto se pretendía ajustar (la FC al final del primer año tras el TxC). En todos los modelos finales se forzó la entrada de la edad del donante, habida cuenta de la correlación observada entre esta variable y la FC. Las variables retenidas en los modelos finales de ajuste fueron edad del donante, sexo del donante y diabetes mellitus (muerte o disfunción del injerto y muerte por cualquier causa), edad del donante, sexo del donante y sexo del receptor (muerte por causas cardiacas) y edad del donante (disfunción del injerto).
Para el análisis de eventos en el seguimiento, los pacientes se clasificaron en 3 subgrupos en función de si su FC al final del primer año tras el TxC se encontraba en el cuartil inferior, en la franja intercuartílica central o en el cuartil superior de la población estudiada. Mediante los modelos multivariables descritos anteriormente, se calcularon las HR ajustadas (HRa) y las curvas de incidencia acumulada de los eventos del estudio en estos subgrupos, considerando como categoría de referencia el subgrupo de pacientes con FC en la franja intercuartílica central.
El estudio de la tendencia de la FC en los primeros 10 años tras el TxC se llevó a cabo mediante un análisis de la varianza para medidas repetidas con corrección de Greenhouse-Geisser. Asimismo, se realizó una estimación de la tendencia temporal de este parámetro en cada uno de los pacientes. Esta se consideró creciente (incremento neto de FC) en los pacientes cuya diferencia entre la media de todas las determinaciones anuales de FC y la determinación basal era > 0. En caso contrario, la tendencia se consideró decreciente (reducción neta de FC). Los modelos multivariables construidos previamente se emplearon para calcular las HRa y las curvas de incidencia acumulada de los eventos del estudio para los subgrupos de pacientes con tendencias creciente y decreciente de la FC en el seguimiento. Para todos los contrastes, se estableció un nivel de significación de p < 0,05. El análisis estadístico se realizó con SPSS 20.
RESULTADOSPacientesEntre 1995 y 2005, 393 pacientes recibieron un TxC ortotópico en nuestro centro, de los que 322 sobrevivieron al menos 1 año tras la intervención. Se excluyó del estudio a 152 pacientes por diferentes razones: tratamiento con fármacos cronotroponegativos (n=132), TxC y trasplante renal simultáneos (n=4), re-TxC (n=2), anemia grave (n=2) y ausencia de electrocardiogramas analizables (n=12). Los 170 pacientes restantes constituyeron la población del estudio. Sus características clínicas basales se muestran en la tabla 1.
Características clínicas de los pacientes incluidos en el estudio
| Receptores | |
| Edad (años) | 52,9±12,6 |
| Mujeres | 34 (20) |
| Cardiopatía de base | |
| Isquémica | 56 (32,9) |
| Dilatada | 84 (49,4) |
| Otras | 30 (17,6) |
| Diabetes mellitus | 36 (21,2) |
| Hipertensión arterial | 111 (65,3) |
| Creatinina (mg/dl) | 1,44±0,49 |
| Índice de masa corporal | 25,6±5,4 |
| Donantes | |
| Edad (años) | 39,6±13,3 |
| Mujeres | 42 (24,7) |
| Serología de citomegalovirus | |
| Receptor + | 144 (84,7) |
| Receptor –/donante + | 20 (11,8) |
| Receptor –/donante – | 6 (3,5) |
| Cirugía de trasplante | |
| Trasplante urgente | 34 (20) |
| Tiempo de isquemia (min) | 182,1±81,1 |
| Tiempo de CEC (min) | 119,6±30,6 |
| Inmunosupresión | |
| Muromonab-CD3 | 86 (50,6) |
| Basiliximab | 84 (49,4) |
| Ciclosporina | 153 (90) |
| Tacrolimus | 16 (9,4) |
| Prednisona | 170 (100) |
| Micofenolato mofetilo | 134 (78,8) |
| Azatioprina | 30 (17,6) |
| Sirolimus o everolimus | 7 (4,1) |
CEC: circulación extracorpórea.
Los valores expresan n (%) o media±desviación estándar.
Al final del primer año tras el TxC, la FC en reposo de la población del estudio se adecuaba a la distribución normal (test de Kolmogorov-Smirnov, p=0,522). La FC media era 96,1±12,4 lpm, y los cuartiles 1, 2, 3 y 4 eran, respectivamente, de 55-89, 90-96, 97-104 y 105-132 lpm. La única variable clínica basal que mostró una correlación estadísticamente significativa con la FC al final del primer año tras el TxC fue la edad del donante (r=–0,253; p=0,001). En las tablas 1 y 2 del material suplementario se muestra la correlación entre las diferentes variables clínicas basales estudiadas y la FC.
Eventos adversosDurante un seguimiento medio de 8,9±3,1 años, 20 pacientes (11,8%) presentaron disfunción del injerto y 47 (27,6%) fallecieron. En total, 55 pacientes (32,3%) sufrieron el evento combinado principal del estudio.
La disfunción del injerto se atribuyó a EVI en 10 pacientes, a rechazo humoral en 4 y a rechazo celular en 3. No fue posible identificar una causa específica de disfunción del injerto en los 3 casos restantes.
Se atribuyeron 23 muertes (48,9%) a causas cardiacas; 7 pacientes fallecieron por IC refractaria (secundaria a EVI en 5 casos y a rechazo celular en 2 casos) y 16 pacientes sufrieron muerte súbita (de los que 5 tenían diagnóstico previo de EVI). Las muertes por causa no cardiaca se debieron a neoplasias (n=13), infección (n=8), hepatopatía (n=1), abuso de drogas (n=1) y hemorragia (n=1).
Valor pronóstico de la frecuencia cardiacaEl análisis de Cox univariable mostró una asociación estadísticamente significativa entre mayor FC en reposo al final del primer año del TxC y la incidencia del evento combinado principal (HR bruta=1,042; intervalo de confianza del 95% [IC95%], 1,019-1,065; p<0,001). Tras el ajuste multivariable (tabla 2), esta asociación mantuvo su significación estadística (HRa=1,054; IC95%, 1,028-1,080; p<0,001). Además, se observó una asociación significativa entre la FC y el riesgo de muerte por cualquier causa (HRa=1,058; IC95%, 1,030-1,087; p<0,001), así como el riesgo de muerte por causa cardiaca (HRa=1,069; IC95%, 1,026-1,113; p=0,001). La asociación entre la FC y el riesgo de disfunción del injerto no alcanzó la significación estadística (HRa=1,028; IC95%, 0,989-1,069; p=0,161).
Variables clínicas asociadas con el evento primario combinado de muerte o disfunción del injerto: análisis multivariable de riesgos proporcionales de Cox
| HR (IC95%) | p | HRa (IC95%) | p | |
|---|---|---|---|---|
| Frecuencia cardiaca | 1,042 (1,019-1,065) | < 0,001 | 1,054 (1,028-1,080) | < 0,001 |
| Edad del receptor | 1,017 (0,994-1,042) | 0,149 | ||
| Sexo del receptor | 0,660 (0,312-1,399) | 0,278 | ||
| Cardiopatía isquémica | 1,305 (0,999-1,704) | 0,051 | ||
| Diabetes mellitus | 1,543 (0,862-2,765) | 0,145 | 1,670 (0,925-3,014) | 0,089 |
| Hipertensión arterial | 0,794 (0,425-1,480) | 0,467 | ||
| Creatinina | 1,118 (0,643-1,946) | 0,692 | ||
| Índice de masa corporal | 1,021 (0,984-1,060) | 0,274 | ||
| Edad del donante | 1,001 (0,990-1,029) | 0,365 | 1,028 (1,006-1,050) | 0,011 |
| Donante mujer | 0,477 (0,233-0,978) | 0,043 | 0,486 (0,235-1,008) | 0,053 |
| Tiempo de isquemia | 1,003 (1-1,007) | 0,049 | ||
| Tiempo de CEC | 1,009 (1,001-1,017) | 0,030 | ||
| Trasplante cardiaco urgente | 1,229 (0,600-2,515) | 0,573 | ||
| Serología de CMV D -/R + | 1,307 (0,520-3,284) | 0,569 | ||
| Uso de tacrolimus | 0,929 (0,334-2,580) | 0,887 | ||
| Uso de micofenolato mofetilo | 0,832 (0,453-1,526) | 0,552 |
CEC: circulación extracorpórea; CMV: citomegalovirus; D: donante; HR: hazard ratio bruta; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; R: receptor.
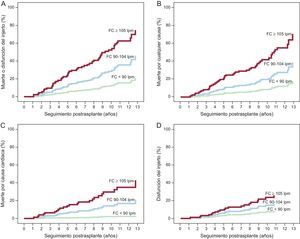
La figura 1 muestra las curvas de incidencia acumulada de cada uno de los eventos del estudio en los subgrupos de pacientes con FC en el cuartil inferior (< 90 lpm), en la franja intercuartílica central (90-104 lpm) y en el cuartil superior (≥ 105 lpm). En comparación con la categoría central de referencia, las HRa para el evento combinado principal fueron, respectivamente, 2,233 (IC95%, 1,250-3,989; p=0,007) y 0,380 (IC95%, 0,161-0,895; p=0,027) en los pacientes con FC ≥ 105 y<90 lpm. En la tabla 3 se muestran las HRa para los demás eventos del estudio.
Análisis multivariable de riesgos proporcionales de Cox
| HRa (IC95%) | p | |
|---|---|---|
| Muerte o disfunción del injerto | ||
| FC ≥ 105 lpm | 2,233 (1,250-3,989) | 0,007 |
| FC < 90 lpm | 0,380 (0,161-0,895) | 0,027 |
| Muerte por cualquier causa | ||
| FC ≥ 105 lpm | 2,476 (1,324-4,630) | 0,005 |
| FC < 90 lpm | 0,392 (0,153-1,004) | 0,051 |
| Disfunción del injerto | ||
| FC ≥ 105 lpm | 1,677 (0,628-4,477) | 0,302 |
| FC < 90 lpm | 0,472 (0,128–1,739) | 0,259 |
| Muerte por causa cardiaca | ||
| FC ≥ 105 lpm | 2,407 (1-5,798) | 0,050 |
| FC<90 lpm | 0,120 (0,015-0,937) | 0,043 |
FC: frecuencia cardiaca; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%.
HRa de los eventos del estudio en 3 categorías de FC en reposo al final del primer año tras el trasplante. La estimación de riesgos se ha realizado con respecto a la categoría de referencia de pacientes con FC dentro del intervalo intercuartílico central (90-104 lpm).
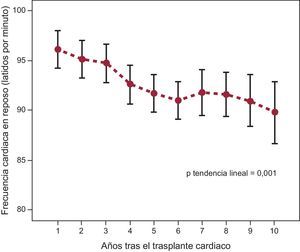
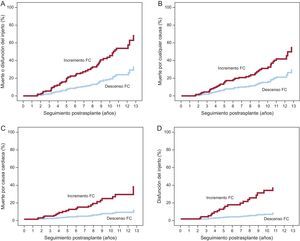
En los primeros 10 años de seguimiento tras el TxC, la FC media de la población del estudio presentó una tendencia temporal lineal decreciente (p=0,001) (figura 2). Los pacientes en los que hubo incremento neto de la FC en el seguimiento tuvieron una incidencia significativamente mayor del evento combinado principal (HRa=2,857; IC95%, 1,514-5,391; p=0,001) respecto a los pacientes con descenso neto de la FC. Los riesgos de muerte por cualquier causa (HRa=2,104; IC95%, 1,069-4,142; p=0,031), disfunción del injerto (HRa=6,839; IC95%, 2,371-19,730; p<0,001) y muerte por causa cardiaca (HRa=4,051; IC95%, 1,536-10,684; p=0,005) también fueron significativamente mayores en los pacientes con incremento neto de la FC. En la figura 3 se presentan las curvas de incidencia acumulada de eventos en función de la tendencia evolutiva de la FC.
Tendencia temporal de la frecuencia cardiaca en reposo en los primeros 10 años tras el trasplante. Los puntos representan valores medios de frecuencia cardiaca al final del primer año y en los seguimientos anuales posteriores, y las barras de error muestran los respectivos intervalos de confianza del 95%.
Este estudio avala el valor pronóstico de la FC en los pacientes con TxC. En nuestra serie, la presencia de un mayor valor de FC en reposo al final del primer año tras el TxC se asoció de modo independiente con un incremento de la incidencia acumulada del evento combinado de muerte por cualquier causa y disfunción del injerto. Este resultado se obtuvo a expensas de un incremento de la mortalidad total; sin embargo, la tendencia observada hacia un mayor riesgo de disfunción del injerto no alcanzó la significación estadística, probablemente debido al pequeño número de episodios y la escasa potencia estadística para el análisis individual de este evento. Cabe destacar que el significado pronóstico de la FC no se limitó a una única medida, ya que la tendencia temporal del parámetro se mostró como un marcador pronóstico independiente de los valores basales.
La cirugía del TxC lleva implícita la transección de las fibras autonómicas que inervan el corazón nativo. Debido a la falta de estimulación parasimpática, la FC del injerto cardiaco se determina fundamentalmente por la respuesta a las catecolaminas circulantes11. En comparación con controles sanos, los receptores de TxC muestran una elevación persistente de la FC en reposo con variabilidad circadiana limitada y una respuesta al ejercicio más retardada11. Hasta ahora no se ha definido con claridad la FC «normal» de los receptores de TxC, con valores medios que oscilan entre 85 y 100 lpm en diferentes series12–17. Esta aparente variabilidad está condicionada por diferencias en las técnicas quirúrgicas, la edad del donante o el tratamiento farmacológico, así como por el tiempo transcurrido desde el TxC, ya que algunos pacientes experimentan un fenómeno de reinervación gradual del injerto que resulta en una caída progresiva de la FC20.
Al final del primer año tras el TxC, los valores de FC en reposo de nuestra población seguían una distribución normal, con media y mediana coincidentes en 96 lpm y un intervalo intercuartílico central de 90-104 lpm. En relación con esta categoría de referencia, los pacientes con FC ≥ 105 lpm mostraron un incremento de más de 2 veces en la incidencia de la variable principal muerte o disfunción del injerto, mientras que esta se redujo en una proporción similar en el grupo de pacientes con FC<90 lpm. En la misma línea, Anand et al12 y Castel et al14 observaron una reducción significativa de la supervivencia de los pacientes con TxC que presentaban una FC en reposo > 90 lpm en comparación con los que tenían FC<90 lpm, mientras que Melero-Ferrer et al13 alcanzaron una conclusión similar utilizando el punto de corte de 100 lpm. La medición de la FC se realizó al año del TxC en dos de estos estudios13,14 y a los 3 meses en el otro12.
El impacto pronóstico negativo de los valores elevados de FC observado en nuestro estudio es atribuible a un incremento del riesgo de muerte por causas cardiacas, principalmente IC refractaria y muerte súbita. La EVI fue la enfermedad cardiaca subyacente más frecuente en estos casos, al afectar a cerca de la mitad de los pacientes fallecidos por causas cardiacas. No obstante, la ausencia de coronariografías sistemáticas de los pacientes trasplantados durante los primeros años del estudio dificulta una estimación precisa del impacto de la EVI como causa de muerte en nuestra población. De hecho, dada la alta proporción de muertes súbitas inexplicadas, es probable que sea todavía mayor que el detectado. En el estudio de Castel et al14, la menor supervivencia de los receptores de TxC con las FC más altas se atribuyó a un exceso de mortalidad por EVI. Sin embargo, Anand et al12 no observaron relación alguna entre la FC en reposo y la distribución de las causas de muerte. En el estudio de Melero-Ferrer et al. no se aporta información específica acerca de las causas de mortalidad13.
Hasta el momento, no se conocen con claridad las razones que justifican la asociación entre FC y riesgo de muerte de los pacientes con TxC. En algunos casos, la alta FC se puede atribuir a una reacción adaptativa21 a una condición clínica subyacente adversa como hipovolemia, anemia, disfunción del injerto, enfermedad broncopulmonar, infección o neoplasia, de modo que, más que un factor de riesgo propiamente dicho, se debería interpretar como un marcador de riesgo. No obstante, también se postula que la taquicardia permanente podría por sí sola tener un papel causal en el desarrollo de disfunción contráctil del injerto, mediada por el agotamiento energético del miocardio21. En otros casos, la elevación de la FC puede reflejar una concentración de catecolaminas circulantes alta, que conllevaría mayor riesgo de hipertensión, isquemia miocárdica, remodelado ventricular adverso y arritmogénesis22. Además, cabe recordar que en pacientes con corazón nativo la elevación persistente de la FC es un factor implicado en la génesis y la progresión de la enfermedad arterial coronaria23. Se ha demostrado que la FC alta estimula la expresión endotelial de moléculas de adhesión y citocinas como interleucina 6 y factor de necrosis tumoral alfa24, por lo que, hipotéticamente, podría incrementar la respuesta inmunológica contra los vasos coronarios del injerto. De todos modos, los estudios realizados hasta el momento no han demostrado asociación firme entre FC persistentemente alta e incremento del riesgo de EVI en los receptores de TxC15–17.
La historia natural de los pacientes con TxC incluye una reinervación gradual del injerto con una reducción progresiva de la FC en reposo y una mejora de la respuesta de la FC al ejercicio20,21. En los primeros 10 años tras el TxC, la FC media de nuestra población se redujo de modo paulatino y, lo que resulta más interesante, la incidencia del evento primario combinado fue significativamente mayor en los pacientes en que hubo un incremento neto de la FC en ese periodo en comparación con aquellos que experimentaron el descenso neto esperado. En su estudio, Anand et al12 describió una asociación similar entre la tendencia decreciente de la FC en reposo y una menor tasa de mortalidad a largo plazo. El descenso progresivo de la FC tras el TxC muy probablemente sea reflejo de la recuperación de una inervación parasimpática eficaz del injerto. Este fenómeno contrarresta los efectos deletéreos de la estimulación adrenérgica crónica, motivo por el que se considera relevante para el mantenimiento de la función contráctil del corazón trasplantado a largo plazo21,25. La reinervación parasimpática del injerto es, sin embargo, menos frecuente que la reinervación simpática26,27.
El tratamiento crónico con fármacos reductores de la FC, como los bloqueadores beta o la ivabradina, ha mostrado beneficio pronóstico para pacientes con IC y enfermedad coronaria8–10. Hasta el momento, sin embargo, se desconoce su eficacia en receptores de TxC. En general, tratar a estos pacientes con bloqueadores beta se desaconseja, ya que pueden conllevar un empeoramiento de la función contráctil del injerto y de la capacidad de ejercicio28,29. Un estudio preliminar señaló que el empleo de diltiazem durante el primer año tras el TxC podría enlentecer la progresión futura de la EVI30, pero este beneficio no se confirmó posteriormente. Recientemente, un pequeño estudio ha demostrado que la ivabradina es un fármaco seguro, bien tolerado y eficaz para reducir la FC en pacientes con TxC en ritmo sinusal31, pero por el momento no hay datos concluyentes acerca de su potencial beneficio clínico en esta población.
Este estudio tiene algunas limitaciones. Debido a su diseño observacional y retrospectivo, podría estar condicionado por los sesgos de selección e información inherentes a este tipo de investigación. Además, pese a que se ha realizado un riguroso ajuste multivariable, no es posible descartar que algún otro factor de confusión no testado pudiese haber condicionado la asociación observada entre FC y eventos adversos. La ausencia de información acerca de la aparición de taquiarritmias de novo en el seguimiento es otra limitación del estudio, si bien, dada su baja incidencia en los pacientes intervenidos mediante técnica bicava32, se considera poco probable un impacto significativo en los resultados observados. Por último, el limitado contexto del estudio, realizado en un único centro, implica que su validez externa no está garantizada, y que los hallazgos deben ser confirmados en muestras multicéntricas de mayor tamaño.
En comparación con los estudios previos que han abordado la relación entre FC y pronóstico tras el TxC (todos ellos también unicéntricos y de pequeño tamaño muestral)12–14, las principales fortalezas de este trabajo son su largo seguimiento, los criterios de selección rigurosos (p. ej., empleo de la misma técnica quirúrgica en todos los pacientes, exclusión de pacientes con fármacos o comorbilidades que pudiesen afectar a la FC), el análisis de otros eventos además de la mortalidad total (p. ej., disfunción del injerto, muerte por causas cardiacas) y la descripción de la tendencia temporal de la FC y su implicación pronóstica.
CONCLUSIONESEste estudio confirma la existencia de una fuerte asociación entre mayores valores de FC en reposo y peor pronóstico a largo plazo en pacientes con TxC. Esta asociación se justifica principalmente por un incremento del riesgo de muerte por causas cardiacas, principalmente EVI, a través de los mecanismos de muerte súbita e IC refractaria. Según nuestros resultados, el pronóstico es especialmente adverso para los pacientes que muestran una FC en reposo marcadamente alta (> 105 lpm) al final del primer año tras el TxC y aquellos cuya FC muestra una tendencia temporal creciente. Esta investigación apoya la introducción de la FC en reposo como marcador de riesgo simple y de fácil medición para el manejo clínico de los pacientes con TxC y apunta a la necesidad de plantear nuevos estudios que evalúen el potencial beneficio clínico de los fármacos reductores de la FC en esta población. La confirmación del favorable pronóstico a largo plazo que presentan los pacientes con TxC y FC en reposo < 90 lpm, en línea con lo observado en trabajos previos, apunta a este valor de corte como un hipotético objetivo terapéutico en futuros estudios de intervención.
CONFLICTO DE INTERESESNinguno.