La enzima lisil-oxidasa se expresa al alza en el miocardio de pacientes con cardiopatía hipertensiva. Se propone investigar si los pacientes con insuficiencia cardiaca y fracción de eyección conservada de origen hipertensivo-metabólico (ICFEc-HM) presentaban también concentraciones elevadas de prolisil-oxidasa circulante (pLOXc) y las posibles consecuencias de ello.
MétodosSe cuantifican las concentraciones de pLOXc de 85 pacientes no isquémicos con ICFEp-HM en estadio C y se comparan con las de 51 controles sanos. Se evaluaron además las correlaciones entre las concentraciones de pLOXc y ciertos parámetros de rigidez miocárdica, productos del ciclo del colágeno y citocinas fibrogénicas, así como el valor predictivo de la concentración plasmática de la proenzima a 1 año de seguimiento.
ResultadosSe detectaron valores aumentados de pLOXc y se encontró que se correlacionaban con los cocientes E/E’ y las constantes de rigidez que se calcularon. El subgrupo de pacientes con disfunción diastólica de tipo 1 mostró una correlación negativa solo entre la pLOXc y el péptido natriurético cerebral, mientras que en los pacientes con un patrón diastólico restrictivo se demostró una fuerte correlación entre la pLOXc y la galectina-3. El análisis de Kaplan-Meier reveló que las concentraciones de pLOXc > 52,20 ng/ml incrementaron ligeramente el riesgo de desenlace fatal (test de log rank= 4,45; p = 0,034). Al aplicar la regresión de COX, se obtuvo que la pLOXc es un significativo predictor independiente de muerte u hospitalización por descompensación de la ICFEp-HM (HR = 1,360; IC95%, 1,126-1,638; p = 0,046).
ConclusionesLos pacientes con ICFEp-HM sintomática tienen altas concentraciones séricas de pLOXc, lo cual se asocia con índices de llenado diastólico restrictivo. Tales concentraciones representan un factor de riesgo moderado de mal pronóstico. A lo largo de la historia natural de la ICFEp-HM, se ha constatado que las concentraciones de pLOXc al principio se correlacionan negativamente con las de péptido natriurético cerebral, y después tienen correlación positiva con las de galectina-3, a medida que se desarrolla una disfunción diastólica avanzada.
Palabras clave
La insuficiencia cardiaca con fracción de eyección conservada (IC-FEc) es un síndrome clínico y hemodinámico complejo de capital importancia rodeado de todo tipo de controversia, derivada en parte de su enorme heterogeneidad1,2. Para abordar esta cuestión, Shah et al.3,4 elaboraron una clasificación fenotípica de este trastorno y establecieron una variedad de IC–FEc común u ordinaria (que en adelante designaremos como IC–FEc hipertensiva-metabólica [ICFEc-HM]) como entidad clínica y etiológica separada que debe diferenciarse de otras formas de IC–FEc, en especial de la isquémica y la derecha. Los trabajos experimentales respaldan claramente el concepto de una fibrosis no cicatrizante, intersticial, perivascular y predominantemente subendocárdica, debida a un depósito de colágeno de tipos I y III como proceso clave que acompaña a la IC–FEc de los pacientes no isquémicos, hipertensos y diabéticos5.
La disposición de las fibras de colágeno se debe a la acción de la lisil-oxidasa (LOX), una enzima de la matriz extracelular dependiente del cobre, codificada por un gen situado en el cromosoma 5q23.3-31.26, que cataliza la formación de aldehídos altamente reactivos de residuos de lisina en los precursores de la elastina y el colágeno. Esto da lugar a la formación de enlaces cruzados moleculares, lo cual es esencial para la estabilización de las fibrillas de colágeno rígidas dentro de la matriz miocárdica. Un depósito equilibrado de este tipo de fibrillas desempeña un papel crucial en la hemodinámica cardiaca normal7.
La LOX se sintetiza en las células fibrogénicas en forma de una proenzima precursora 111 de 50 kDa (pro-LOX), que luego es procesada en una proporción equimolar para producir la enzima LOX activa8. Dado que las concentraciones de LOX son casi desdeñables en la sangre de los individuos sanos, se ha propuesto que la concentración plasmática de LOX podría ser útil como biomarcador de la fibrosis del órgano en varios trastornos inflamatorios y neoplásicos9,10. En cambio, la identificación de la LOX como posible biomarcador plasmático del depósito de colágeno rígido en la cardiopatía apenas se ha investigado, a pesar de que hay estudios que aportan evidencia que indica que el exceso enzimático en el tejido cardiaco se asocia con un aumento de los enlaces cruzados de colágeno I y de la rigidez del ventrículo izquierdo (VI) en el corazón en insuficiencia de los pacientes con miocardiopatía hipertensiva11. Según nuestro conocimiento, no se han realizado estudios clínicos para analizar las concentraciones de LOX o pro-LOX en sangre de una población de pacientes de la práctica clínica real con ICFEc-HM.
MÉTODOSPoblación del estudioEntre abril de 2013 y diciembre de 2015, se evaluó a un total de 205 pacientes tratados en régimen ambulatorio tras el alta de una hospitalización por IC–FEc grave sintomática (clase funcional de la New York Heart Association [NYHA] II, 86 pacientes; NYHA III-IV, 119 pacientes) de posible etiología hipertensiva o metabólica. Es de destacar que, para determinar la aptitud para participar en este estudio, se examinó tan solo a pacientes estables con antecedentes de hipertensión (presumiblemente dependiente de la sal) o como mínimo 1 factor de riesgo adicional del síndrome metabólico (aumento de glucosa en ayunas, aumento de perímetro de cintura, aumento de triglicéridos o reducción de colesterol unido a lipoproteínas de alta densidad)12. Todos los pacientes habían sido hospitalizados en las 6 semanas previas a causa de una descompensación congestiva aguda, acompañada o no de otra enfermedad cardiovascular (síndrome coronario agudo, bradiarritmia o taquiarritmia no controladas, derrame pericárdico con deterioro hemodinámico, enfermedad tromboembólica o hipertensión arterial grave) o comorbilidades no cardiovasculares. El diagnóstico no invasivo de la IC–FEc se realizó según los criterios de Framingham y las recomendaciones de la Sociedad Europea de Cardiología (todos los pacientes presentaban una fracción de eyección del VI ≥ 50% y cifras de péptido natriurético cerebral (BNP)> 35 pg/ml)13. No se utilizaron biopsias endomiocárdicas ni una determinación directa de las presiones de llenado del VI y las constantes de tiempo de relajación (τ) con fines diagnósticos en ninguno de los pacientes. Se evaluó sistemáticamente la posible presencia de enfermedad coronaria y miocardiopatías no HM mediante un examen cuidadoso de las historias clínicas, los electrocardiogramas y los ecocardiogramas. Se realizó una prueba de estrés (electrocardiograma con prueba de esfuerzo convencional en cinta ergométrica, prueba de estrés con dobutamina-atropina y ecocardiografía con evaluación visual o bidimensional estándar de speckle tracking y gammagrafía con tomografía computarizada por emisión monofotónica con talio-201-dipiridamol) (18 procedimientos), coronariografía (49 procedimientos) o cardiorresonancia magnética (24 procedimientos) en 88 pacientes registrados. A continuación, tras aplicar todos los criterios de exclusión correspondientes al fenotipo de la IC–FEc (véase más adelante), se clasificó a los 132 pacientes restantes como casos definitivos de síndrome de ICFEc-HM. Por último, teniendo en cuenta los objetivos del estudio, se excluyó a 47 de los 132 pacientes debido a la coexistencia de la ICFEc-HM con algunos otros posibles trastornos fibrosos extracardiacos (véase más adelante). En resumen, un total de 85 pacientes con IC–FEc en estadio C estable y con diagnóstico específico de fenotipo HM no isquémico, pero sin ninguna otra enfermedad fibrogénica importante, fueron considerados aptos para la inclusión en el protocolo del estudio. Se incluyó a 51 controles sanos emparejados por edad y sexo, 28 mujeres y 23 varones, de edad> 60 años (media, 72±4,5 años), sin enfermedades ni factores de riesgo cardiovascular importantes, ya que no estaban tomando medicación alguna. Los participantes que se prestaron voluntariamente a actuar como controles fueron seleccionados de manera aleatoria entre los trabajadores hospitalarios de un hospital de veteranos y entre los familiares de los pacientes que cumplían los criterios antes mencionados. Se determinó la ausencia de antecedentes patológicos o de factores de riesgo cardiovascular importantes mediante anamnesis, determinación habitual de la presión arterial y exploración por ecocardiografía ordinaria.
Criterios de exclusiónLos siguientes criterios de exclusión estuvieron relacionados con el fenotipo de la IC–FEc (se excluyó a 73 pacientes): a) antecedentes de síndrome coronario agudo bien documentado o de infarto agudo de miocardio previo no identificado, según el esquema de códigos de Minnesota (anomalías importantes de las ondas Q/QS)14 (41 pacientes); b) cardiopatía isquémica activa evidenciada por angina, una prueba de estrés positiva o una cardiorresonancia magnética anormal o una enfermedad arterial coronaria importante demostrada angiográficamente (15 pacientes); c) dilatación o disfunción ventricular derecha predominante, cor pulmonale, insuficiencia tricuspídea grave o presión arterial pulmonar sistólica calculada con Doppler> 65mmHg (12 pacientes); d) cardiopatía congénita, pericárdica o valvular grave, incluida la miocardiopatía hipertrófica (4 pacientes), y e) probable miocardiopatía restrictiva primaria (amiloidosis cardiaca senil) (1 paciente).
Se aplicaron los siguientes criterios de exclusión relacionados con trastornos fibroinflamatorios posiblemente activos (exclusión de 47 pacientes): enfermedad pulmonar obstructiva crónica grave (grados III–IV de la Global Initiative for Chronic Obstructive Lung Disease) o fibrosis pulmonar (14 pacientes), demencia con deterioro cognitivo significativo (11 pacientes), tasa de filtrado glomerular estimada<15 ml/min/1,73 m2 (5 pacientes), hemoglobina <9,0 g/dl (4 pacientes), colagenosis activa (2 pacientes), enfermedad arterial periférica con claudicación intermitente grave (2 pacientes), hepatopatía crónica (2 pacientes), antecedentes de radioterapia amplia (1 paciente), hipotiroidismo e hipertiroidismo (1 paciente), antecedentes de trasplante de órgano sólido (1 paciente), reanimación cardiopulmonar reciente (< 3 meses) (1 paciente), traumatismo grave (1 paciente), ictus permanente (1 paciente) y cirugía mayor (1 paciente).
Objetivos del estudioLos objetivos de este estudio observacional en pacientes con síndrome de ICFEc-HM son examinar: a) las concentraciones de pLOXc; b) las correlaciones de la pLOXc con los índices de rigidez del miocardio; c) los mecanismos plausibles de control humoral de la LOX, y d) el valor predictivo clínico de la pLOXc.
Variables evaluadasLas variables evaluadas en el estudio fueron: a) para la evaluación hemodinámica pLOXc, cociente E/E’ (como indicador indirecto de las presiones de llenado del VI) y constante de rigidez del VI estimada; b) para la evaluación fisiopatológica, pLOXc (variable dependiente), BNP y un panel de algunas citocinas profibróticas y biomarcadores del recambio del colágeno (variables explicativas) (véase más adelante), y c) para la evaluación de los resultados clínicos ajustados, pLOXc y biomarcadores séricos con un valor predictivo de IC–FEc reconocido (BNP, galectina-3, receptor de tipo toll/interleucina 1 tipo II soluble, factor de diferenciación del crecimiento-15, metaloproteinasa de matriz (MMP) 2 y troponina T de alta sensibilidad)15.
Análisis de laboratorioSe incluyó a 11 pacientes; se extrajeron muestras de sangre de la vena antecubital izquierda y se recogieron en tubos de plasma con EDTA y tubos de plasma sin revestimiento. Se dejó que las muestras coagularan a temperatura ambiente y se centrifugaron a 3.500g durante 10min. Poco después, se prepararon alícuotas de sueros y plasma que se conservaron a–70°C hasta el momento del análisis. Las determinaciones cuantitativas de pLOXc (Uscn Life Science Inc.; Ubei, China), galectina-3 (US Biological Life Sciences; Swampscott, Massachusetts, Estados Unidos), factor de crecimiento transformador-ß1 (Boster Immunoleader; Fremont, California, Estados Unidos), receptor de tipo toll/interleucina 1 tipo II soluble (Swampscott), factor de diferenciación del crecimiento-15 (Abnova Co.; Taipei, Taiwán), propéptido de procolágeno I carboxiterminal (Uscn Life Science Inc.), propéptido de procolágeno III carboxiterminal y telopéptido de colágeno I carboxiterminal (SunRed Biological Technologies; Shangai, China), diversas MMP (MMP-2 y MMP-9) e inhibidor tisular de MMP-1 (Boster Immunoleader) se llevaron a cabo en los sueros conservados mediante un ELISA en sándwich según lo indicado en las especificaciones de cada fabricante. Además, se determinaron el BNP y la troponina T de alta sensibilidad en muestras de sangre recién extraídas mediante inmunoanálisis de electroquimioluminiscencia específicos y de alta sensibilidad (Elecsys proBNP y Elecsys Troponin T hs, Roche Diagnostics; Mannheim, Alemania). La tasa de filtrado glomerular estimada se calculó mediante la ecuación de MDRD (Modification of Diet in Renal Disease).
EcocardiografíaLa ecocardiografía transtorácica se repitió 2 veces en el momento de la extracción de sangre para determinar los biomarcadores, y la realizaron 2 ecocardiografistas expertos independientes que no conocían los resultados de los análisis bioquímicos ni clínicos, con un sistema de ecografía Siemens Acuson X 700 o Mindray 7 (1,0-4,0MHz). A continuación se calculó y se registró la media de los índices ecocardiográficos estándar para la evaluación de la disfunción diastólica (DD). Se estimó también la constante de rigidez del VI mediante el tiempo de desaceleración de llenado temprano Doppler con la fórmula de Garcia et al.16, partiendo del supuesto de un orificio mitral no restrictivo (constante de rigideznoreposo del VI=[0,07/ETD]2, con una constante de rigidez del VI=1,01 constante de rigideznoreposo−0,02).
Diseño del estudioSe registraron los parámetros clínicos y ecocardiográficos basales de todos los participantes para clasificarlos como afectados por una DD de tipos I (leve, patrón de relajación deteriorado), II (moderada, patrón seudonormal con elevación leve o moderada de las presiones de llenado del VI) o III/IV (reversible/irreversible, grave, patrón restrictivo con aumento significativo de las presiones de llenado del VI) según las recomendaciones de la European Association of Echocardiography y la American Society of Echocardiography17. Se estudió a los pacientes para analizar si: a) presentaban un aumento de las concentraciones de proenzima respecto a las de los controles; b) la concentración de pLOXc se correlaciona con las variables hemodinámicas y bioquímicas del estudio, y c) la pLOXc incorporaba alguna información pronóstica en el seguimiento realizado a los 12 meses. La variable de valoración principal combinada fue la muerte de causa cardiovascular o la descompensación de la IC con necesidad de reingreso hospitalario para aliviar la congestión sistémica o pulmonar grave.
El protocolo de investigación fue aprobado por el Comité de Ética de Investigación local del centro (Hospital Universitario Príncipe de Asturias, Madrid, España) según la legislación de la Unión Europea y la Declaración de Helsinki de la Asociación Médica Mundial (autorización de CE 05-2012). Todos los participantes firmaron el documento de consentimiento informado antes de la participación en el estudio. Los autores tuvieron pleno acceso a la totalidad de los datos y todos estuvieron de acuerdo en la versión del manuscrito presentada.
Análisis estadísticoPara la estadística descriptiva y la estadística inferencial, las variables continuas se presentan en forma de media±desviación estándar o mediana [intervalo intercuartílico] cuando así se especifica, y las variables discretas en forma de porcentajes. Se utilizó la prueba de la t de Student y un ANOVA (análisis de la varianza) de 1 vía con el método de Scheffé post hoc para comparar las variables continuas de distribución normal, y las pruebas de la U de Mann-Whitney y de Kruskal-Wallis para las variables con una distribución no normal según la evaluación realizada con la prueba de Kolgomorov-Smirnov. Las asociaciones bivariables de las concentraciones de pLOXc se evaluaron con las correlaciones de Pearson o de Spearman, según lo indicado. Para el análisis de regresión lineal multivariable ajustado (Wald), se utilizó la pLOXc como variable dependiente, con una eliminación retrógrada de las demás variables explicativas, hasta seleccionar los 4 biomarcadores relacionados más significativos. Una vez dicotomizadas las concentraciones de los biomarcadores usando la mediana, se evaluó la asociación sin ajustar de cada posible biomarcador pronóstico con el resultado clínico, utilizando un análisis de tiempo hasta el evento con regresiones de riesgos proporcionales de Cox univariables (mediana del valor de corte de la pLOXc, 38,20 ng/ml). A continuación se elaboró un modelo de Cox multivariable con los biomarcadores con p <0,05 en el análisis multivariable. Tras un ajuste respecto a edad, sexo, clase funcional de la NYHA, presencia de al menos 3 comorbilidades (incluidos todos los componentes del síndrome metabólico, enfermedad vascular cerebral/periférica crónica, fibrilación auricular y enfermedad pulmonar obstructiva crónica/síndrome de apneas-hipopneas obstructivas del sueño), puntuación del Kansas City Cardiomyopathy Questionnaire, tasa de filtrado glomerular estimada, grado de DD, E/E’ y presión arterial pulmonar sistólica, se obtuvo un modelo estadístico resultante. Este modelo incluía la pLOXc y los 2 biomarcadores más significativos (BNP y galectina-3) de todos los biomarcadores predictivos evaluados en el análisis univariable, y se elaboró con un método escalonado. El modelo requería un mínimo de 10 eventos de cada variable seleccionada con objeto de obtener una estimación exacta de la regresión18. Se utilizó el método de Kaplan-Meier para medir la supervivencia total a 12 meses y la prueba de orden logarítmico para evaluar la significación de la comparación entre los terciles de concentraciones de pLOXc. Se aceptaron como significativas las diferencias con p ≤ 0,05 (bilateral). Todos los cálculos se realizaron con el software estadístico SPSS 14.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
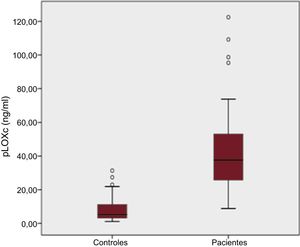
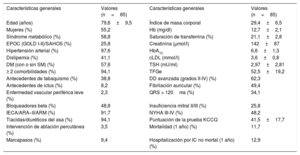
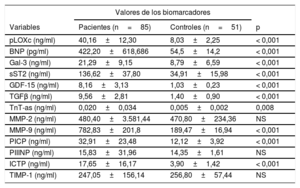
RESULTADOSCaracterísticas basalesLos datos clínicos generales y los parámetros ecocardiográficos y bioquímicos de interés se resumen en la tabla 1, la tabla 2, la tabla 3 y la tabla 4. Debe resaltarse que nuestros pacientes (y en especial los que presentan una DD más avanzada [tipos II-IV]) mostraron un aumento inequívoco de las concentraciones de pLOXc en comparación con los controles (pLOXc, 40,16±12,30 frente a 8,03±2,25 ng/ml; p <0,001) (figura 1).
Características generales del grupo de pacientes
| Características generales | Valores (n=85) | Características generales | Valores (n=85) |
|---|---|---|---|
| Edad (años) | 79,6±9,5 | Índice de masa corporal | 29,4±6,5 |
| Mujeres (%) | 55,2 | Hb (mg/dl) | 12,7±2,1 |
| Síndrome metabólico (%) | 58,8 | Saturación de transferrina (%) | 21,1±2,8 |
| EPOC (GOLD I-II)/SAHOS (%) | 25,8 | Creatinina (μmol/l) | 142±87 |
| Hipertensión arterial (%) | 97,6 | HbA1c | 6,6±1,3 |
| Dislipemia (%) | 41,1 | cLDL (mmol/l) | 3,6±0,8 |
| DM (con o sin SM) (%) | 57,6 | TSH (mU/ml) | 2,97±2,81 |
| ≥ 2 comorbilidades (%) | 94,1 | TFGe | 52,5±19,2 |
| Antecedentes de tabaquismo (%) | 38,8 | DD avanzada (grados II-IV) (%) | 62,3 |
| Antecedentes de ictus (%) | 8,2 | Fibrilación auricular (%) | 49,4 |
| Enfermedad vascular periférica leve (%) | 2,3 | QRS > 120ms (%) | 34,1 |
| Bloqueadores beta (%) | 48,8 | Insuficiencia mitral II/III (%) | 25,8 |
| IECA/ARA–II/ARM (%) | 91,7 | NYHA III-IV (%) | 48,2 |
| Tiacidas/diuréticos del asa (%) | 94,1 | Puntuación de la prueba KCCQ | 41,5±17,7 |
| Intervención de ablación percutánea (%) | 3,5 | Mortalidad (1 año) (%) | 11,7 |
| Marcapasos (%) | 9,4 | Hospitalización por IC no mortal (1 año) (%) | 12,9 |
ARA–II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; cLDL: colesterol unido a lipoproteínas de baja densidad; DD: disfunción diastólica; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; GOLD: Global Initiative for Chronic Obstructive Lung Disease; Hb: hemoglobina; HbA1c: glucohemoglobina; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; KCCQ: Kansas City Cardiomyopathy Questionnaire; NYHA: New York Heart Association; SAHOS: síndrome de apneas-hipopneas obstructivas del sueño; SM: síndrome metabólico; TFGe: tasa de filtrado glomerular estimada; TSH: tirotropina.
Salvo otra indicación, los valores expresan media±desviación estándar.
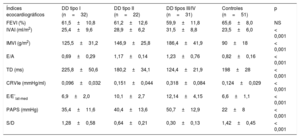
Índices ecocardiográficos en cada subgrupo hemodinámico
| Índices ecocardiográficos | DD tipo I (n=32) | DD tipo II (n=22) | DD tipos III/IV (n=31) | Controles (n=51) | p |
|---|---|---|---|---|---|
| FEVI (%) | 61,5±10,8 | 61,2±12,6 | 59,9±11,8 | 65,6±8,0 | NS |
| IVAI (ml/m2) | 25,4±9,6 | 28,9±6,2 | 31,5±8,8 | 23,5±6,0 | < 0,001 |
| IMVI (g/m2) | 125,5±31,2 | 146,9±25,8 | 186,4±41,9 | 90±18 | < 0,001 |
| E/A | 0,69±0,29 | 1,17±0,14 | 1,23±0,76 | 0,82±0,16 | < 0,001 |
| TD (ms) | 225,8±50,6 | 180,2±34,1 | 124,4±21,9 | 198±28 | < 0,001 |
| CRVIe (mmHg/ml) | 0,096±0,032 | 0,151±0,044 | 0,318±0,084 | 0,124±0,029 | < 0,001 |
| E/E’lat-med | 6,9±2,0 | 10,1±2,7 | 12,14±4,15 | 6,6±1,1 | < 0,001 |
| PAPS (mmHg) | 35,4±11,6 | 40,4±13,6 | 50,7±12,9 | 22±8 | < 0,001 |
| S/D | 1,28±0,58 | 0,64±0,21 | 0,30±0,13 | 1,42±0,45 | < 0,001 |
A: velocidad de la onda de flujo transmitral máxima tardía diastólica; CRVIe: constante de rigidez ventricular izquierda estimada; DD: disfunción diastólica; E/E’lat-med: índice de llenado ventricular izquierdo basado en las velocidades medias del Doppler tisular del anillo valvular mitral lateral y medial; E: velocidad de la onda de flujo transmitral máxima temprana diastólica; FEVI: fracción de eyección del ventrículo izquierdo; IMVI: índice de masa ventricular izquierda; IVAI: índice de volumen auricular izquierdo; PAPS: presión arterial pulmonar sistólica; TD: tiempo de desaceleración; S/D: cociente de velocidades de onda sistólica frente a diastólica en el flujo venoso pulmonar.
Los valores expresan media±desviación estándar.
Valores de pLOXc, citocinas profibrogénicas, hormonas y biomarcadores del recambio del colágeno en el grupo total de pacientes
| Valores de los biomarcadores | |||
|---|---|---|---|
| Variables | Pacientes (n=85) | Controles (n=51) | p |
| pLOXc (ng/ml) | 40,16±12,30 | 8,03±2,25 | < 0,001 |
| BNP (pg/ml) | 422,20±618,686 | 54,5±14,2 | < 0,001 |
| Gal-3 (ng/ml) | 21,29±9,15 | 8,79±6,59 | < 0,001 |
| sST2 (ng/ml) | 136,62±37,80 | 34,91±15,98 | < 0,001 |
| GDF-15 (ng/ml) | 8,16±3,13 | 1,03±0,23 | < 0,001 |
| TGFβ (ng/ml) | 9,56±2,81 | 1,40±0,90 | < 0,001 |
| TnT-as (ng/ml) | 0,020±0,034 | 0,005±0,002 | 0,008 |
| MMP-2 (ng/ml) | 480,40±3.581,44 | 470,80±234,36 | NS |
| MMP-9 (ng/ml) | 782,83±201,8 | 189,47±16,94 | < 0,001 |
| PICP (ng/ml) | 32,91±23,48 | 12,12±3,92 | < 0,001 |
| PIIINP (ng/ml) | 15,83±31,96 | 14,35±1,61 | NS |
| ICTP (ng/ml) | 17,65±16,17 | 3,90±1,42 | < 0,001 |
| TIMP-1 (ng/ml) | 247,05±156,14 | 256,80±57,44 | NS |
BNP: péptido natriurético cerebral; Gal-3: galectina-3; GDF-15: factor de diferenciación del crecimiento-15; ICTP: telopéptido de colágeno I carboxiterminal; MMP: metaloproteinasa de matriz; PICP: propéptido de procolágeno I carboxiterminal; PIIINP: propéptido de procolágeno III aminoterminal; pLOXc: prolisil-oxidasa circulante; sST2: receptor de tipo toll/interleucina 1 tipo II soluble; TGFβ: factor de crecimiento transformador beta; TIMP-1: inhibidor tisular de metaloproteinasa-1; TnT-as: troponina T de alta sensibilidad.
Los valores expresan media±desviación estándar.
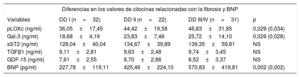
Valores de las citocinas relacionadas con la fibrosis y de péptido natriurético cerebral en cada subgrupo hemodinámico
| Diferencias en los valores de citocinas relacionadas con la fibrosis y BNP | ||||
|---|---|---|---|---|
| Variables | DD I (n=32) | DD II (n=22) | DD III/IV (n=31) | p |
| pLOXc (ng/ml) | 36,05±17,45 | 44,42±19,58 | 46,83±31,85 | 0,029 (0,034) |
| Gal-3 (ng/ml) | 18,68±4,19 | 23,83±7,46 | 25,72±14,10 | 0,026 (0,028) |
| sST2 (ng/ml) | 128,04±40,04 | 134,67±39,89 | 139,35±59,81 | NS |
| TGFβ1 (ng/ml) | 9,11±2,81 | 9,63±2,48 | 9,74±3,45 | NS |
| GDF-15 (ng/ml) | 7,61±2,55 | 8,70±2,86 | 8,52±3,37 | NS |
| BNP (pg/ml) | 227,78±119,11 | 425,46±224,10 | 570,83±419,81 | 0,002 (0,002) |
BNP: péptido natriurético cerebral; DD: disfunción diastólica; Gal-3: galectina-3; GDF-15: factor de diferenciación del crecimiento-15; pLOXc: prolisil-oxidasa circulante; sST2: receptor de tipo toll/interleucina 1 tipo II soluble; TGFβ1: factor de crecimiento transformador beta 1.
Los valores expresan media±desviación estándar.
Diagrama de caja (box and whisker) de las concentraciones de pLOXc de los pacientes con insuficiencia cardiaca y fracción de eyección conservada hipertensiva-metabólica (n=85) y los controles (n=51) (diagrama convencional de valores extremos, mediana, intervalo y valores atípicos). pLOXc: prolisil-oxidasa circulante.
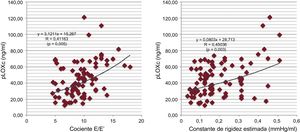
Se confirmó la existencia de correlaciones de Pearson positivas con una significación débil entre la pLOXc y las variables que reflejan aumento de las presiones de llenado del VI (cociente E/E’) y rigidez miocárdica (constante de rigidez del VI estimada) en el conjunto del grupo con ICFEc-HM (respectivamente, R=0,411; p=0,005, y R=0,450; p=0,003) (figura 2).
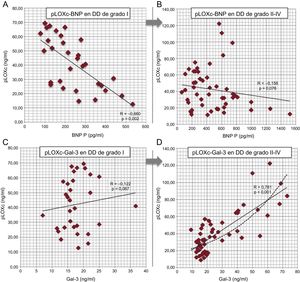
Por lo que se refiere al análisis de asociación de la pLOXc, la concentración de la proenzima mostró correlaciones de Pearson directas con los siguientes biomarcadores: galectina-3, receptor de tipo toll/interleucina 1 tipo II soluble, factor de crecimiento transformador beta, propéptido de procolágeno I carboxiterminal y BNP (datos no presentados), aunque solo la galectina-3 conservó una relación independiente significativa (β=0,688; p <0,001) en un modelo ajustado en el que el BNP tenía también una correlación negativa (tabla 5A). En relación con las correlaciones independientes de la pLOXc dentro de cada subgrupo hemodinámico, solo unas pocas de ellas fueron relevantes en el análisis multivariable (tabla 5B). De manera resumida, en el subgrupo de DD tipo I, la pLOXc mostró una correlación negativa con el BNP (β=–0,660; p=0,002), pero no con la galectina-3 (figura 3A y figura 3B). En cambio, en el grupo de pacientes con DD de II–IV, solo la galectina-3 mostró una sustancial relación positiva con la pLOXc (β=0,781; p <0,001) (figura 3C y figura 3D). Los demás biomarcadores no mostraron asociación significativa con la pLOXc.
Resultados de la evaluación fisiopatológica de la pLOXc en el conjunto de la cohorte (A) y en cada subgrupo de disfunción diastólica (B)
| A. Análisis de regresión lineal multivariable general (n=85) | ||
|---|---|---|
| Variables | β | p |
| pLOXc-Gal-3 | 0,688 | < 0,001 |
| pLOXc-sST2 | 0,243 | 0,050 |
| pLOXc-TGF-ß1 | 0,214 | 0,068 (NS) |
| pLOXc-GDF-15 | 0,137 | 0,125 (NS) |
| pLOXc-BNP | –0,401 | 0,019 |
| B. Análisis de regresión lineal multivariable diferencial | ||||||||
|---|---|---|---|---|---|---|---|---|
| Variables | DD I (n=32) | DD II (n=22) | DD III/IV (n=31) | DD II/IV (n=53) | ||||
| β | p | β | p | β | p | β | p | |
| pLOXc-Gal-3 | 0,122 | NS | 0,661 | 0,005 | 0,910 | < 0,001 | 0,781 | < 0,001 |
| pLOXc-sST2 | 0,203 | NS | 0,200 | NS | 0,317 | 0,040 | 0,238 | NS |
| pLOXc-TGF-ß1 | 0,146 | NS | 0,157 | NS | 0,313 | 0,041 | 0,230 | NS |
| pLOXc-GDF-15 | 0,096 | NS | 1,304 | NS | 1,569 | NS | 0,145 | NS |
| pLOXc-BNP | –0,660 | 0,002 | –0,176 | NS | –0,101 | NS | –0,158 | NS |
BNP: péptido natriurético cerebral; DD: disfunción diastólica; Gal-3: galectina-3; GDF-15: factor de diferenciación del crecimiento-15; pLOXc: prolisil-oxidasa circulante; sST2: receptor de tipo toll/interleucina 1 tipo II soluble; TGFβ: factor de crecimiento transformador beta.
Evaluación fisiopatológica de la pLOXc dentro de cada subgrupo de DD (análisis multivariable de algunos valores de biomarcadores seleccionados en pacientes con DD de grado I en comparación con los pacientes de grados II a IV). A y B: correlaciones entre la pLOXc y el BNP; C y D: correlaciones entre la pLOXc y la galectina-3; se muestra también la tendencia exponencial en los grados II a IV (línea a trazos). BNP: péptido natriurético cerebral; DD: disfunción diastólica; Gal-3: galectina-3; pLOXc: prolisil-oxidasa circulante.
Al finalizar el periodo de seguimiento de 1 año, un total de 21 pacientes (24,7%) habían sido rehospitalizados por una descompensación aguda de la IC como mínimo en una ocasión y dados de alta después, y otros 10 (11,7%) habían fallecido por causas cardiovasculares. El análisis de supervivencia de Kaplan-Meier de los participantes divididos en terciles de concentración de pLOXc mostró diferencias significativas en la tasa de mortalidad a los 12 meses cuando las concentraciones de pLOXc eran> 52,20 ng/ml (resultados no presentados) (log-rank test=4,45; p=0,034). En consecuencia, este valor de corte puede usarse como un discriminador del riesgo de mortalidad discreto pero identificable. No obstante, después de introducir un ajuste respecto a las variables clínicas, bioquímicas y ecográficas, el análisis de regresión de riesgos proporcionales de Cox puso de manifiesto que la pLOXc tenía valor pronóstico independiente como parte de un modelo optimizado que incluía el BNP y la galectina-3 como biomarcadores copredictivos más claros a los 12 meses (cpLOX, hazard ratio [HR]=1,360; intervalo de confianza del 95% [IC95%], 1,126-1,638, p=0,046; galectina-3, HR=1,923; IC95%, 1,022-2,853, p=0,009; BNP, HR=2,976; IC95%, 1,210-4,216; p <0,001).
DISCUSIÓNPerspectiva general respecto a la lisil-oxidasa miocárdica en la insuficiencia cardiaca con fracción de eyección conservada hipertensiva-metabólicaEn ausencia de información acerca de la LOX circulante en el ámbito clínico de la IC–FEc, nuestros resultados confirman un aumento sustancial de las concentraciones de la proenzima en este trastorno; este aumento fue más pronunciado cuando había una DD avanzada. En conjunto, estas cifras son totalmente compatibles con las observaciones moleculares previas de una expresión de la LOX aumentada en el tejido miocárdico de los pacientes hipertensos19 y respaldan también el concepto de que un proceso fibrótico catalizado por la LOX e impulsado por diferentes hormonas y citocinas constituye uno de los elementos clave en el desarrollo de la ICFEc-HM20–23. No obstante, hay que expresar ciertas reservas respecto a que la sobreexpresión de la LOX y el depósito de colágeno I sean el mecanismo específico, mediado por la LOX, de una mala distensibilidad cardiovascular en diferentes circunstancias anatomopatológicas. Por ejemplo, Chen et al.24 observaron que los índices de rigidez arterial aumentados en los pacientes obesos se traducían en una disminución de las concentraciones séricas absolutas de LOX, lo cual indica que la expresión excesiva de varios productos y el estrés oxidativo que se observan habitualmente en los pacientes obesos sintomáticos pueden causar una falta de maduración de la LOX, acompañada de fragmentación de la elastina y pérdida de la distensibilidad arterial. Así pues, parece haber un equilibrio entre el depósito de colágeno I rígido y la formación de elastina distensible en situaciones fisiológicas. Por lo tanto, se presume que no solo ciertos trastornos cardiovasculares, como la miocardiopatía dilatada o la reestenosis de aloinjertos coronarios25, sino también la ICFEc-HM podrían ser consecuencia de un aumento de la LOX que cause una acumulación o exceso absoluto de colágeno I rígido. Sin embargo, en otros trastornos como la rigidez aórtica grave en pacientes obesos sin insuficiencia cardiaca sintomática, la pérdida de distensibilidad vascular puede deberse a una expresión enzimática insuficiente que cause una producción escasa de elastina y abundancia relativa de colágeno I.
Posibles mecanismos del control humoral de la lisil-oxidasa miocárdica en la insuficiencia cardiaca con fracción de eyección conservada hipertensiva-metabólicaTeniendo en cuenta los estudios previos que han demostrado la presencia de células inflamatorias en el miocardio humano en insuficiencia, en general se ha aceptado que la fibrosis por colágeno conlleva una respuesta a estímulos fisicoquímicos específicos que se producen a través de hormonas y citocinas26. Sin embargo, es poco lo que se sabe acerca del mecanismo específico de la regulación humoral de la LOX miocárdica in vivo, ya que la mayor parte de los estudios sobre la fisiología de la LOX fueron histoquímicos y moleculares o como resultado de experimentos realizados en una línea tumoral de miocardiocitos auriculares de ratón27. Así pues, la notable correlación observada entre la pLOXc y la galectina-3 apunta a la posible existencia de un mecanismo de estimulación humoral dependiente de la galectina-3 para las vías de señalización de transcripción de la LOX cardiaca, lo cual concuerda con lo ya demostrado con el homólogo LOX-2 en animales de experimentación28. Además, teniendo en cuenta que los macrófagos vasculares son la principal fuente de galectina-3 y que los ratones con supresión de linfocitos T y macrófagos carecen de actividad de LOX29, para explicar nuestros resultados se puede sostener que la galectina-3 desempeña un papel clave en la regulación de la síntesis de la LOX cardiaca. Desde un punto de vista finalista, se podría especular incluso con la posibilidad de que la notable asociación negativa independiente del BNP con la pLOXc que se detectó en los casos con un deterioro simple de la relación del miocardio pudiera reflejar los efectos antifibróticos del BNP para contrarrestar las concentraciones plasmáticas de hormonas y citocinas fibrogénicas superiores a lo normal30.
En resumen, nuestros resultados concuerdan con que: a) la formación del colágeno I organizado tiene su origen en el inicio de la DD a pesar de los efectos del BNP; b) la galectina-3, más que cualquier otra citocina, puede tener una influencia crucial en la fibrosis cardiaca mediada por la LOX a medida que progresa el deterioro hemodinámico, y c) por lo que respecta al mecanismo de acción, el BNP y la galectina-3 podrán tener efectos reguladores opuestos en la LOX cardiaca a todo lo largo de la evolución natural de la ICFEc-HM. En otras palabras, se podría asumir que la rigidez miocárdica (que es una característica distintiva esencial de la ICFEc-HM31) depende de la formación temprana de enlaces cruzados del colágeno I y que ello adquiere mayor relevancia cuando predomina la regulación al alza de la LOX mediada por la galectina-3.
Valor pronóstico de la prolisil-oxidasa circulante en la insuficiencia cardiaca con fracción de eyección conservada hipertensiva-metabólicaLa poca exactitud de la pLOXc como biomarcador para proporcionar una información pronóstica relevante en comparación con la de otros biomarcadores cardiacos32 limita la utilidad de determinarla en la práctica clínica. No obstante, esta ausencia de un valor predictivo potente en la IC–FEc resalta indirectamente que la fibrosis rígida del corazón (que cabe presumir a la vista de los valores de pLOXc) parece progresar a partir de la ICFEc-HM de tipo I relativamente benigna hacia los estadios de DD finales y de máxima gravedad. Sin embargo, dado que las concentraciones de pLOXc> 52,2 ng/ml se asociaron con un aumento de la mortalidad a los 12 meses en nuestra serie, no es contradictorio plantear la hipótesis de que cuanto mayores sean las cifras de la enzima, más grave es el deterioro de la función diastólica y, por lo tanto, más negativo es el pronóstico general. La posibilidad de que la pLOXc pueda llegar a ser un biomarcador pronóstico útil en la ICFEc-HM deberá determinarse con un análisis comparativo del área bajo la curva (estadístico C) en futuros estudios con cohortes de pacientes más amplias.
LimitacionesEste trabajo tiene algunas limitaciones claras, aunque son similares a las de cualquier estudio de observación, descriptivo y de un solo centro. En primer lugar, no se puede descartar que haya factores de confusión no medidos como posible explicación alternativa de los resultados obtenidos. Además, el tamaño relativamente pequeño de nuestras muestras hace que sea difícil extraer conclusiones firmes acerca de los objetivos del estudio. En segundo lugar, aunque se hizo lo posible por evaluar solo a individuos estables sin enfermedades fibróticas típicas, muchos de ellos eran ancianos con comorbilidades no críticas que podrían haber tenido un medio interno profibrótico (p. ej., fibrilación auricular, enfermedad arterial periférica asintomática/cerebrovascular crónica, insuficiencia renal no avanzada, artrosis). Así pues, nuestros resultados deben interpretarse con precaución. Por último, no se pudo comparar las concentraciones de proenzima en pacientes sin ICFEc-HM y, por consiguiente, serán necesarios futuros estudios con un mayor número de muestras más diversas para evaluar la pLOXc en otros fenotipos de IC–FEc.
CONCLUSIONESLa presunta sobreexpresión de la LOX miocárdica en la ICFEc-HM ordinaria en estadio C no isquémica se acompaña de altas cifras de pLOXc, en especial cuando los pacientes sufren una DD avanzada. Estos valores muestran una correlación moderada con las presiones de llenado del VI estimadas y con la rigidez del miocardio, y tienen cierto valor predictivo clínico a los 12 meses. Según nuestro modelo de análisis de asociación, la actividad de la LOX en el proceso de la fibrosis cardiaca podría ser impulsada principalmente por la galectina-3, cuando el aumento de la presión de llenado del VI es evidente. Además, nuestros resultados indican que podría haber un mecanismo de contrarregulación de la LOX dependiente del BNP en la ICFEc-HM. Sin embargo, este mecanismo acaba resultando insuficiente para impedir la acumulación constante de colágeno I inducida por la galectina-3. Sea cual fuere el alcance que tengan las consecuencias de nuestras observaciones, debe resaltarse que estas consideraciones fisiopatológicas son hipótesis lógicas basadas en nuestras observaciones, que deben confirmarse en futuros estudios con cohortes más amplias y con un estudio molecular adicional. En este mismo sentido, creemos que tanto el BNP como la galectina-3 merecen una atención especial como reguladores de efectos opuestos en la actividad enzimática a lo largo de toda la evolución natural de la ICFEc-HM y como dianas específicas para una intervención farmacológica antifibrótica en un futuro cercano.
FINANCIACIÓNEste estudio fue financiado por una subvención de la Fundación para la Investigación Biomédica del Hospital Universitario Príncipe de Asturias (subvención FIB-PI09-03).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La fibrosis miocárdica intersticial es un proceso clave que acompaña a la IC–FEc; la disposición de las fibras de colágeno es consecuencia de la acción de la LOX; esta enzima se expresa abundantemente en el tejido miocárdico de los pacientes hipertensos.
- –
Las concentraciones de LOX son casi desdeñables en la sangre de los individuos sanos; no hay información sobre la LOX en plasma de los pacientes con IC–FEc.
- –
Se sabe que se produce una regulación al alza de la LOX en determinados modelos animales y en ciertos trastornos cardiovasculares humanos (hipertrofia cardiaca experimental, miocardiopatía dilatada, reestenosis de aloinjerto coronario, fibrilación auricular).
- –
La galectina-3 estimula las vías de señalización de la transcripción del homólogo LOX-2 en animales de experimentación.
- –
La ICFEc-HM de tipo común, no isquémica, se acompaña de altas concentraciones de pLOXc.
- –
La pLOXc se correlaciona con las presiones de llenado del VI estimadas ecográficamente y con los parámetros de rigidez del miocardio.
- –
En los pacientes con IC–FEc, las altas concentraciones de pLOXc muestran una correlación inversa con el BNP en los pacientes con un menor grado de DD, y una correlación directa con la galectina-3 si se produce un patrón de DD restrictivo.
- –
Aunque no tiene relevancia clínica, la concentración de pLOXc parece tener cierto valor predictivo a los 12 meses en los pacientes con IC–FEc.