Las micropartículas son marcadores de la activación celular y la apoptosis y podrían aportar una información muy valiosa e inasequible con los datos clínicos. En este estudio se evalúa la relación clínica y biológica entre las micropartículas de pequeño tamaño presentes en diferentes formas de la insuficiencia cardiaca sistólica isquémica y los marcadores de la inflamación y la reparación.
MétodosSe compararon 49 pacientes con insuficiencia cardiaca aguda, 39 con insuficiencia cardiaca estable y 25 pacientes con enfermedad coronaria estable. Se cuantificaron las micropartículas de pequeño tamaño mediante citometría de flujo de alta resolución. Se analizaron también tres subpoblaciones monocitarias diferentes y su expresión de receptores barredores de la inflamación y la adhesión empleando un citómetro de flujo convencional.
ResultadosEl recuento de micropartículas CD144+ de origen endotelial mostró reducción en los grupos con insuficiencia cardiaca (p = 0,008). Se observó que el recuento de micropartículas unidas a anexina V aumentaban en la insuficiencia cardiaca (p=0,024) y en los pacientes con peor clase funcional (p=0,013). El recuento de micropartículas CD42b+ de origen plaquetario presentaron una correlación positiva con la fracción de eyección del ventrículo izquierdo (p=0,006), y los de micropartículas unidas a anexina V presentaron correlación positiva con la concentración de interleucina 6 en la insuficiencia cardiaca estable (p=0,034). En el estado agudo, el recuento de micropartículas unidas a anexina V mostró intensa correlación con la expresión del receptor toll-like-4 en todos los subgrupos de monocitos (p<0,01 en todos los casos). Tres meses después del ingreso por insuficiencia cardiaca aguda, el recuento de micropartículas unidas a anexina V tenía correlación positiva con los receptores de interleucina 6, CD163 y CD204 (p<0,05 en todos los casos).
ConclusionesEl recuento de micropartículas unidas a anexina V es una valiosa característica distintiva del estado agudo descompensado en la insuficiencia cardiaca sistólica. La relación observada entre las micropartículas de pequeño tamaño unidas a anexina V y los receptores barredores respalda su intervención en la progresión de la respuesta aguda a la lesión y, por lo tanto, su contribución en la patogenia de la insuficiencia cardiaca aguda descompensada.
Palabras clave
La insuficiencia cardiaca (IC) sistólica sigue siendo un trastorno debilitante y que pone en peligro la vida de los pacientes pese a los considerables logros en su tratamiento1,2. Hay múltiples vías importantes que conducen a alteraciones protrombóticas y proaterógenas y a una lesión endotelial, que convergen en el corazón isquémico o hipertenso, y los procesos moleculares que se producen constituyen una compleja red de vías en interacción3.
Las micropartículas son valiosos marcadores de la activación celular y la apoptosis4. En un estudio previo se ha descrito que el recuento de micropartículas de origen endotelial predice de manera fiable futuros eventos cardiovasculares en pacientes con IC, lo cual indica que las micropartículas podrían intervenir en la patogenia de varios trastornos cardiovasculares aparte de las complicaciones aterotrombóticas5. Además, las micropartículas circulantes están aumentadas en los individuos con factores de riesgo cardiovascular y enfermedad coronaria (EC)6,7; recientemente se han relacionado con índices de lesión y reparación en los pacientes con síndrome coronario agudo y con predictores independientes de futura IC en pacientes con infarto de miocardio sin elevación del segmento ST8. Además, no está claro el papel de los monocitos en los trastornos isquémicos. Estas funciones incluyen la respuesta inflamatoria, la regulación del estado trombogénico (p. ej., a través de la expresión de factores tisulares y la modulación de la fibrinolisis), pero también propiedades beneficiosas relacionadas con la eliminación de sustancias sobrantes/peligrosas, la angiogénesis y la reparación9,10. Teniendo en cuenta las interrelaciones entre la disfunción vascular, la inflamación o la apoptosis y la función cardiaca, es concebible que las micropartículas pudieran ser un marcador diagnóstico relacionado con la fisiopatología de la cardiopatía aguda11.
El objetivo del presente estudio era investigar la relevancia de las micropartículas en la IC mediante un abordaje que permitiera la discriminación y cuantificación de una amplia variedad de micropartículas de un tamaño de microesferas polistireno ≥ 0,1 μm (p. ej., las micropartículas de «pequeño tamaño»)12. Este tamaño corresponde a la definición aceptada para las micropartículas13. La hipótesis era que la generación y el origen de las micropartículas de pequeño tamaño están relacionados con mecanismos patológicos diferenciados que se evalúan mediante índices de activación monocitaria y, en última instancia, con el daño y la gravedad de la enfermedad. En consecuencia, se exa-minó la relación de la concentración de micropartículas de pequeño tamaño circulantes en pacientes con IC aguda (ICA) o estable (ICE) de origen isquémico, comparándolos con pacientes de «control de la enfermedad» que tenían EC estable y función ventricular izquierda preservada. Además, investigamos las relaciones de las cifras de micropartículas de pequeño tamaño con la expresión de receptores barredores en los monocitos como marcadores de inflamación y reparación, con objeto de obtener una perspectiva respecto al estado fisiopatológico de la enfermedad.
MÉTODOSPoblación en estudioEn el siguiente estudio prospectivo, se reclutó consecutivamente a 49 pacientes con ICA y 39 con ICE. El grupo de ICA (todos los pacientes en clase funcional de la New York Heart Association [NYHA] IV) se definió según la guía de la European Society of Cardiology como el inicio/progresión rápidos de signos y síntomas de IC de manera secundaria a una función cardiaca anormal, con necesidad de ingreso hospitalario14. Se reclutó a los pacientes con ICE (NYHA I-III) en clínicas ambulatorias; presentaban IC crónica sin deterioro de su estado clínico. Todos los pacientes con IC tenían fracción de eyección del ventrículo izquierdo (FEVI) ≤ 40% en la determinación por ecocardiografía o ventriculografía izquierda. Con objeto de evaluar la repercusión de la IC, se reclutó solo a pacientes con EC subyacente como etiología de la IC. Se excluyó a los pacientes con síndrome coronario agudo (dolor torácico con alteraciones de la onda ST/T en el electrocardiograma±troponina positiva). El tiempo transcurrido entre el último episodio agudo y la hospitalización fue > 6 meses.
Esto debía permitir la realización de comparaciones con un adecuado grupo de control con EC (n=25), función ventricular preservada y sin IC, pero con un patrón similar de comorbilidades, factores de riesgo (como diabetes o hipertensión) y medicación de base. Los «controles con enfermedad» que tenían una EC estable se definieron por infarto de miocardio más de 6 meses antes y/o una estenosis > 50% documentada angiográficamente en al menos una arteria coronaria y FEVI ≥ 55%. En todos los grupos de estudio, los criterios de exclusión incluyeron los factores que podían afectar al recuento de micropartículas de pequeño tamaño y al fenotipo monocitario (trastornos infecciosos e inflamatorios, cáncer, creatinina > 200 μmol/l, corticoides y terapia hormonal sustitutiva), la fibrilación auricular y la valvulopatía moderada o grave.
Muestras de sangre y momentos de obtenciónPara los análisis de laboratorio, se extrajeron muestras de sangre venosa periférica sin estar en ayunas de todos los participantes y se analizaron mediante citometría de flujo en un plazo de 60 min, para la evaluación de las características de los monocitos (sangre total en fresco). Se congelaron y conservaron muestras de plasma con depleción de plaquetas para un posterior análisis por lotes de las citocinas y las micropartículas de pequeño tamaño (véase la información detallada más adelante).
Para evaluar la dinámica de las micropartículas de pequeño tamaño y de los parámetros monocitarios en la ICA a lo largo del tiempo, se analizaron muestras de sangre en los siguientes momentos de valoración: a) durante las primeras 24 h después del ingreso; b) el día de alta hospitalaria, y c) 3 meses después de la hospitalización. De una parte de los pacientes (n=14) no se obtuvo seguimiento completo debido a abandono del estudio (n=3) o muerte (n=11). El estudio se llevó a cabo cumpliendo las directrices de la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación de Warwickshire. Todos los participantes dieron su consentimiento informado por escrito.
Análisis de laboratorioAnálisis de micropartículas de pequeño tamañoSe obtuvo plasma citrado tras 15min de centrifugación a 2.800g y temperatura ambiente. Se congelaron muestras alícuotas de plasma a –70°C para un posterior análisis por lotes de las micropartículas de pequeño tamaño/matriz de clasificación celular activada por fluorescencia y se sometieron a un único ciclo de congelación-descongelación. La metodología para el análisis de las micropartículas de pequeño tamaño y los controles apropiados se han descrito en publicaciones previas8,12,15. Las micropartículas de pequeño tamaño de origen plaquetario (sPMP) CD42b+, las micropartículas de pequeño tamaño de origen endotelial (sEMP) CD144+ y las micropartículas de pequeño tamaño unidas a anexina V (sAMP) se cuantificaron automáticamente con el método volumétrico utilizando un citómetro de flujo (Apogee Flow Systems; Hertfordshire, Reino Unido). Los coeficientes de variación intraanalítica e interanalítica fueron<5%. Los límites de detección fueron<100 sMP/μl para las sPMP y las sEMP y<500 sMP/μl para las sAMP.
Análisis de la activación monocitariaSe llevó a cabo un análisis de citometría de flujo para distintos subgrupos de monocitos empleando el citómetro de flujo Calibur de clasificación de células activadas por fluorescencia (Becton Dickinson; Oxford, Reino Unido). Se definieron los subgrupos de monocitos como CD14++CD16–CCR2+ (Mon1, «clásicos»), CD14++CD16+CCR2+ (Mon2, «intermedios»), y CD14+CD16++CCR2– (Mon3, no clásicos) mediante los controles de isotipos adecuados y ateniéndose al consenso actual16,17. Los anticuerpos anti-CD14, anti-CD16 y anti-CCR2 se mezclaron con 50 μl de sangre con EDTA (ácido etilendiaminotetraacético) y anticuerpos conjugados con ficoeritrina (todos ellos de R&D Systems; Abingdon, Reino Unido) dirigidos contra el receptor toll-like-4, CXCR4, el receptor de factor de crecimiento endotelial vascular 1 o CD34 (Becton Dickinson), y anticuerpos conjugados con aloficocianina dirigidos contra el receptor de interleucina (IL) 6, CD204, CD163 o el receptor de molécula de adhesión celular vascular 1. La expresión de los marcadores de superficie se cuantificó mediante la intensidad de fluorescencia media18.
Análisis de matriz para clasificación de células activadas por fluorescenciaSe determinaron las concentraciones plasmáticas de diversas interleucinas (IL-6, IL-10, IL-1β) y proteína quimiotáctica monocitaria-1 mediante la tecnología de matrices de microesferas de citometría con kit de reactivos comerciales (todos ellos de BD Biosciences; Oxford, Reino Unido), según las recomendaciones del fabricante19. Los límites de detección de las IL y proteína quimiotáctica monocitaria-1 fueron<0,1 y<5 ng/ml; los coeficientes de variación intraanalítica e interanalítica de todos los análisis fueron<8%. Se utilizó el citómetro de flujo Calibur de clasificación de células activadas por fluorescencia para la obtención de datos, y el análisis de estos se realizó con el programa de análisis de citometría de flujo Array v2.0.2 (Burnsville, Minnesota, Estados Unidos).
Análisis hematológicos y bioquímicosEl análisis hematológico se realizó en nuestro departamento con un analizador automático ADVIATM 120 (Bayer, Alemania), aplicando técnicas estándares. Todos los análisis se realizaron tras la extracción de las muestras de sangre.
Análisis estadísticoLos datos se expresan como media±desviación estándar cuando se trata de datos con distribución normal o como mediana [intervalo intercuartílico] para los datos con distribución no normal. Los datos transversales se sometieron a análisis de la varianza de una vía y los datos longitudinales, con ANOVA para medidas repetidas (ajuste de intervalo de confianza de Sidak). Se utilizó la prueba de Kruskal-Wallis o la prueba de Friedman para los datos con distribución no normal. Se aplicó una prueba de Tukey post-hoc para evaluar las diferencias entre los grupos cuando ello era apropiado. Se aplicó una transformación logarítmica de las variables de distribución no normal cuando fue posible, antes del análisis post-hoc de ANOVA. Se utilizó la prueba de Mann-Whitney para comparar los recuentos de micropartículas de pequeño tamaño de los pacientes con EC estable con los valores de 3 meses de los pacientes con ICA. Las correlaciones entre los parámetros de estudio al ingreso por IC se evaluaron con el método de Pearson (para los parámetros de distribución normal) o el de Spearman (para los parámetros con distribución no normal). Se realizó un análisis multivariable mediante regresión lineal para identificar los factores asociados a las cifras de sAMP en los pacientes con disnea grave. Las variables con p ≤ 0,15 en el análisis univariable se incluyeron en el modelo de regresión multivariable. El nivel de significación se estableció en p<0,05 y un valor ómnibus de p ≤ 0,017 (para las pruebas de Mann-Whitney y de Wilcoxon). Se utilizó el programa SPSS 18.0 para los análisis estadísticos (SPSS, Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSCaracterísticas clínicas de los pacientesLos grupos de estudio eran comparables en cuanto a edad, sexo, origen étnico, presión arterial, índice de masa corporal, hipertensión, diabetes mellitus y tabaquismo (tabla 1). El uso de bloqueadores beta fue menos frecuente en los pacientes ingresados por ICA (p<0,001), pero no se observaron diferencias en los demás tratamientos prescritos (p ómnibus > 0,017).
Características basales de las poblaciones estudiadas
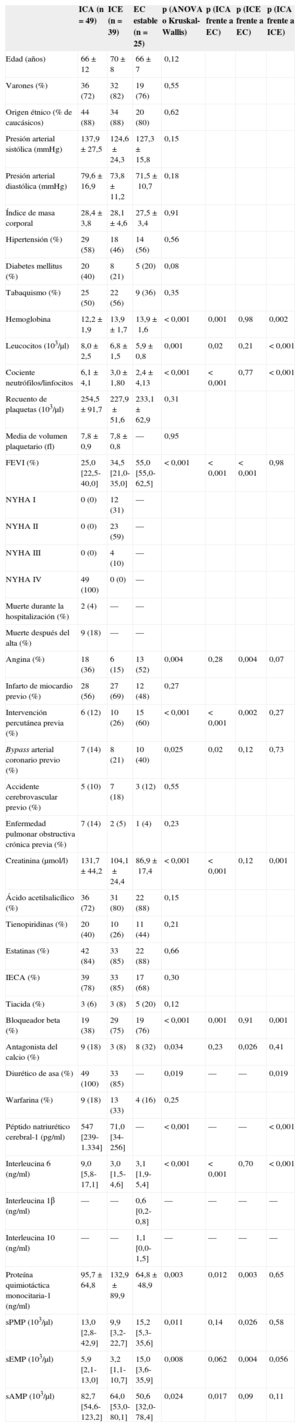
| ICA (n=49) | ICE (n=39) | EC estable (n=25) | p (ANOVA o Kruskal-Wallis) | p (ICA frente a EC) | p (ICE frente a EC) | p (ICA frente a ICE) | |
|---|---|---|---|---|---|---|---|
| Edad (años) | 66±12 | 70±8 | 66±7 | 0,12 | |||
| Varones (%) | 36 (72) | 32 (82) | 19 (76) | 0,55 | |||
| Origen étnico (% de caucásicos) | 44 (88) | 34 (88) | 20 (80) | 0,62 | |||
| Presión arterial sistólica (mmHg) | 137,9±27,5 | 124,6±24,3 | 127,3±15,8 | 0,15 | |||
| Presión arterial diastólica (mmHg) | 79,6±16,9 | 73,8±11,2 | 71,5±10,7 | 0,18 | |||
| Índice de masa corporal | 28,4±3,8 | 28,1±4,6 | 27,5±3,4 | 0,91 | |||
| Hipertensión (%) | 29 (58) | 18 (46) | 14 (56) | 0,56 | |||
| Diabetes mellitus (%) | 20 (40) | 8 (21) | 5 (20) | 0,08 | |||
| Tabaquismo (%) | 25 (50) | 22 (56) | 9 (36) | 0,35 | |||
| Hemoglobina | 12,2±1,9 | 13,9±1,7 | 13,9±1,6 | <0,001 | 0,001 | 0,98 | 0,002 |
| Leucocitos (103/μl) | 8,0±2,5 | 6,8±1,5 | 5,9±0,8 | 0,001 | 0,02 | 0,21 | < 0,001 |
| Cociente neutrófilos/linfocitos | 6,1±4,1 | 3,0±1,80 | 2,4±4,13 | < 0,001 | < 0,001 | 0,77 | < 0,001 |
| Recuento de plaquetas (103/μl) | 254,5±91,7 | 227,9±51,6 | 233,1±62,9 | 0,31 | |||
| Media de volumen plaquetario (fl) | 7,8±0,9 | 7,8±0,8 | — | 0,95 | |||
| FEVI (%) | 25,0 [22,5-40,0] | 34,5 [21,0-35,0] | 55,0 [55,0-62,5] | < 0,001 | < 0,001 | < 0,001 | 0,98 |
| NYHA I | 0 (0) | 12 (31) | — | ||||
| NYHA II | 0 (0) | 23 (59) | — | ||||
| NYHA III | 0 (0) | 4 (10) | — | ||||
| NYHA IV | 49 (100) | 0 (0) | — | ||||
| Muerte durante la hospitalización (%) | 2 (4) | — | — | ||||
| Muerte después del alta (%) | 9 (18) | — | — | ||||
| Angina (%) | 18 (36) | 6 (15) | 13 (52) | 0,004 | 0,28 | 0,004 | 0,07 |
| Infarto de miocardio previo (%) | 28 (56) | 27 (69) | 12 (48) | 0,27 | |||
| Intervención percutánea previa (%) | 6 (12) | 10 (26) | 15 (60) | < 0,001 | < 0,001 | 0,002 | 0,27 |
| Bypass arterial coronario previo (%) | 7 (14) | 8 (21) | 10 (40) | 0,025 | 0,02 | 0,12 | 0,73 |
| Accidente cerebrovascular previo (%) | 5 (10) | 7 (18) | 3 (12) | 0,55 | |||
| Enfermedad pulmonar obstructiva crónica previa (%) | 7 (14) | 2 (5) | 1 (4) | 0,23 | |||
| Creatinina (μmol/l) | 131,7±44,2 | 104,1±24,4 | 86,9±17,4 | < 0,001 | < 0,001 | 0,12 | 0,001 |
| Ácido acetilsalicílico (%) | 36 (72) | 31 (80) | 22 (88) | 0,15 | |||
| Tienopiridinas (%) | 20 (40) | 10 (26) | 11 (44) | 0,21 | |||
| Estatinas (%) | 42 (84) | 33 (85) | 22 (88) | 0,66 | |||
| IECA (%) | 39 (78) | 33 (85) | 17 (68) | 0,30 | |||
| Tiacida (%) | 3 (6) | 3 (8) | 5 (20) | 0,12 | |||
| Bloqueador beta (%) | 19 (38) | 29 (75) | 19 (76) | < 0,001 | 0,001 | 0,91 | 0,001 |
| Antagonista del calcio (%) | 9 (18) | 3 (8) | 8 (32) | 0,034 | 0,23 | 0,026 | 0,41 |
| Diurético de asa (%) | 49 (100) | 33 (85) | — | 0,019 | — | — | 0,019 |
| Warfarina (%) | 9 (18) | 13 (33) | 4 (16) | 0,25 | |||
| Péptido natriurético cerebral-1 (pg/ml) | 547 [239-1.334] | 71,0 [34-256] | — | < 0,001 | — | — | < 0,001 |
| Interleucina 6 (ng/ml) | 9,0 [5,8-17,1] | 3,0 [1,5-4,6] | 3,1 [1,9-5,4] | < 0,001 | < 0,001 | 0,70 | < 0,001 |
| Interleucina 1β (ng/ml) | — | — | 0,6 [0,2-0,8] | — | — | — | — |
| Interleucina 10 (ng/ml) | — | — | 1,1 [0,0-1,5] | — | — | — | — |
| Proteína quimiotáctica monocitaria-1 (ng/ml) | 95,7±64,8 | 132,9±89,9 | 64,8±48,9 | 0,003 | 0,012 | 0,003 | 0,65 |
| sPMP (103/μl) | 13,0 [2,8-42,9] | 9,9 [3,2-22,7] | 15,2 [5,3-35,6] | 0,011 | 0,14 | 0,026 | 0,58 |
| sEMP (103/μl) | 5,9 [2,1-13,0] | 3,2 [1,1-10,7] | 15,0 [3,6-35,9] | 0,008 | 0,062 | 0,004 | 0,056 |
| sAMP (103/μl) | 82,7 [54,6-123,2] | 64,0 [53,0-80,1] | 50,6 [32,0-78,4] | 0,024 | 0,017 | 0,09 | 0,11 |
ANOVA: análisis de la varianza; EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda; ICE: insuficiencia cardiaca estable; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: New York Heart Association; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico] para las variables de distribución normal o no normal.
Las comparaciones de datos apareados (prueba de Tukey post-hoc o prueba de Mann-Whitney) fueron significativas con p ómnibus ≤ 0,017.
Los parámetros hematológicos en los pacientes agudos en el momento del ingreso fueron superiores a los del grupo de control o de ICE (tabla 1), excepto por lo que respecta a las concentraciones de hemoglobina (p<0,001). Los pacientes con EC clínicamente estable y con ICE presentaron un valor inferior del cociente de neutrófilos/linfocitos (p<0,001) y del recuento leucocitario (p=0,001). Tan solo el recuento de plaquetas y el volumen plaquetario medio se mantuvieron inalterados con independencia del grupo de pacientes y del tratamiento prescrito.
En el presente estudio, los títulos de IL-6 y péptido natriurético cerebral-1 de los pacientes con ICA fueron significativamente superiores a los de los pacientes con EC o ICE (p=0,001). La proteína quimiotáctica de macrófagos-1 estaba aumentada tanto en los pacientes con ICA (p=0,012) como en los pacientes con ICE (p=0,003) en comparación con los pacientes con EC, aunque no hubo diferencias significativas entre los dos subgrupos de la enfermedad (tabla 1). Los valores de creatinina fueron más altos en la ICA que en la ICE y la EC (p<0,001 y p=0,001 respectivamente). Se realizó un seguimiento del estado clínico de los pacientes con ICA al ingreso (el 100% en NYHA IV) 3 meses después de la descompensación aguda: el 6% en NYHA I, el 30% en NYHA II, el 24% en NYHA III y el 12% en NYHA IV. Se realizó también un seguimiento de las citocinas de fase aguda y los parámetros hematológicos (datos no presentados).
Recuentos de micropartículas de pequeño tamaño circulantes en los estudios transversales y longitudinalesEn el momento basal de la ICA, los recuentos de micropartículas de pequeño tamaño no fueron significativamente diferentes de los del grupo de ICE (figura 1). Los pacientes con ICE presentaron cifras de sEMP inferiores a las del grupo de EC (p=0,004); las diferencias en los recuentos de sPMP (p=0,026) no fueron significativas aplicando el valor de p ómnibus (figura 1). Los pacientes con ICA al ingreso presentaron un recuento de sAMP significativamente superior (p=0,017).
Recuentos de micropartículas de pequeño tamaño (103 sMP/μl) en plasma con depleción de plaquetas en el estudio transversal. Comparación de los recuentos de micropartículas de pequeño tamaño en pacientes con enfermedad arterial coronaria estable (n=25) frente a pacientes con insuficiencia cardiaca aguda durante las primeras 24 h siguientes al ingreso (día 1, n=49) y pacientes con insuficiencia cardiaca estable (n=39) (pruebas de Mann-Whitney y Kruskal-Wallis). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; ICE: insuficiencia cardiaca estable; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Las líneas paralelas indican la mediana [intervalo intercuartílico].
Como se muestra en la figura 2, no hubo cambios significativos en los valores de sPMP en los 3 meses de descompensación aguda de la IC (p=0,048), si bien los títulos de sEMP aumentaron significativamente en los 3 meses (p=0,014). No se observaron diferencias entre las micropartículas de pequeño tamaño de diferentes orígenes en los pacientes con ICA y con EC 3 meses después del ingreso (figura 2). En un estudio transversal de comparación de los pacientes con ICE y con ICA 3 meses después del ingreso, se observaron recuentos de sEMP superiores en los pacientes agudos (p=0,008) (datos no presentados).
Dinámica de los recuentos de micropartículas de pequeño tamaño (103 sMP/μl) tras insuficiencia cardiaca aguda a lo largo de los 3 meses siguientes a la descompensación aguda (n=32) (prueba de Friedman). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Se realizó también una comparación de los recuentos de micropartículas de pequeño tamaño entre las primeras 24 h siguientes al ingreso [ICA_1], el día de alta hospitalaria [ICA_2], 3 meses después del ingreso [ICA_3] y el grupo de enfermedad (EC) (prueba de Mann-Whitney). Las líneas paralelas indican mediana [intervalo intercuartílico].
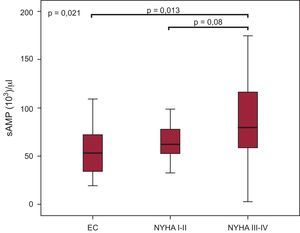
De entre los parámetros hematológicos, solo los valores de hemoglobina presentaron una correlación con los de micropartículas de pequeño tamaño en los diferentes grupos y a lo largo del tiempo. De hecho, los recuentos de sAMP con correlación positiva con la hemoglobina en la ICA al ingreso (r=0,41; p=0,026) y después de 3 meses aumentaron también con las cifras de sPMP y sEMP (r=0,49; p=0,022 y r=0,43; p=0,050 respectivamente). La FEVI al ingreso de los pacientes con ICA mostró correlación positiva con los recuentos de sPMP (r=0,42; p=0,006) y los pacientes con FEVI<25% presentaron cifras de sPMP inferiores (p=0,013). Esta relación se perdía a los 3 meses del ingreso. Al considerar la totalidad de los pacientes con IC, se observó que los recuentos de sAMP se asociaban también a la gravedad de la clase funcional (NYHA III-IV) en comparación con la EC (p=0,013) (figura 3). Por lo que respecta a los tratamientos farmacológicos, los recuentos de sPMP inferiores se asociaron al uso de bloqueadores beta (β=–0,38; p=0,016), mientras que el empleo de ácido acetilsalicílico estaba relacionado con recuentos de sAMP más bajos (β=–0,42; p=0,008) en los pacientes con ICE (datos no presentados).
Comparación de los recuentos de micropartículas de pequeño tamaño unidas a anexina V (103 sMP/μl) en los pacientes con enfermedad coronaria y los pacientes con insuficiencia cardiaca. EC: enfermedad coronaria; NYHA: New York Heart Association; sAMP: micropartículas de pequeño tamaño unidas a anexina V. El estado funcional de los pacientes con insuficiencia cardiaca se evaluó con la clase de la New York Heart Association (pruebas de Mann-Whitney y de Kruskal-Wallis). Los gráficos de cajas indican mediana [intervalo intercuartílico].
Tan solo la IL-6 presentó correlación positiva con los recuentos de sAMP en la ICE (r=0,35; p=0,034). En la ICE, la creatinina también se correlacionó positivamente con los diferentes orígenes de las micropartículas de pequeño tamaño (p<0,05 en todos los casos) (datos no presentados).
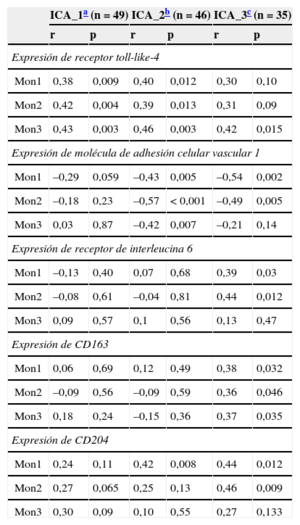
Expresión de receptores barredores monocitarios y recuento de micropartículas de pequeño tamaño unidas a anexina VDado que se ha descrito que las sAMP son un marcador de la apoptosis20, evaluamos la relación entre los recuentos de sAMP y diferentes receptores de barredores de los subgrupos de monocitos en el estudio longitudinal de la ICA (tabla 2). La expresión del receptor toll-like-4 en los tres subgrupos de monocitos mostró correlación positiva con los recuentos de sAMP al ingreso por ICA (Mon1, r=0,38, p=0,009; Mon2, r=0,42, p=0,004; Mon3, r=0,43, p=0,003). Esta relación se mantuvo el día del alta (ICA_2), pero se perdió en cambio a los 3 meses del ingreso (ICA_3). El día del alta, la molécula de adhesión celular vascular-1 estaba correlacionada negativamente con los recuentos de sAMP (Mon1, r=–0,43, p=0,005; Mon2, r=0,57, p<0,001; Mon3, r=–0,42, p=0,007) y continuó estándolo después de 3 meses, excepto por la subpoblación Mon3. Las concentraciones de receptor de IL-6, CD163 y CD204 no presentaron correlación con las sAMP en los momentos de valoración 1 y 2, pero apareció relación con la recuperación de un estado clínico más favorable.
Correlaciones entre recuento de micropartículas de pequeño tamaño unidas a anexina V y la expresión de receptores de superficie en las diferentes subpoblaciones de monocitos y momentos de valoración
| ICA_1a (n=49) | ICA_2b (n=46) | ICA_3c (n=35) | ||||
|---|---|---|---|---|---|---|
| r | p | r | p | r | p | |
| Expresión de receptor toll-like-4 | ||||||
| Mon1 | 0,38 | 0,009 | 0,40 | 0,012 | 0,30 | 0,10 |
| Mon2 | 0,42 | 0,004 | 0,39 | 0,013 | 0,31 | 0,09 |
| Mon3 | 0,43 | 0,003 | 0,46 | 0,003 | 0,42 | 0,015 |
| Expresión de molécula de adhesión celular vascular 1 | ||||||
| Mon1 | –0,29 | 0,059 | –0,43 | 0,005 | –0,54 | 0,002 |
| Mon2 | –0,18 | 0,23 | –0,57 | < 0,001 | –0,49 | 0,005 |
| Mon3 | 0,03 | 0,87 | –0,42 | 0,007 | –0,21 | 0,14 |
| Expresión de receptor de interleucina 6 | ||||||
| Mon1 | –0,13 | 0,40 | 0,07 | 0,68 | 0,39 | 0,03 |
| Mon2 | –0,08 | 0,61 | –0,04 | 0,81 | 0,44 | 0,012 |
| Mon3 | 0,09 | 0,57 | 0,1 | 0,56 | 0,13 | 0,47 |
| Expresión de CD163 | ||||||
| Mon1 | 0,06 | 0,69 | 0,12 | 0,49 | 0,38 | 0,032 |
| Mon2 | –0,09 | 0,56 | –0,09 | 0,59 | 0,36 | 0,046 |
| Mon3 | 0,18 | 0,24 | –0,15 | 0,36 | 0,37 | 0,035 |
| Expresión de CD204 | ||||||
| Mon1 | 0,24 | 0,11 | 0,42 | 0,008 | 0,44 | 0,012 |
| Mon2 | 0,27 | 0,065 | 0,25 | 0,13 | 0,46 | 0,009 |
| Mon3 | 0,30 | 0,09 | 0,10 | 0,55 | 0,27 | 0,133 |
ICA: insuficiencia cardiaca aguda.
La expresión de los marcadores de superficie se muestra mediante la intensidad de fluorescencia media.
Los cálculos se basaron en un análisis de correlación de Spearman.
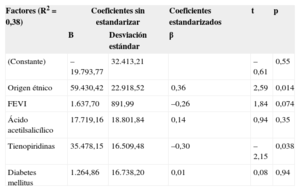
Con objeto de identificar factores independientes determinantes de la concentración plasmática de sAMP, se realizó inicialmente un análisis bivariable en los pacientes con disnea grave (NYHA IV). El objetivo del análisis de parámetros únicos fue la selección de las variables y la exclusión de las que no tenían asociación con el recuento de sAMP (p≤0,15). El análisis bivariable mostró que los valores de sAMP tenían mayor probabilidad de estar relacionados con el origen étnico, una FEVI menor, el ácido acetilsalicílico y las tienopiridinas. En la tabla 3 se presentan los resultados del modelo de análisis multivariable (p≤0,005); el origen étnico en el sur de Asia y el tratamiento con tienopiridinas (p<0,05 en ambos casos) influían significativamente en los títulos de sAMP. Los biomarcadores de remodelado ventricular (FEVI y péptido natriurético cerebral-1) no parecen influir en la concentración de sAMP en el estudio multivariable.
Análisis multivariable de las variables de recuento de micropartículas de pequeño tamaño unidas a anexina V en pacientes con insuficiencia cardiaca aguda y disnea grave (clase funcional IV de la New York Heart Association)*
| Factores (R2=0,38) | Coeficientes sin estandarizar | Coeficientes estandarizados | t | p | |
|---|---|---|---|---|---|
| B | Desviación estándar | β | |||
| (Constante) | –19.793,77 | 32.413,21 | –0,61 | 0,55 | |
| Origen étnico | 59.430,42 | 22.918,52 | 0,36 | 2,59 | 0,014 |
| FEVI | 1.637,70 | 891,99 | –0,26 | 1,84 | 0,074 |
| Ácido acetilsalicílico | 17.719,16 | 18.801,84 | 0,14 | 0,94 | 0,35 |
| Tienopiridinas | 35.478,15 | 16.509,48 | –0,30 | –2,15 | 0,038 |
| Diabetes mellitus | 1.264,86 | 16.738,20 | 0,01 | 0,08 | 0,94 |
B: coeficiente de regresión; FEVI: fracción de eyección del ventrículo izquierdo.
Origen étnico hace referencia a los caucásicos frente a los del sur de Asia (el 88% de caucásicos).
En el análisis se utilizaron los valores de micropartículas de pequeño tamaño unidas a anexina V sin transformar.
Este es el primer estudio que muestra un aumento de sAMP circulantes tras la descompensación de la ICA, en comparación con los pacientes de control con etiología similar. Los recuentos de sAMP más altos se asociaron al estado funcional grave (NYHA III-IV) y fueron paralelos a los marcadores monocitarios de reparación e inflamación. En segundo lugar, este estudio muestra de qué manera una evaluación cuantitativa de los biomarcadores derivados de procesos patológicos como la apoptosis (sAMP), la activación plaquetaria (sPMP) y los receptores monocitarios (que conducen a las complicaciones aterotrombóticas) puede tener utilidad y valor clínico para el diagnóstico de los pacientes con IC de alto riesgo y etiología isquémica.
El análisis de micropartículas no se utiliza todavía con fines clínicos, debido en gran parte a las limitaciones existentes en los métodos de cuantificación de micropartículas y el manejo de las muestras de sangre21. Es probable que la utilización de citómetros de flujo específicamente diseñados para el análisis de las partículas de pequeño tamaño aporte ventajas metodológicas considerables y deba ser una opción preferible. Nuestro grupo ha comparado recientemente las vesículas de menor tamaño denominadas «micropartículas de pequeño tamaño» en pacientes con EC y síndrome coronario agudo y ha observado cifras de sEMP más bajas en la isquemia aguda8. En los datos que se presentan aquí, no está claro por qué los recuentos de sPMP y sEMP disminuyen con la IC mientras los de sAMP aumentan, lo cual indica que las sAMP podrían tener su origen en tejidos o células diferentes y mostrar una sensibilidad funcional diferente de la isquemia. Un estudio reciente ha indicado que el aumento de micropartículas después de una tensión cardiaca parece ser una respuesta fisiológica normal que está reducida cuando el estado clínico es peor, lo cual podría explicar algunos de estos recuentos bajos en la ICA y la ICE22. También es plausible que el tratamiento cause un deterioro de la liberación de micropartículas de pequeño tamaño, y se ha observado ya que los bloqueadores beta inhiben la liberación de micropartículas de las plaquetas y los monocitos en los pacientes hipertensos23,24. En consonancia con ello, el uso de tienopiridinas reduce significativamente la liberación de sAMP en clase funcional avanzada (NYHA IV).
En estudios recientes se ha evaluado la asociación entre recuento de micropartículas circulantes y varias enfermedades cardiovasculares, y se ha observado relación con la gravedad de la enfermedad; se ha señalado incluso que pueden ser un nuevo biomarcador pronóstico en la IC5. Con objeto de cuantificar la utilidad de las sAMP para la estratificación del riesgo, dividimos a los pacientes en dos grupos en función de las manifestaciones clínicas y la FEVI (pero con similar presencia de comorbilidades). Se analizó también otros biomarcadores que corresponden a vías fisiopatológicas (remodelado ventricular, inflamación, activación monocitaria y parámetros de laboratorio que se determinan habitualmente). Además, la reducción de la función renal tiene una frecuencia creciente en los pacientes con IC y es una causa bien documentada de anemia25. Los recuentos de sPMP inferiores en la ICA se asocian aquí a cifras de FEVI inferiores, lo cual indica que la liberación de micropartículas de pequeño tamaño podría estar relacionada con el grado de la lesión isquémica sufrida por el corazón. Las correlaciones entre recuentos de micropartículas de origen plaquetario y FEVI también fueron evidentes en los pacientes con infarto de miocardio con elevación del segmento ST7, aunque la consideración de las micropartículas se definió utilizando microesferas de 0,5-1,5 μm. Además, los recuentos de micropartículas de pequeño tamaño se compararon también con la gravedad de la enfermedad, y se observó correlación positiva entre peor estado clínico (NYHA III-IV) y recuentos de sAMP más altos. El presente estudio respalda, pues, que los recuentos de sAMP (al ingreso) y de sEMP (3 meses después del ingreso) podrían ser biomarcadores útiles para diferenciar el estado patológico de los pacientes con ICA descompensada de etiología isquémica. Sin embargo, es importante señalar que la utilidad clínica de los recuentos de micropartículas como marcadores de peor estado clínico en una población con IC es actualmente poco clara, y son necesarios estudios experimentales para demostrar que las sAMP no son simplemente un marcador, sino que intervienen en la patogenia de la IC y la EC.
El interés de la investigación sobre la heterogeneidad monocitaria y los receptores barredores ha recibido un gran impulso durante la última década16–19,26. El objetivo previo era investigar si los recuentos de receptores barredores de los monocitos diferían en los pacientes con ICA e IC crónica27; sin embargo, eran necesarios más estudios para determinar la relación fisiopatológica con otros elementos circulantes como las micropartículas de pequeño tamaño. De entre los anticuerpos con diferentes especificidades utilizados en este estudio, se observó que el receptor toll-like-4, que está relacionado con la inestabilidad de la placa aterosclerótica28, aumentaba en paralelo con los recuentos de sAMP, y luego desaparecía regularmente después del alta. Después de la mejora de los síntomas del paciente, los recuentos de sAMP disminuyeron lentamente, al tiempo que aumentaba la expresión de la VCAM-1, lo cual indica un reinicio de la adhesión tras la fase aguda29. La expresión del receptor de IL-6 y los recuentos de sAMP se redujeron en paralelo después de 3 meses de descompensación aguda de la IC, lo cual concuerda con el aumento de IL-6 que en la ICA se ha demostrado que interrumpe el marcaje de anticuerpos. La IL-6 induce la producción de proteínas de fase aguda, incluida la proteína C reactiva, por las células hepáticas30. La intensidad de fluorescencia de CD204 no mostró correlación con los recuentos de sAMP en la ICA al ingreso (mayor expresión y, por lo tanto, eliminación de elementos apoptóticos), pero apareció una correlación positiva después del alta. Dado que interviene en la eliminación de las células apoptóticas31, resulta tentador plantear la hipótesis de que el CD204 pudiera intervenir también en la eliminación de las sAMP, pero este mecanismo se evita o se sobrepasa en los estados agudos. El receptor toll-like-4, la VCAM-1, el receptor de IL-6, el CD163 y el CD204 son cruciales en la activación, la eliminación y la acumulación de los leucocitos, y están relacionados con la función vascular y la inflamación. Este estudio apunta ahora que los recuentos de sAMP son representativos de un estado proaterogénico al darse conjuntamente con la expresión monocitaria de moléculas de adhesión. No obstante, el carácter observacional del estudio no permite determinar la causalidad y los papeles específicos en la fase aguda de la IC.
LimitacionesEl estudio es de naturaleza descriptiva, puesto que compara a pacientes con ICE y pacientes con una IC más grave (ICA) que no son representativos de la población general, pero son el centro de interés de la mayor parte de los ensayos clínicos sobre IC. El diseño del estudio impide que los grupos evaluados estén plenamente equilibrados por lo que respecta a todas las variables clínicas y demográficas, con lo que queda abierta una posibilidad de sesgo al respecto. El presente estudio tiene también la limitación del número de pacientes relativamente bajo. Será preciso establecer por completo el significado fisiopatológico de las micropartículas de pequeño tamaño en la IC y su valor pronóstico. A pesar de las limitaciones en la interpretación de los biomarcadores plasmáticos, este estudio ha observado correlaciones entre recuentos de sAMP y diversos biomarcadores de inflamación y reparación, así como una asociación con características de gravedad de la IC.
CONCLUSIONESLos pacientes con IC presentan un aumento de los recuentos de sAMP como indicador de la lesión aguda y menor capacidad funcional. La relación entre las sAMP y la expresión de receptores barredores puede comportar un menor potencial funcional de reparación, lo cual podría contribuir a la patogenia de la ICA descompensada. Queda por establecer si las micropartículas de pequeño tamaño desempeñan un papel como mensajeros de información biológica y reguladores directos de procesos fisiopatológicos y contribuyen a la progresión causal de la enfermedad.
FINANCIACIÓNLa investigación que llevó a estos resultados ha contado con financiación de Heart Research UK (RG2579/09/10), European Society of Cardiology y el People Programme (Marie Curie Actions) del Seventh Framework Programme de la Unión Europea (FP7/2007-2013) en el marco del acuerdo de subvención REA n.o 608765.
CONFLICTO DE INTERESESNinguno.
S. Montoro-García ocupa un puesto posdoctoral en la UCAM (Universidad Católica San Antonio de Murcia), Murcia, España.



![Recuentos de micropartículas de pequeño tamaño (103 sMP/μl) en plasma con depleción de plaquetas en el estudio transversal. Comparación de los recuentos de micropartículas de pequeño tamaño en pacientes con enfermedad arterial coronaria estable (n=25) frente a pacientes con insuficiencia cardiaca aguda durante las primeras 24 h siguientes al ingreso (día 1, n=49) y pacientes con insuficiencia cardiaca estable (n=39) (pruebas de Mann-Whitney y Kruskal-Wallis). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; ICE: insuficiencia cardiaca estable; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Las líneas paralelas indican la mediana [intervalo intercuartílico]. Recuentos de micropartículas de pequeño tamaño (103 sMP/μl) en plasma con depleción de plaquetas en el estudio transversal. Comparación de los recuentos de micropartículas de pequeño tamaño en pacientes con enfermedad arterial coronaria estable (n=25) frente a pacientes con insuficiencia cardiaca aguda durante las primeras 24 h siguientes al ingreso (día 1, n=49) y pacientes con insuficiencia cardiaca estable (n=39) (pruebas de Mann-Whitney y Kruskal-Wallis). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; ICE: insuficiencia cardiaca estable; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Las líneas paralelas indican la mediana [intervalo intercuartílico].](https://static.elsevier.es/multimedia/03008932/0000006800000011/v1_201511051440/S0300893215000512/v1_201511051440/es/main.assets/thumbnail/gr1.jpeg?xkr=eyJpdiI6IlhNU2c5ckU5Q25kQWNzWWpqbGQ0M0E9PSIsInZhbHVlIjoiSVA1cmpDeUVSRFhhdVI0S2FBWGEwMFlKcXFrc3ZlYUdDZG1GMzkvQVZ6UT0iLCJtYWMiOiIxYzU2NmRhNzc1OTcwMzJjMTRhNmY3NTk0ZDE2MzYzMDVmNDc2NThkNjFhYWI4N2Y4Y2MxMjMzZTJkYzA4NmNiIiwidGFnIjoiIn0=)
![Dinámica de los recuentos de micropartículas de pequeño tamaño (103 sMP/μl) tras insuficiencia cardiaca aguda a lo largo de los 3 meses siguientes a la descompensación aguda (n=32) (prueba de Friedman). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Se realizó también una comparación de los recuentos de micropartículas de pequeño tamaño entre las primeras 24 h siguientes al ingreso [ICA_1], el día de alta hospitalaria [ICA_2], 3 meses después del ingreso [ICA_3] y el grupo de enfermedad (EC) (prueba de Mann-Whitney). Las líneas paralelas indican mediana [intervalo intercuartílico]. Dinámica de los recuentos de micropartículas de pequeño tamaño (103 sMP/μl) tras insuficiencia cardiaca aguda a lo largo de los 3 meses siguientes a la descompensación aguda (n=32) (prueba de Friedman). A: sMP de plaquetas CD42b+. B: sMP endoteliales CD144+. C: sMP de unión a anexina V+. EC: enfermedad coronaria; ICA: insuficiencia cardiaca aguda; sAMP: micropartículas de pequeño tamaño unidas a anexina V; sEMP: micropartículas de pequeño tamaño de origen endotelial; sPMP: micropartículas de pequeño tamaño de origen plaquetario. Se realizó también una comparación de los recuentos de micropartículas de pequeño tamaño entre las primeras 24 h siguientes al ingreso [ICA_1], el día de alta hospitalaria [ICA_2], 3 meses después del ingreso [ICA_3] y el grupo de enfermedad (EC) (prueba de Mann-Whitney). Las líneas paralelas indican mediana [intervalo intercuartílico].](https://static.elsevier.es/multimedia/03008932/0000006800000011/v1_201511051440/S0300893215000512/v1_201511051440/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6Ii8wdC9MQkwrNVRlcGpKZ3RRZjZJK2c9PSIsInZhbHVlIjoiM1IwaUFlZEJDaWNDK3dWS3dSeklFL2JOdmdmRUpBbTRaL2twTFcyeUp0RT0iLCJtYWMiOiJiNDIyMjhjZTM0MDBjZjFiYzA5MDcwYjI3ZWM2NjU1Yjg3NTk4OTcxZjNlMTFlM2Y5OWY0YTQ5MGRkY2NhYTViIiwidGFnIjoiIn0=)
![Comparación de los recuentos de micropartículas de pequeño tamaño unidas a anexina V (103 sMP/μl) en los pacientes con enfermedad coronaria y los pacientes con insuficiencia cardiaca. EC: enfermedad coronaria; NYHA: New York Heart Association; sAMP: micropartículas de pequeño tamaño unidas a anexina V. El estado funcional de los pacientes con insuficiencia cardiaca se evaluó con la clase de la New York Heart Association (pruebas de Mann-Whitney y de Kruskal-Wallis). Los gráficos de cajas indican mediana [intervalo intercuartílico]. Comparación de los recuentos de micropartículas de pequeño tamaño unidas a anexina V (103 sMP/μl) en los pacientes con enfermedad coronaria y los pacientes con insuficiencia cardiaca. EC: enfermedad coronaria; NYHA: New York Heart Association; sAMP: micropartículas de pequeño tamaño unidas a anexina V. El estado funcional de los pacientes con insuficiencia cardiaca se evaluó con la clase de la New York Heart Association (pruebas de Mann-Whitney y de Kruskal-Wallis). Los gráficos de cajas indican mediana [intervalo intercuartílico].](https://static.elsevier.es/multimedia/03008932/0000006800000011/v1_201511051440/S0300893215000512/v1_201511051440/es/main.assets/thumbnail/gr3.jpeg?xkr=eyJpdiI6ImxxQlphRU5EaWZxMDRIN2FUcG5nWHc9PSIsInZhbHVlIjoiWDlud2k1a1YyZmZ3VnltNnZiak1hMWF5cCtmSUNkaWVldFordmVUN1FnTT0iLCJtYWMiOiIzNDI0NDM5ZjBjOTY5YjNjNmNmYjI0N2Q3M2RlYzk1MTRjODg3MDMxYTI1MDQ3NDIxMTkyOTYzZjM0MDQ1MmYwIiwidGFnIjoiIn0=)